子宫内膜癌是妇科常见恶性肿瘤。患者是否存在淋巴结转移是治疗及预后的一个重要参考指标,即使是低危子宫内膜癌患者仍有10%的人会发生淋巴结转移[1]。如何对低危患者淋巴结转移进行更加细致的风险分层仍是目前大多数研究努力的方向[2]。雌激素受体(estrogen receptor,ER)和孕激素受体(progesterone receptor,PR)是子宫内膜癌的经典免疫组化标志物[3],并且已被证明与患者的不良预后密切相关[4],在乳腺癌中,我国乳腺癌雌孕激素受体指南[5]建议将雌孕激素受体阳性阈值定为≥1%,但在子宫内膜癌中目前尚缺乏一个公认的可接受的阳性阈值,找到此阈值可作为低风险子宫内膜癌患者风险分层的一个辅助参考指标,有助于临床医生更好的制定围术期治疗方案及对患者进行更加细致的预后管理等。本研究旨在通过纳入低危子宫内膜癌患者人群,探讨影响低危子宫内膜癌淋巴结转移间的相关因素,确定雌孕激素受体用于预测低危子宫内膜癌淋巴结转移的阳性阈值,寻找预测淋巴结转移的最佳预测因子组合,为临床诊疗及患者预后管理提供辅助参考指标。
1 资料与方法 1.1 研究对象该研究已通过重庆医科大学伦理委员会批准(伦理审批号:2020192),参与本研究的所有患者均被电话告知并取得患者同意。纳入2013年10月至2020年6月于重庆医科大学附属第一医院妇科接受了初级手术治疗的子宫内膜癌住院患者的临床病理资料,患者中位年龄51(25~77)岁, 体质指数为24.56 (16.35~45.72) kg/m2。纳入标准:①术后病理诊断为子宫内膜癌且FIGO分期为Ⅰ~Ⅲ期的患者;②入院即接受初步手术治疗,未进行术前其他辅助治疗的患者;排除标准:①未行标准手术治疗患者;②未行淋巴结切除术患者;③合并其他恶性肿瘤患者;④病历资料缺失的患者;⑤术后失访患者;⑥伴有以下淋巴结转移高危临床病理因素的患者:非子宫内膜样癌,高级别子宫内膜样癌,深肌层浸润(浸润深度≥1/2),宫颈基质浸润[6-7]。所有患者均接受了包括至少全子宫及双侧输卵管卵巢切除术伴盆腔淋巴结切除术伴或不伴腹主动脉旁淋巴结切除术的全面分期手术。按照MEYDANLI等[8]的标准,盆腔淋巴结切除个数在10个以上,(伴或不伴)腹主动脉旁淋巴结切除个数在5个以上为有效的淋巴结切除术。
1.2 术后病理及免疫组化分析所有患者术后标本离体后立即予以福尔马林组织固定液固定,并在20 min内送至重庆医科大学病理实验中心按照统一标准进行包埋,切片,HE染色及免疫组化分析。病理结果(肿瘤大小,侵犯范围,肿瘤分型,分级,是否有淋巴结转移及淋巴结转移个数等)最初由病理实验中心初级医师进行判断,并由上级医师进行复核。
免疫组化分析是使用免疫组织化学自动染色仪(Leica Bond-Max,英国米尔顿凯恩斯)里经过优化和验证的免疫组化方案进行[9-10]。以下小鼠单克隆抗体用作一抗并在4 ℃下孵育过夜:ER (clone SP1), PR (clone MX009) 和P53 (clone MX008, 购自中国福州迈新生物科技公司)。免疫组化结果判读[4, 10]:在最活跃的肿瘤区域(“热点区”)随机观察5个高倍视野(×400), 肿瘤细胞的细胞核见棕黄色颗粒则被认为是阳性细胞,每个视野计数100个肿瘤细胞,并分别计算每个免疫组化参数(ER,PR and P53)的平均阳性百分比(0~100%)。该过程由两名经验丰富的病理科医师独立进行评估并分别记录结果,如果两名观察者的计数结果差异≤10%,则认为观察结果是一致的;如果计数结果差异>10%, 则由两名观察者重新观察计数并获得共识。最终将两名观测者的结果取平均值以代表免疫组化参数阳性肿瘤细胞比例的最终结果。根据P53三分类判读系统[9, 11],P53免疫组化结果以异常(突变)表达及正常表达(野生型表达)表示,ER,PR免疫组化结果以阳性百分比(0~100%)表示。
1.3 研究设计方案及统计学分析首先分析各临床病理因素(包括年龄,体质指数,肿瘤病理分级,淋巴脉管间隙侵犯,血清学指标C125,免疫组化指标ER,PR及P53)与低危子宫内膜癌淋巴结转移之间的相关性,进一步确定雌孕激素受体(ER,PR)用于预测淋巴结转移的最佳阳性阈值,在此基础上通过比较单一预测因子与联合预测因子之间的预测价值从而找到预测淋巴结转移的最佳预测因子组合,最后基于最佳预测因子组合构建Logistic回归模型对低危子宫内膜癌淋巴结转移进行预测。
采用SPSS 25.0统计学软件对数据进行处理。计量资料以x±s或M(P25, P75)表示,组间比较采用t检验或秩和检验;计数资料以频数(%)表示,组间比较采用χ2检验。相关因素的单因素及多因素分析均采用Logistic回归模型进行。ER、PR的最佳阳性阈值由受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)和约登指数确定[12]。最后运用ROC曲线下面积(area under the curve,AUC)比较各预测指标的临床预测价值[1],各AUC值间的比较采用Z检验。检验水准α=0.05。
2 结果 2.1 患者一般临床病理资料特征2013年10月至2020年6月,共1 018例Ⅰ~Ⅲ期子宫内膜癌患者在重庆医科大学附属第一医院接受了标准外科手术治疗,按照纳入及排除标准共纳入409例低危子宫内膜癌患者。其中308(75.3%)例患者仅仅接受了盆腔淋巴结切除术,而101(24.7%)例患者接受了盆腔淋巴结切除术及腹主动脉旁淋巴结切除术,患者中位淋巴结切除数为32(10~93)个,共有38(9.3%) 例患者发生了淋巴结转移,其中有7(1.7%)例患者合并有腹主动脉旁淋巴结转移,未观察到孤立腹主动脉旁淋巴结转移患者。免疫组化标志物ER的分布范围为0~95%(中位数为60%);PR的分布范围为0~95%(中位数为70%,表 1)。
| 临床特征 | 人数(n=409) |
| 年龄/岁 | 25~77(51.34±8.39) |
| 体质指数/kg·m-2 | 16.35~45.72(25.03±3.84) |
| 病理分级 | |
| 1 | 167(40.8) |
| 2 | 242(59.2) |
| LVSI | 59(14.4) |
| Ca125/U·mL-1 | |
| < 35 | 332(81.2) |
| ≥35 | 77(18.8) |
| ER阳性百分比(%) | 0~95,60.00(25.00,90.00) |
| PR阳性百分比(%) | 0~95,70.00(32.50,90.00) |
| P53表达 | |
| 正常(野生型) | 253(61.9) |
| 异常(突变型) | 156(38.1) |
| 淋巴结切除范围 | |
| 仅行盆腔淋巴结切除术 | 308(75.3) |
| 盆腔+腹主动脉旁淋巴结切除术 | 101(24.7) |
| 淋巴结切除个数/个 | 10~93,32.00(22.00,41.00) |
| 淋巴结转移 | |
| 盆腔淋巴结转移 | 31(7.6) |
| 盆腔合并腹主动脉旁淋巴结转移 | 7(1.7) |
2.2 与淋巴结转移相关的单因素及多因素Logistic回归分析
单因素Logistic回归分析显示病理分级(P=0.028),淋巴脉管间隙侵犯(Lymphovascular space invasion,LVSI)(P=0.000),Ca125(P=0.000),ER(P=0.000),PR(P=0.000),P53表达(P=0.025)是淋巴结转移的相关因素,而年龄(P=0.363)及体质指数(P=0.598)因单因素分析P>0.05而未被纳入多因素分析。对于上述单因素分析中P<0.05的因素,进一步被纳入到多因素分析中,包括病理分级,LVSI,Ca125,ER,PR及P53表达。而多因素分析发现LVSI(P=0.000),Ca125(P=0.027),ER(P=0.004),PR(P=0.045),P53表达(P=0.003)与单因素分析结果趋势相同(表 2)。
| 变量 | 单因素分析 | 多因素分析 | |||||
| OR | 95% CI | P | OR | 95% CI | P | ||
| 分级(2 vs 1) | 2.390 | 1.100~5.192 | 0.028 | 2.082 | 0.843~5.142 | 0.112 | |
| LVSI (阳性vs阴性) | 9.459 | 4.613~19.394 | 0.000 | 11.079 | 4.684~26.204 | 0.000 | |
| Ca125 (≥35 vs < 35) | 3.696 | 1.835~7.443 | 0.000 | 2.639 | 1.114~6.254 | 0.027 | |
| ER阳性百分比(0~100%) | 0.971 | 0.959~0.983 | 0.000 | 0.977 | 0.962~0.993 | 0.004 | |
| PR阳性百分比(0~100%) | 0.975 | 0.965~0.986 | 0.000 | 0.985 | 0.970~1.000 | 0.045 | |
| P53表达(异常vs正常) | 2.159 | 1.101~4.235 | 0.025 | 3.602 | 1.565~8.290 | 0.003 | |
| 缩略词:LVSI:淋巴脉管间隙侵犯;ER:雌激素受体;PR:孕激素受体 | |||||||
2.3 与淋巴结转移相关的ER及PR的最佳阳性阈值
ROC曲线及约登指数(约登指数=敏感度+特异度-1)揭示预测淋巴结转移的ER最佳阳性阈值为38%(曲线下面积=0.737;灵敏度为73.7%;特异性为73.6%),PR最佳阳性阈值为43%(曲线下面积=0.719;灵敏度为71.1%;特异性为71.2%,图 1)。

|
| A:ER的最佳阳性阈值为38%(AUC=0.737;灵敏度为73.7%;特异度为73.6%);B:PR的最佳阳性阈值为43%(AUC=0.719;灵敏度为71.1%;特异度为71.2%) 图 1 ER及PR用于预测淋巴结转移的ROC曲线 |
2.4 各预测指标及其组合的临床预测价值
ROC曲线(图 2)显示,对于预测低危子宫内膜癌淋巴结转移而言,ER联合Ca125及P53表达的组合(组合B)的曲线下面积(AUC=0.0.837,95%CI:0.782~0.891)优于其他单一预测指标,包括病理参数LVSI(AUC=0.711,95%CI:0.611~0.811),血清学指标Ca125(AUC=0.628,95%CI:0.527~0.730),免疫组化标志物ER(AUC=0.736,95%CI:0.651~0.821),PR(AUC=0.711,95%CI:0.624~0.799)及P53表达(AUC=0.594,95% CI:0.498~0.690),差异具有显著统计学意义(P<0.05)。由于PR与ER存在多重共线性,在组合B基础上加入免疫组化指标PR(组合A)仅能小幅度提升预测性能(AUC=0.846,95%CI:0.791~0.901),相较于组合B而言,差异无明显统计学意义(P=0.818,表 3)。因此,基于预测因子的组合B及统计分析结果,构建了如下Logistics回归方程用于对低危子宫内膜癌淋巴结转移进行联合预测,最后根据回归方程计算每个患者的风险概率(即P值),并且以ROC曲线及约登指数确定回归方程预测的风险阈值为0.085(灵敏度为89.5%,特异度为69.3%)。
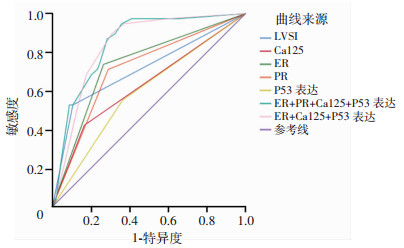
|
| 图 2 各预测指标的ROC曲线 |
| 变量 | AUC(95%CI) | P* |
| LVSI | 0.711(0.611~0.811) | 0.030 |
| Ca125 | 0.628(0.527~0.730) | < 0.001 |
| ER | 0.736(0.651~0.821) | 0.048 |
| PR | 0.711(0.624~0.799) | 0.017 |
| P53表达 | 0.594(0.498~0.690) | < 0.001 |
| 组合A:ER+PR+Ca125+P53表达 | 0.846(0.791~0.901) | 0.818 |
| 组合B:ER+Ca125+P53表达 | 0.837(0.782~0.891) | |
| LVSI:淋巴脉管间隙侵犯;ER:雌激素受体;PR:孕激素受体;*:各AUC值与组合B的AUC值相比较的统计学显著性 | ||
Ln[P/(1-P)] =-4.144+2.096X1+1.304X2+0.951X3
[注:P表示淋巴结转移风险概率,范围0~1;X1表示ER根据阳性阈值(38%)定义的二分类表达情况,取值0(ER高表达)或1(ER低表达);X2表示Ca125表达情况,取值0(Ca125 < 35)或1(Ca125>35);X3表示P53表达情况,取值0(P53正常表达)或1(P53异常表达)]
3 讨论在本研究中,经过单因素及多因素(表 2)分析发现LVSI(P=0.000),Ca125(P=0.027),ER(P=0.004),PR(P=0.045),P53表达(P=0.003)是低危子宫内膜癌患者淋巴结转移的相关预后因子,并且通过ROC曲线及约登指数确定了用于预测淋巴结转移的ER及PR的最佳阳性阈值,分别为38%及43%。该结果显示ER及PR阳性阈值较为一致,大约集中在40% 左右,这表明我们可以尝试以40%的阳性阈值对ER及PR进行二分类处理以作为预测淋巴结转移的一个辅助参考指标。在此基础上,通过比较ROC曲线下面积我们发现,ER联合Ca125及P53表达(表 3组合B)的预测性能优于其他单一预测指标,这表明在术前术后我们可以此方式进行联合预测,基于此,我们构建了Logistic回归方程,通过此方程我们可以更加精准地预测患者淋巴结转移状况,并根据回归方程风险阈值(0.085)进一步对低危患者进行风险分层。例如,对于术前预测风险概率大于0.085的患者,术中可适当增加前哨淋巴结活检的淋巴结个数或扩大活检范围以评估患者是否存在淋巴结转移,必要时(如前哨淋巴结活检证实淋巴结转移阳性)还需进行系统性淋巴结切除术;对于术后预测风险概率大于0.085的患者,由于其淋巴结转移风险较高,则可能需要补充适当的辅助治疗(放化疗),必要时(如术后短期影像学或其他辅助检查高度怀疑存在淋巴结转移)可能需进行二次手术以补充淋巴结切除术。
值得一提的是,尽管经典病理参数LVSI和淋巴结转移存在强烈的相关性,并且在其他许多类似研究中[1, 8],LVSI亦被认为是淋巴结转移的一个重要预测因子,但往往需要进行完整的全子宫切除术后才能对LVSI进行充分的评估[8],这表明LVSI不能作为很好的术前预测指标,因此在本研究中未将LVSI纳入到联合预测的组合因子中。与LVSI不同的是,血清学指标Ca125和免疫组化标志物ER及P53在术前常规检查及术前活检标本(例如术前诊刮活检)即可进行评估,因此在术前我们即可对患者淋巴结转移风险进行一个大致判断,以制定围术期治疗方案。当然,术前活检标本与术后病理标本诊断的一致性仍需进行前瞻性研究加以评估[10]。
我们的研究也存在一定的局限性。首先,该研究是单中心回顾性研究,需要多中心前瞻性实验加以验证;其次,该研究对免疫组化标志物ER及PR的结果判读存在主观误差,需要建立一个国际化的评估标准完善免疫组化结果的解读。
综上,我们分析了低危子宫内膜癌患者淋巴结转移的相关因素并确定了用于预测淋巴结转移的免疫组化标志物ER及PR的最佳阳性阈值(约为40%)。在此基础上,我们可以以ER联合Ca125及P53为最佳预测因子组合构建Logistic回归方程对低危子宫内膜癌淋巴结转移进行预测,并基于回归方程风险阈值(0.085)对患者进行风险分层,从而制定更加完善的手术计划及预后管理措施。
| [1] |
BENDIFALLAH S, CANLORBE G, LAAS E, et al. A predictive model using histopathologic characteristics of early-stage type 1 endometrial cancer to identify patients at high risk for lymph node metastasis[J]. Ann Surg Oncol, 2015, 22(13): 4224-4232. |
| [2] |
DONG Y Y, CHENG Y, TIAN W J, et al. An externally validated nomogram for predicting lymph node metastasis of presumed stage Ⅰ and Ⅱ endometrial cancer[J]. Front Oncol, 2019, 9: 1218. |
| [3] |
GÜLSEREN V, KOCAER M, ÖZDEMIRİ A, et al. Do estrogen, progesterone, P53 and Ki67 receptor ratios determined from curettage materials in endometrioid-type endometrial carcinoma predict lymph node metastasis?[J]. Curr Probl Cancer, 2020, 44(1): 100498. |
| [4] |
SMITH D, STEWART C J R, CLARKE E M, et al. ER and PR expression and survival after endometrial cancer[J]. Gynecol Oncol, 2018, 148(2): 258-266. |
| [5] |
杨文涛, 步宏. 乳腺癌雌、孕激素受体免疫组织化学检测指南[J]. 中华病理学杂志, 2015, 44(4): 237-239. YANG W T, BU H. Immunohistochemical detection guidelines of estrogen and progesterone receptors in breast cancer[J]. Chin J Pathol, 2015, 44(4): 237-239. |
| [6] |
National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology (NCCN Guidelines©) uterine neoplasms version 1.2021[EB/OL]. (2020-10-20)[2021-03-01]. https://www.nccn.org/.
|
| [7] |
PECORELLI S. Revised FIGO staging for carcinoma of the vulva, cervix, and endometrium[J]. Int J Gynaecol Obstet, 2009, 105(2): 103-104. |
| [8] |
MEYDANLI M M, ASLAN K, OZ M, et al. A novel multivariable prediction model for lymphatic dissemination in endometrioid endometrial cancer: The lymph node metastasis risk index[J]. Eur J Obstet Gynecol Reprod Biol, 2019, 240: 310-315. |
| [9] |
JIANG P, JIA M Z, HU J, et al. Prognostic value of Ki67 in patients with stage 1-2 endometrial cancer: validation of the cut-off value of Ki67 as a predictive factor[J]. Oncotargets Ther, 2020, 13: 10841-10850. |
| [10] |
YANG B, SHAN B, XUE X, et al. Predicting lymph node metastasis in endometrial cancer using serum CA125 combined with immunohistochemical markers PR and Ki67, and a comparison with other prediction models[J]. PLoS ONE, 2016, 11(5): e0155145. |
| [11] |
KÖBEL M, RONNETT B M, SINGH N, et al. Interpretation of P53 immunohistochemistry in endometrial carcinomas: toward increased reproducibility[J]. Int J Gynecol Pathol, 2019, 38(Suppl 1): S123-S131. |
| [12] |
SCHISTERMAN E F, PERKINS N J, LIU A, et al. Optimal cut-point and its corresponding Youden Index to discriminate individuals using pooled blood samples[J]. Epidemiology, 2005, 16(1): 73-81. |




