2. 637000 四川 南充,川北医学院: 附属医院心血管疾病研究室;
3. 637000 四川 南充,川北医学院: 基础医学院组织胚胎教研室
2. Department of Cardiovascular Diseases, Affiliated Hospital, North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China;
3. Department of Tissue and Embryology, Basic Medical College, North Sichuan Medical College, Nanchong, Sichuan Province, 637000, China
腹主动脉瘤是一种危及生命的心血管疾病,其特征是动脉壁进行性永久性扩张,与正常直径相比至少扩张50%以上[1]。国外流行病学调查显示,腹主动脉瘤在65岁以上男性发病率为4%~7%,女性发病率为1%~2%,其瘤体破裂死亡居65岁以上老年人群全部死因的第10位[2]。腹主动脉瘤的主要病理改变为慢性炎症、细胞外基质断裂、血管平滑肌细胞凋亡等[3]。目前对腹主动脉瘤发病机制的认识尚不明确,由于在体实验存在诸多局限,因此,构建理想的动物模型对研究腹主动脉瘤的发病机制具有重要意义。弹性蛋白酶腔内加压灌注联合氯化钙腔外浸润法是目前理想的建模方法之一,通过破坏中膜弹性纤维层并诱发炎症反应,激活内源性蛋白酶,模拟人类腹主动脉瘤细胞外基质降解及钙化的过程。尽管有大量的报道证明这种方法的有效性,但需借助显微外科技术,建模难度大,且存在长时间麻醉,高压灌注造成高死亡率以及下肢缺血造成高致残率[4-5]。此外,传统的手术方式为经腹腔入路,增加了腹腔感染机会,术中需对肠道牵拉,极易并发肠梗阻,并需对腹膜、后腹膜分离延长手术时间,增加了死亡风险[6]。而经腹膜后入路可直达腹主动脉,避免了经腹腔入路所致的风险,经腹膜后入路可采用侧卧位经腰部切口或俯卧位经背部切口施术。因此,本研究采用经腹膜后入路简化手术方式,并联合腔内弹性蛋白酶灌注和腔外氯化钙浸润法,期望构建简单易行,且具有高成瘤率,低死亡率,可复制性和拟人性强的大鼠腹主动脉瘤模型。
1 材料与方法 1.1 材料健康成年SD大鼠20只,体质量250~300 g,购自川北医学院实验动物中心。自由摄食进水,室温22~25 ℃,定时通风,术前5只一笼群养,术后单笼饲养。主要试剂:Ⅰ型猪胰弹性蛋白酶(E1250)购自美国Sigma公司。无菌氯化钙1 mol/L购自北京诺博莱德科技有限公司。弹力纤维染色液(EVG)购自珠海贝索生物技术有限公司。改良Masson三色染色液购自Solarbio公司。smooth muscle actin Polyclonal antibody和抗鼠/兔通用型免疫组化检测试剂盒购自Proteintech公司。显微外科手术器械、游标卡尺购自上海手术器械厂。明胶海绵购自南昌沪士达医疗科技有限公司。一次性胰岛素注射器1 mL(30 G)购自贝朗公司。切片机为Leica CM3050S,显微镜Nikon E600及显微镜成像系统Nikon DXM1200为日本尼康公司产品。
1.2 实验分组20只大鼠按雌雄比例1 ∶1,随机分为模型组和对照组,每组10只。模型组为弹性蛋白酶灌注和氯化钙浸润组,对照组为生理盐水组。所有大鼠术后饲养4周,术后4周开腹收集腹主动脉标本。
1.3 动物模型建立大鼠术前12 h禁食,按40~50 mg/kg,予戊巴比妥钠麻醉,麻醉满意后取右侧卧位,常规备皮,消毒,取左侧腋后线肋缘下至大腿根部间连线为切口,长3.0~3.5 cm,逐层切开皮肤,皮下组织及肌肉,便可见腹膜后脂肪组织,并沿着脂肪组织找到腹膜与腰背肌潜在间隙,用棉签分离此间隙可直达腹主动脉,仔细分离腹主动脉与下腔静脉,于左肾下方游离长约1 cm的腹主动脉主干,用游标卡尺测量肾下腹主动脉直径,并记录(由两人测量,取平均值)。
充分游离并用慕丝线结扎灌注段腹主动脉分支,用乳突撑开器充分暴露手术视野,先用显微血管夹阻断腹主动脉近端,接着用显微止血钳将灌注段血管内血液挤向远端,再用显微血管夹阻断腹主动脉远端(两血管夹之间距离应>0.5 cm),血管完全塌陷,表明血管密闭性好,然后用一次性胰岛素注射器(1 mL 30 G)抽取0.2 mL弹性蛋白酶(约含10 U), 并用血管钳将注射器针头稍折弯,使其略呈“L”型后穿刺腹主动脉,穿刺成功后缓慢注入弹性蛋白酶0.1 mL(约含5 U),便使灌注段腹主动脉充分充盈,固定穿刺针,保留20 min,期间若有少许弹性蛋白酶外渗及时补充,使灌注段腹主动脉始终保持充分充盈状态,术毕回抽血管内药物,拔针,明胶海绵覆盖穿刺点,棉球加压,先取远端血管夹,再取近端血管夹,观察数分钟,未见活动性出血,便将浸泡在1.0 mol/L无菌氯化钙中的小纱条敷在灌注段腹主动脉表面,10 min后取出小纱条,清洗腹膜后间隙,检查若无出血,逐层关闭切口。术后大鼠单笼饲养,常规进食。见图 1。
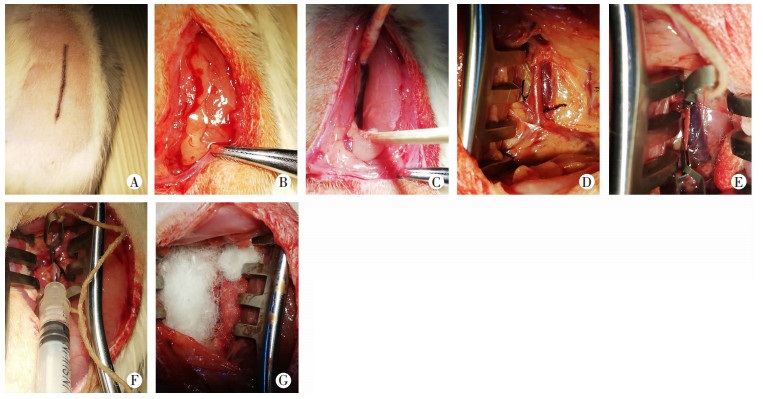
|
| A: 手术切口; B: 腹膜后间隙标志腹膜后脂肪; C: 腹膜后间隙入口; D: 结扎灌注段腹主动脉侧支; E: 阻断灌注段腹主动脉; F: 弹性蛋白酶灌注; G: 氯化钙浸润 图 1 大鼠肾下腹主动脉瘤模型建立手术过程 |
计算大鼠手术成功率、存活率和腹主动脉瘤成瘤率。手术成功率=术中存活大鼠数量/总大鼠数量×100%;存活率=术中和术后存活大鼠数量/总大鼠数量×100%;成瘤率=达到成瘤标准大鼠数量/总大鼠数量×100%。腹主动脉扩张率=(术后4周腹主动脉直径-灌注前腹主动脉直径)/灌注前腹主动脉直径×100%。以术后4周腹主动脉扩张率50%以上或动脉瘤破裂作为诊断腹主动脉瘤的标准[6]。
1.4 取材及病理学观察术后4周,再次麻醉大鼠,经腹腔入路游离出灌注段腹主动脉,观察形态并拍照,用游标卡尺测量直径,并记录(由两人测量,取平均值),取下灌注段腹主动脉放入4%多聚甲醛固定,石蜡包埋。
1.4.1 HE染色组织切片常规脱蜡、水化;苏木精染4 min;流水冲洗1 min;1%盐酸酒精分化10 s;流水冲洗1 min;伊红染3.5 min;流水冲洗1 min;脱水;透明;封片。
1.4.2 Masson染色组织切片常规脱蜡、水化;Bouin液滴染室温过夜;流水冲洗至切片上黄色消失;天青石蓝染色液滴染3 min;流水冲洗5 s;Mayer苏木精染色液滴染3 min;流水冲洗5 s;酸性乙醇分化液分化8 s;流水冲洗10 min;丽春红品红染色液滴染10 min;蒸馏水冲洗5 s;磷钼酸溶液处理10 min;倾去上液,切片不水洗,直接滴入苯胺蓝染液5 min;倾去上液滴入弱酸处理2 min;脱水;透明;封片。
1.4.3 EVG染色组织切片常规脱蜡、水化;高锰酸钾溶液滴染5 min;流水冲洗5 s;草酸溶液滴染3 min;流水冲洗5 s;95%乙醇5 s;Elastin滴染37 ℃ 30 min(组织切片放入湿化盒,每5~10分钟补加Elastin染液,防止切片干涸);95%乙醇分化5 s;流水冲洗3 min;Van Gieson滴染1 min,倾去染液,不可经水洗;95%乙醇分化5 s;脱水;透明;封片。
1.5 免疫组织化学检测组织切片常规脱蜡、水化;柠檬酸抗原修复;3%H2O2去除内源性过氧化物酶;5%山羊血清封闭;孵育smooth muscle actin Polyclonal antibody4度过夜;孵育抗兔/鼠HRP标记聚合物二抗室温30 min;DAB显色;苏木精复染;脱水、透明、封片。阳性表现为细胞质呈棕褐色,每张切片在高倍镜视野下随机选取5个视野测量阳性区域面积。
1.6 统计学分析采用SPSS 21.0统计软件对数据进行分析。计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以率(%)表示,采用χ2检验或Fisher确切概率法。P<0.05表示差异有统计学意义。采用Image J和Image Pro Plus6.0软件进行图像分析和血管参数测量。
2 结果 2.1 动物存活率及手术成功率两组手术成功率均为100%。对照组术中、术后均无死亡,存活率100%。模型组术中无死亡,术后第4天和第19天分别死亡1只,死亡原因为动脉瘤破裂出血,存活率80%。两组动物存活率和手术成功率差异无统计学意义(P>0.05)。
2.2 腹主动脉扩张程度及成瘤率两组灌注前腹主动脉直径分别为(1.23±0.09)mm,和(1.28±0.13)mm,差异无统计学意义(P>0.05)。术后4周两组腹主动脉直径和扩张率分别为[(1.31±0.08)mm,(6.69±5.29)%]和[(2.25±0.58)mm,(76.10±37.99)%],差异具有统计学意义(P<0.05)。对照组无1例成瘤,模型组有8只成瘤,成瘤率为80%。见图 2。

|
| A: 对照组灌注段腹主动脉无扩张;B: 模型组灌注段腹主动脉囊状动脉瘤局部;C、D:分别为模型组第4天和第19天动脉瘤破裂出血 图 2 大鼠腹主动脉扩张程度及成瘤外观 |
2.3 灌注段腹主动脉大体及组织学改变
模型组腹主动脉呈梭形或囊状扩张,灌注段腹主动脉周围黏连明显,局部可见钙化灶。镜检见管壁变薄,中膜细胞外基质降解,部分夹层形成,弹性纤维失去连续性,部分断裂、缺失,平滑肌细胞减少,中外膜炎症细胞浸润。对照组无上述现象。与对照组比较,模型组血管厚度减小、弹性纤维含量、胶原纤维含量、平滑肌细胞含量均显著减少(P<0.05,表 1、图 3)。
| 组别 | n | 腹主动脉扩张率(%) | 血管厚度/μm | 弹性纤维含量(%) | 胶原纤维含量(%) | 平滑肌细胞含量(%) |
| 对照组 | 10 | 6.69±5.29 | 52.09±42.41 | 37.47±9.62 | 26.27±4.30 | 36.51±4.97 |
| 模型组 | 8 | 76.10±37.99a | 18.14±6.02a | 19.54±5.09a | 21.50±4.04a | 19.98±3.04a |
| a: P<0.05,与对照组比较 | ||||||

|
| 图 3 大鼠术后4周腹主动脉病理组织学变化 |
3 讨论
目前腹主动脉瘤的发病机制尚不明确,构建简单可靠的腹主动脉瘤动物模型为研究腹主动脉瘤发病机制及治疗方法提供理论和实践基础。腹主动脉瘤动物模型主要通过模拟炎症反应、内膜损伤、细胞外基质降解、内源性蛋白酶激活等实现[7]。建模方法主要分为物理模型、基因缺陷模型、化学诱导模型。物理模型主要用于外科手术治疗的研究,基因缺陷模型主要用于研究遗传学和基因治疗,化学诱导模型主要用于发病机制的研究[8]。可惜的是,这些已建立的模型不能完全模拟人类腹主动脉瘤病理生理过程[9]。为了解决目前动物模型的不足,研究者在此基础上不断改进,通过联合两种或多种化学诱导方法构建出与人类腹主动脉瘤高度相似的模型。其中最常用的是TANAKA等[10]提出的腔内弹性蛋白酶灌注联合腔外氯化钙浸润构建大鼠腹主动脉瘤模型。然而,该建模手术入路方式与传统建模方式相同,均为经腹腔入路施术,该入路的缺点是操作复杂,手术难度较大,有腹腔感染风险,术中需对肠道牵拉,极易并发肠梗阻和损伤腔内脏器,并需对腹膜、后腹膜分离延长手术时间,增加了死亡风险。为了降低手术难度,提高手术成功率和存活率,本研究采用经腹膜后入路施术,经腹膜后入路是泌尿外科常用手术方式[11],由于腹主动脉与肾脏解剖位置毗邻同属于腹膜外位器官,为经腹膜后入路构建大鼠肾下腹主动脉瘤模型提供可能。经该入路的优点是可直达腹主动脉,无腔内脏器干扰,操作相对简单,可避免经腹腔入路所致的风险。本研究证实了经腹膜后入路构建大鼠肾下腹主动脉瘤模型是切实可行的。该入路局限之处是:①腹膜后间隙为非自然腔隙,缺乏体表标志,寻找手术入口较传统经腹腔手术难度大;②腹膜后间隙狭小,视野暴露及操作空间有限,完全游离裸露全段腹主动脉难度较大。
为此,本研究在TANAKA等实验的基础上对一些细节加以改进,进一步简化手术操作,同时保证成瘤率。与传统建模方式比较除了手术入路不同外,还有以下优点:①不需完全游离裸露全段肾下腹主动脉,保证灌注段腹主动脉>0.5 cm即可,无论采取哪种入路施术,过多游离裸露血管会增加副损伤导致大出血,或因结扎过多分支及腰动脉导致局部组织和脊髓缺血进而增加大鼠死亡风险。②传统的弹性蛋白酶灌注需利用液压或微量泵注射器维持100 mmHg甚至更高的灌注压,然而实际上并不能准确达到并维持相等的压力,过高的压力可致弹性蛋白酶进入循环导致大鼠死亡[12-14]。且灌注结束后需结扎穿刺侧髂动脉或股动脉[4, 10],易发生单侧肢体缺血坏死,致残率高。虽有将穿刺部位改为腹主动脉,灌注结束后换成可吸收血管缝合线修复腹主动脉穿刺口,恢复腹主动脉原有解剖结构的报道[6],但该法需借助显微外科技术,操作难度大,术者需有一定的血管外科基础,限制了广泛应用。本研究未采用加压灌注,因为人类腹主动脉瘤形成过程也没有外在机械性压力的作用[10]。仅需将弹性蛋白酶缓慢注入灌注段腹主动脉,使其保持充盈即可,所选择的穿刺针为胰岛素针(30 G),对血管损伤极小,灌注结束后局部压迫便可止血。显著提高了手术成功率,使模型更符合人类腹主动脉瘤形成过程。此方法简单易行,不需借助显微外科技术和微量泵等昂贵仪器,易于推广。③减少了弹性蛋白酶的用量(5 U), 过大的弹性蛋白酶用量易导致大鼠死亡[13]。为了不影响成瘤率,在减少弹性蛋白酶用量的同时,加大氯化钙浓度(1.0 mmol/L),因为氯化钙浓度与动脉瘤的形成密切相关,据报道0.2~1.0 mmol/L浓度都可在大小鼠不同遗传背景下成功诱导动脉瘤形成[15-16]。④缩短了灌注时间(20 min),经典的弹性蛋白酶灌注时间是2 h,过长的阻断腹主动脉时间,易形成血栓,且血液长时间集中在阻断部位以上易导致脑水肿和下肢缺血,死亡率高[17-18]。汪浩等[19]将灌注时间缩短至30 min成功建立了腹主动脉瘤,显著减少了脑水肿的发生,降低了死亡率,但仍有一定比例的下肢缺血发生率。本研究在联合氯化钙浸润的基础上,缩短灌注时间至20 min,无1例下肢缺血发生,且不影响成瘤率。
通过手术入路的改变及术中细节的改进,本研究中手术成功率100%,总存活率90%,模型组成瘤率80%,瘤体在组织形态学、血管基质破坏方面与人类腹主动脉瘤病理生理表现高度相似。该建模方法简单易行,不需借助显微外科技术和昂贵仪器设备,且有高成瘤率,低死亡率,可复制性和拟人性强等优点,是研究腹主动脉瘤发病机制及治疗方法理想的动物模型。
| [1] |
ZHAO G, LU H, CHANG Z, et al. Single-cell RNA sequencing reveals the cellular heterogeneity of aneurysmal infrarenal abdominal aorta[J]. Cardiovasc Res, 2021, 117(5): 1402-1416. |
| [2] |
WANHAINEN A. Response to "Re 'European society for vascular surgery (ESVS) 2019 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms'"[J]. Eur J Vasc Endovascular Surg, 2020, 60(6): 951. |
| [3] |
GOLLEDGE J. Abdominal aortic aneurysm: update on pathogenesis and medical treatments[J]. Nat Rev Cardiol, 2019, 16(4): 225-242. |
| [4] |
ANIDJAR S, SALZMANN J L, GENTRIC D, et al. Elastase-induced experimental aneurysms in rats[J]. Circulation, 1990, 82(3): 973-981. |
| [5] |
BUSCH A, CHERNOGUBOVA E, JIN H, et al. Four surgical modifications to the classic elastase perfusion aneurysm model enable haemodynamic alterations and extended elastase perfusion[J]. Eur J Vasc Endovasc Surg, 2018, 56(1): 102-109. |
| [6] |
熊飞, 曾国军, 赵纪春, 等. 大鼠肾下型腹主动脉瘤模型的建立及方法改良[J]. 四川大学学报(医学版), 2014, 45(6): 1010-1014. XIONG F, ZENG G J, ZHAO J C, et al. Establishment of experimental abdominal aortic aneurysm model in rats[J]. J Sichuan Univ Med Sci Ed, 2014, 45(6): 1010-1014. |
| [7] |
YUAN Z, LU Y, WEI J, et al. Abdominal aortic aneurysm: roles of inflammatory cells[J]. Front Immunol, 2020, 11: 609161. |
| [8] |
TROLLOPE A, MOXON J V, MORAN C S, et al. Animal models of abdominal aortic aneurysm and their role in furthering management of human disease[J]. Cardiovasc Pathol, 2011, 20(2): 114-123. |
| [9] |
SÉNÉMAUD J, CALIGIURI G, ETIENNE H, et al. Translational relevance and recent advances of animal models of abdominal aortic aneurysm[J]. Arterioscler Thromb Vasc Biol, 2017, 37(3): 401-410. |
| [10] |
TANAKA A, HASEGAWA T, CHEN Z, et al. A novel rat model of abdominal aortic aneurysm using a combination of intraluminal elastase infusion and extraluminal calcium chloride exposure[J]. J Vasc Surg, 2009, 50(6): 1423-1432. |
| [11] |
PRUDHOMME T, ROUMIGUIÉ M, GAS J, et al. Comparison between retroperitoneal and transperitoneal laparoscopic adrenalectomy: Are both equally safe?[J]. J Visc Surg, 2020, S1878-S7886(20): 30216-2. |
| [12] |
AZUMA J, ASAGAMI T, DALMAN R, et al. Creation of murine experimental abdominal aortic aneurysms with elastase[J]. J Vis Exp, 2009(29): 1280. |
| [13] |
YAMAGUCHI T, YOKOKAWA M, SUZUKI M, et al. Factors influencing mortality in the rat elastase-induced-aneurysm model[J]. J Surg Res, 2000, 94(2): 81-83. |
| [14] |
YUE J N, YIN L, SHEN J, et al. A modified murine abdominal aortic aneurysm rupture model using elastase perfusion and angiotensin Ⅱ infusion[J]. Ann Vasc Surg, 2020, 67: 474-481. |
| [15] |
KARAPOLAT S, UNLU Y, ERKUT B, et al. Influence of indomethacin in the rat aneurysm model[J]. Ann Vasc Surg, 2006, 20(3): 369-375. |
| [16] |
BASALYGA D M, SIMIONESCU D T, XIONG W F, et al. Elastin degradation and calcification in an abdominal aorta injury model: role of matrix metalloproteinases[J]. Circulation, 2004, 110(22): 3480-3487. |
| [17] |
GUARINI S. A highly reproducible model of arterial thrombosis in rats[J]. J Pharmacol Toxicol Methods, 1996, 35(2): 101-105. |
| [18] |
曹旭, 王嫕, 秦彦文. 腔内弹力蛋白酶压力灌注联合腔外氯化钙浸润构建腹主动脉瘤大鼠模型[J]. 中国医药, 2014, 9(2): 225-229. CAO X, WANG Y, QIN Y W. A novel rat model of abdominal aortic aneurysm set up by combination of intraluminal elastase-infusion and extraluminal calcium chloride exposure[J]. China Med, 2014, 9(2): 225-229. |
| [19] |
汪浩, 景在平. 腹主动脉瘤发病机理的实验研究I.腹主动脉瘤动物模型的建立及改进[J]. 中国现代普通外科进展, 2002, 5(4): 211-213. WANG H, JING Z P. Improvement in the elastase-induced rat model of abdominal aortic aneurysm[J]. Chin J Curr Adv Gen Surg, 2002, 5(4): 211-213. |




