2. 710061 西安,西安交通大学第一附属医院脑研究中心;
3. 710004 西安,西安交通大学第二附属医院儿科;
4. 400715 重庆,西南大学生命科学院;
5. 400038 重庆,陆军军医大学(第三军医大学)基础医学院:组织胚胎学教研室
2. Center for Brain Science, the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an, Shaanxi Province, 710061;
3. Department of Pediatrics, the Second Affiliated Hospital of Xi'an Jiaotong University, Xi'an, Shaanxi Province, 710004;
4. School of Life Sciences, Southwest University, Chongqing, 400715, China;
5. Department of Histology and Embryology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038
阿尔茨海默病(Alzheimer’s disease, AD)是导致痴呆症的最主要原因,也是严重威胁人类健康的神经退行性疾病。迄今为止,AD尚无有效的预防和治疗方法[1-2]。流行病学调查显示绝经后女性AD发病率高于男性,提示绝经导致的雌激素(estrogens, E2)缺乏可能是AD发病的重要因素之一[3-4],但针对AD的雌激素替代治疗(estrogen replacement therapy, ERT)的效果并不理想,且有致雌激素反应性肿瘤的风险[5-6]。此外,除了女性易患AD以外, 男性AD发病率也呈逐年增加的趋势,给家庭和社会带来沉重的经济和精神负担,因此亟须寻找AD预防和治疗的新靶点。
E2是由芳香化酶(aromatase, AROM)催化雄激素转化而来,因此AROM是E2合成过程中的限速酶。近年研究证实,除了外周组织如卵巢有高水平的E2外,多个脑区如海马和下丘脑等都能合成E2[7],更有研究表明AD患者脑源性E2水平显著低于对照而血液中E2水平相当,提示脑源性E2缺乏可能是导致AD发病的关键危险因素[8]。实验动物研究结果显示,海马的E2生成可能独立于外周组织[9],雄性和雌性小鼠海马的E2浓度分别高达8 nmol/L和0.5~2.0 nmol/L,均远远高于外周血中E2的浓度[9-11]。然而,目前关于海马E2的功能及其机制研究多来自于利用AROM抑制剂所进行的离体海马脑片研究,这些研究发现抑制脑片AROM后突触和树突棘的数量、电生理特性如LTP的振幅等突触可塑性指标会发生变化[12-14]。为数不多的在体实验结果显示,海马内注射AROM抑制剂可破坏小鼠的物体识别和物体位置记忆巩固[15-16]、导致斑马雀的空间记忆功能损害[17],脑室内注射AROM抑制剂可以阻断外周E2替代所诱导的海马依赖性记忆,提示海马源性的E2介导了外周E2诱导的认知增强功能[18]。我们前期工作证实,用RNA干扰技术抑制海马AROM后可导致空间学习记忆下降和突触可塑性改变,在卵巢切除小鼠海马抑制AROM则可进一步加重小鼠的空间学习记忆障碍和突触可塑性改变[19]。但是,海马特异性过表达AROM能否改善痴呆小鼠的症状、对痴呆小鼠海马突触可塑性和AD病理有什么作用尚不清楚。
因此,本研究拟利用雄性APP/PS1转基因小鼠(AD小鼠),在明确其海马AROM与相关分子表达增龄性变化特点的基础上,构建AROM过表达病毒载体(oAROM)并立体定位注射到AD小鼠海马,明确海马特异性过表达AROM对AD小鼠空间学习记忆、特异性病理特征(Aβ沉积、tau-磷酸化)、actin细胞骨架动态变化(Profilin-1和Cofilin)及突触蛋白表达[PSD-95、synaptophysin(SYN)和GluR1]、CA1突触密度与突触后膜厚度的影响,从而为寻找治疗AD的新靶点提供实验证据。
1 材料与方法 1.1 实验动物、主要器材与试剂不同月龄雄性APP/PS1(APPsw/PS1dE9)转基因痴呆小鼠(AD小鼠)和雄性同月龄野生型(wild type, WT)小鼠由南京君科生物工程有限公司提供。于SPF级环境饲养,12 h光照,自由进食、水,室温20~25 ℃,湿度为50%~70%。
实验所用立体定位注射仪和小动物麻醉剂来自深圳瑞沃德生物技术有限公司,Morris水迷宫来自众实迪创科技发展有限公司,高尔基染液试剂盒购自美国FD Neurotechologies公司,DAB试剂盒购自美国Vector公司。实验所用一抗AROM(ab18995)、AR(ab133273)、BACE1(ab108394)、ADAM10(ab124695)、tau(ab32057) 和p-tau396(ab109390)购自美国Abcam公司,Rictor(sc-271081)、Aβ (6E10,sc-28365)、SRC-1(sc-8995)、ERα(sc-542)和IDE(sc-393887)购自美国Santa Cruz公司, PSD-95(3409S)、Cofilin(3318S)、Profilin-1(3237S),P-AKT(92717)和AKT(9272)购自美国Cell Signaling公司,GluR1(04-855)和SYN(04-1019)购自美国Millipore公司。HRP-交联的各种二抗(羊抗兔、羊抗小鼠等)均购自北京中杉金桥生物技术公司;ECL化学发光液购自美国Bio-Rad公司。
1.2 海马芳香化酶过表达腺相关病毒载体的构建AROM过表达腺相关病毒载体(AAV)由上海和元生物技术有限公司提供,病毒载体构建示意图如图 3-A所示。正义序列: 5′-AAAACCCCGGTCCGGCTAG-CGCCACCATGTTCTTGGAAATG-3′;反义序列:5′-TCG-CCAGATCCGCCGGATCCCTGTTGGAGGTACTTGTCTG-AATTC-3′。AAV病毒载体构建后经效率验证后用于后续病毒注射实验。
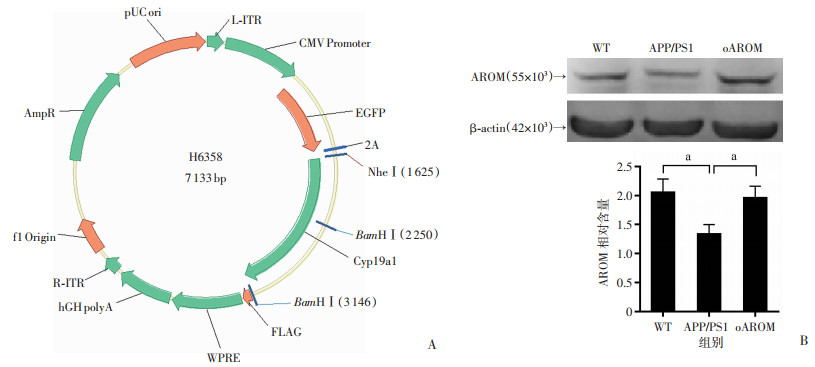
|
| A:AROM过表达病毒载体结构示意图AROM基因(Cyp19a1)过表达序列位于BamHⅠ(2250)和BamHⅠ(3146)之间;B:Western blot检测9月龄WT小鼠、APP/PS1小鼠及oAROM小鼠AROM的表达a:P < 0.05 图 3 小鼠海马AROM过表达病毒载体的构建与验证 |
1.3 海马过表达AROM小鼠模型的制备
实验动物分为WT、AD小鼠空病毒载体组(APP/PS1)和AD小鼠海马过表达芳香化酶组(oAROM)。小鼠海马立体定位注射参考课题组前期方法进行[19-20]。将6月龄小鼠称体质量后用4%水合氯醛(100 mL/kg)腹腔麻醉;将小鼠固定于立体定位仪上,3% H2O2擦拭后去骨膜,暴露前囟,以前囟与矢状缝交点为原点,旁开1.5 mm,后开1.6 mm处即为海马的体表透射点。将微量注射器平颅骨平面下行2 mm,每侧注射1 μL病毒,5 min注射完毕后原位留置5 min,缓慢退出注射器;缝合皮肤及皮下组织。小鼠置于28 ℃恒温鼠笼中苏醒后正常饲养。对照组APP/PS1小鼠采用相同的操作步骤进行空载体病毒注射。3个月后进行空间学习记忆行为学检测,然后灌注取海马进行相关指标检测。另取9月龄雄性WT小鼠作为空白对照。
1.4 Morris水迷宫实验检测小鼠空间学习记忆行为的变化各组小鼠空间学习记忆的检测按照课题组前期方法进行[20]。实验开始前1 d,先进行适应性训练,以确保每只小鼠的动物运动能力的一致性并且没有视觉障碍。在学习期的隐藏平台试验中,动物每天以随机象限入水,在第1~5天的同一时段重复此试验。在第6天的记忆测试中撤掉平台,各组小鼠均从对侧象限入水,记录时间为60 s,记录并分析小鼠的运动轨迹、各象限停留时间、穿越平台的次数、游泳速度和游泳距离等参数。
1.5 免疫荧光/免疫组化检测海马Aβ的表达将各组小鼠进行灌注取海马组织,后固定在4%多聚甲醛中,常规包埋后行冷冻切片(片厚20 μm),然后按课题组前期的实验方法[21]行Aβ免疫组化(硫酸镍铵增强显色法)和免疫荧光染色。
1.6 Western blot检测芳香化酶相关蛋白、Aβ相关蛋白、突触蛋白与actin骨架聚合相关蛋白的表达参考课题组前期的实验方法进行[21]。各组小鼠麻醉后取其海马组织,按照蛋白提取试剂盒(N-PERTM Neuronal Protein Extraction Reagent,Thermo ScientificTM,87792)的操作说明提取海马组织总蛋白。蛋白在沸水中变性、冷却后,-80 ℃冰箱保存备用。配好胶后,每组取20 μL进行电泳,PVDF膜封闭后加入相应稀释倍数的一抗,4 ℃孵育过夜,TBST洗膜3次,15 min/次,27 ℃孵育二抗1.5 h,TBST洗膜3次,15 min/次。最后曝光显影。通过扫描密度测定和计算机辅助图像分析对信号进行量化。以β-actin为内参,蛋白质水平为目的蛋白质与内参的比值。
1.7 透射电镜检测海马突触密度及突触后膜厚度参考课题组前期方法进行[20]。分离各组小鼠海马后,将其转移到2.5%冷戊二醛中。4 ℃固定24 h,乙醇梯度脱水,环氧丙烷过渡。用环氧树脂Epon812渗透与包埋,对海马CA1区辐射层超薄切片,4%醋酸铀酰和枸橼酸染色,40KV透射电镜下观察拍照。应用Image-Pro Plus软件和三维测量技术分析CA1区的突触密度及突触后膜厚度[22]。突触密度的计算公式为Nv=8ENa/π2,Nv为突触密度,Na=ΣNx/ΣAr,Na为单位面积内的突触数目, Nx为突触数目,Ar为拍摄图片的面积,E为突触长度倒数的平均值。
1.8 统计学分析实验均重复3次,数据结果以x±s表示。应用SPSS 22.0软件进行统计分析。行为学数据采用重复测量的双因素混合方差分析(时间×处理因素),其他数据采用单因素方差分析(Tukey test),检验水准α=0.05。
2 结果 2.1 雄性WT和AD小鼠海马AROM与相关蛋白表达的变化将2、4、6、8、10月龄雄性WT小鼠和APP/PS1小鼠灌注取脑,解剖显微镜下分离双侧海马组织进行Western blot结果显示:WT小鼠10月龄时海马AROM表达才开始下降,而AD小鼠在6月龄时AROM表达即开始下降且表达水平显著低于6月龄对照小鼠(P < 0.01,图 1A)。各月龄WT小鼠海马雄激素受体(androgen receptor, AR)的表达无明显变化,而APP/ PS1组10月龄时海马AR才开始下降(和6月龄相比,P < 0.05)且较同月龄WT鼠显著降低(图 1B)。
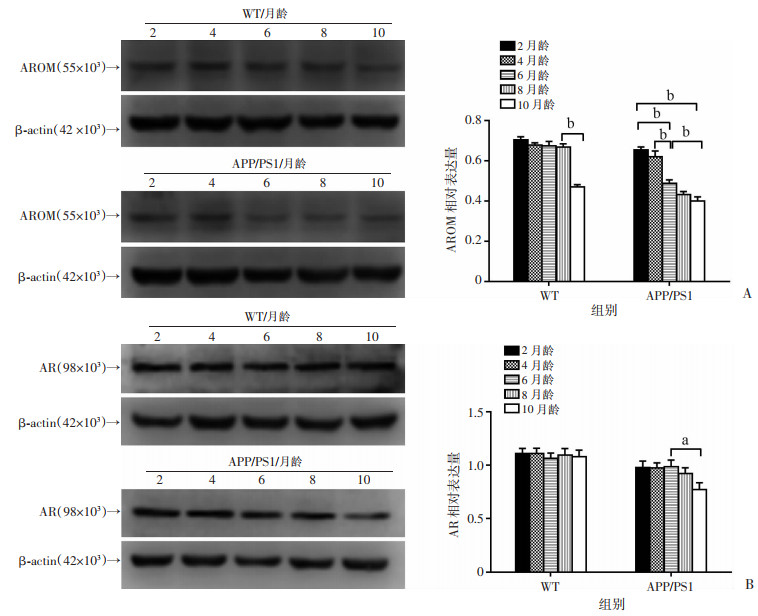
|
| a:P < 0.05;b: P < 0.01; A: 不同月龄的WT小鼠和APP/PS1小鼠海马AROM的表达;B: 不同月龄的WT小鼠和APP/PS1小鼠AR的表达 图 1 Western blot检测不同月龄WT小鼠和APP/PS1小鼠海马AROM和AR的表达 |
2~10月龄的WT小鼠雌激素受体ERα、类固醇受体辅助活化因子SRC-1的表达无明显变化(P>0.05),而APP/PS1组10月龄时ERα、SRC-1表达显著下降(和8月龄相比,P < 0.05或P < 0.01),且与同龄WT小鼠比较显著下降(图 2)。
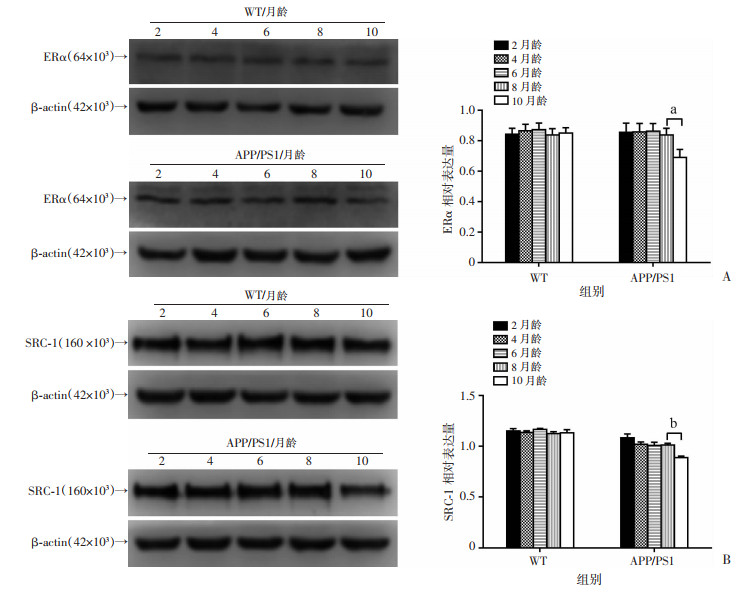
|
| a:P < 0.05;b:P < 0.01;A: 不同月龄的WT小鼠和APP/PS1小鼠海马ERα的表达;B: 不同月龄的WT小鼠和APP/PS1小鼠海马SRC-1的表达 图 2 Western blot检测不同月龄WT小鼠和APP/PS1小鼠雌激素相关蛋白的表达 |
2.2 小鼠海马AROM过表达病毒载体的构建与验证
构建小鼠AROM过表达腺相关病毒载体(图 3A)并注射到6月龄AD小鼠的海马,3个月后即9月龄时处死小鼠取海马进行Western blot实验,结果显示:9月龄时,oAROM小鼠海马AROM表达较APP/PS1对照小鼠明显增加,达到WT小鼠水平(P < 0.05,图 3B),表明海马注射病毒载体后能够有效过表达AROM,可用于后续实验。
2.3 AD小鼠海马过表达AROM对空间学习记忆的影响采用经典的Morris水迷宫试验检测oAROM对小鼠空间学习记忆能力的影响。结果显示:在前5 d的学习测试中,处理方法(F=12.798, P < 0.01)与实验天数(F=110.421, P < 0.01)均对小鼠学习记忆能力有显著影响,但两者无交互作用(F=0.849,P>0.05)。进一步分析结果显示随着训练天数的增加,3组小鼠的潜伏期逐渐缩短。但与WT组相比,APP/PS1组小鼠从第3天开始就出现了明显的空间学习记忆障碍(P < 0.05);而oAROM组与WT组和APP/PS1组从第4天开始出现明显差异(P < 0.05,P < 0.01),这种差异延续到了第5天(P < 0.01)。此外,3组小鼠的平均游泳速度(F=0.193,P>0.05)和总游泳距离(F=0.019,P>0.05)的差异无统计学意义,表明各组小鼠不存在运动障碍(图 4A~C)。

|
|
a:P < 0.05,b: P < 0.01;c:P < 0.01 A:3组小鼠学习过程中潜伏期的比较;B、C:记忆测试中3组小鼠游泳距离和游泳速度的比较;D~J:3组小鼠在目标象限停留的代表性轨迹图与停留时间的比较;K:3组小鼠穿过平台次数的比较 图 4 海马特异性过表达AROM对3组小鼠空间学习记忆的影响 |
第6天的空间记忆测试单因素方差分析(F=6.691,P < 0.01)结果显示:APP/PS1小鼠在目标象限的停留时间较WT小鼠明显减少(P < 0.01),但该变化可被oAROM所逆转至WT小鼠正常水平(P>0.05)。另外,各组小鼠在目标象限的停留时间(F=7.223,P < 0.01)均显著高于其他3个象限(P < 0.01),APP/PS1小鼠穿越平台次数显著少于WT(P < 0.01)和oAROM组(P < 0.05),但WT组与oAROM组相比差异无统计学意义(P>0.05),见图 4D~K。表明过表达AROM可预防APP/PS1小鼠的空间学习记忆障碍。
2.4 AD小鼠海马过表达AROM对AD病理(Aβ和p-tau)的影响免疫组化(F=124.1,P < 0.01)和免疫荧光(F=247.2,P < 0.01)结果均显示,WT小鼠海马未见明显Aβ沉积,APP/PS1组小鼠海马可见大量的Aβ沉积斑块(P < 0.01),但在oAROM小鼠海马Aβ斑块则显著减少(P < 0.01),表明海马过表达AROM可抑制APP/PS1组小鼠海马Aβ的沉积,见图 5A、B。

|
|
a:P < 0.05,b: P < 0.01 A、B:免疫组化/免疫荧光检测过表达AROM对AD小鼠海马Aβ沉积水平的影响;C~E:Western blot检测过表达AROM对AD小鼠海马Aβ代谢相关蛋白的影响; F:过表达AROM对AD小鼠海马p-tau表达的影响 图 5 海马特异性过表达AROM对AD特征性病理及相关蛋白表达的影响 |
Western blot检测结果显示,AD小鼠海马ADAM10(即α-分泌酶)表达较对照WT小鼠显著降低(P < 0.05),但oAROM并不能逆转该下降。然而,oAROM可显著下调AD小鼠BACE1(即β分泌酶)的表达(P < 0.05),并上调IDE的表达(P < 0.01),表明海马过表达AROM可通过抑制Aβ生成且促进其降解,从而预防Aβ沉积形成老年斑,见图 5C~E。
Western blot检测各组小鼠微管相关tau蛋白的过度磷酸化(p-tau)的表达,结果显示AD小鼠海马p-tau的表达较WT小鼠显著增加(P < 0.01),但在一定程度上可被oAROM所逆转(P < 0.05,图 5F)。
2.5 AD小鼠海马过表达AROM对海马突触密度、突触后膜厚度与突触蛋白表达的影响采用透射电镜检测各组小鼠海马CA1区的突触密度及突触后膜的厚度,结果显示:与WT小鼠比较,AD小鼠的突触密度及突触后膜的厚度显著下降(P < 0.01),oAROM处理后尽管不能达到对照水平,但仍可显著提升AD小鼠的突触密度及突触后膜厚度(P < 0.01,图 6A、B)。

|
|
a:P < 0.05,b: P < 0.01 A:透射电镜观察各组小鼠海马CA1辐射区突触形态及突触密度统计分析;B:透射电镜观察各组小鼠海马CA1辐射区突触形态及突触后膜厚度统计分析;C~E:Western blot检测各组小鼠突触可塑性相关调节蛋白的表达 图 6 透射电镜和Western blot检测海马特异性过表达AROM对AD小鼠海马突触密度、突触后膜厚度及突触蛋白表达的影响 |
Western blot检测结果显示, AD小鼠海马PSD-95、SYN表达较WT小鼠显著下降(P < 0.01),而过表达AROM能逆转这一下降趋势甚至恢复至WT小鼠水平(图 6C、D)。但与WT小鼠比较,APP/PS1组及oAROM组谷氨酸受体(GluR1)表达无变化,表明海马过表达AROM不影响GluR1的表达(P>0.05,图 6E)。
2.6 AD小鼠海马过表达AROM对actin细胞骨架调节相关蛋白的作用Western blot检测结果显示,AD小鼠海马Rictor、P-AKT和Profilin-1的表达较WT小鼠显著下降(P < 0.05),见图 7。而这些下降均可被oAROM所逆转(P < 0.05或<0.01)。相反,与WT小鼠比较,AD小鼠Cofilin显著上调(P < 0.01,图 7),且被oAROM所阻断(P < 0.01,图 7)。结果表明海马过表达AROM对actin细胞骨架的聚合有强烈的修复作用。
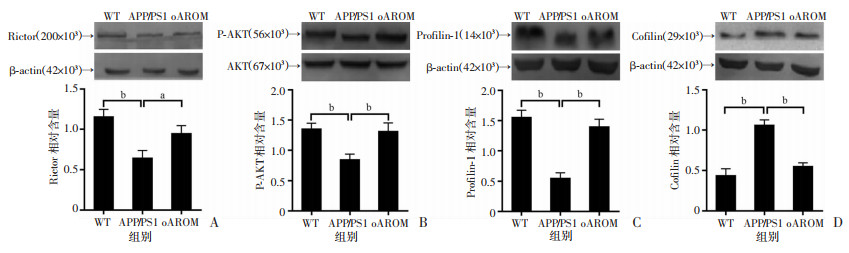
|
|
a:P < 0.05,b: P < 0.01 A:海马特异性过表达AROM对Rictor的影响;B:海马特异性过表达AROM对P-AKT的影响;C:海马特异性过表达AROM对海马Profilin-1的影响;D:海马特异性过表达AROM对小鼠海马Cofilin的影响 图 7 Western blot检测过表达AROM对APP/PS1小鼠海马细胞骨架调节相关蛋白表达的影响 |
3 讨论
空间学习记忆障碍是AD最主要的临床特征,海马是与空间学习记忆最相关的脑区,因此海马对学习记忆的调控一直是神经科学研究的焦点。基于AD在男性也有一定的发病比例且避免动情周期对海马结构与功能的影响,本研究以雄性AD小鼠为对象进行了有关研究。有研究表明抑制ERα和SRC-1都与学习记忆有关[23-25],ADAM10和BACE1与Aβ的生成有关,而IDE能降解Aβ,Rictor及其下游的P-AKT、Profilin-1和Cofilin通过调节actin细胞骨架的聚合从而参与对学习记忆的调节[26-28]。研究表明海马AROM催化产生的E2能调节海马的突触可塑性以及依赖海马的空间学习记忆行为[12-16, 18-19]。课题组前期研究发现AD小鼠的痴呆行为始见于8月龄,卵巢雌激素和SRC-1均可调节海马突触可塑性和空间学习记忆[22, 24-26, 29],但海马特异性过表达AROM是否具有预防AD的作用尚不清楚。
本研究首先检测了不同月龄WT小鼠和AD小鼠海马AROM、AR、ERα和SRC-1表达的变化,发现AROM的下降最早(6月龄),且在AD小鼠的记忆障碍出现(8月龄)之前[26],强烈提示AROM或许可以作为AD的预防靶点。因此,在6月龄AD小鼠海马过表达AROM,3个月后用Morris水迷宫检测空间学习记忆行为的变化,结果显示对照AD小鼠在9月龄出现了学习记忆障碍,而过表达AROM的AD小鼠其空间学习记忆能力恢复到正常水平,这些结论与前期在啮齿动物和斑马雀中有关AROM的研究结果基本一致[12-16, 18-19]。然而,前期研究主要是在正常或卵巢切除小鼠中进行的研究,本研究则利用AD小鼠证实在出现痴呆行为之前,海马特异性过表达海马AROM可以预防AD特征性的空间记忆障碍。
突触可塑性(包括突触形态、分子表达、电生理特性以及神经环路的可塑性)是记忆与认知行为改变的基础。为了进一步探讨海马特异性过表达AROM预防AD行为障碍的机制,我们用透射电镜和Western blot检测了海马突触密度、突触后膜以及突触蛋白、actin聚合调节蛋白表达的变化。结果显示,过表达AROM尽管不影响GluR1的表达,但可诱导AD小鼠海马突触密度、突触后膜厚度的显著增加与突触蛋白PSD-95、SYN表达的显著上升。本研究还发现AD小鼠海马与actin聚合相关的Rictor、P-AKT和Profilin-1表达显著下降,而诱导actin解聚的Cofilin表达显著上升。这些变化可被oAROM所逆转,即oAROM可促进actin聚合、抑制actin解聚,从而诱导actin细胞骨架向聚合成多聚体形式的方向进行,最终增加树突棘密度和突触密度。这些结果与有关卵巢雌激素、海马雌激素以及Rictor通路的研究结果相符[19-20, 24, 28-29]。因此,以上研究表明,在出现AD痴呆症状以前海马特异性过表达AROM能够通过改善海马的突触可塑性进而改善AD的痴呆症状。
Aβ产生及清除障碍导致脑内Aβ的异常沉积是AD的主要病理特征之一,也是导致学习记忆和认知功能损伤的重要原因。因此一直以来清除脑内Aβ被认为是防治AD的重要策略之一[30-32]。根据2018年更新的AD药物开发信息,在三期临床试验中超过5成的药物针对的靶标是Aβ,但这些药物均因未取得良好的临床疗效最终宣告失败[33-34]。上述临床试验失败的主要原因是外源性药物很难透过血脑屏障,或透过血脑屏障后会破坏脑内环境的稳态、造成神经或血管性损害,因此通过内源性方法抑制Aβ的形成可能是AD防治的新策略。本研究发现,AD小鼠海马特异性过表达AROM尽管不影响淀粉样蛋白前体蛋白(Amyloid Precuser Protein, APP)的非Aβ源性代谢途径(不影响ADAM10的表达),但可通过下调BACE1的表达减少Aβ的生成、上调IDE的表达促进Aβ的降解,从而有效抑制Aβ的沉积,这也被Aβ染色结果进一步证实。这些结果虽与研究报道ADAM10在AD小鼠海马有所下降的结果[20, 26]不相同(可能是不同批次的动物有差异的原因),但是与AD小鼠海马BACE1表达上升、IDE表达下降、Aβ表达增加的结果[20, 26]一致,强烈提示提高海马AROM的表达从而提高雌激素水平可能是防治Aβ沉积形成老年斑的重要途径。另外,tau蛋白的过度磷酸化是AD的另一重要病理特征,p-tau形成包涵体在脑内跨突触播散,聚集形成NFT,最终造成神经元变性坏死[35-36],这也是导致学习记忆障碍的重要因素。本研究发现AD小鼠海马p-tau表达上升,这与文献[20, 26]的报道一致;我们还发现海马过表达AROM后p-tau表达显著减少,表明AROM对p-tau具有抑制作用,但是海马AROM如何调节tau的磷酸化还需要继续深入研究。
综上,本研究证实了海马特异性过表达AROM可能通过调节海马的突触可塑性、降低Aβ的沉积和tau蛋白的异常磷酸化从而改善AD的痴呆症状。由于本研究的AROM过表达时间早于AD痴呆行为发生的时间,这些结果提示适时在海马内过表达AROM可能是预防AD发生的重要途径。由于AAV病毒载体具有非常高的安全性,美国FDA已批准其用于临床治疗,后续或可利用能高效透过血脑屏障的AAV-PHP.eB载体等方式提高脑源性雌激素浓度,这对于临床探索治疗AD的新方向具有重要的指导意义。
| [1] |
JIA J, WEI C, CHEN S, et al. The cost of Alzheimer's disease in China and re-estimation of costs worldwide[J]. Alzheimers Dement, 2018, 14(4): 483-491. DOI:10.1016/j.jalz.2017.12.006 |
| [2] |
JOE E, RINGMAN J M. Cognitive symptoms of Alzheimer's disease: clinical management and prevention[J]. BMJ, 2019, 367: l6217. DOI:10.1136/bmj.l6217 |
| [3] |
SCHATZ M, SARAVANAN S, D'ADESKY N D, et al. Osteocalcin, ovarian senescence, and brain health[J]. Front Neuroendocrinol, 2020, 59: 100861. DOI:10.1016/j.yfrne.2020.100861 |
| [4] |
CHAN K Y, WANG W, WU J J, et al. Epidemiology of Alzheimer's disease and other forms of dementia in China, 1990-2010: a systematic review and analysis[J]. Lancet, 2013, 381(9882): 2016-2023. DOI:10.1016/s0140-6736(13)60221-4 |
| [5] |
YU J T, XU W, TAN C C, et al. Evidence-based prevention of Alzheimer's disease: systematic review and meta-analysis of 243 observational prospective studies and 153 randomised controlled trials[J]. J Neurol Neurosurg Psychiatry, 2020, 91(11): 1201-1209. DOI:10.1136/jnnp-2019-321913 |
| [6] |
MEDWAY C, COMBARROS O, CORTINA-BORJA M, et al. The sex-specific associations of the aromatase gene with Alzheimer's disease and its interaction with IL10 in the Epistasis Project[J]. Eur J Hum Genet, 2014, 22(2): 216-220. DOI:10.1038/ejhg.2013.116 |
| [7] |
KANDASAMY M, RADHAKRISHNAN R K, POORNIMAI ABIRAMI G P, et al. Possible existence of the hypothalamic-pituitary-hippocampal (HPH) axis: a reciprocal relationship between hippocampal specific neuroestradiol synthesis and neuroblastosis in ageing brains with special reference to menopause and neurocognitive disorders[J]. Neurochem Res, 2019, 44(8): 1781-1795. DOI:10.1007/s11064-019-02833-1 |
| [8] |
LI R, HE P, CUI J, et al. Brain endogenous estrogen levels determine responses to estrogen replacement therapy via regulation of BACE1 and NEP in female Alzheimer's transgenic mice[J]. Mol Neurobiol, 2013, 47(3): 857-867. DOI:10.1007/s12035-012-8377-3 |
| [9] |
KONKLE A T, MCCARTHY M M. Developmental time course of estradiol, testosterone, and dihydrotestosterone levels in discrete regions of male and female rat brain[J]. Endocrinology, 2011, 152(1): 223-235. DOI:10.1210/en.2010-0607 |
| [10] |
MUKAI H, KIMOTO T, HOJO Y, et al. Modulation of synaptic plasticity by brain estrogen in the hippocampus[J]. Biochim Biophys Acta, 2010, 1800(10): 1030-1044. DOI:10.1016/j.bbagen.2009.11.002 |
| [11] |
KATO A, HOJO Y, HIGO S, et al. Female hippocampal estrogens have a significant correlation with cyclic fluctuation of hippocampal spines[J]. Front Neural Circuits, 2013, 7: 149. DOI:10.3389/fncir.2013.00149 |
| [12] |
KRETZ O, FESTER L, WEHRENBERG U, et al. Hippocampal synapses depend on hippocampal estrogen synthesis[J]. J Neurosci, 2004, 24(26): 5913-5921. DOI:10.1523/jneurosci.5186-03.2004 |
| [13] |
GRASSI S, TOZZI A, COSTA C, et al. Neural 17beta-estradiol facilitates long-term potentiation in the hippocampal CA1 region. 2011, 192: 67-73. DOI: 10.1016/j.neuroscience.2011.06.078.
|
| [14] |
PRANGE-KIEL J, FESTER L, ZHOU L, et al. Estrus cyclicity of spinogenesis: underlying mechanisms[J]. J Neural Transm (Vienna), 2009, 116(11): 1417-1425. DOI:10.1007/s00702-009-0294-x |
| [15] |
KOSS W A, FRICK K M. Activation of androgen receptors protects intact male mice from memory impairments caused by aromatase inhibition[J]. Horm Behav, 2019, 111: 96-104. DOI:10.1016/j.yhbeh.2019.01.002 |
| [16] |
TUSCHER J J, SZINTE J S, STARRETT J R, et al. Inhibition of local estrogen synthesis in the Hippocampus impairs hippocampal memory consolidation in ovariectomized female mice[J]. Horm Behav, 2016, 83: 60-67. DOI:10.1016/j.yhbeh.2016.05.001 |
| [17] |
BAILEY D J, MA C, SOMA K K, et al. Inhibition of hippocampal aromatization impairs spatial memory performance in a male songbird[J]. Endocrinology, 2013, 154(12): 4707-4714. DOI:10.1210/en.2013-1684 |
| [18] |
NELSON B S, BLACK K L, DANIEL J M. Circulating Estradiol Regulates Brain-Derived Estradiol via Actions at GnRH Receptors to Impact Memory in Ovariectomized Rats[J]. eNeuro, 2016, 3(6): ENEURO.0321-16.2016. DOI:10.1523/ENEURO.0321-16.2016 |
| [19] |
LAN Z, MENG Z Y, LIAN B Y, et al. Hippocampal aromatase knockdown aggravates ovariectomy-induced spatial memory impairment, Aβ accumulation and neural plasticity deficiency in adult female mice[J]. Neurochem Res, 2021. DOI:10.1007/s11064-021-03258-5 |
| [20] |
LIAN B, LIU M, LAN Z, et al. Hippocampal overexpression of SGK1 ameliorates spatial memory, rescues Aβ pathology and actin cytoskeleton polymerization in middle-aged APP/PS1 mice[J]. Behav Brain Res, 2020, 383: 112503. DOI:10.1016/j.bbr.2020.112503 |
| [21] |
MENG Z, ZHAO T, ZHOU K, et al. A20 ameliorates intracerebral hemorrhage-induced inflammatory injury by regulating TRAF6 polyubiquitination[J]. J Immunol, 2017, 198(2): 820-831. DOI:10.4049/jimmunol.1600334 |
| [22] |
ZHAO J, BIAN C, LIU M, et al. Orchiectomy and letrozole differentially regulate synaptic plasticity and spatial memory in a manner that is mediated by SRC-1 in the Hippocampus of male mice[J]. J Steroid Biochem Mol Biol, 2018, 178: 354-368. DOI:10.1016/j.jsbmb.2018.02.007 |
| [23] |
XING F Z, ZHAO Y G, ZHANG Y Y, et al. Nuclear and membrane estrogen receptor antagonists induce similar mTORC2 activation-reversible changes in synaptic protein expression and actin polymerization in the mouse Hippocampus[J]. CNS Neurosci Ther, 2018, 24(6): 495-507. DOI:10.1111/cns.12806 |
| [24] |
ZHAO Y, HE L, ZHANG Y, et al. Estrogen receptor alpha and beta regulate actin polymerization and spatial memory through an SRC-1/mTORC2-dependent pathway in the Hippocampus of female mice[J]. J Steroid Biochem Mol Biol, 2017, 174: 96-113. DOI:10.1016/j.jsbmb.2017.08.003 |
| [25] |
BIAN C, HUANG Y, ZHU H, et al. Steroid receptor coactivator-1 knockdown decreases synaptic plasticity and impairs spatial memory in the Hippocampus of mice[J]. Neuroscience, 2018, 377: 114-125. DOI:10.1016/j.neuroscience.2018.02.034 |
| [26] |
SUN H, LIU M, SUN T, et al. Age-related changes in hippocampal AD pathology, actin remodeling proteins and spatial memory behavior of male APP/PS1 mice[J]. Behav Brain Res, 2019, 376: 112182. DOI:10.1016/j.bbr.2019.112182 |
| [27] |
SHI Y, YAMADA K, LIDDELOW S A, et al. ApoE4 markedly exacerbates tau-mediated neurodegeneration in a mouse model of tauopathy[J]. Nature, 2017, 549(7673): 523-527. DOI:10.1038/nature24016 |
| [28] |
HUANG W, ZHU P J, ZHANG S, et al. mTORC2 controls actin polymerization required for consolidation of long-term memory[J]. Nat Neurosci, 2013, 16(4): 441-448. DOI:10.1038/nn.3351 |
| [29] |
ZHANG Y Y, LIU M Y, LIU Z, et al. GPR30-mediated estrogenic regulation of actin polymerization and spatial memory involves SRC-1 and PI3K-mTORC2 in the Hippocampus of female mice[J]. CNS Neurosci Ther, 2019, 25(6): 714-733. DOI:10.1111/cns.13108 |
| [30] |
ZENARO E, Piacentino G, Constantin G. The blood-brain barrier in Alzheimer's Disease. Neurobiol Dis. 2017, 107: 41-56. DOI: 10.1016/j.nbd.2016.07.007.
|
| [31] |
CHEN S H, TIAN D Y, SHEN Y Y, et al. Amyloid-beta uptake by blood monocytes is reduced with ageing and Alzheimer's disease[J]. Transl Psychiatry, 2020, 10(1): 423. DOI:10.1038/s41398-020-01113-9 |
| [32] |
LIU Y H, WANG J, LI Q X, et al. Association of naturally occurring antibodies to β-amyloid with cognitive decline and cerebral amyloidosis in Alzheimer's disease[J]. Sci Adv, 2021, 7(1): eabb0457. DOI:10.1126/sciadv.abb0457 |
| [33] |
MULLANE K, WILLIAMS M. Alzheimer's disease (AD) therapeutics - 1: Repeated clinical failures continue to question the amyloid hypothesis of AD and the current understanding of AD causality[J]. Biochem Pharmacol, 2018, 158: 359-375. DOI:10.1016/j.bcp.2018.09.026 |
| [34] |
EKETJÄLL S, JANSON J, KASPERSSON K, et al. AZD3293: a novel, orally active BACE1 inhibitor with high potency and permeability and markedly slow off-rate kinetics[J]. J Alzheimers Dis, 2016, 50(4): 1109-1123. DOI:10.3233/jad-150834 |
| [35] |
ASAI H, IKEZU S, TSUNODA S, et al. Depletion of microglia and inhibition of exosome synthesis halt tau propagation[J]. Nat Neurosci, 2015, 18(11): 1584-1593. DOI:10.1038/nn.4132 |
| [36] |
IBA M, GUO J L, MCBRIDE J D, et al. Synthetic tau fibrils mediate transmission of neurofibrillary tangles in a transgenic mouse model of Alzheimer's-like tauopathy[J]. J Neurosci, 2013, 33(3): 1024-1037. DOI:10.1523/jneurosci.2642-12.2013 |




