2. 400016 重庆,重庆医科大学: 附属第一医院生殖健康与不孕症中心;
3. 400016 重庆,重庆医科大学: 第一临床学院
2. Center of Reproduction Medicine and Infertility, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China;
3. the First Clinical College of Chongqing Medical University, Chongqing, 400016, China
骨质疏松症是一种全身性代谢性骨病,表现为骨量减少、骨组织微结构改变,导致骨强度降低、脆性增加,易引起骨折,是中老年人致残、死亡的重要原因之一[1]。基于骨发育的健康骨重塑对于骨质疏松症的治疗和康复极为重要。这一目标的实现仍存在诸多难题,骨髓基质细胞体内自我更新和成骨分化的调控是关键。
过去认为骨细胞是静止细胞,近来研究表明在机械和激素刺激下,骨细胞可以反向调控骨形成与骨吸收[2-6],对骨细胞及其细胞内分子机制的研究正在迅速兴起。本课题组前期研究发现,特异性激活小鼠骨细胞Wnt/β-catenin信号,促进骨合成代谢,增加骨量,证实了发育终端的骨细胞具有反向调控成骨分化的作用,并且在激活Wnt信号的骨细胞中检测到骨形态发生蛋白4 (bone morphogenetic protein-4, BMP4)的表达升高[7]。有研究报道指出成骨细胞中敲除BMP Ⅰ型受体A(BMPR1A)后,sclerostin表达降低,从而增加Wnt信号促进骨形成,导致小鼠骨量上升[8-9]。BMP4作为BMP信号的配体之一,在骨折愈合过程中可以促进骨折区域的血管生成和骨再生[10-11],还可以调节胚胎干细胞向内皮细胞的分化, 并刺激内皮细胞的迁移和管腔的形成[12]。然而,骨细胞中的BMP4对骨形成以及血管生成的影响尚有待研究。
Notch信号是一条进化过程中高度保守的信号通路,对成骨分化以及血管生成起着至关重要的作用[13-14]。有研究报道Notch信号参与BMP2、BMP9诱导的MSCs成骨分化[15],但是Notch信号是否参与骨细胞BMP4反向调控骨髓基质细胞成骨分化的过程没有相关报道。因此,本研究首先使用Ad-BMP4感染骨细胞MLO-Y4后与ST2细胞进行共培养,探究骨细胞过表达BMP4的促成骨和促成血管功能;并在此基础上探讨了Notch信号是否介导这一过程,旨在揭示骨细胞BMP4发挥促骨形成的生理作用与机制,为BMP4靶向骨细胞治疗骨质疏松提供依据以及为研发促骨形成药物提供新的思路。
1 材料与方法 1.1 材料与仪器实验材料:骨细胞MLO-Y4、骨髓基质细胞ST2均由美国Lynda Bonewald教授赠予。α-MEM培养基以及TRIzol RNA抽提液购自美国Thermo Fisher公司;胎牛血清购自以色列Biological Industries公司;Polybrene购自美国Sigma公司;BCA检测试剂盒、RIPA裂解液BCIP/NBT碱性磷酸酶显色试剂盒以及碱性磷酸酶(alkaline phosphatase, ALP)检测试剂盒均购自上海碧云天生物工程公司;反转录试剂盒和实时荧光定量PCR试剂盒购买于日本TaKaRa公司;DAPT购买于美国MCE公司;一抗BMP4购自沈阳万类生物科技有限公司;一抗GAPDH及二抗均购自武汉三鹰生物科技有限公司;显影液购自上海雅酶生物医药科技有限公司。
实验仪器:37 ℃、5%CO2细胞培养箱(新加坡,ESCO)、低温高速离心机(德国,Sigma)、倒置荧光显微镜(德国,Leica)、qPCR仪(美国,Bio-Rad)。
1.2 方法 1.2.1 细胞培养MLO-Y4细胞与ST2细胞均使用含有10%胎牛血清的α-MEM完全培养基在37 ℃、5% CO2的条件下培养。
1.2.2 骨细胞系MLO-Y4感染腺病毒当MLO-Y4细胞密度达到90%时,使用胰酶消化、计数后,按照2×104/孔的密度铺板至24孔板,分别加入加腺病毒Ad-BMP4或者Ad-GFP感染细胞,同时加入polybrene促感染,24 h后,观察荧光以及收集RNA检测BMP4以及Notch配体基因的表达,收集蛋白样品检测BMP4的表达。实验分组为Ad-GFP组与Ad-BMP4组。
1.2.3 MLO-Y4细胞与ST2细胞共培养以及DAPT干预① 感染Ad-BMP4或Ad-GFP的MLO-Y4细胞,使用胰酶消化并计数后,按照2×104/孔铺入24孔板,ST2细胞8×104/孔,铺板至同一24孔板共培养1、3、5 d。②在培养基中添加DAPT抑制共培养体系Notch信号,DAPT终浓度10 μmol/L。实验分为:GFP组、GFP+DAPT组、BMP4组、BMP4+DAPT组。
1.2.4 碱性磷酸酶(ALP)活性检测① ALP染色:待细胞共培养1、3、5 d后,吸弃培养基并用PBS润洗,4%甲醛固定10 min,再用PBS润洗2次,最后按碱性磷酸酶显色试剂盒说明书加入染液,室温避光反应30 min后用PBS润洗去除染液,观察并拍照。②ALP定量:细胞共培养后,吸弃培养基并使用PBS润洗,然后每孔加入300 μL Tris (50 mmol/L, pH=7.4),收集细胞于EP管中,使用超声破碎仪破碎细胞,4 ℃ 15 000×g离心3 min,收集上清液按ALP检测试剂盒说明书检测不同样本与底物反应体系在405 nm的光密度值,并根据标准底物浓度曲线计算酶活性。
1.2.5 RNA提取及RT-PCR细胞培养完成后,吸弃培养基,每孔加入200 μL TRIzol裂解细胞,根据TRIzol法提取细胞RNA,并测定其浓度;取1 μg RNA,按TaKaRa反转录试剂盒操作说明去除基因组DNA后,进行反转录反应获得cDNA,对cDNA进行5倍稀释后进行后续qPCR检测。
1.2.6 实时定量PCR按照SYBR Green Supermix试剂盒说明书依次加入5 μL SYBR Premix Ex Taq Ⅱ(2×)、正反引物各0.4 μL(10 μmmol/L)、1.2 μL cDNA,用Mili Q水补足至10 μL。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次; GAPDH基因作为内参,每组3个样品,使用2-ΔΔCt法计算目的基因的相对表达量。引物序列见表 1。
| 基因名称 | 上游引物(5'-3') | 下游引物(5'-3') | 产物长度/bp |
| GAPDH | GCACAGTCAAGGCCGAGAAT | GCCTTCTCCATGGTGGTGAA | 151 |
| BMP4 | GAGGAGTTTCCATCACGAAGA | GCTCTGCCGAGGAGATCA | 122 |
| Jag1 | CCAACACGGTCCCCATTA | TTGGCAAAGCGGACTTTC | 124 |
| Jag2 | CACGCTGGCATGATCAAC | TGTTGCAGGTGGCACTGT | 124 |
| Dll4 | GGGCCTTCCTTCTGCATT | ACTCTTGGCGGGTTCACA | 122 |
| ALP | ACACCAATGTAGCCAAGAATGTCA | GATTCGGGCAGCGGTTACT | 77 |
| Runx2 | CCGGTCTCCTTCCAGGAT | GGGAACTGCTGTGGCTTC | 122 |
| OCN | CAGCGGCCCTGAGTCTGA | GCCGGAGTCTGTTCACTACCTTA | 71 |
| CollagenⅠ | GCTGGCAAGAATGGCGAC | AAGCCACGATGACCCTTTATG | 161 |
| VEGF | ACCACAGCAGATGTGAATGC | AATGCTTTCTCCCGCGCTGAA | 88 |
| HIFα | TGCTCATCAGTTGCCACTTCC | TGCCTTCATCTCATCTTCACTGTC | 139 |
| Hey1 | GGCCTGCTTGGCTTTTCT | CCAAGTGCAGGCAAGGTC | 120 |
| Hey2 | CAGCTGCACACAGCTTCC | CTGCGGATACCGACAAGG | 123 |
1.2.7 Western blot
细胞培养后,吸弃培养基,用PBS清洗1遍,加入适量RIPA裂解液,用细胞刮刮下细胞后收集至1.5 mL EP管中。按照说明书使用BCA试剂盒测量蛋白浓度,加上样缓冲液,金属浴100 ℃ 10 min。使用试剂盒配胶完成后按总蛋白量30 μg上样。使用70 V恒压待样品进入分离胶后加压至120 V恒压电泳全程,转膜按恒流250 mA 1 h后,使用5%脱脂奶粉封闭2 h。然后敷一抗4 ℃过夜,第2天使用TBST洗膜3次,每次10 min,敷二抗室温2 h,再使用TBST洗膜3次,每次10 min,最后采集图像。
1.3 统计学分析采用GraphPad Prism 8.0进行统计分析。每个实验独立重复3次,数据用x±s表示。多组间比较采用单因素方差分析,两组间比较采用Student-t检验。P<0.05被认为具有统计学意义。
2 结果 2.1 腺病毒感染MLO-Y4过表达BMP4Ad-GFP或Ad-BMP4分别感染MLO-Y4,24 h后于倒置荧光显微镜下观察细胞中绿色荧光蛋白表达情况,光镜下显示细胞状态良好,感染效率高于90%(图 1A)。qPCR及Western blot结果显示:在基因及蛋白水平,Ad-BMP4组表达BMP4较Ad-GFP组显著增加(P<0.05,图 1B~D),提示Ad-BMP4感染MLO-Y4过表达BMP4。
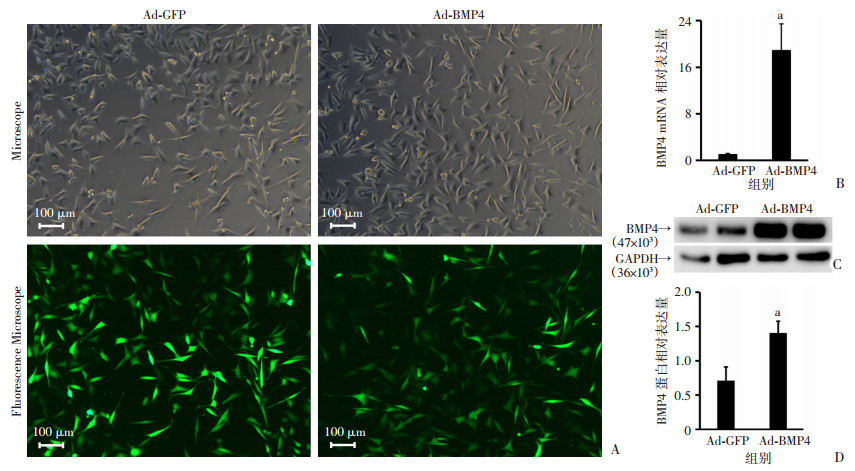
|
| A: 倒置荧光显微镜下观察Ad-GFP、Ad-BMP4转染MLO-Y4细胞;B: qPCR检测BMP4在MLO-Y4细胞的表达(n=3,x±s),a:P<0.05,与Ad-GFP组比较;C: Western blot检测两组MLO-Y4细胞BMP4蛋白表达;D:BMP4蛋白相对表达量(n=3,x±s), a:P<0.05,与Ad-GFP组比较 图 1 骨细胞过表达BMP4 |
2.2 MLO-Y4过表达BMP4促进ST2成骨分化
ALP染色与生化定量结果显示,共培养第1天,BMP4组与GFP组ALP活性无明显差异,第3、5天,BMP4组ALP活性相比于GFP组显著增强(P<0.05,图 2A、B)。

|
| A:ALP染色;B:ALP生化定量;C~F分别为:成骨标志基因Alp、Runx2、Ocn、CollagenⅠ的表达,a: P<0.05,与GFP组比较 图 2 MLO-Y4过表达BMP4对ST2成骨分化的影响(n=3, x±s) |
qPCR检测共培养体系细胞成骨标志基因Alp、Runx2、Ocn、CollagenⅠ的mRNA表达。结果显示,在共培养第1天,BMP4组仅Runx2表达高于GFP组(P<0.05,图 2C~F),第3、5天,BMP4组成骨标志基因Alp、Runx2、Ocn、CollagenⅠ的表达均显著高于GFP组(P<0.05,图 2C~F)。以上结果表明,骨细胞MLO-Y4过表达BMP4促进骨髓基质细胞ST2成骨分化,且成骨分化随共培养时间增加而增强。
2.3 共培养体系中Notch信号表达增加通过qPCR检测共培养第3天体系中Notch信号靶基因的表达,与GFP组相比,BMP4组Hey1与Hey2的表达升高(P<0.05,图 3)。
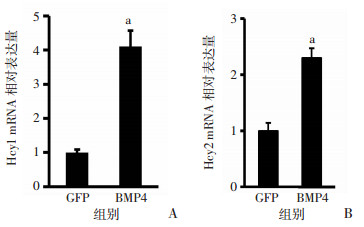
|
| A:Hey1基因的表达;B:Hey2基因的表达;a: P<0.05,与GFP组比较 图 3 qPCR检测Notch靶基因的表达(n=3, x±s) |
2.4 MLO-Y4过表达BMP4上调Notch配体表达
Notch信号的激活需要Notch配体与受体结合,为了验证MLO-Y4过表达BMP4对Notch配体表达的影响,qPCR检测Notch配体在感染Ad-BMP4的MLO-Y4中的表达。结果显示:与Ad-GFP组比较,Ad-BMP4组的MLO-Y4 Notch配体Jag1、Jag2、Dll4表达更高(P<0.05,图 4)。

|
| A:Jag1;B:Jag2;C:Dll4 a: P<0.05,与Ad-GFP组比较 图 4 qPCR检测Ad-BMP4感染的MLO-Y4细胞中Notch配体的表达(n=3, x±s) |
2.5 阻断Notch信号抑制MLO-Y4过表达BMP4诱导的ST2成骨分化
为了探讨MLO-Y4过表达BMP4促进ST2成骨分化这一现象是否与Notch信号上调有关。在共培养体系中加入γ分泌酶抑制剂DAPT(10 μmol/L)抑制Notch信号。在第3天,ALP染色及生化定量结果显示BMP4+DAPT组ALP活性高于GFP组和GFP+DAPT组,但显著低于BMP4组(P<0.05, 图 5A、B),与成骨标志基因Alp、Runx2、Ocn以及Col1的表达结果一致(P<0.05, 图 5C~F)。表明DAPT抑制共培养体系Notch信号后,部分抑制了MLO-Y4过表达BMP4对ST2成骨分化的促进作用。

|
| A:ALP染色;B:ALP生化定量;C~F分别为Alp、Runx2、Ocn、CollagenⅠ基因的表达a: P<0.05与GFP组比较;b: P<0.05,与DMSO比较 图 5 DAPT抑制MLO-Y4过表达BMP4诱导的ST2成骨分化(n=3, x±s) |
2.6 DAPT抑制Notch信号靶基因的表达
为了进一步论证Notch信号在MLO-Y4过表达BMP4促ST2成骨分化的重要作用,验证DAPT对Notch信号的有效抑制作用。检测了共培养体系Notch靶基因Hey1以及Hey2的表达,结果表明:DAPT抑制Notch靶基因Hey1、Hey2的表达(P<0.05)。表明DAPT作为Notch信号抑制剂成功抑制了共培养体系中的Notch信号(图 6)。
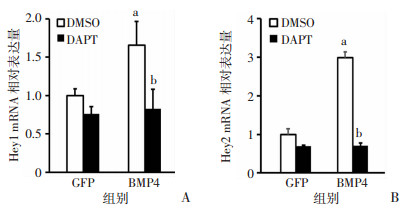
|
| A:Hey1;B:Hey2 a: P<0.05,与GFP组比较;b: P<0.05,与DMSO比较 图 6 DAPT抑制Notch信号靶基因的表达(n=3, x±s) |
2.7 DPTA抑制MLO-Y4过表达BMP4的促血管生成功能
前述已证明过表达BMP4的MLO-Y4表达更高的Notch配体,而BMP4及Notch配体Dll4与血管生成紧密相关,进一步检测共培养3 d后促血管生长因子HIF1α、VEGF mRNA转录水平。qPCR结果显示:与GFP组比较,BMP4组的VEGF、HIF1α的表达显著升高(P<0.05),当使用DAPT抑制共培养体系Notch信号以后,BMP4+DAPT组HIF1α、VEGF较BMP4组表达降低(P<0.05),表明骨细胞MLO-Y4过表达BMP4具有促血管生成功能,这可能与Notch信号激活有关(图 7)。
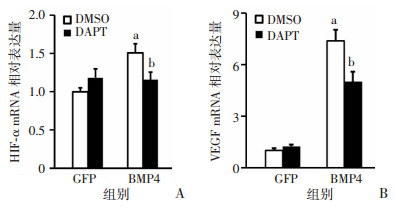
|
| A: HIF1α;B: VEGF; a: P<0.05,与GFP组比较;b: P<0.05,与DMSO比较 图 7 DAPT抑制MLO-Y4过表达BMP4的促血管生成功能(n=3, x±s) |
3 讨论
骨发育与再生受到多种信号通路调控,例如Wnt、Notch以及BMP信号等。BMP信号通过调节细胞增殖、分化和凋亡,在机体的发育和维持中发挥关键作用[16]。本研究发现在骨细胞中过表达BMP4显著促进骨髓基质细胞的成骨分化,同时上调VEGF的表达,具有潜在促血管生成的作用,经典的Nocth信号可能在这一过程中发挥重要作用。
目前BMP2、BMP7等在临床上仅仅作为治疗骨不连药物,而未被作为增骨药物使用,其体内增骨作用仍未得到证明。BMP信号在成骨发育过程中具有阶段性的作用,促进基质细胞的成骨分化[15];相反,有研究发现成骨细胞BMP信号抑制骨形成[11-12],随后通过DMP1-Cre敲除小鼠成骨及骨细胞中BMPR1A,导致小鼠骨量、骨密度和机械强度显著增加[17],但其结果并不能特异性证明骨细胞BMP信号在骨形成中的作用,因此仍需对骨细胞中BMP信号进行进一步的研究。本研究使用骨细胞系MLO-Y4,排除了成骨细胞的影响,结果表明骨细胞过表达BMP4促进骨髓基质细胞的成骨分化,为BMP作为增骨药物的临床应用提供重要依据。
Notch信号已被证明在不同阶段调节成骨分化,导致不同的生物学反应[18-19]。在成骨细胞中激活Notch信号促进其矿化[20],而激活干细胞Notch信号抑制其成骨分化[21],另有研究表明单独激活ST2细胞中的Notch信号,抑制其成骨分化[22]。目前为止,大多数研究都依赖于NICD的过表达,这不能真实地代表生理性的Notch信号作用。经典Notch信号的传导需要严格的配体与受体结合,不同的Notch反应元件(配体/受体)具有不同的生物学功能[23-24]。本研究结果表明,骨细胞过表达BMP4促进骨髓基质细胞成骨分化,DAPT抑制共培养体系Notch信号后,骨细胞过表达BMP4促骨髓基质细胞的成骨分化作用减弱,但仍然强于GFP组,证明骨细胞BMP4对骨髓基质细胞的促成骨分化作用,部分是通过Notch信号介导。我们进一步检测过表达BMP4对骨细胞自身Notch配体的表达的影响,结果表明BMP4上调骨细胞Jag1/2、Dll4的表达。根据我们前期研究表明骨细胞Dll4通过激活骨髓基质细胞Notch信号促成骨分化[25],因此,我们认为骨细胞过表达BMP4可能通过上调自身Notch配体Dll4的表达,从而激活骨髓基质细胞Notch信号,进而导致其成骨分化增强。但是BMP4同时还上调了骨细胞Jag1、Jag2的表达,其作用需要进一步验证。
在骨组织中, 血管形成与骨形成的相互偶联促进骨骼生长发育和维持骨量平衡,骨血管生成能够促进成骨分化, 成骨细胞也能够分泌VEGF调控血管内皮细胞的增殖及血管化[26]。有研究报道同时激活BMP和Notch信号通路能够促进骨髓间充质干细胞向成骨和血管分化[27]。在骨折愈合中BMP4能够促进骨形成与血管生成[28],同时检测到Notch信号表达上调[29]。BMP4通过激活成骨细胞中的p70S6激酶来刺激VEGF的合成,成骨细胞系也被认为是VEGF的主要来源[30]。作为主要的促血管生成因子,VEGF在血管生成过程中具有重要调控作用。
本研究结果表明骨细胞过表达BMP4促进骨髓基质细胞向成骨细胞分化的同时,VEGF的表达也上调,在抑制Notch信号后,成骨分化与VEGF表达下降。提示骨细胞过表达BMP4可能通过BMP4-Dll4-Notch信号途径发挥促成骨和促成血管功能。该结果对于骨组织工程修复骨缺损具有重要应用意义。
综上所述,本研究发现骨细胞过表达BMP4可以促进骨髓基质细胞的成骨分化以及具有潜在的促血管生成功能。这一过程可能与Notch信号的增强有关,确切的机制需要进一步探讨。本研究下一步拟通过RNA- Seq技术从基因表达的角度进一步深入研究,揭示骨细胞BMP4与Notch信号协同调控骨形成的机制;通过构建仅在骨细胞中特异性过表达BMP4的小鼠模型,在体内论证骨细胞过表达BMP4的成骨和成血管功能。为BMP4的临床应用以及靶向骨细胞促骨形成药物研发提供理论依据。
| [1] |
MEETA M, HARINARAYAN C V, MARWAH R, et al. Clinical practice guidelines on postmenopausal osteoporosis: An executive summary and recommendations-update 2019-2020[J]. J Midlife Health, 2020, 11(2): 96-112. |
| [2] |
TRESGUERRES F G F, TORRES J, LÓPEZ-QUILES J, et al. The osteocyte: a multifunctional cell within the bone[J]. Ann Anat, 2020, 227: 151422. |
| [3] |
NAKASHIMA T, HAYASHI M, FUKUNAGA T, et al. Evidence for osteocyte regulation of bone homeostasis through RANKL expression[J]. Nat Med, 2011, 17(10): 1231-1234. |
| [4] |
ZHU X, CHAN Y T, YUNG P S H, et al. Subchondral bone remodeling: a therapeutic target for osteoarthritis[J]. Front Cell Dev Biol, 2020, 8: 607764. |
| [5] |
XIONG J, ONAL M, JILKA R L, et al. Matrix-embedded cells control osteoclast formation[J]. Nat Med, 2011, 17(10): 1235-1241. |
| [6] |
BELLIDO T. Osteocyte-driven bone remodeling[J]. Calcif Tissue Int, 2014, 94(1): 25-34. |
| [7] |
TU X, DELGADO-CALLE J, CONDON K W, et al. Osteocytes mediate the anabolic actions of canonical Wnt/β-catenin signaling in bone[J]. Proc Natl Acad Sci USA, 2015, 112(5): E478-E486. |
| [8] |
KAMIYA N, YE L, KOBAYASHI T, et al. BMP signaling negatively regulates bone mass through sclerostin by inhibiting the canonical Wnt pathway[J]. Development, 2008, 135(22): 3801-3811. |
| [9] |
KAMIYA N, YE L, KOBAYASHI T, et al. Disruption of BMP signaling in osteoblasts through type IA receptor (BMPRIA) in-creases bone mass[J]. J Bone Miner Res, 2008, 23(12): 2007-2017. |
| [10] |
KONDO A, OTSUKA T, KUROYANAGI G, et al. Resveratrol inhibits BMP-4-stimulated VEGF synthesis in osteoblasts: sup-pression of S6 kinase[J]. Int J Mol Med, 2014, 33(4): 1013-1018. |
| [11] |
GAO X, USAS A, PROTO J D, et al. Role of donor and host cells in muscle-derived stem cell-mediated bone repair: differentiation vs. paracrine effects[J]. Faseb J, 2014, 28(8): 3792-3809. |
| [12] |
XIONG X, TU S, WANG J, et al. CXXC5: A novel regulator and coordinator of TGF-β, BMP and Wnt signaling[J]. J Cell Mol Med, 2019, 23(2): 740-749. |
| [13] |
RAMASAMY S K, KUSUMBE A P, WANG L, et al. Endothelial Notch activity promotes angiogenesis and osteogenesis in bone[J]. Nature, 2014, 507(7492): 376-380. |
| [14] |
ZANOTTI S, CANALIS E. Notch signaling and the skeleton[J]. Endocr Rev, 2016, 37(3): 223-253. |
| [15] |
VIALE-BOURONCLE S, GOSAU M, MORSCZECK C. NOTCH1 signaling regulates the BMP2/DLX-3 directed osteogenic differentiation of dental follicle cells[J]. Biochem Biophys Res Commun, 2014, 443(2): 500-504. |
| [16] |
LOWERY J W, ROSEN V. The BMP Pathway and Its Inhibitors in the Skeleton[J]. Physiol Rev, 2018, 98(4): 2431-2452. |
| [17] |
KAMIYA N, SHUXIAN L, YAMAGUCHI R, et al. Targeted disruption of BMP signaling through type IA receptor (BMPR1A) in osteocyte suppresses SOST and RANKL, leading to dramatic increase in bone mass, bone mineral density and mechanical strength[J]. Bone, 2016, 91: 53-63. |
| [18] |
CANALIS E. Notch in skeletal physiology and disease[J]. Osteoporos Int, 2018, 29(12): 2611-2621. |
| [19] |
TU X, CHEN J, LIM J, et al. Physiological notch signaling maintains bone homeostasis via RBPjk and Hey upstream of NFATc1[J]. PLoS Genet, 2012, 8(3): e1002577. |
| [20] |
XU Y, SHU B, TIAN Y, et al. Notch activation promotes osteoblast mineralization by inhibition of apoptosis[J]. J Cell Physiol, 2018, 233(10): 6921-6928. |
| [21] |
HILTON M J, TU X, WU X, et al. Notch signaling maintains bone marrow mesenchymal progenitors by suppressing osteoblast differentiation[J]. Nat Med, 2008, 14(3): 306-314. |
| [22] |
SCIAUDONE M, GAZZERRO E, PRIEST L, et al. Notch 1 impairs osteoblastic cell differentiation[J]. Endocrinology, 2003, 144(12): 5631-5639. |
| [23] |
SEKINE C, KOYANAGI A, KOYAMA N, et al. Differential regulation of osteoclastogenesis by Notch2/Delta-like 1 and Notch1/Jagged1 axes[J]. Arthr Res Ther, 2012, 14(2): R45. |
| [24] |
BENEDITO R, ROCA C, SÖRENSEN I, et al. The notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis[J]. Cell, 2009, 137(6): 1124-1135. |
| [25] |
冯玮, 谢正松, 罗岑, 等. 过表达Notch配体Delta-like基因的MLO-Y4骨细胞株的建立及其对骨髓基质细胞成骨分化的作用[J]. 第三军医大学学报, 2020, 42(09): 899-907. FENG W, XIE Z S, LUO C, et al. Construction of MLO- Y4 cells with overexpression of Delta-like genes and their effects on osteogenic differentiation of bone marrow stromal cells[J]. J Third Mil Med Univ, 2020, 42(9): 899-907. |
| [26] |
MAES C, KOBAYASHI T, SELIG M K, et al. Osteoblast precursors, but not mature osteoblasts, move into developing and fractured bones along with invading blood vessels[J]. Dev Cell, 2010, 19(2): 329-344. |
| [27] |
LIAO J, WEI Q, ZOU Y, et al. Notch Signaling Augments BMP9-induced bone formation by promoting the osteogene-sis-angiogenesis coupling process in mesenchymal stem cells (MSCs)[J]. Cell Physiol Biochem, 2017, 41(5): 1905-1923. |
| [28] |
YANG X, JIANG J, ZHOU L, et al. Osteogenic and angiogenic characterization of mandible and femur osteoblasts[J]. J Mol Histol, 2019, 50(2): 105-117. |
| [29] |
WANG C C, INZANA J A, MIRANDO A J, et al. NOTCH signaling in skeletal progenitors is critical for fracture repair[J]. J Clin Investig, 2016, 126(4): 1471-1481. |
| [30] |
HU K, OLSEN B R. Osteoblast-derived VEGF regulates osteoblast differentiation and bone formation during bone repair[J]. J Clin Invest, 2016, 126(2): 509-526. |




