2. 541001 广西 桂林,中国人民解放军联勤保障部队第九二四医院心内科;
3. 400038 重庆,陆军军医大学(第三军医大学)第二附属医院肾内科
2. Department of Cardiology, No. 924 Hospital of Chinese PLA Joint Service Support Force, Guilin, Guangxi Zhuang Autonomous Region, 541001;
3. Department of Nephrology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
成人慢性肾脏病(chronic kidney disease,CKD)发病率高达10% [1],其中很大部分患者最终将发展为终末期肾衰。近年来,虽然透析技术、透析液、透析耗材等方面有了很大的改进和发展,但维持性血液透析患者的年病死率仍居高不下(10%左右)。而死亡病例中,50%以上的直接死亡原因是心、脑血管事件[2]。透析虽然能缓解多种毒素、酸碱失衡、水电解质紊乱等致死因子对生命的直接威胁,但其对尿毒症常见的心、脑血管病变本身并无明显缓解作用,这不得不让我们对现代透析技术的局限性进行重新审视。
目前已证实的尿毒症毒素有90多种,有部分毒素能与蛋白结合,称为蛋白结合毒素(protein-bound uremic toxins)[3]。对甲酚就是一种典型的难解离蛋白结合毒素,其通过共价键的形式与白蛋白高度结合,结合率为94%,在临床上很难采用常规的透析方法将其清除[4]。既往研究表明游离的对甲酚可以抑制内皮细胞的增殖与修复,导致内皮细胞损伤[5]。对甲酚可以通过对内皮祖细胞中一氧化氮合酶(endothelial nitric oxide syntase,eNOS)的磷酸化水平的抑制,进而阻碍内皮祖细胞的生成,并抑制内皮祖细胞对血管内皮的保护、修复作用,造成血管内皮的损伤[6]。但游离的对甲酚毒素对内皮细胞具有损伤作用,不等于结合在白蛋白上的蛋白结合对甲酚亦有着类似的作用。因此,弄清楚蛋白结合的对甲酚是否具有毒性是我们研究关注的重点。
新近研究发现,实验性慢性肾衰家兔存在显著的加速性动脉硬化[7];尿毒症血清能抑制体外培养的血管内皮细胞增殖、促进其凋亡,泛素途径诱导的NF-κB激活促进慢性肾衰竭大鼠和家兔加速性动脉硬化,蛋白酶体抑制剂MG-132可显著逆转尿毒症血清对培养血管内皮细胞的毒性作用,抑制慢性肾衰竭家兔动脉粥样硬化进程,提示尿毒症毒素能诱导血管内皮细胞氧化应激,并在加速性动脉硬化的形成机制中起重要作用,但究竟是血清中游离毒素的作用,还是血清蛋白结合毒素譬如对甲酚等也参与了对血管内皮细胞的氧化应激作用尚不清楚[8-9]。因此,研究蛋白结合的对甲酚在血管内皮细胞中氧化应激的作用就显得十分重要。
本研究以人冠状动脉内皮细胞为研究对象,观察游离的对甲酚和蛋白结合的对甲酚对内皮细胞氧化应激的影响以及其可能的机制,以探讨蛋白结合的对甲酚在尿毒症患者血管内皮损伤中的作用,为CKD患者的心脑血管并发症发病机制研究及其治疗提供新的思路。
1 材料与方法 1.1 主要材料人冠状动脉内皮细胞(human coronary artery endothelial cells, HCAECs)购自美国ATCC细胞库,内皮细胞专用完全培养基购自武汉普诺赛生命科技有限公司,胎牛血清、胰酶均购自美国Gibico公司;NOX2抗体和NOX4抗体购自Abcam公司、p-p38抗体与p38抗体购自CST公司,抗鼠、抗兔二抗购自武汉博士德生物工程有限公司,α-Tublin抗体购自北京锐抗生物科技有限公司;TRIzol试剂购自美国Invitrogen公司,反转录试剂盒购自美国Thermo Scientific公司;聚合酶链反应(PCR)引物购自南京金斯瑞生物科技公司;MTT试剂盒购自上海碧云天生物技术有限公司,活性氧(reactive oxygen free radicals,ROS) ELISA试剂盒购自上海臻科生物有限公司;人血白蛋白和对甲酚冻干粉购自Sigma公司,将人血白蛋白用灭菌注射用水配制成4%浓度的溶液,对甲酚冻干粉溶解于甲醇溶液中(甲醇终体积比=1/1 000),用PBS稀释,参考CKD中患者的血清对甲酚水平[10-11]和我们既往的细胞实验[12],将对甲酚配制成40、80 μg/mL的储存液,过滤除菌,避光保存。
1.2 HCAECs细胞培养和分组将HCAECs细胞培养于内皮细胞专用完全培养基中,置于5%CO2,37 ℃恒温培养箱培养,当细胞生长至40%~50%融合时,弃去完全培养基,用基础培养基同步12 h后,将HCAECs进行分组。参考既往蛋白结合毒素的体外实验,和我们前期所做的蛋白结合对甲酚对人脐静脉内皮细胞影响的研究,向体外培养体系内加入4%白蛋白,可以提供让毒素与蛋白稳定结合的载体,模拟毒素与蛋白结合的体外环境,代表结合在白蛋白上的对甲酚[4-5, 13]。
实验分组:①不同浓度对甲酚组(40、80 μg/mL);②对照组(加入的甲醇与80 μg/mL对甲酚组相同体积);③对甲酚+4%白蛋白组(对甲酚40 μg/mL +4%白蛋白、对甲酚80 μg/mL+4%白蛋白);④对照(加入的甲醇与80 μg/mL对甲酚组相同体积)+4%白蛋白组,各组均用内皮细胞专用完全培养基继续培养。
1.3 细胞增殖能力检测将HCAECs细胞按照实验设计分组,将HCAECs接种于96孔板中,调整对数生长期的细胞数为2 000个每孔,细胞贴壁后,按照实验分组处理细胞,在5% CO2、37 ℃恒温培养箱分别培养24、48 h,每组设置5个复孔。采用MTT细胞增殖检测试剂盒,到相应培养时间结束前1 h,每孔加入10 μL MTT溶液,放置于细胞培养箱内继续孵育4 h,然后每孔加入100 μL Formazan溶解液,适当混匀,在细胞培养箱内再继续孵育4 h。用酶标仪在570 nm测定各组样品的光密度值D(570),并计算各组细胞增殖抑制率。细胞增殖抑制率=[D(570)对照组-D(570)实验组]/D(570)对照组×100%。
1.4 细胞内ROS含量检测按照实验设计分为对照组,对甲酚40 μg/mL组,对甲酚80 μg/mL组,对照+4%白蛋白组,对甲酚40 μg/mL +4%白蛋白组,对甲酚80 μg/mL+4%白蛋白组。收集各组HCAECs细胞上清,用离心机1 000 r/min离心20 min,取上清液。采用ROS ELISA试剂盒,实验完成后,在450 nm波长处测定各孔光密度值D(450)。横坐标为所测标准品的光密度值,纵坐标为标准品的浓度值,绘制标准曲线,并得到直线回归方程,将样品的光密度值代入方程,计算出各组ROS含量(U/mL)。
1.5 实时荧光定量PCR(Quantitative Real-time PCR,RT-qPCR)检测各组细胞NOX2和NOX4的mRNA表达按照实验设计分为对照组,对甲酚80 μg/mL组,对照+4%白蛋白组,对甲酚80 μg/mL+4%白蛋白组。将各组HCAECs细胞接种于24孔板中,分组作用48 h后,提取每组细胞的RNA,经过反转录后获得cDNA。根据CFX96 real-time PCR检测系统的实验步骤进行RT-qPCR反应。NOX2和NOX4的mRNA相对表达量采用2-△△Ct法表示,每个样品设置5个复孔,全部样品的结果以β-actin的表达水平为标准。测定所使用的引物见表 1。
| 基因 | 引物序列(5’→3’) | 产物大小/bp |
| NOX2 | 上游AATCCCTGCTCCACTAACA | 108 |
| 下游TTTCAAGATGCGTGGAAACTAC | ||
| NOX4 | 上游GGCTGATTGTCGTGTTCCTC | 147 |
| 下游TATTTGCCTGGAGTGCTTGC | ||
| β-actin | 上游CTCACCATGGATGATGATATCGC | 163 |
| 下游AGGAATCCTTCTGACCCATGC |
1.6 Western blot检测各组细胞NOX2、NOX4、p-p38和p-38的蛋白表达
按照实验设计分为对照组、对甲酚80 μg/mL组、对照+4%白蛋白组、对甲酚80 μg/mL+4%白蛋白组;将各组HCAECs细胞接种于6孔板中,分组作用48 h后,采用蛋白提取试剂盒提取各组细胞蛋白,每组3个复孔,并用BCA蛋白试剂盒测定蛋白浓度。配制10%分离胶和浓缩胶。电泳条件:浓缩胶75 V 45 min,分离胶120 V 50 min。300 mA恒流湿转120 min。转膜完成后,用5%BSA室温封闭1 h。一抗NOX2(1 ∶1 000),NOX4(1 ∶1 000),p-p38(1 ∶1 000),p38(1 ∶1 000),α-Tublin(1 ∶5 000)在4℃孵育过夜。洗膜后加入二抗室温孵育1 h。洗膜后,采用化学发光液进行显影。用Image J软件计算灰度值,目的蛋白NOX2和NOX4与α-Tublin蛋白的灰度值比作为蛋白的相对表达量,p-p38与p-38蛋白的灰度值比作为蛋白的相对表达量。
1.7 统计学分析采用SPSS 22.0统计软件,计量资料数据以x±s表示,多组间差异比较采用单因素方差分析,组间两两比较采用LSD检验(方差齐时)或采用Dunnett t3检验(方差不齐时)。两组数据间的比较使用成组t检验。P<0.05视为差异有统计学意义。
2 结果 2.1 游离的和蛋白结合对甲酚抑制HCAECs的增殖MTT结果显示,不同浓度游离的对甲酚作用HCAECs 24、48 h后,与对照组比较,对甲酚40 μg/mL组和对甲酚80 μg/mL组的内皮细胞增殖均出现不同程度的抑制, 且随着作用时间的延长,其细胞增殖抑制率逐渐增加。同时,不同浓度蛋白结合的对甲酚作用24、48 h后,与对照+4%白蛋白组比较,对甲酚40 μg/mL+4%白蛋白组和对甲酚80 μg/mL+4%白蛋白组的内皮细胞增殖也出现不同程度的抑制;且随着作用时间的延长,细胞增殖抑制率逐渐增加(图 1)。结果表明,游离的对甲酚和蛋白结合的对甲酚均可以显著抑制HCAECs的增殖(P<0.05)。
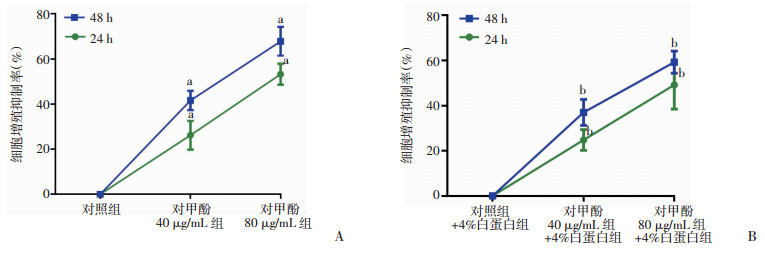
|
|
a:P<0.05,与对照组比较; b:P<0.05,与对照+4%白蛋白组比较 A:不同浓度游离的对甲酚对HCAECs不同时间的增殖抑制曲线;B:不同浓度蛋白结合的对甲酚对HCAECs不同时间的增殖抑制曲线 图 1 MTT检测游离对甲酚和蛋白结合对甲酚作用HCAECs不同时间的增殖抑制曲线(n=6, x±s) |
2.2 游离的和蛋白结合对甲酚增加HCAECs中ROS的含量
各组HCAECs中ROS的含量如图 2所示,与对照组相比,对甲酚40 μg/mL组和对甲酚80 μg/mL组的ROS显著增加;且与对甲酚40 μg/mL组相比,对甲酚80 μg/mL组的ROS含量显著增加。与对照+4%白蛋白组比较,对甲酚40 μg/mL+4%白蛋白组和对甲酚80 μg/mL+4%白蛋白组的ROS显著增加;且与对甲酚40 μg/mL+4%白蛋白组相比,对甲酚80 μg/mL +4%白蛋白组的ROS含量显著增加。结果表明,游离的对甲酚和蛋白结合的对甲酚均可以显著增加HCAECs中ROS的含量(P<0.05)。
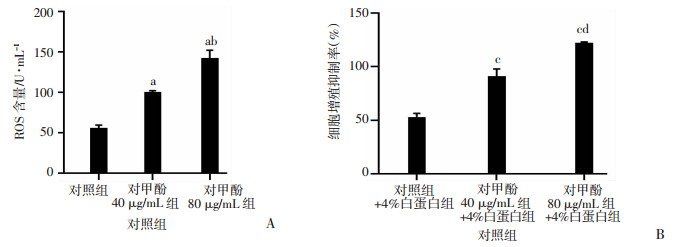
|
|
a:P<0.05,与对照组比较; b:P<0.05,与对甲酚40 μg/mL组比较;c:P<0.05,与对照+4%白蛋白组比较;d:P<0.05,与对甲酚40 μg/mL+4%白蛋白组比较 A:不同浓度游离对甲酚对HCAECs中ROS含量的影响;B:不同浓度蛋白结合对甲酚对HCAECs中ROS含量的影响 图 2 ELISA检测游离对甲酚和蛋白结合对甲酚对HCAECs中ROS含量的影响(n=3, x±s) |
2.3 游离的和蛋白结合对甲酚增加HCAECs中NOX2和NOX4的mRNA表达水平
采用RT-qPCR检测各组HCAECs中NOX2和NOX4的mRNA表达,结果如图 3所示,对甲酚作用HCAECs 48 h后,与对照组相比,对甲酚80 μg/mL组的NOX2和NOX4的mRNA表达显著增加;与对照+4%白蛋白组相比,对甲酚80 μg/mL+4%白蛋白组的NOX2和NOX4的mRNA表达水平显著增加。结果表明,游离的和蛋白结合的对甲酚均可以显著增加HCAECs中NOX2和NOX4的mRNA表达(P<0.05)。
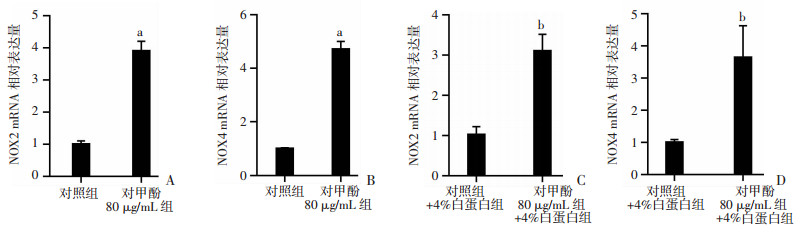
|
|
a:P<0.05,与对照组比较; b:P<0.05,与对照+4%白蛋白组比较 A、B:游离对甲酚对HCAECs中NOX2和NOX4 mRNA表达的影响;C、D:蛋白结合的对甲酚对HCAECs中NOX2和NOX4 mRNA表达的影响 图 3 RT-qPCR检测游离对甲酚和蛋白结合对甲酚对HCAECs中NOX2和NOX4 mRNA表达的影响(n=3, x±s) |
2.4 游离的和蛋白结合对甲酚增加HCAECs中NOX2、NOX4和p-p38的蛋白表达水平
Western blot结果显示,对甲酚作用HCAECs 48 h后,与对照组相比,对甲酚80 μg/mL组的NOX2、NOX4和p-p38的蛋白表达显著增加;与对照+4%白蛋白组相比,对甲酚80 μg/mL+4%白蛋白组的NOX2、NOX4和p-p38的蛋白表达显著增加。结果表明,游离的和蛋白结合的对甲酚均可以显著增加HCAECs中NOX2、NOX4和p-p38的蛋白表达(P<0.05,图 4)。
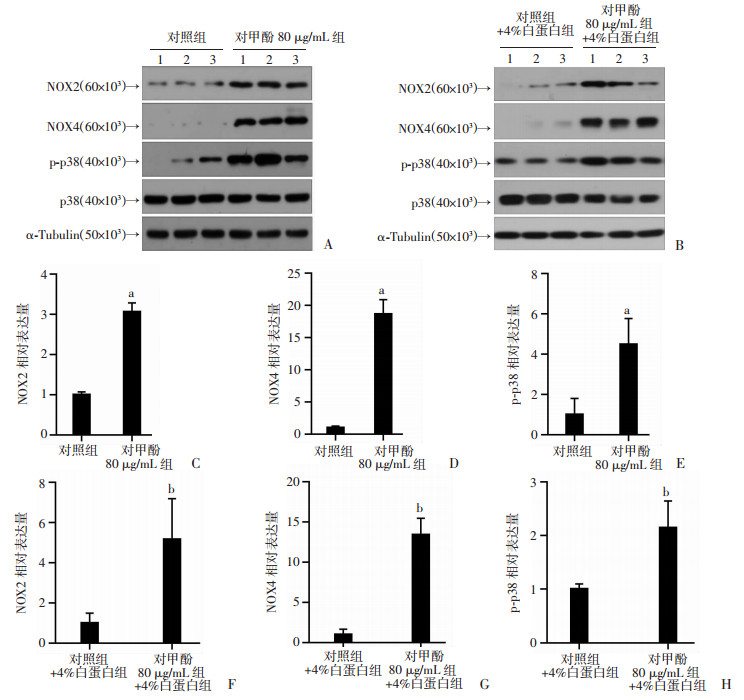
|
|
a:P<0.05,与对照组比较; b:P<0.05,与对照+4%白蛋白组比较 A、B:Western blot结果;C、D、E分别为游离对甲酚对HCAECs中NOX2、NOX4和p-p38蛋白表达水平的半定量分析;F、G、H分别为蛋白结合的对甲酚对HCAECs中NOX2、NOX4和p-p38蛋白表达水平的半定量分析 图 4 Western Blot检测游离对甲酚和蛋白结合的对甲酚对HCAECs中NOX2、NOX4和p-p38蛋白表达水平的影响(n=3, x±s) |
3 讨论
对甲酚是一种酚类挥发性化合物,是难解离蛋白结合尿毒症毒素的代表,它起源于大肠中的细菌发酵,并由饮食中的苯丙氨酸和酪氨酸代谢合成[14]。游离的对甲酚相对分子质量很小,仅为108.1,可以通过透析而清除;但大部分(94%)对甲酚在血液循环中与血浆白蛋白结合,不易被普通的透析所清除[4]。在肾衰竭中晚期的CKD患者中,血清中对甲酚的水平高出健康人约10倍[12]。先前的研究已经证实,对甲酚与血液透析患者中血管内皮功能障碍密切相关[12]。我们既往的研究发现,游离的对甲酚和蛋白结合的对甲酚均能够呈浓度和时间依赖性地抑制HUVECs的增殖,并且游离的对甲酚以及与蛋白结合的对甲酚均可以通过上调p21 Cip1蛋白的表达,下调Cyclin D1蛋白的表达,诱导HUVECs细胞周期停滞在G0/G1期,抑制DNA合成从而抑制HUVEC的增殖[13]。这也反映出蛋白结合的对甲酚对血管内皮细胞确实具有毒性作用。
氧化应激是指ROS及其代谢产物过量聚集,并通过激活相关信号通路调控某些效应基因的转录与表达,从而对细胞产生多种毒性作用的一种病理状态。大量研究证实,氧化应激是导致内皮细胞损伤的一个重要因素,氧化激酶可以刺激ROS的释放从而更进一步加快动脉粥样硬化进程[15]。本研究通过向体外培养的人冠状动脉内皮细胞中加入4%白蛋白,提供了对甲酚与白蛋白高度结合的体外环境。结果表明,游离的对甲酚和蛋白结合的对甲酚均可以显著抑制HCAECs的增殖,并且显著增加HCAECs中ROS的含量。在尿毒症患者中,难以通过透析消除的与蛋白结合的对甲酚,在循环血液中不断积累,刺激血管内皮细胞,抑制内皮细胞的增殖和修复,释放大量的活性氧,这可能是CKD患者加速性动脉粥样硬化的重要机制。
还原型烟酰胺腺嘌呤二核苷酸(NADPH)氧化酶是血管细胞生成ROS的重要来源。NADPH氧化酶中的NOX蛋白家族是一种唯一专职产生ROS的酶,是内皮细胞ROS产生的主要来源[16]。NOX位于质膜,存在于不同的细胞中,NOX2和NOX4主要在血管内皮细胞中表达,当NOX家族蛋白异常表达或激活时,产生大量的ROS,参与诱导动脉粥样硬化、炎症等疾病的发生和进展[16]。本研究体外实验结果发现,游离的和蛋白结合的对甲酚均可以显著增加HCAECs中NOX2和NOX4的mRNA和蛋白表达水平,表明游离的和蛋白结合的对甲酚可能通过促进HCAECs内NADPH氧化酶活性增加细胞中ROS表达量,诱导内皮细胞发生氧化应激。
新近的研究认为,ROS不仅能够直接损伤内皮细胞,还能够作为体内重要的信号分子,通过调控下游信号通路,控制内皮细胞生长、增殖和凋亡[17]。ROS下游信号分子之一是丝裂原活化蛋白激酶(MAPKs)家族,包含4个亚家族,分别是细胞外信号调节激酶1/2(包括ERK1和ERK2两种)、氨基末端激酶(JNKs,包括JNK1、JNK2和JNK3等3种亚型)、P38MAPKs(包括p38-α、p38-β、p38-γ和p38-δ等4种亚型)以及细胞外信号调节激酶5(ERK5)[18]。当氧化应激增强时,细胞内生成大量的ROS诱导MAPKs过度激活并转至细胞核周围,进而调控某些相关基因的转录,造成血管内皮细胞损伤[18]。并且,研究已经证实,MAPK信号传导途径与动脉粥样硬化病理生理学密切相关,因为它能引起血管平滑肌细胞的增殖和迁移[19]。体外实验已经表明,促炎介质可以引起内皮细胞凋亡和活化,它主要是通过MAPKs依赖途径来增加EMPs的释放,P38-MAPK途径参与控制TNF-α依赖的EMPs释放[20]。BARRETO等[21]的研究进一步发现,硫酸吲哚酚,一种与对甲酚具有相似的与白蛋白结合区域的蛋白结合毒素,通过活化MAPKs信号通路途径促进血管平滑肌细胞增殖和血管内皮细胞损伤。我们的研究结果发现,游离的和蛋白结合的对甲酚均可以显著增加HCAECs内MAPKs信号通路相关蛋白p-38的磷酸化,表明其可能通过激活MAPKs信号通路来诱导内皮细胞氧化应激,损伤血管内皮细胞。
综上所述,在CKD的进程中,具有氧化功能的尿毒症毒素对甲酚在血液循环中长时间蓄积并作用于血管内皮细胞,细胞内氧化——抗氧化平衡状态被打破,蛋白结合毒素对甲酚引发的氧化应激损伤发挥作用,引起内皮细胞ROS过量生成,并通过激活MAPKs信号通路造成内皮细胞功能障碍,加重CKD患者的血管病变。本研究结果表明与白蛋白高度结合的对甲酚确实具有致内皮损伤的毒性作用,进一步探索并开发出更好的解决方案以去除蛋白结合的尿毒症毒素,从而减轻蛋白结合毒素对尿毒症患者内皮功能的影响,是今后研究工作的方向。
| [1] |
DEO A, SCHMID C H, EARLEY A, et al. Loss to analysis in randomized controlled trials in CKD[J]. Am J Kidney Dis, 2011, 58(3): 349-355. |
| [2] |
REISS A B, MIYAWAKI N, MOON J, et al. CKD, arterial calcification, atherosclerosis and bone health: Inter-relationships and controversies[J]. Atherosclerosis, 2018, 278: 49-59. |
| [3] |
CLARK W R, DEHGHANI N L, NARSIMHAN V, et al. Uremic toxins and their relation to dialysis efficacy[J]. Blood Purif, 2019, 48(4): 299-314. |
| [4] |
GOMÓȽKA M, NIEMCZYK L, SZAMOTULSKA K, et al. Protein-bound solute clearance during hemodialysis[J]. Adv Exp Med Biol, 2019, 1153: 69-77. |
| [5] |
DOU L, BERTRAND E, CERINI C, et al. The uremic solutes p-cresol and indoxyl sulfate inhibit endothelial proliferation and wound repair[J]. Kidney International, 2004, 65: 442-451. |
| [6] |
JOURDE-CHICHE N, DOU L, SABATIER F, et al. Levels of circulating endothelial progenitor cells are related to uremic toxins and vascular injury in hemodialysis patients[J]. J Thromb Haemost, 2009, 7(9): 1576-1584. |
| [7] |
FENG B, ZHANG Y, MU J, et al. Preventive effect of a proteasome inhibitor on the formation of accelerated atherosclerosis in rabbits with uremia[J]. J Cardiovasc Pharmacol, 2010, 55(2): 129-138. |
| [8] |
FENG B, ZHANG Y Q, MU J, et al. Uraemic serum induces dysfunction of vascular endothelial cells: role of ubiquitin-proteasome pathway[J]. Exp Physiol, 2011, 96(8): 801-815. |
| [9] |
MU J, FENG B, YE Z, et al. Visfatin is related to lipid dysregulation, endothelial dysfunction and atherosclerosis in patients with chronic kidney disease[J]. J Nephrol, 2011, 24(2): 177-184. |
| [10] |
JANSEN J, JANKOWSKI J, GAJJALA P R, et al. Disposition and clinical implications of protein-bound uremic toxins[J]. Clin Sci Lond Engl, 2017, 131(14): 1631-1647. |
| [11] |
GRYP T, VANHOLDER R, VANEECHOUTTE M, et al. p-Cresyl Sulfate[J]. Toxins, 2017, 9(2): 52. |
| [12] |
李莉, 光丽霞, 王代红, 等. 对甲酚对人脐静脉内皮细胞增殖和细胞周期的影响[J]. 中华肾脏病杂志, 2013(9): 676-680. LI L, GUANG L X, WANG D H, et al. Effects of p-cresol on the proliferation and cell cycle of human umbilical vein endothelial cells[J]. Chin J Nephrol, 2013(9): 676-680. |
| [13] |
LI L, LI J, LI X, et al. Protein-bound P-cresol inhibits human umbilical vein endothelial cell proliferation by inducing cell cycle arrest at G0/G1[J]. Am J Transl Res, 2017, 9(4): 2013-2023. |
| [14] |
ATHERTON J G, HAINS D S, BISSLER J, et al. Generation, clearance, toxicity, and monitoring possibilities of unaccounted uremic toxins for improved dialysis prescriptions[J]. Am J Physiol Ren Physiol, 2018, 315(4): F890-F902. |
| [15] |
INCALZA M A, D'ORIA R, NATALICCHIO A, et al. Oxidative stress and reactive oxygen species in endothelial dysfunction associated with cardiovascular and metabolic diseases[J]. Vascul Pharmacol, 2018, 100: 1-19. |
| [16] |
ZHANG Y, MURUGESAN P, HUANG K, et al. NADPH oxidases and oxidase crosstalk in cardiovascular diseases: novel therapeutic targets[J]. Nat Rev Cardiol, 2020, 17(3): 170-194. |
| [17] |
SUN H J, WU Z Y, NIE X W, et al. Role of endothelial dysfunction in cardiovascular diseases: the link between inflammation and hydrogen sulfide[J]. Front Pharmacol, 2019, 10: 1568. |
| [18] |
YUE J, LOPEZ J M. Understanding MAPK signaling pathways in apoptosis[J]. Int J Mol Sci, 2020, 21(7): 2346. |
| [19] |
TANAKA K, HONDA M, TAKABATAKE T. Redox regulation of MAPK pathways and cardiac hypertrophy in adult rat cardiac myocyte[J]. J Am Coll Cardiol, 2001, 37(2): 676-685. |
| [20] |
MCCUBREY J A, LAHAIR M M, FRANKLIN R A. Reactive oxygen species-induced activation of the MAPkinase signaling pathways[J]. Antioxid Redox Signal, 2006, 8(9/10): 1775-1789. |
| [21] |
BARRETO F C, BARRETO D V, LIABEUF S, et al. Serum indoxyl sulfate is associated with vascular disease and mortality in chronic kidney disease patients[J]. Clin J Am Soc Nephrol, 2009, 4(10): 1551-1558. |




