急性心肌缺血严重且持久容易引发成为不可逆的心肌梗死,具有较高的死亡率,每年造成近730万人死亡[1]。目前经皮冠状动脉介入(percutaneous coronary intervention,PCI)紧急开通血管是首选方案[2-3],但我国目前医疗资源有限,且PCI治疗时间窗短,导致PCI治疗率低于10%,而溶栓治疗仍是当前治疗的重要手段之一[4-5]。如何在血流恢复前尽可能保护心脏功能或延长治疗窗口,减少严重并发症及死亡受到广泛关注[6]。线粒体功能障碍是心肌细胞功能障碍与结构损伤的重要环节[7],恢复线粒体功能可以改善心肌代谢、减少氧化应激和凋亡等发挥心脏保护作用。正常情况下,线粒体处于持续的分裂融合的动态平衡中,该平衡对维持线粒体及细胞功能极其重要[8]。线粒体过度分裂被认为是引发能量耗竭、代谢障碍,进一步诱导细胞凋亡等的重要因素。研究显示,缺血后心肌线粒体形态发生明显改变[9]。
以往在离体水平发现线粒体分裂抑制剂mdivi-1预处理显著降低了缺氧或内毒素等导致的细胞死亡,这些结果提示其对缺血性心脏病有治疗作用[10]。mdivi-1是否能在体内通过抑制线粒体分裂、恢复线粒体功能,减轻心肌损伤程度来发挥心脏保护作用尚不清楚。本研究复制小鼠急性心肌缺血模型并给予mdivi-1,研究其对小鼠心脏急性缺血的保护作用。
1 材料与方法 1.1 试剂mdivi-1购自Tocris Bioscience公司(英国),货号:3982,相对分子质量为353.33 g/mol。DMSO购自Sigma-Aldrich公司(美国)。Mito-Tracker DeepRed购自ThermoFisher公司(美国), 货号:M22426,使用时用DMEM培养基配制成50 nmol/L浓度。HE染色及脂质氧化(MDA)、ATP、活性氧(ROS)、超氧化物歧化酶(SOD)试剂盒购自上海碧云天生物技术有限公司。
1.2 小鼠急性心肌缺血模型制备C57BL/6J小鼠,SPF级别,雌雄随机,体质量(25±5)g,10周龄,购自斯贝福(北京)生物技术有限公司[实验动物许可证号SCXK(渝)2017-0006]。所有动物实验均通过陆军军医大学伦理审查委员会审查(AMUWEC20171288)。小鼠隔夜禁食,使用3%戊巴比妥钠剂量为45 mg/kg腹腔注射麻醉小鼠,根据文献结扎心脏冠状动脉左前降支(LAD)复制急性心肌缺血模型[11]。具体操作为:将麻醉后小鼠仰卧位固定于操作台上,采用小鼠四肢皮下插入电极接心电图监测小鼠心肌状态,剪开颈部皮肤便于观察,确保导管从口腔插入气管深度在会厌软骨约0.5 cm处。导管与小鼠气管连接保证小鼠正常呼吸。在小鼠左胸第3根肋骨处从小鼠左胸往右胸斜向上方向约1 cm左右皮肤开口,为了减少出血,避开血管剪断第3根肋骨,用小鼠胸腔撑开器沿肋骨断开方向暴露心脏,钝性分离心包膜,迅速由左心耳下沿向右前方约3 mm处穿线将LAD结扎,当观察到小鼠心电图ST段抬高,表明造模成功,取下撑开器分层关闭胸腔,心肌缺血2 h后取血液及组织标本进行观察。
1.3 实验分组和实验设计小鼠分成4组:假手术组、假手术+mdivi-1组、心肌缺血组、mdivi-1组。假手术组LAD穿线不结扎;假手术+mdivi-1组:LAD穿线不结扎给予mdivi-1;缺血组:LAD穿线结扎制作心肌缺血组;mdivi-1组:LAD穿线结扎造模成功后,给予mdivi-1处理。mdivi-1为经尾静脉一次性注射1 mg/kg。
第1批实验采用64只(n=16),造模完成后待小鼠麻药苏醒,放回鼠笼水粮自由喂养,持续密切观察10 d后统计存活情况;第2批实验32只(n=8),造模完成后收集小鼠血浆检测心肌标志物肌钙蛋白T(TnT)及急性分离心肌细胞观察线粒体形态;第3批实验32只(n=8),造模完成后收集小鼠心脏检测ATP、SOD、ROS、MDA;第4批实验12只(n=3),造模完成后收集小鼠心脏于多聚甲醛中固定,进行HE染色观察心脏病理形态。
1.4 指标检测 1.4.1 心肌线粒体形态观察造模完成后采用Ⅱ型胶原酶消化小鼠心脏急性分离小鼠心肌细胞[12]。沉淀即为分离出的心肌细胞,将细胞吸出转移到1 cm培养皿中,利用DMEM培养基配制Mito-Tracker DeepRed为50 nmol/L工作浓度,37 ℃孵育30 min标记。在激光共聚焦显微镜下观察线粒体形态,每次实验中每组细胞选择4个目标视野(ROI)统计线粒体长度。本研究中定义长轴大于1.5 μm为正常线粒体, 长轴小于1 μm碎片化线粒体[13]。
1.4.2 心脏丙二醛(MDA)检测按照试剂盒使用说明书通过比色法操作提取MDA测定,在酶标仪上检测并计算得出MDA含量。用BCA蛋白浓度试剂盒测定心脏组织蛋白浓度。用酶标仪在532 nm进行测定,设定450 nm为参考波长。根据测定的蛋白浓度将MDA进行标准化。
1.4.3 心脏ATP检测按照试剂盒使用说明书通过荧光素酶法测定ATP,在荧光酶标仪上检测并计算得出ATP含量。用BCA蛋白浓度测定试剂盒测定心脏组织蛋白浓度,根据测定的蛋白浓度将ATP进行标准化。
1.4.4 心脏(活性氧)ROS检测按照试剂盒使用说明书用DCFH-DA探针检测活性氧。用BCA蛋白浓度测定试剂盒测定蛋白浓度。利用荧光酶标仪在激发波490 nm和发射波525 nm测定其荧光强度。根据测定的蛋白浓度将探针荧光强度进行标准化。
1.4.5 心脏总超氧化物歧化酶(SOD)活性检测按照试剂盒使用说明书通过WST-8法操作测定总SOD酶活力(单位U)。用BCA蛋白浓度测定试剂盒测定蛋白浓度,根据测定的蛋白浓度总SOD酶活力进行标准化。
1.4.6 病理学检测取实验后的小鼠心脏,经过4%多聚甲醛固定,脱水透明后石蜡包埋,切3 μm厚度的心脏切片进行HE染色,在显微镜下观察缺血区域周围细胞。
1.4.7 心肌损伤标志物肌钙蛋白T(TnT)检测模型成功后抽血取300 μL血浆检测TnT含量,用电化学发光全自动免疫分析系统(罗氏Cobas e601,瑞士罗氏公司)测定。
1.5 统计学方法计量资料采用单因素方差分析,组间差异采用Tukey进行比较;存活时间采用平均存活时间表示并用Kaplan-Meier法分析。P < 0.05为差异有统计学意义。
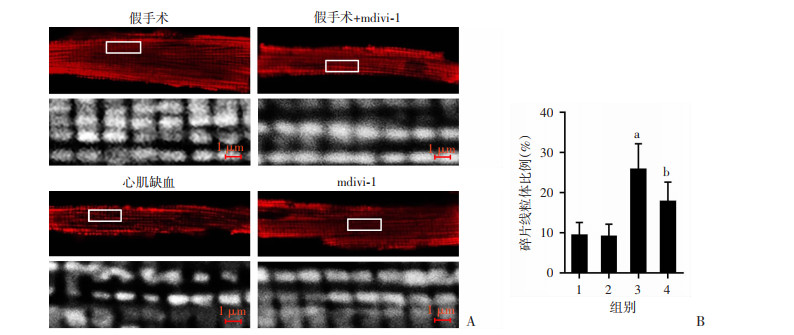
2 结果 2.1 mdivi-1对心肌缺血小鼠线粒体结构的影响本实验室分离得到的心肌细胞,75%以上为“长杆状”、纹路清晰整齐、折光性好的细胞。假手术组和假手术+mdivi-1组心肌细胞内线粒体排列规律,形状规则;心肌缺血得到的心肌细胞线粒体碎片化程度高,排列紊乱,形态异质性增高;mdivi-1组相比于缺血组的心肌线粒体形态有所恢复,线粒体的异常形态比例相比缺血心肌细胞明显减少,单位面积异常线粒体比例由25.78%显著降至17.78%(P < 0.01),表明mdivi-1能保护心肌线粒体结构(图 1)。
|
| A:激光共聚焦显微镜观察心肌细胞(上排为单个心肌细胞图片,下排为框选区域放大图片);B:单位面积碎片化线粒体比例(n=12 ROI/组);1:假手术组;2:假手术+mdivi-1组;3:心肌缺血组;4:mdivi-1组;a: P < 0.01, 与假手术组比较;b: P < 0.01, 与心肌缺血组比较 图 1 mdivi-1对小鼠缺血心肌线粒体形态的影响 |
2.2 mdivi-1对心肌缺血小鼠线粒体功能的影响
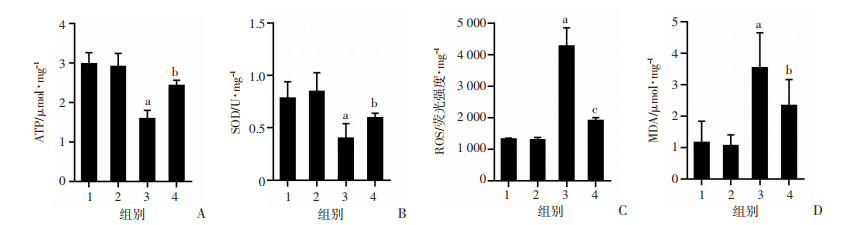
与假手术组比较,心肌缺血组小鼠心肌线粒体功能明显受损,氧化应激与抗氧化失衡。表现为心肌ATP减少47.9%、SOD降低54%、ROS增加2.2倍,MDA增加1.24倍。与缺血组相比,mdivi-1组ATP增加50.3%、SOD上升65.4%、ROS下降1.2倍、MDA下降26.2%(P < 0.05),表明mdivi-1能提高缺血心肌组织中ATP合成能力并减轻氧化应激水平(图 2)。
|
| A:mdivi-1对小鼠心肌ATP的影响; B: mdivi-1对小鼠心肌SOD的影响; C: mdivi-1对小鼠心肌ROS的影响; D: mdivi-1对小鼠心肌MDA的影响;1:假手术组;2:假手术+mdivi-1组;3:心肌缺血组;4:mdivi-1组;a: P < 0.01, 与假手术组比较;b:P < 0.05, c:P < 0.01, 与心肌缺血组比较 图 2 mdivi-1对心肌缺血小鼠线粒体功能的影响 |
2.3 mdivi-1对心肌缺血小鼠心脏病理的影响
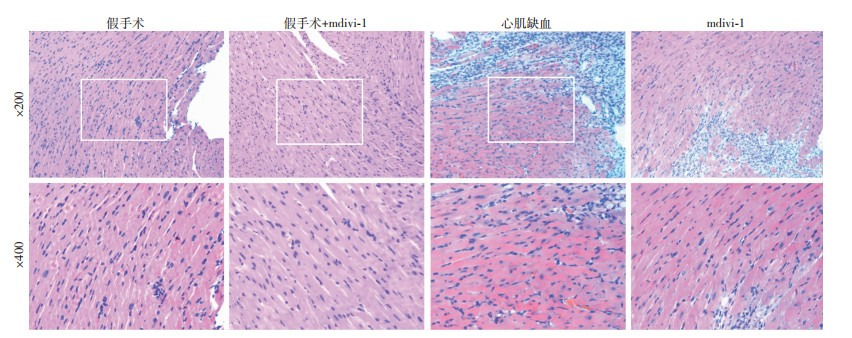
通过心肌缺血组与注射mdivi-1组心脏组织HE染色,观察到缺血组心肌组织周围的细胞水肿、白细胞浸润多,有细胞死亡,mdivi-1组缺血心肌细胞周围损伤带缩窄,心肌细胞边界清晰,表明mdivi-1对小鼠缺血心肌周围的细胞有保护作用(图 3)。
|
| 图 3 mdivi-1对心肌缺血小鼠心肌损伤的影响 |
2.4 mdivi-1对心肌缺血小鼠心肌标志物及存活、存活率的影响
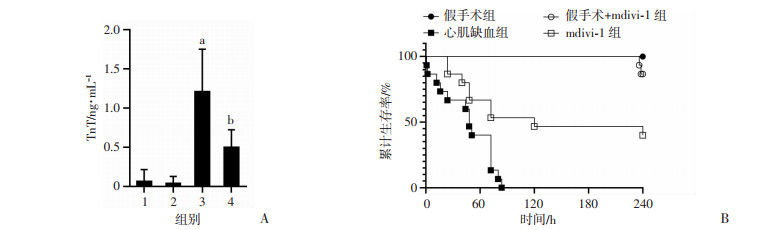
心肌缺血组小鼠TnT含量比假手术组上升了17.36倍;而mdivi-1组TnT含量比心肌缺血组降低了61.9%,表明mdivi-1能降低小鼠心肌损伤程度(P < 0.01, 图 4A);与假手术组比较,6/16心肌缺血组小鼠在24 h内死亡,平均存活时间43.25 h;假手术+mdivi-1组与之相比无明显差异;mdivi-1组在12 h内无死亡,50%小鼠存活超过120 h,平均存活时间148 h,120 h存活率为8/16,说明mdivi-1能够显著提高小鼠存活率(图 4B)。
|
| A:mdivi-1对心肌缺血小鼠心肌标志物的影响(n=8);B: mdivi-1对心肌缺血小鼠存活、存活率的影响(n=16);1:假手术组;2:假手术+mdivi-1组;3:心肌缺血组;4:mdivi-1组;a:P < 0.01,与假手术组比较; b:P < 0.05,与心肌缺血组比较 图 4 mdivi-1对心肌缺血小鼠心肌损伤标志物及存活、存活率的影响 |
3 讨论
近年来,随着生活水平的提高,我国冠心病的发病率和病死率逐年升高,并呈年轻化趋势,而急性心肌梗死发病率也随之升高[14]。长期缺血和缺氧而引起有氧代谢紊乱,导致心肌细胞间质充血、水肿和退行性坏死,并发心力衰竭[15]、衰弱和死亡[11]。因此,心肌梗死仍然是全世界高发病率和死亡率的严重疾病[16-18]。本研究结果显示mdivi-1能够明显减小心肌组织和线粒体受损程度,结果提示mdivi-1在急性心肌缺血小鼠心脏功能损伤中具有保护作用,可改善线粒体供能不足,保护心脏功能,提高小鼠的存活率。以往研究证实,在长时间的缺血状态下心肌细胞开始死亡,虽然再灌注会改善这个过程,但它也会进一步导致细胞死亡,扩大梗死面积。
急性心肌缺血会对心肌细胞造成致命的损伤,很难保留心肌功能。缺血心肌的快速再灌注在几十年前就被认为是一种对心肌梗死非常有益的治疗方法,但是再灌注在很多情况下无法实施,时间窗短且存在再灌注损伤风险,如何在细胞死亡发生前减轻细胞损伤具有很高的研究价值,在进一步明确其损伤机制时制定保护心脏的策略具有重要意义。有证据表明,线粒体在细胞凋亡、坏死、铁死亡等多种细胞死亡途径中都起着重要作用。在心肌细胞中,线粒体分裂、融合、自噬和生成是一个动态平衡的过程,线粒体过度分裂、融合减少或自噬障碍能打破线粒体质量平衡进而引起功能障碍,包括ATP形成减少、ROS增多、细胞色素C释放并影响细胞活力。介导线粒体分裂的主要蛋白质是动力蛋白相关蛋白1(dynaminrelated protein1, DRP1)[19],线粒体外膜蛋白通过募集DRP1促进线粒体分裂[20]。mdivi-1是DRP1的抑制剂,可通过变构防止DRP1寡聚化抑制其功能[21],从而抑制线粒体过度分裂保护心肌功能。本研究采用mdivi-1处理小鼠缺血心脏,结果显示心肌线粒体结构改变显著减轻,心肌线粒体功能障碍程度显著降低,表明mdivi-1对缺血心肌具有保护作用。另一方面,通过促进线粒体融合也可能发挥对细胞的保护作用。线粒体融合受到线粒体融合蛋白1/2(MFN1/MFN2)的调节[22]。研究显示利用线粒体融合激动剂M1能促进线粒体融合,增强线粒体氧化磷酸化偶联及ATP生成,进而改善心肌细胞肥大、防止心肌细胞凋亡、减小心肌缺血面积等[23]。但融合过度会导致线粒体质量控制失调,如突变DNA及脂质过氧化物的积累,影响线粒体的清除过程。
本研究显示,利用线粒体分裂抑制剂mdivi-1抑制线粒体过度分裂,能显著改善心肌细胞线粒体形态,纠正线粒体功能障碍,减轻缺血导致的心肌损伤。提示调节线粒体分裂、融合动态平衡是防止缺血性心肌损伤、保护心肌功能的重要手段。
| [1] |
PASCUAL-GIL S, GARBAYO E, DÍAZ-HERRÁEZ P, et al. Heart regeneration after myocardial infarction using synthetic biomaterials[J]. J Control Release, 2015, 203: 23-38. |
| [2] |
O'GARA P T, KUSHNER F G, ASCHEIM D D, et al. 2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines: developed in collaboration with the American College of Emergency Physicians and Society for Cardiovascular Angiography and Interventions[J]. Catheter Cardiovasc Interv, 2013, 82(1): E1-E27. |
| [3] |
IBANEZ B, JAMES S, AGEWALL S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC)[J]. Eur Heart J, 2018, 39(2): 119-177. |
| [4] |
LI J, LI X, WANG Q, et al. ST-segment elevation myocardial infarction in China from 2001 to 2011 (the China PEACE-Retrospective Acute Myocardial Infarction Study): a retrospective analysis of hospital data[J]. Lancet, 2015, 385(9966): 441-451. |
| [5] |
ROSSELLÓ X, HUO Y, POCOCK S, et al. Global geographical variations in ST-segment elevation myocardial infarction management and post-discharge mortality[J]. Int J Cardiol, 2017, 245: 27-34. |
| [6] |
林春, 陈关海, 吴柱国. 急性心肌梗死预后的影响因素[J]. 海南医学, 2020, 31(2): 227-230. LIN C, CHEN G H, WU Z G. Prognostic factors of acute myocardial infarction[J]. Hainan Med J, 2020, 31(2): 227-230. |
| [7] |
薛大忠, 赵自刚, 牛春雨. 线粒体损伤及其在心肌细胞损伤中的作用[J]. 中国老年学杂志, 2016, 36(1): 223-227. XUE D Z, ZHAO Z G, NIU C Y. Mitochondrial damage and its role in myocardial cell injury[J]. Chin J Gerontol, 2016, 36(1): 223-227. |
| [8] |
赵丽, 周巧霞, 王拴, 等. 线粒体分裂和融合相关蛋白质的研究进展[J]. 生理学报, 2018, 70(4): 424-432. ZHAO L, ZHOU Q X, WANG S, et al. Research progress of mitochondrial fission and fusion related proteins[J]. Acta Physiol Sin, 2018, 70(4): 424-432. |
| [9] |
DUAN C Y, WANG L, ZHANG J, et al. Mdivi-1 attenuates oxidative stress and exerts vascular protection in ischemic/hypoxic injury by a mechanism independent of Drp1 GTPase activity[J]. Redox Biol, 2020, 37: 101706. |
| [10] |
GAO E, LEI Y H, SHANG X, et al. A novel and efficient model of coronary artery ligation and myocardial infarction in the mouse[J]. Circ Res, 2010, 107(12): 1445-1453. |
| [11] |
SUN T T, ZHANG L H, LI X X, et al. MicroRNA-1 and circulating microvesicles mediate the protective effects of dantonic in acute myocardial infarction rat models[J]. Front Physiol, 2018, 9: 664. |
| [12] |
DAVIDSON S M, ARJUN S, BASALAY M V, et al. The 10th Biennial Hatter Cardiovascular Institute workshop: cellular protection-evaluating new directions in the setting of myocardial infarction, ischaemic stroke, and cardio-oncology[J]. Basic Res Cardiol, 2018, 113(6): 43. |
| [13] |
任静娜, 马宏昕, 饶本龙, 等. 大鼠心肌细胞急性分离方法及影响因素探讨[J]. 中西医结合心脑血管病杂志, 2018, 16(8): 1034-1037. REN J N, MA H X, RAO B L, et al. Acute isolation of cardiomyocytes in rat and its influencing factors[J]. Chin J Integr Med Cardio-/Cerebrovasc Dis, 2018, 16(8): 1034-1037. |
| [14] |
钟敏, 宁竹之, 石凯, 等. 锻炼与药物复合处理对模拟高原低氧下小鼠心肌线粒体作用的图象分析[J]. 解放军预防医学杂志, 1996, 14(6): 402-404. ZHONG M, NING Z Z, SHI K, et al. Image analysis of the effects of the combination use of training and drug intervention on myocardlal mitochondria in mice[J]. J Prev Med Chin PLA, 1996, 14(6): 402-404. |
| [15] |
YANG T F, ZHANG X F, MA C M, et al. TGF-β/Smad3 pathway enhances the cardio-protection of S1R/SIPR1 in in vitro ischemia-reperfusion myocardial cell model[J]. Exp Ther Med, 2018, 16(1): 178-184. |
| [16] |
JANAHMADI Z, NEKOOEIAN A A, MOAREF A R, et al. Oleuropein offers cardioprotection in rats with acute myocardial infarction[J]. Cardiovasc Toxicol, 2015, 15(1): 61-68. |
| [17] |
YU B, ZHANG G, AN Y, et al. Morroniside on anti-inflammation activities in rats following acute myocardial infarction[J]. Korean J Physiol Pharmacol, 2018, 22(1): 17-21. |
| [18] |
SHANMUGAM K, RAVINDRAN S, KURIAN G A, et al. Fisetin confers cardioprotection against myocardial ischemia reperfusion injury by suppressing mitochondrial oxidative stress and mitochondrial dysfunction and inhibiting glycogen synthase kinase 3β activity[J]. Oxid Med Cell Longev, 2018, 2018: 9173436. |
| [19] |
ELGASS K, PAKAY J, RYAN M T, et al. Recent advances into the understanding of mitochondrial fission[J]. Biochim Biophys Acta, 2013, 1833(1): 150-161. |
| [20] |
ZHANG Z Z, LIU L, WU S N, et al. Drp1, Mff, Fis1, and MiD51 are coordinated to mediate mitochondrial fission during UV irradiation-induced apoptosis[J]. Faseb J, 2016, 30(1): 466-476. |
| [21] |
CHEN Y, LIN J R, GAO P J. Mitochondrial division inhibitor Mdivi-1 ameliorates angiotensin Ⅱ-induced endothelial dysfunction[J]. Acta Physiol Sin, 2016, 68(5): 669-676. |
| [22] |
李献帅, 穆军升. 线粒体融合蛋白1、线粒体融合蛋白2与心肌细胞生理机能关系的研究进展[J]. 中国胸心血管外科临床杂志, 2013, 20(4): 457-462. LI X S, MU J S. Research progress of relationship between mitochondrial fusion protein 1, mitochondrial fusion protein 2 and physiological function of cardiomyocyte[J]. Chin J Clin Thorac Cardiovasc Surg, 2013, 20(4): 457-462. |
| [23] |
LEES J G, KONG A M, CHEN Y C, et al. Mitochondrial fusion by M1 promotes embryoid body cardiac differentiation of human pluripotent stem cells[J]. Stem Cells Int, 2019, 2019: 6380135. |




