2. 400030 重庆,重庆市肿瘤医院
2. Chongqing Cancer Hospital, Chongqing, 400030, China
急性肺损伤(acute lung injury, ALI)作为脓毒症的严重并发症,主要表现为肺泡上皮屏障功能障碍、弥漫性肺间质及肺泡水肿、大量炎症因子释放以及细胞凋亡[1]。脓毒症ALI时机体难以控制的炎症反应及免疫功能抑制是脓毒症患者死亡的一个主要原因。自噬(autophagy)是一种细胞自我保护过程,由一系列相关信号分子调控形成自噬泡,将受损的蛋白质转运至溶酶体进行降解和循环,以维持细胞内环境的稳定。评估自噬水平最准确的方法是检测自噬流水平[2],即包括从自噬小体形成到与溶酶体融合的整个动态过程的检测。研究表明[3-6],自噬与多种病因所致的肺损伤病理过程相关。目前研究发现,自噬可参与调控脓毒症ALI时炎症反应,在脓毒症ALI小鼠模型中,激活并促进自噬可调节炎症反应,减少细胞凋亡及继发性组织损伤[7-8]。
嗜铬粒蛋白A(chromogranin A,CGA)[9]是一种广泛分布于神经内分泌细胞和神经元内的可溶性糖蛋白,可调节激素和神经肽的储存和分泌,参与机体内环境稳定的调控,是多种生物活性肽的前体,在不同组织中可分解为不同片段。其衍生多肽CGA47-66(chromofungin,CHR)是一个具有多种生物活性的小分子多肽,参与先天免疫调节。EISSA等[10]的研究发现CHR可降低结肠炎小鼠局部炎症反应及组织学损伤。本课题组前期研究[11-12]提示,在TNF-α所致炎症状态下,CHR可改善血管内皮细胞的高通透性。在脓毒症ALI时,CHR可激活自噬改善肺损伤。然而CHR对自噬动态过程的具体影响如何,及其调控自噬后如何改善肺损伤的机制,尚未完全阐明。
本研究通过LPS刺激建立脓毒症小鼠模型,明确CHR促进肺组织中自噬流水平增高,发挥抗炎保护作用,预防性保护脓毒症所致急性肺损伤,为进一步探讨脓毒症ALI的神经内分泌自身保护机制打下基础。
1 材料与方法 1.1 实验动物与分组6~8周龄雄性C57BL/6小鼠,体质量(20±5)g,购自重庆医科大学实验动物中心,饲养于SPF级动物房内,本实验遵循《实验动物保护条例》。64只小鼠按随机数字表法分为4组(n=16),分别为:①模型组(LPS),腹腔注射相应剂量的LPS(10 mg/kg);②对照组,腹腔注射等量生理盐水;③CHR预处理组(CHR+LPS),LPS处理前腹腔注射低浓度CHR(77.5 μg/kg)预处理30 min;④Rapa组(Rapa+LPS),LPS处理前腹腔注射Rapa (10 mg/kg)预处理30 min。观察小鼠一般情况及5 d生存率。各组小鼠于LPS作用6 h后采集标本进行后续实验。
1.2 主要试剂LPS粉剂购于美国Sigma公司,溶于注射用水,配制成1 mg/mL的母液,4 ℃冰箱储存备用。胎牛血清、RPMI1640培养基购于HyClone公司。兔多抗LC3B、兔多抗Atg7、兔多抗P62均购自武汉三鹰生物技术有限公司。辣根过氧化物酶(HRP)标记的山羊抗兔/小鼠IgG、山羊抗鼠Dylight488、山羊抗兔Dylight549等购自亚科因(武汉)生物技术有限公司。苏木精伊红染色试剂盒、苯甲基磺酰氟(PMSF)、RIPA裂解液、BCA蛋白定量试剂盒、Western blot试剂盒、DAPI、抗荧光淬灭封片液等购自上海碧云天生物技术有限公司。多肽购自上海科肽生物科技有限公司。嗜铬粒蛋白(CGA)衍生多肽CGA47-66(CHR:RILSILRHQNLLKE-LQDLAL)由上海科肽生物科技有限公司合成。
1.3 肺组织病理学改变各组小鼠予以相应处理6 h后,处死小鼠,充分暴露胸腔,取右肺组织于1.5 mL EP管中,加入4%多聚甲醛外固定24 h,脱水、透明、浸蜡、石蜡包埋、切片、HE染色,显微镜下观察肺组织病理变化。
1.4 ELISA检测肺泡灌洗液中炎症相关细胞因子改变各组小鼠接受相应处理6 h后,处死小鼠,仰卧位固定,充分暴露颈前及胸腔,用组织剪在气管上端做一切口,置入气管导管,注入0.3 mL生理盐水反复灌洗,灌洗5次,收集约1.5 mL肺泡灌洗液于EP管中,4 ℃,1 500 r/min离心10 min,提取上清液,根据ELISA试剂盒说明操作,检测肺泡灌洗液中促炎因子IL-6、TNF-α、抗炎因子IL-10的浓度。实验重复3次。
1.5 Western blot检测自噬标志蛋白表达各个实验组处理同前述,提取左肺组织处理成组织匀浆,冰上裂解,4 ℃,12 000 r/min离心20 min,收集上清液,对等量组织蛋白进行SDS-PAGE分离,电泳后转移到PVDF膜上后,封闭液封闭,自噬标志蛋白LC3和底物蛋白P62抗体4 ℃孵育过夜,二抗常温下孵育2 h,ECL显影液处理,X线片曝光,Image J软件分析目的蛋白/相应内参灰度值比值。实验重复3次。
1.6 免疫荧光检测自噬表达各实验组处理方法如前述,LPS作用6 h后,提取各组小鼠右肺组织,置于4%多聚甲醛中固定,4 ℃过夜,脱水、晾干、OCT冰冻包埋,切片、通透、封闭,一抗孵育4 ℃过夜,二抗室温下孵育1 h,滴加含DAPI的抗荧光淬灭封片液封片,荧光显微镜下观察各组肺组织荧光强度。实验重复3次。
1.7 透射电镜观察自噬小体超微结构实验动物处理方法如前述,处死小鼠后,取左肺切成1 mm3大小组织块,用4%戊二醛电镜固定液固定,4 ℃保存,送至重庆医科大学电子显微镜室进行透射电镜观察。
1.8 统计学分析采用Graphpad Prism 8统计软件分析,计量资料以x±s表示,组间比较采用单因素方差分析,两两比较采用t检验,检验水准α=0.05。
2 结果 2.1 CHR对脓毒症小鼠生存率的影响CHR与Rapa预处理30 min后,用LPS腹腔注射处理小鼠,观察各组小鼠进食、活动度等一般情况,统计并分析5 d生存率的差异。结果显示,对照组小鼠无死亡,与对照组相比,LPS组小鼠5 d生存率显著降低为12.5%(P < 0.05);与LPS组相比,CHR与Rapa预处理后小鼠生存率均增高,其中CHR组小鼠5 d生存率为68.75%(P < 0.05),而Rapa预处理后小鼠5 d生存率为81.25%(P < 0.05),差异均具有统计学意义,见图 1。

|
| a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 1 小鼠5 d生存率分析 |
2.2 CHR对LPS刺激后小鼠肺组织病理损伤的影响
倒置显微镜观察结果显示,LPS组小鼠肺间质水肿增厚,肺泡腔明显萎陷,完整性破坏,大量炎性细胞浸润,呈明显的急性炎症反应表现。同时,与LPS组相比,CHR组炎性渗出、肺实变及肺水肿等组织学损伤相对较轻;自噬诱导剂Rapa作用后同样减轻了肺组织炎性渗出、组织水肿、结构破坏等病理学改变,见图 2。
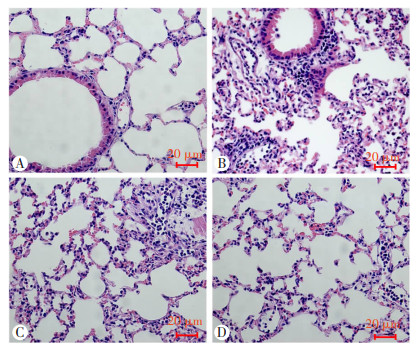
|
| A:对照组;B:LPS组;C:CHR+LPS组;D:Rapa+LPS组 图 2 小鼠肺组织病理形态学变化(HE) |
2.3 CHR对脓毒症小鼠肺组织中自噬水平的影响
通过Western blot检测小鼠肺组织中自噬相关蛋白表达变化,观察CHR对脓毒症时肺组织中自噬的影响,结果显示,与对照组相比,LPS组小鼠肺组织LC3 Ⅱ、P62蛋白水平明显增加(P < 0.05)。与LPS组相比,CHR组与Rapa组中LC3 Ⅱ蛋白表达量均增加(P < 0.05),P62蛋白表达则均显著减少(P < 0.05, 图 3A、B)。应用免疫荧光方法进一步观察各组小鼠肺组织中自噬标志物的荧光表达变化,发现与对照组相比,LPS组中LC3B与Atg7的荧光表达强度增强,CHR与Rapa预处理后较LPS组均有明显增强;LPS组与对照组相比,P62的荧光强度未有明显差异,而CHR组与Rapa组中P62荧光强度明显降低(图 3C)。
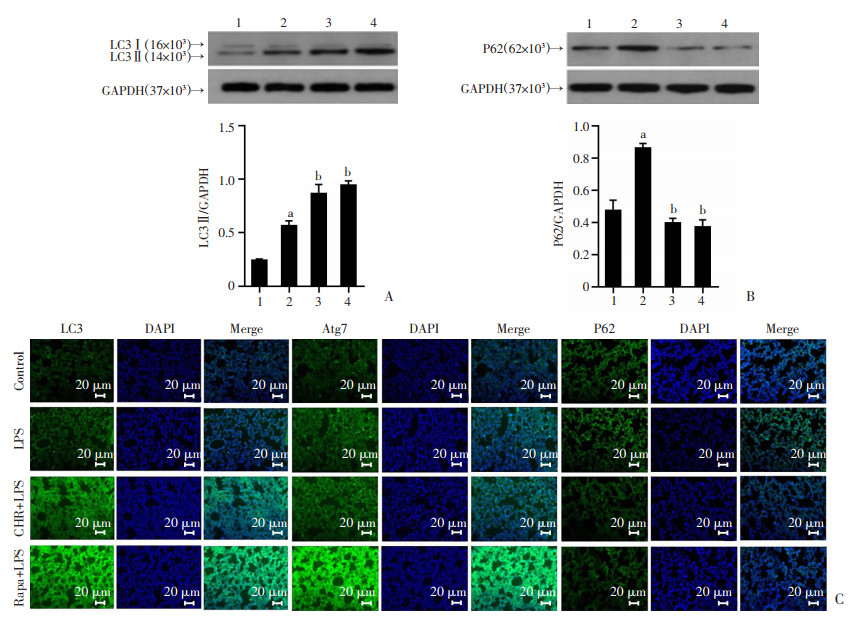
|
| A:Western blot检测自噬标志蛋白LC3表达水平;B:Western blot检测自噬底物蛋白P62表达水平;C:免疫荧光检测自噬相关蛋白LC3、Atg7、P62荧光表达强度 1:对照组;2:LPS组;3:CHR+LPS组;4:Rapa+LPS组; a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 3 小鼠肺组织自噬相关蛋白表达水平 |
2.4 CHR对脓毒症小鼠肺组织自噬流的影响
为了进一步观察CHR对各组小鼠肺组织中自噬过程的影响,通过透射电子显微镜观察肺组织超微结构,结果显示,与对照组(图 4A)相比,LPS组中部分细胞结构水肿,出现空泡,胞内发现板层小体(图 4B);CHR及Rapa预处理后肺组织肿胀明显改善,CHR预处理后可观察到成熟自噬小体与自噬溶酶体(图 4C);Rapa组中观察到大量自噬溶酶体形成(图 4D)。

|
| A:对照组;B:LPS组;C:CHR+LPS组;D:Rapa+LPS组; 蓝色箭头示自噬小体;红色箭头示自噬溶酶体 图 4 透射电镜观察CHR对脓毒症小鼠肺组织自噬流的影响 |
2.5 CHR对脓毒症小鼠肺炎症反应的影响
为了验证CHR对肺组织炎症因子水平的影响,进一步提取小鼠肺泡灌洗液(BALF),ELISA检测BALF中促炎因子TNF-α、IL-6以及抗炎因子IL-10的表达,结果显示:与对照组相比,LPS组中TNF-α、IL-6浓度显著增加,同时IL-10表达降低(P < 0.05)。与LPS组相比,CHR预处理后TNF-α、IL-6相对水平降低,IL-10水平升高(P < 0.05)。此时,Rapa组中炎症因子TNF-α、IL-6水平降低,抗炎因子IL-10表达增加(P < 0.05),差异均具有统计学意义,见图 5。
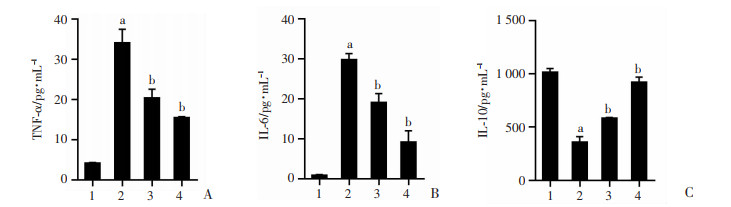
|
| A:TNF-α水平;B:IL-6水平;C:IL-10水平; 1:对照组;2:LPS组;3:CHR+LPS组;4:Rapa+LPS组; a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 5 CHR对小鼠肺部炎症反应的影响 |
3 讨论
急性肺损伤/急性呼吸窘迫综合征[13-14]作为脓毒症诱发的常见肺部严重并发症,发展迅速,发生率及病死率高,至今仍无特异性治疗[4]。ALI的病理生理学特征复杂,过度炎症反应和免疫损伤是ALI的核心特征,而在不同病因所致ALI中,因病原体及受影响细胞类型不同可引起不同水平自噬的激活,进而发挥对肺损伤的保护作用[15-16],但其具体机制尚不清楚。自噬是细胞膜包裹细胞质上可溶性大分子、受损细胞器或其他微生物形成双层膜结构的自噬小体,然后运送至溶酶体,形成自噬溶酶体再降解自噬小体内容物的高度动态、多步骤的生理过程[17-18]。本研究发现:①通过腹腔注射LPS建立脓毒症肺损伤小鼠模型,CHR预处理后显著提高小鼠生存率,改善肺组织病理损伤,提示CHR对LPS诱导的ALI具有保护作用。②LPS诱导的脓毒症ALI小鼠中,自噬处于不完全激活状态,予以CHR干预后,显著促进自噬水平,改善ALI。③CHR促进脓毒症ALI时肺组织上自噬小体的形成,及其与自噬溶酶体的融合,明确了CHR可通畅自噬流整个动态过程。④CHR促进自噬流通畅,可抑制脓毒症时肺组织中炎症反应,进而改善了ALI。总之,这些结果显示,CHR通过调控自噬流改善了脓毒症中肺组织所受炎性损害。CHR对自噬流的调控,为关于CGA及其衍生多肽的研究提供了新认识,可能促进脓毒症所致ALI治疗方法的新发展。
本研究结果提示LPS刺激后,脓毒症ALI时自噬发生不完全激活。本研究通过Western blot及免疫荧光检测发现,LPS刺激后自噬标志蛋白表达上调,同时自噬底物蛋白积累,提示此时可能自噬激活但尚未形成自噬小体。为准确评估自噬水平,通过透射电镜直观地观察自噬流过程,结果在透射电镜下未观察到LPS处理后自噬小体也无自噬溶酶体的积累,进一步明确了脓毒症时肺组织中自噬激活时,尚未形成自噬小体,提示在脓毒症ALI时自噬可能呈现不完全激活状态。与既往LIN等[19]发现脓毒症肝损伤时自噬处于不完全激活状态的结果相似。
为明确CHR对LPS刺激后所致ALI时自噬水平的影响,本研究采用Western blot检测自噬相关蛋白的表达,结果发现,与LPS组相比,予以CHR预处理后,自噬标志蛋白表达水平显著升高,自噬底物蛋白水平降低。Rapa是自噬诱导剂,能直接激活自噬,在本研究中Rapa预处理后自噬相关蛋白水平变化与CHR预处理后基本一致。进一步通过透射电镜检测,明确观察到CHR处理后自噬小体形成,且自噬溶酶体出现,提示CHR调控自噬流全过程通畅,上调自噬水平。与之一致的是,自噬诱导剂Rapa预处理后出现溶酶体吞噬自噬小体,降解内容物的表现,提示自噬流通畅,自噬水平增高。已有研究证实[20-21],在脓毒症时上调自噬相关蛋白能发挥肺保护性作用。本课题组前期研究表明CHR可通畅自噬流改善脓毒症所致ALI[11]。本研究结果进一步明确了脓毒症ALI时自噬发生不完全激活,予以CHR预处理可能与自噬诱导剂Rapa一样,可通畅肺组织上自噬流,提高自噬水平,对脓毒症肺损伤起到保护作用。
炎症的过度激活是脓毒症ALI发生的重要基础,本研究提取小鼠肺泡灌洗液,通过ELISA检测炎症因子水平,发现CHR预处理后,促炎因子水平显著降低,抗炎因子水平显著增高,提示CHR可下调脓毒症ALI的过度炎症反应,与Rapa影响炎症相关细胞因子水平的改变基本一致。因此,我们认为CHR减轻脓毒症所致ALI不仅取决于自身对炎症反应抑制,还取决于其具有自噬增强特性,可以通过提高肺组织自噬流的通畅,减少炎症相关细胞因子水平,改善脓毒症所致肺损伤。
嗜铬粒蛋白A(CGA)是人体神经内分泌系统参与调节机体代谢、先天免疫、组织修复等不同生物学功能的重要激素前蛋白[6],研究表明血浆CGA水平与炎症反应评估指标之间存在相关性,且血浆CGA水平与脓毒症患者的预后及死亡率相关[22],是脓毒症患者临床不良预后的独立预测指标。CHR作为CGA水解后短肽,课题组前期研究发现,CHR可改善炎性状态下血管内皮细胞的高通透性所致损伤[12]。此外,在溃疡性结肠炎中CHR通过影响相关炎症介质及巨噬细胞的极化,发挥调控炎症反应及先天免疫的作用,以此改善肠道炎症[8]。本研究结果显示CGA及其衍生蛋白的重要全身炎症反应调节机制和脏器保护作用,在脓毒症肺损伤目前治疗遭遇瓶颈的现状下,CHR作为CGA的重要功能片段,在机体应激反应中起到重要稳态调节作用,本研究着眼于应激调节和自噬激活这两个重要稳态调节机制,寻找脓毒症时脏器保护的新靶点。本研究也存在一定局限性,尚未深入探讨脓毒症ALI时,CHR促进自噬调控炎症反应的具体自噬细胞及分子机制,后续将进一步从细胞水平和具体机制出发,为脓毒症肺损伤的预防和免疫调节治疗提供实验证据和新思路。
综上所述,在前期研究的基础上,本研究明确LPS诱导的脓毒症ALI时自噬不完全激活,CHR通过促进脓毒症时小鼠肺组织中自噬溶酶体的融合形成,转运降解,维护自噬流通畅,促进自噬增强,进而减轻LPS刺激后肺部炎症反应,改善肺组织病理损伤程度,发挥对脓毒症所致ALI的预防性保护作用。
| [1] |
GOTTS J E, MATTHAY M A. Sepsis: pathophysiology and clinical management[J]. BMJ, 2016, 353: i1585. |
| [2] |
MO Y, LOU Y Y, ZHANG A Q, et al. PICK1 deficiency induces autophagy dysfunction via lysosomal impairment and amplifies sepsis-induced acute lung injury[J]. Mediat Inflamm, 2018, 2018: 6757368. |
| [3] |
ZHAO H Y, CHEN H G, MENG X Y, et al. Autophagy activation improves lung injury and inflammation in sepsis[J]. Inflammation, 2019, 42(2): 426-439. |
| [4] |
QIN L, LI M, TAN H L, et al. Mechanistic target of rapamycin-mediated autophagy is involved in the alleviation of lipopolysaccharide-induced acute lung injury in rats[J]. Int Immunopharmacol, 2020, 78: 105790. |
| [5] |
BODAS M, PEHOTE G, SILVERBERG D, et al. Autophagy augmentation alleviates cigarette smoke-induced CFTR-dysfunction, ceramide-accumulation and COPD-emphysema pathogenesis[J]. Free Radic Biol Med, 2019, 131: 81-97. |
| [6] |
KESIREDDY V S, CHILLAPPAGARI S, AHUJA S, et al. Susceptibility of microtubule-associated protein 1 light chain 3β (MAP1LC3B/LC3B) knockout mice to lung injury and fibrosis[J]. Faseb J, 2019, 33(11): 12392-12408. |
| [7] |
WANG Z X, LI Y, YANG X W, et al. Protective effects of rapamycin induced autophagy on CLP septic mice[J]. Comp Immunol Microbiol Infect Dis, 2019, 64: 47-52. |
| [8] |
YEN Y T, YANG H R, LO H C, et al. Enhancing autophagy with activated protein C and rapamycin protects against sepsis-induced acute lung injury[J]. Surg U S, 2013, 153(5): 689-698. |
| [9] |
ZHANG D, SHOOSHTARIZADEH P, LAVENTIE B J, et al. Two chromogranin a-derived peptides induce calcium entry in human neutrophils by calmodulin-regulated calcium independent phospholipase A2[J]. PLoS ONE, 2009, 4(2): e4501. |
| [10] |
EISSA N, HUSSEIN H, KERMARREC L, et al. Chromofungin ameliorates the progression of colitis by regulating alternatively activated macrophages[J]. Front Immunol, 2017, 8: 1131. |
| [11] |
刘疏柯, 姜丽萍, 刘贤, 等. CGA衍生多肽CHR通过调控自噬流减轻脂多糖诱导的小鼠肺损伤[J]. 重庆医科大学学报, 2020, 45(6): 731-736. LIUS K, JIANG L P, LIU X, et al. Chromogranin a-derived polypeptide CHR alleviates lipopolysaccharide induced lung injury in mice by regulating autophagy flux[J]. J Chongqing Med Univ, 2020, 45(6): 731-736. |
| [12] |
LUO L, LIU S Y, ZHANG D, et al. Chromogranin A (CGA)-derived polypeptide (CGA 47-66) inhibits TNF-α-induced vascular endothelial hyper-permeability through SOC-related Ca2+ signaling[J]. Peptides, 2020, 131: 170297. |
| [13] |
PASSMORE M R, BYRNE L, OBONYO N G, et al. Inflammation and lung injury in an ovine model of fluid resuscitated endotoxemic shock[J]. Respir Res, 2018, 19(1): 231. |
| [14] |
TAKAHASHI W, WATANABE E, FUJIMURA L, et al. Kinetics and protective role of autophagy in a mouse cecal ligation and puncture-induced sepsis[J]. Crit Care Lond Engl, 2013, 17(4): R160. |
| [15] |
HU Y, LOU J, MAO Y Y, et al. Activation of MTOR in pulmonary epithelium promotes LPS-induced acute lung injury[J]. Autophagy, 2016, 12(12): 2286-2299. |
| [16] |
ZHANG Y, LIU G J, DULL R O, et al. Autophagy in pulmonary macrophages mediates lung inflammatory injury via NLRP3 inflammasome activation during mechanical ventilation[J]. Am J Physiol Lung Cell Mol Physiol, 2014, 307(2): L173-L185. |
| [17] |
LIN L, ZHANG L J, YU L Z, et al. Time-dependent changes of autophagy and apoptosis in lipopolysaccharide-induced rat acute lung injury[J]. Iran J Basic Med Sci, 2016, 19(6): 632-637. |
| [18] |
LEI M, WANG C J, YU F, et al. Different intensity of autophagy regulate interleukin-33 to control the uncontrolled inflammation of acute lung injury[J]. Inflamm Res, 2019, 68(8): 665-675. |
| [19] |
LIN C W, LO S, PERNG D S, et al. Complete activation of autophagic process attenuates liver injury and improves survival in septic mice[J]. Shock, 2014, 41(3): 241-249. |
| [20] |
ZENG M C, SANG W H, CHEN S, et al. 4-PBA inhibits LPS-induced inflammation through regulating ER stress and autophagy in acute lung injury models[J]. Toxicol Lett, 2017, 271: 26-37. |
| [21] |
GAO Y, WANG N, LI R H, et al. The role of autophagy and the chemokine (C-X-C motif) ligand 16 during acute lung injury in mice[J]. Med Sci Monit, 2018, 24: 2404-2412. |
| [22] |
HSU C H, REYES L F, ORIHUELA C J, et al. Chromogranin A levels and mortality in patients with severe sepsis[J]. Biomarkers, 2015, 20(3): 171-176. |




