肝细胞肝癌(hepatocellular carcinoma,HCC)的病死率在全球癌症死亡率中排名第二,并且是全球癌症相关死亡的第三大主要原因[1], 大约50%的HCC是由乙型肝炎病毒(hepatitis B Virus,HBV)感染引起的[2]。而在HBV中, 病毒调节蛋白HBx的长期稳定表达可以紊乱细胞转录和增殖,并使肝细胞对致癌因子敏感。在肝癌的早期,HBx是HBV的关键蛋白,起着重要作用,它被募集到细胞染色质中并调节特定遗传基因座的染色质动力学[3]。MiRNA是小的保守非编码RNA,可与靶基因mRNA分子的3'-UTR互补,从而促进靶基因mRNA的降解或抑制mRNA翻译。它在调节基因表达中起重要作用,并参与多种生物学过程。现有研究显示,HBx可通过上调或下调miRNA表达来诱导肝癌的发展[4-6]。MiRNA-145是目前已发现的抑癌基因, 其通过调节靶基因c-Myc和Kras的表达来调节肿瘤细胞的增殖[7-9]。而c-Myc和Kras作为原癌基因,在癌症发展过程中均为高表达[10]。miRNA-145在肝癌中作为抑癌基因处于低表达水平[11-12],而在胃癌中,miRNA-145可以通过抑制靶基因c-Myc的表达来抑制胃癌细胞的增殖和侵袭[13]。
由于HBx是否能导致HCC这一理论和具体机制均尚未阐明,本研究采用转染HBx的肝前体细胞(HBx-EGFP-14-19)和转染HBx不同时间段的小鼠,观察HBx对miRNA-145a-5p及其靶基因c-Myc和Kras的调节作用;通过给予HBx-EGFP-14-19细胞和HBx小鼠(饲养至180 d)miRNA-145a-5p模拟物和抑制剂,观察miRNA-145a-5p对肝细胞的凋亡、增殖和周期的调节作用,探讨HBx诱导HCC的机制,为HBx导致HCC理论提供新的依据,也为HCC的诊断和治疗奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞及动物永生化小鼠肝前体细胞株14-19由美国芝加哥大学分子肿瘤研究中心馈赠,经慢病毒转染后的EGFP-14-19(空载对照)和HBx-EGFP-14-19细胞株由本课题组前期构建并保存。无特殊病原体(specific pathogen free,SPF)级昆明小鼠由重庆医科大学动物中心提供并饲养。
1.1.2 主要试剂FBS胎牛血清购自CELL BOX公司,细胞培养基DMEM(高糖)购自HyClone公司,TRIzol总RNA提取试剂盒购自北京康为世纪生物科技有限公司,柱式microRNA抽提试剂盒和miRNA第一链cDNA合成(茎环法)试剂盒均购自上海生工生物工程(上海)股份有限公司,反转录试剂盒购自Vazyme公司,2×SYBR Green qPCR Master Mix购自Bimake公司,HBx抗体购自Abcam公司,GAPDH抗体购自Cell Signaling Technology公司,c-Myc、Kras抗体购自Abcepta公司,Bad、Bax、Bcl-2抗体均购自Abclonal公司,CDK4、CyclinE抗体购自万类生物科技有限公司, CyclinE抗体购自Abways公司,EndoFectinTM-Max转染试剂购自GeneCopoeia公司,miRNA-145a-5p mimic、inhibitor、agomir、antagomir均购自莱博斯生物公司,CCK-8试剂盒购自MCE公司,SDS-PAGE凝胶配置试剂盒购自碧云天生物技术公司,ECL显影液购自Advansta公司,DAB显色液及免疫组化SP试剂盒购自北京中山金桥生物技术有限公司。
1.2 方法 1.2.1 细胞培养及分组肝前体细胞株14-19、EGFP-14-19、HBx-EGFP-14-19在含有10%胎牛血清的DMEM高葡萄糖培养基中于37 ℃,5%CO2条件下培养,并传代3次后进行后续测试。细胞转染时分为6组:①normal组(HBx-EGFP-14-19细胞),②EndoFectin组(HBx-EGFP-14-19细胞+转染试剂),③mimics-miR-145组(HBx-EGFP-14-19细胞+转染试剂+mimics-miR-145),④mimics-NC-miR145组(HBx-EGFP-14-19细胞+转染试剂+mimics-NC-miR-145),⑤inhibitor-miR-145组(HBx-EGFP-14-19细胞+转染试剂+inhibitor-miR-145),⑥inhibitor-NC-miR-145组(HBx-EGFP-14-19细胞+转染试剂+inhibitor-NC-miR-145)。
1.2.2 动物模型的构建及分组根据课题组前期报道[14],构建动物模型时,将小鼠分为3组:生理盐水组(n=10)、EGFP-14-19细胞组(n=10)和HBx-EGFP-14-19细胞组(n=40)。分别将200 μL生理盐水、EGFP-14-19细胞和HBx-EGFP-14-19细胞(5×105细胞悬浮于200 μL PBS)悬浮液通过肝门静脉注射入小鼠体内。选择6~8周龄的小鼠,手术前24 h禁食,乙醚麻醉小鼠,待小鼠昏迷后固定其四肢,用酒精对腹部进行消毒,剑突下行约2 cm纵向切口使肝门静脉暴露,用血管夹夹住门静脉远端,从近端缓慢注射。注射完成后,用PBS湿润的棉签按压止血,并在止血后迅速缝合腹腔。肝脏收集时间为手术后30、90、180、360 d。进行机理研究时将小鼠分为6组:①HBx 180 d组(n=10),②HBx 180d-NS(生理盐水)组(n=10),③HBx 180d-agomir-miR-145组(n=10),④HBx 180 d-agomir-NC-miR-145(阴性对照)组(n=10),⑤HBx 180 d-antagomir-miR-145组(n=10),⑥HBx 180 d-antagomir-NC-miR-145(阴性对照) 组(n=10)。术后180 d,通过尾静脉注射agomir-miR-145a-5p、antagomir-miR-145a-5p、agomir-NC-miR-145a-5p、antagomir-NC-miR-145a-5p和生理盐水。24 h后对小鼠实施安乐死。所有收集的肝脏组织保存在4%多聚甲醛和液氮中,以备后续试验使用。
1.2.3 miR-145a-5p的agomir、antagomir、模拟物、抑制剂和对应NCmiR-145a-5p模拟物是双链RNA:有义序列(5′-GUCCAGUUUUCCCAGGAAUCCCU-3′)和反义序列(5′-AGGGAUUCCUGGGAAAACUGGAC-3′),miR-145a-5p抑制剂为单链(5′-AGGGAUUCCUGGGAAAACUGGAC),且与miR-145a-5p完全互补。非靶向的阴性对照序列(对于模拟物:有义序列5′-UCACAACCUCCUAGAAAGAGUAGA-3′;反义序列5′-UCUACUCUUUCUAGGAGGUGUUGUGA-3′;对于抑制剂:5′-UCUACUCUUUCUAGGAGGUUGUGA-3′)用作对照。模拟物和抑制剂用于体外实验;miR-145a-5p agomir和antagomir分别与模拟物序列和抑制剂序列一样,但对组织细胞的亲和力更高,因此将agomir和antagomir用于体内实验。
1.2.4 苏木素-伊红(HE)染色法小鼠肝脏切片脱蜡后染色并封片,于光学显微镜下观察拍照。
1.2.5 反转录-聚合酶链反应(qRT-PCR)总RNA和miRNA经提取后检测其质量和相应浓度,反转录试剂盒将RNA和miRNA(茎环法)反转录为cDNA,利用SYBR荧光定量法检测其浓度,检测体系为10 μL (cDNA 2μL,SYBR 5 μL,引物1 μL,无酶水2 μL)。引物序列见表 1。
| 基因 | 序列(5’-3’) |
| GAPDH | 上游:CTCGTCCCGTAGACAAAATGGT |
| 下游:GAGGTCAATGAAGGGGTCGTT | |
| HBx | 上游:TGCGGACGACCCTTCTCGGG |
| 下游:GGGCAACATTCGGTGGGCGT | |
| c-Myc | 上游:CCCAAGGGAAGACGATGACG |
| 下游:GCTGAGAAACCGCTCCACATAC | |
| Kras | 上游:GGACTCTGAAGATGTGCCTATGG |
| 下游:TGCTGAGGTCTCAATGAACGGA | |
| U6 | 上游:AGAGAAGATTAGCATGGCCCCTG |
| 下游:ATCCAGTGCAGGGTCCGAGG | |
| 上游:CGGTCCAGTTTTCCCAGGA | |
| miR-145a-5p | 下游:AGTGCAGGGTCCGAGGTATT |
| 上游:TCCATCTGACCCTCCGCC | |
| Bcl-2 | 下游:CCCAGTTCACCCCATCCCT |
| 上游:CTCCGAAGGATGAGCGATGAG | |
| Bad | 下游:TTGTCGCATCTGTGTTGCAGT |
| 上游:TGAAGACAGGGGCCTTTTTG | |
| Bax | 下游:AATTCGCCGGAGACACTCG |
| 上游:GCGTACCCTGACACCAATCTC | |
| CyclinD1 | 下游:ACTTGAAGTAAGATACGGAGGGC |
| 上游:CTCCGACCTTTCAGTCCGC | |
| CyclinE | 下游:CACAGTCTTGTCAATCTTGGCA |
| 上游:TCAGCACAGTTCGTGAGGTG | |
| CDK4 | 下游:TCCATCAGCCGTACAACATTG |
1.2.6 Western blot检测
将适量的小鼠肝组织放入标记好的EP管中,加入200 μL预先配制的裂解液(RIPA ∶PMSF =100 ∶1),用组织研磨机充分研磨后,在冰上放置30 min,每5分钟振动1次。裂解后,于4 ℃以12 000 r/min离心20 min,吸出上清液,用BCA法测定蛋白质浓度。将上样缓冲液添加到剩余的上清液中,在100 ℃下加热15 min,然后在-80 ℃下保存。电泳分离蛋白质后将其转移到PVDF膜上,用5%的脱脂奶粉封闭2 h,摇床上孵育一抗,于4 ℃下过夜。经TBST洗涤后,将PVDF膜与二抗在室温下孵育2 h。用ECL显色法显色,Analysis分析软件对目的条带进行检测分析。
1.2.7 细胞转染试验HBx-EGFP-14-19细胞在96孔(或6孔)平板中以1×105/mL的浓度培养。用EndoFectinTM-Max转染试剂转染miR-145a-5p mimic、miR-145a-5p mimic NC、miR-145a-5p inhibitor和miR-145a-5p inhibitor NC。转染24 h后,进行后续操作。
1.2.8 细胞增殖试验(CCK-8)在96孔板中以1×105/mL的浓度培养HBx-EGFP-14-19细胞,并根据上述转染方法对其进行处理。转染处理24 h后,向每个孔中添加10 μL CCK8试剂,并在37 ℃下孵育2~4 h,在多功能酶标仪上490 nm处测量光密度值D(490)。
1.3 统计学分析GraphPad Prism 5统计软件统计数据,数据以 x±s表示,采用单因素方差分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 体内外HBx表达鉴定为了验证HBx是否成功转染到14-19细胞中,通过qRT-PCR和Western blot检测HBx-EGFP-14-19细胞中HBx的表达。与EGFP-14-19细胞和14-19细胞相比,HBx在HBx-EGFP-14-19细胞中特异性表达(图 1A、C、E)。qRT-PCR和Western blot结果也表明,与正常组小鼠和EGFP组小鼠相比,HBx-EGFP-14-19组小鼠在30、90、180、360 d能稳定表达HBx(图 1B、D、F)。
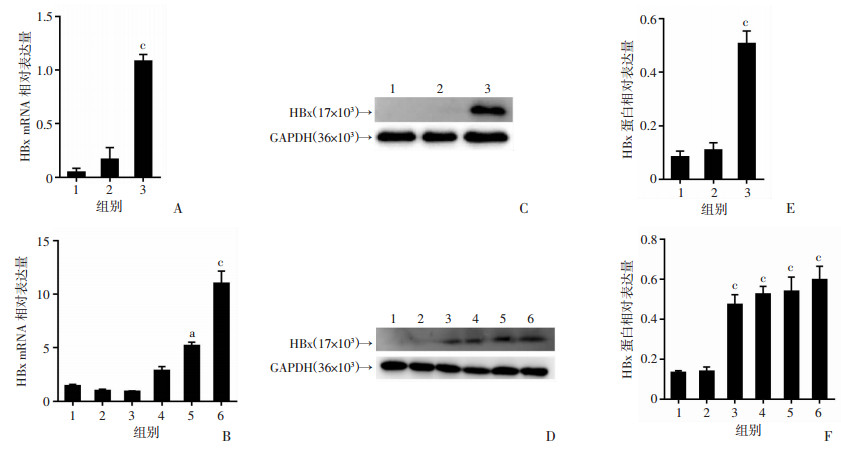
|
| A、C、E:分别为HBx在细胞内mRNA和蛋白的表达 1:14-19细胞株组;2:EGFP-14-19细胞株组;3:HBx-EGFP-14-19细胞株组;a:P < 0.05,c:P < 0.001,与14-19组、EGFP-14-19组比较;B、D、F:分别为HBx在小鼠体内mRNA和蛋白的表达1:NS小鼠组;2:EGFP-14-19小鼠组;3~6:分别为30、90、180、360d的HBx-EGFP-14-19小鼠组;a:P < 0.05,c:P < 0.001,与NS小鼠组、EGFP-14-19小鼠组比较 图 1 细胞株及小鼠HBx的鉴定 |
2.2 miR-145a-5p,c-Myc和Kras在3种细胞株中的表达变化
与未转染HBx的14-19细胞相比,HBx-EGFP-14-19细胞中miR-145 a-5p的表达低于EGFP-14-19组和14-19组(图 2A),而c-Myc和Kras的mRNA和蛋白质的表达增加(图 2)。
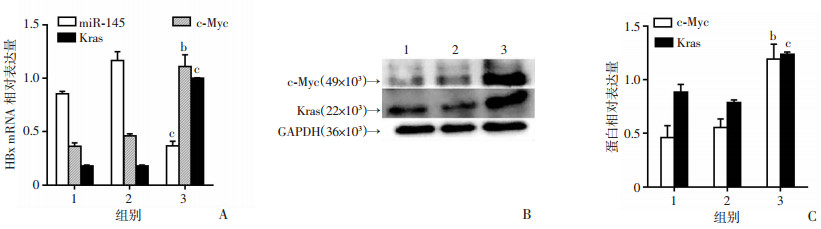
|
| 1:14-19细胞株组;2:EGFP-14-19细胞株组;3:HBx-EGFP-14-19细胞株组;b:P < 0.01,c:P < 0.001,与14-19组、EGFP-14-19组比较。A:miR-145a-5p、c-Myc和Kras的mRNA表达;B、C:c-Myc和Kras的蛋白表达及半定量分析 图 2 miR-145,c-Myc和Kras在3种细胞株中的表达 |
2.3 miR-145a-5p,c-Myc和Kras在HBx小鼠不同时间时期的表达变化
与未转染HBx的小鼠相比,miR-145a-5p在HBx小鼠中的表达低于正常组和对照组,并且其表达随时间下降(图 3A)。c-Myc的mRNA表达在第30和90天,与对照组和盐水组相比无统计学意义,而第180和360天时其表达明显高于对照组和盐水组(图 3A)。然而,Kras的mRNA表达在30、90、180 d时,低于盐水组和对照组,但在第360天显着高于盐水组和对照组(图 3A)。在对c-Myc和Kras蛋白表达进行检测时发现, 在30、90、180、360 d的蛋白表达均高于盐水组和对照组(图 3B、C)。表明HBx可以在体内和体外将miR-145a-5p维持在较低水平,从而降低miR-145a-5p对c-Myc和Kras的调节作用,并促进原癌基因c-Myc和Kras的表达。

|
| 1:NS小鼠组;2:EGFP-14-19小鼠组;3~6:分别为30、90、180、360 d的HBx-EGFP-14-19小鼠组;a:P < 0.05,b:P < 0.01,c:P < 0.001,与NS小鼠组、EGFP-14-19小鼠组比较。A:miR-145a-5p、c-Myc和Kras mRNA在各组HBx小鼠中的表达;B、C:c-Myc和Kras蛋白在各组小鼠中的表达及半定量分析。 图 3 小鼠感染HBx后不同时期miR-145、c-Myc和Kras表达变化 |
2.4 小鼠肝脏组织肿瘤鉴定
观察360 d的HBx小鼠肝脏组织时,发现一些小鼠有肉眼可见的直径约1 cm的结节性病变从肝脏表面突出。HE染色结果显示,肝小叶结构基本消失,肝细胞异型增生且大小不一,核染色质浓染及多核(图 4)。
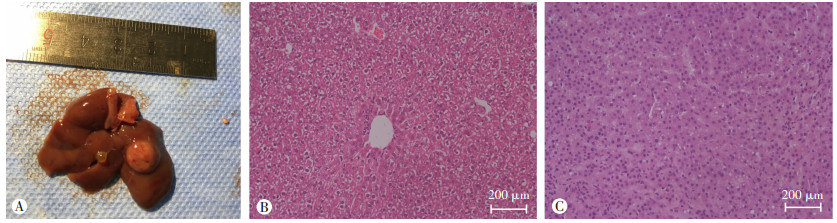
|
| A:肝肿瘤组织照片;B:正常肝组织;C:肝癌组织 图 4 小鼠肝脏组织肿瘤的鉴定结果 |
2.5 miR-145a-5p的上调抑制了HBx-EGFP-14-19细胞的增殖以及c-Myc和Kras的表达
首先检测miR-145a-5p,c-Myc和Kras的表达,结果表明,miR-145a-5p模拟物已成功转染到HBx-EGFP-14-19细胞和HBx小鼠中。与对照组相比,miR-145a-5p的表达量升高可逆转由HBx引起的体外(图 5A~G)和体内(图 6)c-Myc、Kras、细胞周期因子和凋亡因子的异常表达。CCK-8结果表明,miR-145a-5p的过表达可以抑制HBx-EGFP-14-19细胞的增殖(图 5H)。
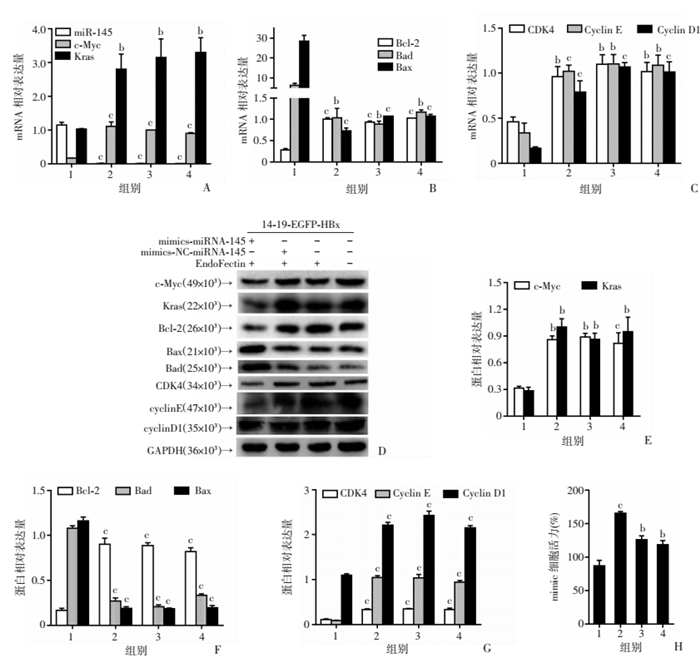
|
| 1:mimics-miR-145+EndoFectin+HBx-EGFP-14-19细胞组;2:mimics-NC-miR-145+EndoFectin+HBx-EGFP-14-19细胞组;3:EndoFectin+HBx-EGFP-14-19细胞组;4:HBx-EGFP-14-19细胞组;a:P < 0.05,b:P < 0.01,c:P < 0.001,与mimics-miR-145+EndoFectin+HBx-EGFP-14-19细胞组比较。A:miR-145、c-Myc和Kras mRNA表达;B:Bcl-2、Bad和Bax mRNA表达;C:CDK4、CyclinE和Cyclin D1的mRNA表达;D~G:c-Myc、Kras、Bcl-2、Bad、Bax、CDK4、CyclinE和Cyclin D1的蛋白表达及半定量分析;H:转染mimics-miR-145后HBx-EGFP-14-19细胞活力。 图 5 miR-145a-5p模拟物在体外的作用 |
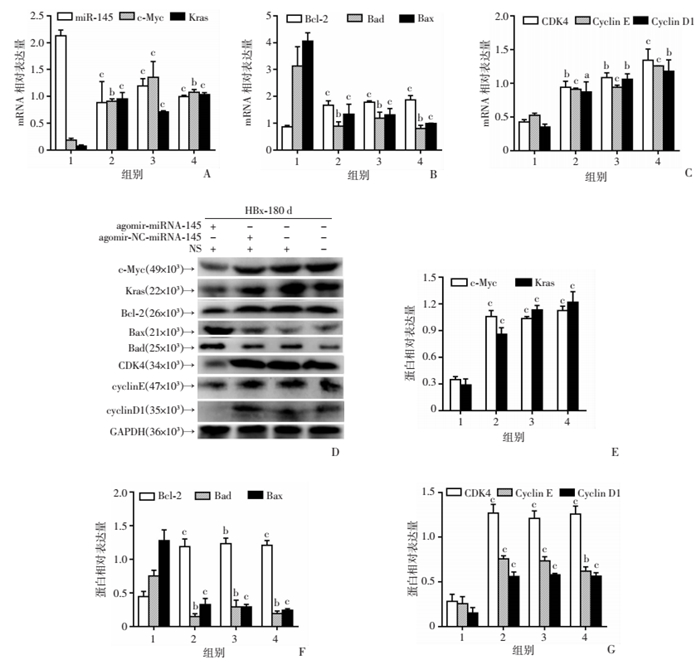
|
| 1:HBx180d-agomir-miR-145小鼠组;2:HBx180d-agomir-NC-miR-145小鼠组;3:HBx180d-NS;4:HBx180d;a:P < 0.05,b:P < 0.01,c:P < 0.001,与HBx180d-agomir-miR-145小鼠组比较 A:miR-145、c-Myc和Kras mRNA表达;B:Bcl-2、Bad和Bax mRNA表达;C:CDK4、CyclinE和Cyclin D1的mRNA表达;D~G:c-Myc、Kras、Bcl-2、Bad、Bax、CDK4、CyclinE和Cyclin D1的蛋白表达及半定量分析。 图 6 miR-145a-5p模拟物在体内的作用 |
2.6 下调miR-145a-5p可促进HBx-EGFP-14-19细胞增殖以及c-Myc和Kras的表达
与对照组相比,miR-145的体外表达量降低可促进由HBx引起的体外(图 7A~G)和体内(图 8)c-Myc、Kras、细胞周期因子和凋亡因子的异常表达。CCK8结果表明,miR-145a-5p的低表达可以促进HBx-EGFP-14-19细胞的增殖(图 7H)。
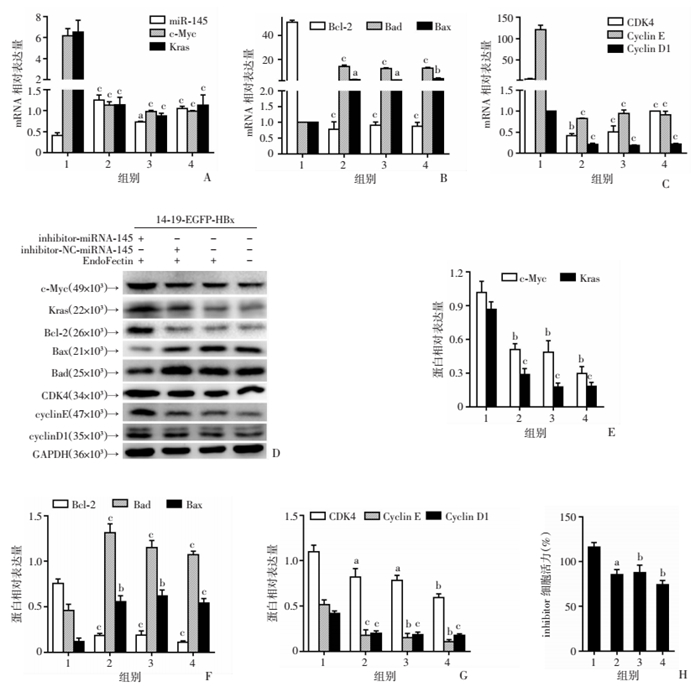
|
| 1:inhibitor-miR-145+EndoFectin+HBx-EGFP-14-19细胞组;2:inhibitor-NC-miR-145+EndoFectin+HBx-EGFP-14-19细胞组;3:EndoFectin+HBx-EGFP-14-19细胞组;4:HBx-EGFP-14-19细胞组;a:P < 0.05,b:P < 0.01,c:P < 0.001,与inhibitor-miR-145+EndoFectin+HBx-EGFP-14-19细胞组比较。A:miR-145、c-Myc和Kras mRNA表达;B:Bcl-2、Bad和Bax mRNA表达;C:CDK4、CyclinE和Cyclin D1的mRNA表达;D~G:c-Myc、Kras、Bcl-2、Bad、Bax、CDK4、CyclinE和Cyclin D1的蛋白表达及半定量分析;H:转染inhibitor-miR-145后HBx-EGFP-14-19细胞活力 图 7 miR-145a-5p抑制剂在体外的作用 |
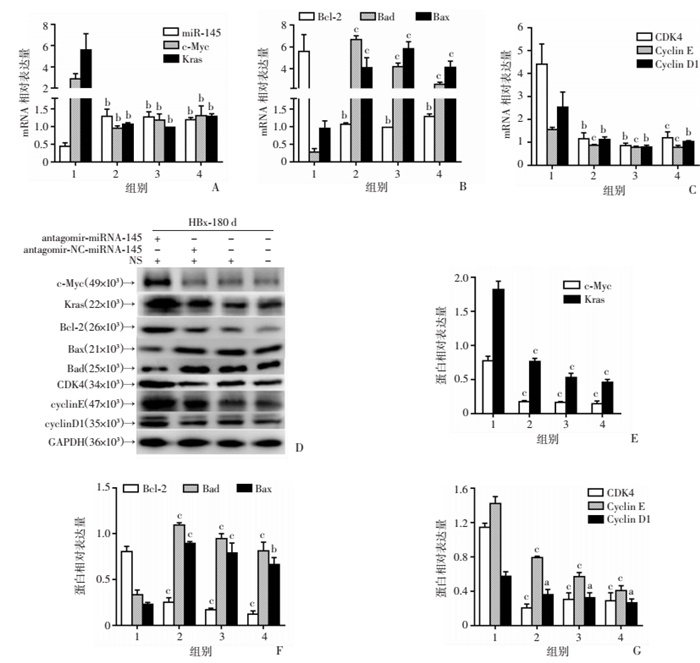
|
| 1:HBx180d-antagomir-miR-145小鼠组;2:HBx180d-antagomir-NC-miR-145小鼠组;3:HBx180 d-NS;4:HBx180 d;a:P < 0.05,b:P < 0.01,c:P < 0.001,与HBx180d-antagomir-miR-145小鼠组比较。A:miR-145、c-Myc和Kras mRNA表达;B:Bcl-2、Bad和Bax mRNA表达;C:CDK4、CyclinE和Cyclin D1的mRNA表达;D~G:c-Myc、Kras、Bcl-2、Bad、Bax、CDK4、CyclinE和Cyclin D1的蛋白表达及半定量分析。 图 8 miR-145a-5p抑制剂在体内的作用 |
3 讨论
这项研究结果显示,当HBx显着上调时,它会导致肝癌的发生。miR-145a-5p的表达在HBx-EGFP-14-19细胞和HBx小鼠中均被下调。miR-145a-5p的表达随转染HBx时间的增长而降低。而当过表达miR-145a-5p时可抑制HBx-EGFP-14-19细胞的增殖,下调miR-145a-5p则可促进HBx-EGFP-14-19细胞的增殖。机制研究表明,可能通过HBx-miR-145a-5p-c-Myc/Kras轴促进HCC的形成。
HBV在HCC的发生和发展中起着重要作用[15]。在HBV感染过程中,适应性免疫从免疫耐受转变为进行性免疫刺激, 经过失活,激活和疲惫后,它会触发免疫反应疾病因子[16]。HBx是HBV病毒中的关键基因片段,可干扰多种细胞过程,例如氧化,DNA修复,信号转导,转录,蛋白质降解,细胞周期进程和凋亡。HBx的致癌因素可能是HBx介导的转录反式激活和信号通路[17]。HCC具有较高的发病率和死亡率,当前有效的潜在治疗方法仍然仅限于手术切除和肝移植,给社会带来了沉重的负担[18]。在HCC的早期筛查中,并非总是能够找到最广泛使用的肝癌生物标志物-AFP(甲胎蛋白)。因此,迫切需要寻找新的诊断和特异性生物标志物用于靶向治疗[19]。
MiRNA失调可导致多种癌症并影响细胞稳态[20]。MiR-145可用于临床疾病的诊断,FU等[21]检测结核病患者血清中miR-145的表达,并通过绘制特定的受体曲线来评估miR-145的诊断准确性。HE等[22]研究显示,抗miR-145和减活miR-145均会触发小鼠肝脏的代谢性炎症。这从一定角度解释了HBx小鼠在老年期出现肝癌:miR-145在老年HBx小鼠中表达较低,从而导致了代谢性肝炎和HCC。
为了了解HBx是否可以通过调控miR-145a-5p表达导致肝癌的发生,我们使用两种不同的方法:抑制miR-145a-5p表达和过表达miR-145a-5p。结果表明,抑制miR-145-5p会导致细胞增殖和周期加快,细胞凋亡减慢以及肿瘤因子的过度表达。而miR-145a-5p的过表达结果则与抑制miR-145a-5p相反。
作为miR-145a-5p的靶基因之一,c-Myc已被证明为一种癌蛋白,在多种癌症(包括HCC)和预后中均高度表达[23-24]。在动物实验中发现,c-Myc的过度表达可导致低分化HCC的发生。目前,c-Myc被认为是“不可治疗的”[25-26]。而miR-145a-5p的另外一个靶基因Kras在人类肝癌中突变被认为是最高的过度表达,Kras属于Ras家族,HCC中发现Ras通路均被激活[27]。YE等[28]在转基因的Alb-Cre; Kras G12D小鼠中发现肝细胞特异性KrasG12D的表达可引起小鼠肝细胞癌,而在KrasG12D和HBx双转基因小鼠中,HBx的共表达促进了KrasG12D诱导的HCC的发生和发展。以上研究表明,寻找c-Myc和Kras的上游调控因子可以抑制HCC的发生发展。
然而,基于miRNA的疗法的实施仍面临重大挑战,主要是解决miRNA模拟物/抑制剂被循环RNA酶破坏并将miRNA准确地递送至病灶的问题。随着美国食品药品监督管理局(FDA)批准首个用于治疗可损害心脏和神经功能的罕见疾病的RNAi药物patisira,核酸药物已成为临床事实,也为核酸药物的临床应用带来了曙光[29]。随着新型冠状病毒的全球流行,RNA疫苗的研究也越来越多[30-31]。
综上所述,本研究通过观测miR-145a-5p在HBx-EGFP-14-19细胞和HBx小鼠中的生物学功能,为miR-145a-5p作为肝癌的诊断物和靶向治疗奠定了基础,miRNA可能是今后在HCC进程中进行研究和干预的新方向。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
Yongyan Chen, Zhigang Tian. HBV-Induced Immune Imbalance in the Development of HCC[J]. Front Immunol, 2019, 10: 2048. |
| [3] |
LEVRERO M, ZUCMAN-ROSSI J. Mechanisms of HBV-induced hepatocellular carcinoma[J]. J Hepatol, 2016, 64(Suppl 1): S84-S101. |
| [4] |
CHEN W S, YEN C J, CHEN Y J, et al. miRNA-7/21/107 contribute to HBx-induced hepatocellular carcinoma progression through suppression of maspin[J]. Oncotarget, 2015, 6(28): 25962-25974. |
| [5] |
GAO F, SUN X Y, WANG L K, et al. Downregulation of MicroRNA-145 caused by hepatitis B virus X protein promotes expression of CUL5 and contributes to pathogenesis of hepatitis B virus-associated hepatocellular carcinoma[J]. Cell Physiol Biochem, 2015, 37(4): 1547-1559. |
| [6] |
LI J F, DAI X P, ZHANG W, et al. Upregulation of microRNA-146a by hepatitis B virus X protein contributes to hepatitis development by downregulating complement factor H[J]. mBio, 2015, 6(2): e02459-e02414. |
| [7] |
CHEN Z, ZENG H Z, GUO Y, et al. miRNA-145 inhibits non-small cell lung cancer cell proliferation by targeting c-Myc[J]. J Exp Clin Cancer Res, 2010, 29: 151. |
| [8] |
YU Y J, NANGIA-MAKKER P, FARHANA L, et al. miR-21 and miR-145 cooperation in regulation of colon cancer stem cells[J]. Mol Cancer, 2015, 14: 98. |
| [9] |
SADEGHIYEH N, SEHATI N, MANSOORI B, et al. MicroRNA-145 replacement effect on growth and migration inhibition in lung cancer cell line[J]. Biomed Pharmacother, 2019, 111: 460-467. |
| [10] |
KAZI A, XIANG S Y, YANG H, et al. GSK3 suppression upregulates β-catenin and c-Myc to abrogate KRas-dependent tumors[J]. Nat Commun, 2018, 9(1): 5154. |
| [11] |
BANDOPADHYAY M, BANERJEE A, SARKAR N, et al. Tumor suppressor microRNA miR-145 and onco microRNAs miR-21 and miR-222 expressions are differentially modulated by hepatitis B virus X protein in malignant hepatocytes[J]. BMC Cancer, 2014, 14: 721. |
| [12] |
GAI X C, TANG B F, LIU F M, et al. mTOR/miR-145-regulated exosomal GOLM1 promotes hepatocellular carcinoma through augmented GSK-3β/MMPs[J]. J Genet Genom, 2019, 46(5): 235-245. |
| [13] |
DU W B, LI D, GUO X M, et al. Circ-PRMT5 promotes gastric cancer progression by sponging miR-145 and miR-1304 to upregulate MYC[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 4120-4130. |
| [14] |
WANG X, HUO B N, LIU J, et al. Hepatitis B virus X reduces hepatocyte apoptosis and promotes cell cycle progression through the Akt/mTOR pathway in vivo[J]. Gene, 2019, 691: 87-95. |
| [15] |
CHATURVEDI V K, SINGH A, DUBEY S K, et al. Molecular mechanistic insight of hepatitis B virus mediated hepatocellular carcinoma[J]. Microb Pathog, 2019, 128: 184-194. |
| [16] |
CHEN Y Y, TIAN Z G. HBV-induced immune imbalance in the development of HCC[J]. Front Immunol, 2019, 10: 2048. |
| [17] |
ALI A, ABDEL-HAFIZ H, SUHAIL M, et al. Hepatitis B virus, HBx mutants and their role in hepatocellular carcinoma[J]. World J Gastroenterol, 2014, 20(30): 10238-10248. |
| [18] |
KIM D W, TALATI C, KIM R. Hepatocellular carcinoma (HCC): beyond sorafenib-chemotherapy[J]. J Gastrointest Oncol, 2017, 8(2): 256-265. |
| [19] |
LUO P, WU S Y, YU Y L, et al. Current status and perspective biomarkers in AFP negative HCC: towards screening for and diagnosing hepatocellular carcinoma at an earlier stage[J]. Pathol Oncol Res, 2020, 26(2): 599-603. |
| [20] |
MISHRA S, YADAV T, RANI V. Exploring miRNA based approaches in cancer diagnostics and therapeutics[J]. Crit Rev Oncol Hematol, 2016, 98: 12-23. |
| [21] |
FU Y H, YANG X, CHEN H Y, et al. Diagnostic value of miR-145 and its regulatory role in macrophage immune response in tuberculosis[J]. Genet Mol Biol, 2020, 43(2): e20190238. |
| [22] |
HE M, WU N, LEONG M C, et al. miR-145 improves metabolic inflammatory disease through multiple pathways[J]. J Mol Cell Biol, 2020, 12(2): 152-162. |
| [23] |
DANG C V. MYC on the path to cancer[J]. Cell, 2012, 149(1): 22-35. |
| [24] |
LIU P, GE M M, HU J J, et al. A functional mammalian target of rapamycin complex 1 signaling is indispensable for c-Myc-driven hepatocarcinogenesis[J]. Hepatology, 2017, 66(1): 167-181. |
| [25] |
SHACHAF C M, KOPELMAN A M, ARVANITIS C, et al. MYC inactivation uncovers pluripotent differentiation and tumour dormancy in hepatocellular cancer[J]. Nature, 2004, 431(7012): 1112-1117. |
| [26] |
CHOW E K, FAN L L, CHEN X, et al. Oncogene-specific formation of chemoresistant murine hepatic cancer stem cells[J]. Hepatology, 2012, 56(4): 1331-1341. |
| [27] |
KARNOUB A E, WEINBERG R A. Ras oncogenes: split personalities[J]. Nat Rev Mol Cell Biol, 2008, 9(7): 517-531. |
| [28] |
YE H, ZHANG C, WANG B J, et al. Synergistic function of Kras mutation and HBx in initiation and progression of hepatocellular carcinoma in mice[J]. Oncogene, 2014, 33(43): 5133-5138. |
| [29] |
LEDFORD H. Gene-silencing technology gets first drug approval after 20-year wait[J]. Nature, 2018, 560(7718): 291-292. |
| [30] |
MULLIGAN M J, LYKE K E, KITCHIN N, et al. Phase Ⅰ/Ⅱ study of COVID-19 RNA vaccine BNT162b1 in adults[J]. Nature, 2020, 586(7830): 589-593. |
| [31] |
WALSH E E, FRENCK R W Jr, FALSEY A R, et al. Safety and immunogenicity of two RNA-based covid-19 vaccine candidates[J]. N Engl J Med, 2020, 383(25): 2439-2450. |




