维生素D是一种脂溶性的维生素,人们可以通过食物摄入,还可以由皮肤在阳光的照射下产生。维生素D的经典作用是调节钙的吸收和稳态、骨代谢以及细胞的生长和分裂[1-2]。维生素D经过2次羟化反应被活化:第1次羟化反应是在肝脏中,生成25(OH)D;第2次羟化反应是在肾脏中,25(OH)D在1α-羟化酶的作用下被进一步羟化为其活性状态1, 25(OH)2D3[3]。维生素D受体(vitamin D receptor,VDR)基因位于染色体12q13.11上,是核受体超家族的一员[4-5]。许多免疫细胞表达VDR,包括T细胞和B细胞、树突细胞和巨噬细胞[3]。表达高水平VDR的组织,如小肠、肾脏、甲状旁腺和骨骼等相互交流以调节骨骼和矿物质代谢[5]。
维生素D主要通过与VDR和视黄酮受体(RXR)结合,吸引多种共调节蛋白完成组蛋白修饰、染色质重塑以及与RNA聚合酶的结合来调节基因转录[1]。维生素D也可以诱导位于细胞膜上和细胞质中的快速信号通路介导非基因组功能。非基因组效应在几秒到几分钟内起作用,包括打开离子通道、诱导第二信使分子(如丝裂原激活蛋白激酶)和分泌激素(如胰岛素)等。维生素D也可以通过旁分泌的作用方式来抑制生长因子和细胞因子的合成与分泌,如Wnt、转化生长因子(TGF-β)和表皮生长因子(EGF),改变其胞质信号通路或目标转录因子的活性[6]。维生素D的基因组和非基因组共同参与机体的先天性和适应性免疫应答。
破骨细胞来自于单核/巨噬细胞谱系前体细胞,是用于骨吸收的特化细胞。它的分化、活性与生存主要由两种关键的细胞因子——核因子κ B受体活化因子配体(receptor activator of nuclear kappa B ligand,RANKL)和巨噬细胞集落刺激因子(macrophage colony-stlimulating factor,M-CSF)起始与调控。在破骨细胞形成的过程中,RANKL和M-CSF激活核因子-κB (NF-κB)和丝裂原活化蛋白激酶(MAPK)信号通路[7-8]。然后激活下游c-Fos和Jun构成AP-1,并进一步诱导NFA Tc1级联放大。随后,下游的破骨细胞特异性基因包括抗酒石酸酸性磷酸酶(TRAP)、组织蛋白酶K (CtsK)和基质金属蛋白酶9 (MMP-9)等被激活与分泌从而降解有机骨基质[9-10]。研究表明,NF-κB在破骨形成过程中起着重要的作用。NF-κB存在于胞质和胞核中。在基础条件下,NF-κB与κB抑制剂(IκB)蛋白结合并失活。当IκB磷酸化,IκB解除对NF-κB的抑制,然后NF-κB易位到细胞核与NF-κB反应元件相结合,促进靶基因转录[11-12]。本研究预探究不同浓度的1, 25(OH)2D3对破骨细胞分化各阶段的作用及其机制。
1 材料与方法 1.1 实验材料与仪器 1.1.1 主要试剂包括:α-MEM培养基、胎牛血清(HyClone公司,美国),RANKL和M-CSF(Minneapolis公司,美国),1, 25(OH)2D3(纯度大于95%,Sigma-Aldrich公司,美国),TRAP染色试剂盒(Sigma-Aldrich公司,美国),FAK染色试剂盒(Millipore公司,德国),胶原板(Corning公司,美国),RIPA裂解液、SDS-PAGE配胶试剂盒(康为世纪,北京),兔抗鼠GAPDH(bs-0755R,博奥森,北京),兔抗鼠NF-κB p65(BS9879M,Bioworld,美国),兔抗鼠磷酸化NF-κB p65(3033S)、IκB α(4812S)、磷酸化IκB α(2859S)、c-Fos(2250S)、VDR(12550S)、NFATc1(8032S)(CST公司,美国),兔抗鼠CtsK(ab187647)、MMP-9(ab228402)(Abcam,英国),羊抗兔二抗(碧云天,上海)。
1.1.2 主要仪器包括:细胞恒温培养箱、低温高速离心机(Thermo Fisher Scientific公司,美国),CFX96荧光定量PCR仪、凝胶成像仪(Bio-Rad公司,美国)。
1.1.3 实验小鼠4~6周大的雄性C57BL/6小鼠来自陆军军医大学实验动物中心。从小鼠四肢骨的骨髓中提取原代细胞(bone marrow derived macrophages,BMMs),用含有25 ng/mL M-CSF的α-MEM培养基在37 ℃培养72 h。所有小鼠在SPF环境下恒温暗/光12 h交替饲养。实验经过陆军军医大学伦理委员会批准(AMUWEC20191148),并按照其指导方法实施。
1.2 方法 1.2.1 细胞培养BMMs在含有25 ng/mL M-CSF的α-MEM培养基中37 ℃孵育72 h。将BMMs细胞以2×103/孔接种于96孔板,以1×106/孔接种于6孔板,在含有50 ng/mL RANKL和25 ng/mL M-CSF的α-MEM培养基中培养72 h。与此同时,实验组分别加入0.1、10、1 000 nmol/L 1, 25(OH)2D3。为了探究分子机制,对照组分别在0、30、45 min时加入50 ng/mL RANKL和25 ng/mL M-CSF的α-MEM培养基处理,实验组分别在0、30、45 min时加入50 ng/mL RANKL、25 ng/mL M-CSF和1 000 nmol/L 1, 25(OH)2D3的α-MEM培养基处理,60 min时收取样品。
1.2.2 TRAP染色首先用PBS清洗细胞,然后用4%多聚甲醛37 ℃固定20 min。根据TRAP染色试剂盒说明书将染色液混合,37 ℃避光孵育至少2 h,直至对照组在显微镜下观察到TRAP阳性细胞。3个以上细胞核的TRAP阳性细胞即成熟的破骨细胞。
1.2.3 FAK染色先用PBS清洗96孔板,再用4%多聚甲醛在37 ℃孵箱中固定20 min。取出用含0.05%吐温-20的PBS清洗2次,用0.1% Triton X-100穿透细胞5 min。再次清洗2次后,用1% BSA在室温下封闭30 min。用TRITC结合的Phalloidin在37 ℃下孵育1 h,用含0.05%吐温-20的PBS清洗3次。最后使用DAPI在室温下对细胞核进行5 min复染,再次清洗细胞3次,用荧光显微镜观察并拍照。
1.2.4 噬骨实验将BMMs细胞接种于胶原板,诱导至破骨细胞自然凋亡。使用次氯酸钠溶液去除剩余细胞,双蒸水洗涤后待充分干燥即可使用光学显微镜(标尺200 μm)拍摄图像,使用Image J软件测量相对吸收面积。
1.2.5 实时定量PCR检测使用TRIzol溶液提取总RNA,使用NanoDrop ND-1000微板阅读器(Thermo Scientific, Loughborough, 英国)测定RNA浓度。取2 μg总RNA用逆转录酶试剂盒(TaKaRa,日本)合成cDNA。在实时定量PCR中,将1 μL cDNA与SYBR green super mix和PCR引物对混合。实验中以GAPDH为内参基因,检测CtsK、c-Fos、MMP-9、NFATc1在破骨细胞不同分化时期的表达情况。PCR引物均由上海生工生物技术有限公司合成,引物序列见表 1。
| 基因 | 引物序列 | 产物长度/bp |
| c-Fos | 正向5′-AGGCAGAACCCTTTGA-3′ | 4 401 |
| 反向5′-GGTGACCACGGGAGTA-3′ | ||
| CtsK | 正向5′-GCGGCATTACCAACAT-3′ | 13 232 |
| 反向5′-CTGGAAGCACCAACGA-3′ | ||
| GAPDH | 正向5′-GGATGCTGGTGCGAAGTG-3′ | 6 000 |
| 反向5′-GCTCCTGGAAGATGGTGAT-3′ | ||
| MMP-9 | 正向5′-ACCCGAAGCGGACATT-3′ | 20 183 |
| 反向5′-GGCATCTCCCTGAACG-3′ | ||
| NFATc1 | 正向5′-GAGGAGTTGGCTCAGTG-3′ | 138 929 |
| 反向5′-TAGCGTTCCGTTCGTT-3′ |
1.2.6 Western blot检测
首先用预冷的PBS洗涤细胞,然后加入适量含有蛋白酶抑制剂的RIPA裂解液在冰上裂解细胞30 min。处理后的蛋白经过10% SDS-PAGE凝胶电泳,然后转移到0.2 μm聚偏氟乙烯膜上。然后用5%脱脂牛奶封闭聚偏氟乙烯膜2 h。封闭完毕后,用兔抗鼠GAPDH、CtsK、IκB α、p-IκBα、VDR、c-Fos、NF-κB p65、p-NFκB p65、MMP-9和NFATc1的特异性单抗4 ℃孵育过夜。第2天用TBST洗膜3次,然后用酶标二抗室温孵育1.5 h,再用TBST洗膜3次。最后使用ECL发光液在凝胶成像仪中曝光并拍照。
1.3 统计学分析实验数据均为计量资料,以x±s表示,两组间的差异比较采用GraphPad Prism 6软件对数据进行t检验,多组间差异比较采用SPSS 22.0软件对数据进行单因素方差分析。P < 0.05代表差异具有统计学意义。
2 结果 2.1 1, 25(OH)2D3能抑制不同时期破骨细胞的分化采用TRAP染色观察1, 25(OH)2D3对破骨细胞分化的影响,结果显示,1, 25(OH)2D3在0.1 nmol/L时对破骨细胞的分化没有明显的影响,在10 nmol/L时对破骨细胞的分化具有轻度的抑制作用,在1 000 nmol/L时能显著抑制破骨细胞的分化(P < 0.05, 图 1A)。采用qPCR和Western blot检测破骨细胞分化阶段的关键转录因子c-Fos和NFATc1的表达。qPCR结果显示:在诱导第1天(即破骨细胞分化早期),仅1 000 nmol/L的1, 25(OH)2D3在mRNA水平对c-Fos和NFATc1具有轻度的抑制作用;在诱导第3天,进入破骨细胞激活期,0.1、10、1 000 nmol/L的1, 25(OH)2D3均在mRNA水平显著抑制c-Fos的表达,而仅1 000 nmol/L的1, 25(OH)2D3对NFATc1的表达具有明显的抑制作用;在诱导第4天,进入破骨细胞成熟期,0.1、10、1 000 nmol/L的1, 25(OH)2D3均在mRNA水平显著抑制c-Fos的表达,其中1 000 nmol/L的抑制作用最强(P < 0.05),但没有观察到各浓度的1, 25(OH)2D3对NFATc1的表达具有抑制作用(图 1B)。Western blot结果显示:在破骨细胞分化早期,1 000 nmol/L的1, 25(OH)2D3对c-Fos和NFATc1蛋白的表达具有明显的抑制作用,在破骨细胞激活期,0.1、10、1 000 nmol/L的1, 25(OH)2D3均在蛋白水平明显抑制c-Fos和NFATc1的表达,而在破骨细胞成熟期,10、1 000 nmol/L的1, 25(OH)2D3显著抑制c-Fos蛋白的表达,仅1 000 nmol/L的1, 25(OH)2D3显著抑制NFATc1蛋白的表达(P < 0.05, 图 1C)。以上结果提示:1, 25(OH)2D3在破骨细胞分化早期开始抑制c-Fos和NFATc1的表达,在激活期的抑制作用最明显,而到了成熟期仅高浓度的1, 25(OH)2D3对破骨细胞具有明显的抑制作用。
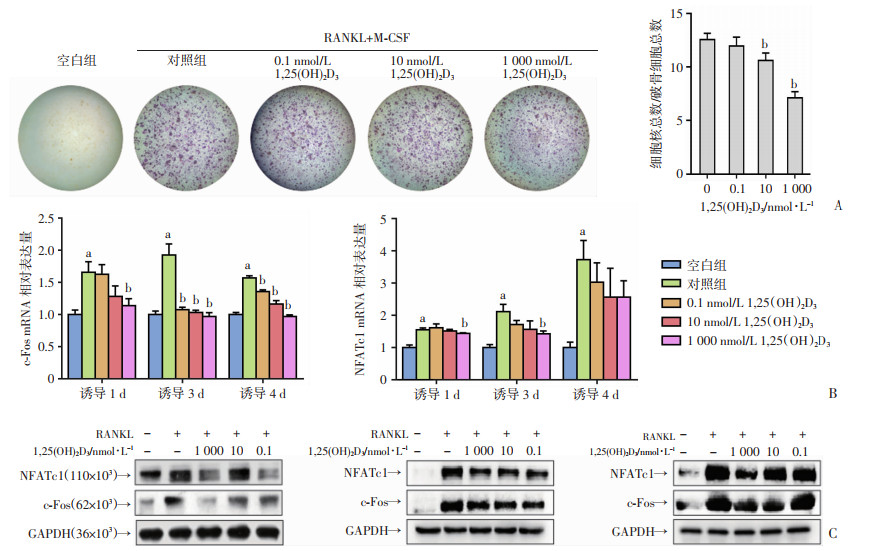
|
| A:TRAP染色检测1, 25(OH)2D3对破骨细胞分化的影响;B:qPCR检测破骨细胞分化1、3、4 d c-Fos和NFATc1的mRNA表达;C:Western blot检测破骨细胞分化1、3、4 d c-Fos和NFATc1的蛋白表达 a:P < 0.05,与空白组比较;b:P < 0.05,与对照组比较 图 1 1, 25(OH)2D3抑制各阶段的破骨细胞分化 |
2.2 1, 25(OH)2D3能抑制不同时期破骨细胞的功能
FAK染色观察1, 25(OH)2D3对破骨细胞融合的影响,结果显示1, 25(OH)2D3在0.1 nmol/L时对破骨细胞融合无明显作用,在10、1 000 nmol/L时能显著抑制破骨细胞的融合,且具有浓度依赖性(P < 0.05, 图 2A)。进一步实施噬骨实验,观察到0.1、10、1 000 nmol/L 1, 25(OH)2D3均能显著减少骨吸收面积并具有浓度依赖性(P < 0.05, 图 2B)。qPCR结果显示:在破骨细胞分化早期,0.1、10、1 000 nmol/L的1, 25(OH)2D3在mRNA水平对CtsK具有轻度的抑制作用;进入破骨细胞激活期后,10、1 000 nmol/L组的抑制作用进一步加强;而破骨细胞成熟期,0.1、10、1 000 nmol/L的1, 25(OH)2D3均能显著抑制CtsK的mRNA表达。此外,在破骨细胞分化早期,10、1 000 nmol/L的1, 25(OH)2D3对MMP-9的表达具有轻度的抑制作用;进入破骨细胞激活期后,该抑制作用进一步加强;而破骨细胞成熟期,0.1、10、1 000 nmol/L的1, 25(OH)2D3均能显著抑制MMP-9的mRNA表达水平(P < 0.05, 图 2C)。Western blot结果显示:在破骨细胞分化早期,各浓度的1, 25(OH)2D3对CtsK和MMP-9蛋白的表达没有明显作用,而在破骨细胞激活期,0.1、10 nmol/L的1, 25(OH)2D3在蛋白水平明显抑制了CtsK的表达,在破骨细胞成熟期,各浓度的1, 25(OH)2D3均显著抑制了CtsK蛋白质的表达且具有浓度依赖性,仅10、1 000 nmol/L的1, 25(OH)2D3显著抑制了MMP-9蛋白质的表达(P < 0.05, 图 2D)。以上结果表明:1, 25(OH)2D3在破骨细胞激活期开始抑制CtsK和MMP-9的表达,在成熟期的抑制作用进一步加强。

|
| A1、A2:FAK染色检测1, 25(OH)2D3对破骨细胞融合的影响;B1、B2:胶原板骨吸收实验检测破骨细胞分化1、3、4 d骨吸收功能;C:qPCR检测破骨细胞分化1、3、4 d CtsK和MMP-9的mRNA表达;D:Western blot检测破骨细胞分化1、3、4 d CtsK和MMP-9的蛋白表达 a:P < 0.05,与空白组比较;b:P < 0.05,与对照组比较 图 2 1, 25(OH)2D3抑制破骨细胞的功能活性 |
2.3 1, 25(OH)2D3抑制破骨细胞的IκB/NF-κB p65信号通路
Western blot检测VDR和NF-κB蛋白表达的变化,结果显示(图 3),NF-κB p65没有明显的变化,VDR蛋白表达在1 000 nmol/L的1, 25(OH)2D3作用下显著上调。为进一步揭示1, 25(OH)2D3抑制破骨细胞生成的机制,检测IκB α和NF-κB p65的磷酸化水平,结果显示,1, 25(OH)2D3对IκB α和NF-κB p65的表达没有明显的作用,但IκB α的磷酸化水平显著降低,p-IκB α/IκB α的比值明显降低(P < 0.05),因此抑制了p65/p50异源二聚体的核转位,并抑制了p65的磷酸化水平。以上结果表明:1, 25(OH)2D3通过VDR抑制了IκB的磷酸化水平,从而抑制了NF-κB p65的核转位与磷酸化水平,抑制了破骨细胞生成。
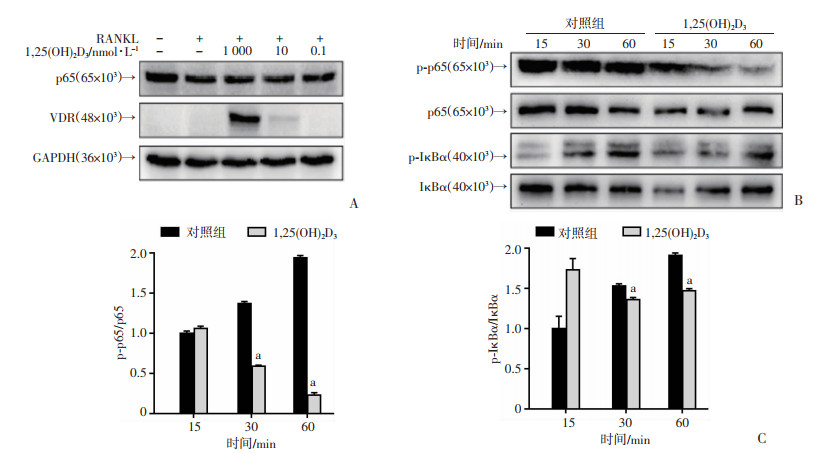
|
| A:VDR、p65蛋白表达水平;B:IκB与NF-κB p65磷酸化蛋白水平;C:半定量分析 图 3 Western blot检测VDR、p65蛋白表达及IκB与NF-κB p65的磷酸化水平 |
3 讨论
骨重塑是一个动态过程,通过维持成骨细胞骨形成和破骨细胞骨吸收之间的微妙平衡实现,而不平衡的骨稳态就会导致病理性或炎症性骨疾病[13-14]。研究表明,维生素D缺乏与许多病理状况有关,包括感染、自身免疫和过敏性疾病。补充维生素D可提高循环钙浓度,在预防和治疗感染方面具有潜在作用[15]。1, 25(OH)2D3与VDR结合直接通过抗菌肽基因近端启动子内存在的维生素D反应元件(VDRE)诱导抗菌肽的转录[16];另一方面,维生素D控制树突状细胞的反应,间接调节Th1和Th2细胞反应的平衡。因此,1, 25(OH)2D3可能通过消除感染以及减轻感染灶的炎症反应来实现抗感染作用。结核分枝杆菌感染引起的异常破骨细胞激活导致骨重建失衡,导致感染性骨破坏[17]。此外,结核分枝杆菌上的病原相关分子模式(pathogen-associated molecular patterns, PAMPs)和单核细胞上的Toll样受体2 (Toll-like receptor 2, TLR2)相互作用可上调VDR的表达[18]。因此,研究1, 25(OH)2D3对破骨细胞的作用及其机制在结核性骨感染治疗中具有重要意义。
本研究从C57BL/6小鼠四肢骨骨髓中提取了BMMs,经过M-CSF和RANKL诱导后,分别用不同浓度的1, 25(OH)2D3干预。结果表明,1, 25(OH)2D3处理后激活了VDR信号通路,对破骨细胞形成过程中的特异基因具有显著的抑制作用,抑制了破骨细胞的分化及功能。本研究成功建立了将BMMs诱导成破骨细胞的体外诱导模型。1, 25(OH)2D3作为VDR的强激动剂,以剂量依赖的方式激活VDR,在1 000 nmol/L时显著抑制破骨细胞分化各阶段标志基因CtsK、c-Fos、MMP-9和NFATc1等mRNA和蛋白表达(P < 0.05)。此外,TRAP和FAK染色结果均显示1, 25(OH)2D3组多核破骨细胞减少(P < 0.05),噬骨实验显示1, 25(OH)2D3组骨吸收功能明显减弱(P < 0.05),提示1, 25(OH)2D3激活VDR抑制了破骨细胞融合与功能。因此,本研究初步得出结论,1, 25(OH)2D3激活VDR从而抑制破骨细胞的分化和成熟。
研究表明,巨噬细胞可能通过上调NF-κB表达来增强自噬作用,促进下游细胞因子的表达和分泌[19]。NF-κB作为破骨细胞形成经典通路的关键分子,在静息状态下稳定地驻留在胞质中,但在RANKL刺激下迅速进入细胞核[9-10]。VDR的激活可以抑制巨噬细胞中炎性转录因子NF-κB的活性且1, 25(OH)2D3能够阻止p65/p50核易位[20-21]。本研究发现,1, 25(OH)2D3对IκB α的表达量没有影响,但显著下调了IκB α的磷酸化水平,从而降低了p-IκB α/IκB α的比值。因此,IκB α稳定地与p65/p50异源二聚体结合,抑制了p65的核转位与磷酸化。
综上所述,本研究结果表明1 000 nmol/L 1, 25(OH)2D3显著上调VDR的表达,1, 25(OH)2D3激活VDR可通过IκB α/p65信号通路抑制破骨细胞分化、融合和骨吸收活性。提示1, 25(OH)2D3作为一种新药在预防和改善骨关节感染性骨丢失方面具有潜在价值。
| [1] |
CANTORNA M T, SNYDER L, LIN Y D, et al. Vitamin D and 1, 25(OH)2D regulation of T cells[J]. Nutrients, 2015, 7(4): 3011-3021. |
| [2] |
ZAREI A, MOROVAT A, JAVAID K, et al. Vitamin D receptor expression in human bone tissue and dose-dependent activation in resorbing osteoclasts[J]. Bone Res, 2016, 4: 16030. |
| [3] |
BATTERSBY A J, KAMPMANN B, BURL S. Vitamin D in early childhood and the effect on immunity to Mycobacterium tuberculosis[J]. Clin Dev Immunol, 2012, 2012: 430972. |
| [4] |
PANWAR A, GARG R K, MALHOTRA H S, et al. 25-hydroxy vitamin D, vitamin D receptor and Toll-like receptor 2 polymorphisms in spinal tuberculosis: a case-control study[J]. Medicine (Baltimore), 2016, 95(17): e3418. |
| [5] |
NAKAMICHI Y, UDAGAWA N, HORIBE K, et al. VDR in osteoblast-lineage cells primarily mediates vitamin D treatment-induced increase in bone mass by suppressing bone resorption[J]. J Bone Miner Res, 2017, 32(6): 1297-1308. |
| [6] |
TROCHOUTSOU A I, KLOUKINA V, SAMITAS K, et al. Vitamin-D in the immune system: genomic and non-genomic actions[J]. Mini Rev Med Chem, 2015, 15(11): 953-963. |
| [7] |
HU J X, LI X H, CHEN Y Q, et al. The protective effect of WKYMVm peptide on inflammatory osteolysis through regulating NF-κB and CD9/gp130/STAT3 signalling pathway[J]. J Cell Mol Med, 2020, 24(2): 1893-1905. |
| [8] |
STARCZAK Y, REINKE D C, BARRATT K R, et al. Absence of vitamin D receptor in mature osteoclasts results in altered osteoclastic activity and bone loss[J]. J Steroid Biochem Mol Biol, 2018, 177: 77-82. |
| [9] |
ONO T, NAKASHIMA T. Recent advances in osteoclast biology[J]. Histochem Cell Biol, 2018, 149(4): 325-341. |
| [10] |
STARCZAK Y, REINKE D C, BARRATT K R, et al. Vitamin D receptor expression in mature osteoclasts reduces bone loss due to low dietary calcium intake in male mice[J]. J Steroid Biochem Mol Biol, 2021, 210: 105857. |
| [11] |
JIMI E, TAKAKURA N, HIURA F, et al. The role of NF-κB in physiological bone development and inflammatory bone diseases: is NF-κB inhibition "killing two birds with one stone"?[J]. Cells, 2019, 8(12): E1636. |
| [12] |
BOYLE W J, SIMONET W S, LACEY D L. Osteoclast differentiation and activation[J]. Nature, 2003, 423(6937): 337-342. |
| [13] |
AMARASEKARA D S, YUN H, KIM S, et al. Regulation of osteoclast differentiation by cytokine networks[J]. Immune Netw, 2018, 18(1): e8. |
| [14] |
ARTHUR A, GRONTHOS S. Eph-ephrin signaling mediates cross-talk within the bone microenvironment[J]. Front Cell Dev Biol, 2021, 9: 598612. |
| [15] |
COUSSENS A K, WILKINSON R J, HANIFA Y, et al. Vitamin D accelerates resolution of inflammatory responses during tuberculosis treatment[J]. Proc Natl Acad Sci USA, 2012, 109(38): 15449-15454. |
| [16] |
HEWISON M. Antibacterial effects of vitamin D[J]. Nat Rev Endocrinol, 2011, 7(6): 337-345. |
| [17] |
MEGHJI S, WHITE P A, NAIR S P, et al. Mycobacterium tuberculosis chaperonin 10 stimulates bone resorption: a potential contributory factor in Pott's disease[J]. J Exp Med, 1997, 186(8): 1241-1246. |
| [18] |
JAIN A K, RAJASEKARAN S, JAGGI K R, et al. Tuberculosis of the spine[J]. J Bone Joint Surgery, 2020, 102(7): 617-628. |
| [19] |
MIZUSHIMA N, KOMATSU M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741. |
| [20] |
DONG B N, ZHOU Y, WANG W, et al. Vitamin D receptor activation in liver macrophages ameliorates hepatic inflammation, steatosis, and insulin resistance in mice[J]. Hepatology, 2020, 71(5): 1559-1574. |
| [21] |
CHEN Y Z, ZHANG J, GE X, et al. Vitamin D receptor inhibits nuclear factor κB activation by interacting with IκB kinase β protein[J]. J Biol Chem, 2013, 288(27): 19450-19458. |




