巨噬细胞是一种具有高度可塑性的细胞,在不同的环境刺激下可分化为M1和M2极化表型[1]。Toll样受体(Toll-like receptors, TLR)的配体(如LPS或IFN-γ)可诱导巨噬细胞极化为M1表型,促进炎症反应,对肿瘤细胞具有杀伤作用;而当巨噬细胞受到辅助型T细胞2(T helper 2,Th2)型细胞因子(如IL-4或IL-13)的刺激时,则会转化为M2表型,抑制炎症反应并促进肿瘤的进展。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)占间质细胞的比例可达50%以上,通过介导免疫抑制、促进血管生成和肿瘤转移等,在肿瘤微环境(tumor microenvironment,TME)中起着至关重要的作用[2-4]。研究表明,TAMs多为M2样巨噬细胞[5],其浸润数量与乳腺癌的恶性程度和转移风险等高度相关[6]。TAMs从M1表型向M2表型的转化是肿瘤进展的关键事件,而阻断TAMs在肿瘤微环境中的功能可能是抑制肿瘤发展的潜在治疗策略[1-2]。因此,一些针对M2分化巨噬细胞的策略已经在临床环境中进行了测试,例如,抑制TAMs分化,阻断TAMs激活和将TAMs重编程到M1型[7-9]等。然而,导致TME中TAMs不同表型转化的分子机制尚不完全清楚。
微RNA(microRNA,miRNA)是一类小型非编码RNA,长度为18~25个核苷酸,通过与靶基因的3’UTR非编码区结合导致mRNA降解或阻断其翻译从而在转录后水平抑制基因表达[10]。近年来,miRNAs通过调控巨噬细胞极化相关基因的表达,已成为巨噬细胞极化的重要调节因子[11-12]。miR-382-5p作为一种抑癌性miRNA,在包括乳腺癌在内的多种肿瘤的发生、发展过程中具有重要的作用[13-15],但miR-382-5p在TME中的作用机制目前尚不清楚。本研究探讨了miR-382-5p在乳腺癌TAMs中的表达和功能,发现miR-382-5p在乳腺癌TAMs中表达水平显著降低,可能通过改变巨噬细胞的极化状态,在乳腺癌进展和转移等过程中发挥了重要作用。
1 材料与方法 1.1 主要材料及试剂4T1小鼠乳腺癌细胞株、THP-1人外周血的单核细胞株、Raw264.7小鼠巨噬细胞株购自中国科学院上海生命科学研究院细胞库;miRNA-up-慢病毒(MI0000799)购自上海吉凯基因化学技术有限公司;RPMI1640培养基和南美胎牛血清购自Gibco公司;TNF-α抗体、IL-10抗体购自Abcam公司;p-Akt抗体、Akt抗体、p-mTOR抗体、mTOR抗体购自Cell Signaling Technology公司;IL-6抗体、Arg-1抗体、β-actin抗体购自上海碧云天生物技术公司;CD86(Fitc标记)、CD206(APC标记)抗体购自Thermo Fisher Scientific公司;反转录试剂盒和TB GreenTM Premix Ex TaqTM (Tli RNase H Plus)试剂盒购自TaKaRa公司;PolyA加尾法microRNA反转录试剂盒和PCR引物购自生工生物工程(上海)股份有限公司;Western blot相关试剂购自碧云天生物技术公司。
1.2 方法 1.2.1 临床标本乳腺癌临床样本及配对癌旁组织来自2018-2020年本院行手术治疗的25例乳腺癌患者,均经术后病理确诊乳腺癌,临床病理资料完整。本研究由重庆医科大学附属第二医院伦理研究委员会批准(2018年科伦审第42号),所有患者知情同意。
1.2.2 原代巨噬细胞的分离及培养将收集的乳腺癌组织及配对的癌旁组织(至少离肿瘤2 cm)转移至培养皿中,用灭菌PBS浸泡并洗涤。将组织剪碎成约1 mm3的碎块,加入Ⅳ型胶原蛋白酶(2 mg/mL)和透明质酸酶(0.25 mg/mL)后转移至离心管中。恒温摇床(37 ℃, 180 r/min)消化2 h,每15 min吹打1次。消化所得细胞悬液经40 μm筛网过滤,PBS冲洗残留在筛网上的组织块, 将滤过的液体收集至离心管,高速离心(2 000 r/min,5 min)后,PBS重悬细胞,利用Ficoll-Hypaque密度梯度离心法分离巨噬细胞[16],吸取交界处的环状白色细胞层,PBS洗涤2次,离心后收集细胞用于后续实验。
1.2.3 细胞株培养及传代4T1、THP-1、Raw264.7细胞培养在饱和湿度的培养箱(37 ℃、5% CO2)中,培养基采用RPMI1640培养基(10% FBS、1%双抗),胰酶(0.25%)消化传代,每2~3天传代1次。
1.2.4 PMs的提取及培养小鼠处死后在75%酒精浸泡1~2 min,仰卧位固定于解剖板上,注射器吸取5 mL含双抗的RPMI1640培养基注射进小鼠腹腔,棉球轻揉小鼠腹部,利用注射器将小鼠腹腔液转移至15 mL离心管中,离心(4 ℃,1 000 r/min,10 min),弃上清,用含双抗的RPMI1640培养基洗涤1次,收集PMs细胞培养在RPMI1640培养基(10% FBS、1%双抗)中,置于饱和湿度的培养箱(37 ℃、5% CO2)中常规培养[17],收集对数生长期细胞,用于后续实验。
1.2.5 实验分组为检测过表达miR-382-5p后TAMs极化指标、Akt/mTOR通路蛋白表达的变化,将TAMs细胞分2组,①对照组:正常培养的TAMs细胞;②miR-382-5p组:转染miR-382-5p过表达慢病毒颗粒的TAMs。为检测过表达miR-382-5p的TAMs对4T1乳腺癌细胞生物学特性的影响,实验分为3组,①对照组:正常培养的4T1细胞;②TAMs组:4T1细胞与TAMs细胞共培养或TAMs的培养上清液处理;③miR-382-5p组:4T1细胞与过表达miR-382-5p的TAMs共培养或TAMs的培养上清液处理。
1.2.6 细胞转染将PMs原代细胞消化后重悬,细胞计数板计数,接种至6孔板中(5×105/孔),每孔加入2 mL培养基, 24 h后更换培养基并加入感染增强液A,分别加入慢病毒颗粒液或阴性慢病毒转染液,轻摇混匀,37 ℃培养12 h后根据细胞状态可更换培养基,转染72 h后,在显微镜下通过绿色荧光强弱判断PMs细胞转染效率。加入嘌呤霉素(2 μg/mL)筛选稳转株,qRT-PCR进行验证。
1.2.7 巨噬细胞体外诱导TAMs:PMs原代细胞与4T1细胞利用Transwell小室(0.4 μm)共培养24 h[18];Mφ型巨噬细胞:Raw264.7细胞培养贴壁或THP-1细胞用50 mg/mL PMA诱导贴壁;M1型巨噬细胞:Raw264.7细胞或贴壁的THP-1细胞用20 ng/mL IFN-γ联合500 ng/mL LPS诱导24 h;M2型巨噬细胞:Raw264.7细胞或贴壁的THP-1细胞用20 ng/mL IL-4诱导24 h。
1.2.8 qRT-PCR实验采用TRIzol法提取细胞总RNA,将总RNA逆转录成cDNA(反应条件:42 ℃-2 min→4 ℃;37 ℃-15 min→85 ℃-5 s→4 ℃)后进行qRT-PCR检测;miR-382-5p检测用PolyA加尾法将microRNA反转录成cDNA(反应条件:37 ℃-60 min→85 ℃-5 min→4 ℃)后再进行qRT-PCR检测。TNF-α、iNOS、IL-10、Arg-1等以β-actin为内参,miR-382-5p以U6为内参,具体引物序列见表 1。反应条件:96 ℃-30 s→(95 ℃-5 s→55 ℃/60 ℃-30 s)×40 cycles。反应结束后,实验结果采用2-ΔΔCt法计算并分析。
| 引物名称 | 上游序列 | 下游序列 |
| TNF-α | 5′-CGCTGAGGTCAATCTGCCCAAGTAC-3′ | 5′-GGGGGCTGGGTAGAGAATGGATG-3′ |
| IL-10 | 5′-AAGGCAGTGGAGCAGGTGAAGAG-3′ | 5′-GCAGGTGTTTTAGCTTTTCATTTTG-3′ |
| iNOS | 5′-CCTTGGTGAAGGGACTGAGC-3′ | 5′-CAACGTTCTCCGTTCTCTTGC-3′ |
| Arg-1 | 5′-CTTGGCTTGCTTCGGAACTC-3′ | 5′-GGAGAAGGCGTTTGCTTAGTTC-3′ |
| β-actin | 5′-ACCCCGTGCTGCTGACCGAG-3′ | 5′-TCCCGGCCAGCCAGGTCCA-3′ |
| miR-382-5p | 5′-GAAGTTGTTCGTGGTGGATTCG-3′ |
1.2.9 流式细胞仪检测极化指标
收集6孔板中的PMs细胞,PBS重悬细胞洗涤2次,细胞计数后加入4%多聚甲醛固定细胞(10 min),PBS吹打重悬洗涤2次,加入适量0.1% Triton通透5 min,PBS洗涤2次,离心后加入CD86(Fitc标记)、CD206(APC标记)抗体,在避光环境下冰上孵育30 min,PBS洗涤2次后弃上清,加入400 μL PBS,把离心后已孵育好抗体的细胞吹打重悬,流式细胞仪检测细胞极化指标。
1.2.10 CCK-8检测细胞增殖能力将各组PMs细胞(1×106个/皿)接种于6 cm培养皿中,体外培养24 h后收集上清液,离心(2 000 r/min, 5 min)后吸取上清液,按1∶1比例加入含20% FBS RMPI1640培养基混合后制成巨噬细胞上清液。将4T1细胞以5×103/孔,接种于96孔细胞培养板,每组设4个复孔,待细胞贴壁后记为0 h,换液并加入各组TAMs上清液100 μL或等量10% FPS培养基,分别于24、48、72 h各时间点加人10 μL CCK-8溶液,37 ℃, 5% CO2, 细胞培养箱中孵育2 h后,利用酶标仪分别检测各孔细胞450 nm波长处的光密度值[D(450)]。
1.2.11 划痕实验在6孔板的背面用黑色记号笔画6条标线。将4T1细胞均匀接种至6孔板中(5×105/孔),将各组巨噬细胞接种至Transwell小室内(5×105/孔),分开培养至细胞贴壁,当4T1细胞长满90%视野后,用200 μL移液枪枪头在6孔板内垂直背面的横线进行均匀划痕,PBS洗涤2次,去除漂浮的细胞,加入无血清培养基, 电子显微镜下拍照并记为0 h。将各组的Transwell小室移至对应分组的6孔板中共培养,更换为无血清培养基,24 h后移除上室,显微镜下拍照并记录。
1.2.12 Transwell侵袭实验水化Matrigel基质胶基底膜,将4T1细胞接种于上室(1×104/孔)并加入100 μL含BSA(0.2%)无血清培养基,下室加入500 μL的PMs、TAMs、过表达miR-382的TAMs细胞悬液(1×105/mL,10% FBS)。24 h后弃上层培养基,用4%多聚甲醛进行固定(30 min),PBS洗涤2次,0.1%结晶紫染色30 min,PBS洗涤3次,棉签拭去上室未迁移细胞,适当风干后显微镜下随机选取5个视野拍照并计数穿膜细胞数。
1.2.13 Western blot实验取对数生长期细胞,RIPA裂解液提取总蛋白,BCA试剂盒测定蛋白浓度,煮沸(100 ℃,10 min),-20 ℃冰箱保存。凝胶按分子量要求制备,每孔蛋白上样量为30 μg,电泳(恒压100 V,100 min),0.2 μm PVDF转膜(恒流250 mA,60~120 min),快速封闭液室温摇床封闭30 min,TBST洗膜后孵育一抗(1∶1 000)4 ℃冰箱过夜,TBST洗膜3次(10 min/次),加对应的二抗(1∶5 000)室温摇床孵育1 h,TBST洗膜3次(10 min/次),ECL特超敏化学发光液按1∶1比例避光混合后在显像仪中显色成像。
1.3 统计学分析采用SPSS 24.0软件进行统计学分析,计量资料以x±s表示,两组配对样本采用配对样本t检验,两组独立样本采用独立样本t检验。检验水准α=0.05。
2 结果 2.1 miR-382-5p在肿瘤相关巨噬细胞中的表达变化 2.1.1 miR-382-5p在乳腺癌临床样本中的表达miR-382-5p在乳腺癌TAMs中相对表达量为1.79±2.02,明显低于癌旁巨噬细胞(4.56±5.17,P < 0.05)。
2.1.2 miR-382-5p在不同极化巨噬细胞株中的表达THP-1细胞株中,与对照组比较,M1型巨噬细胞的miR-382-5p表达升高,M2型巨噬细胞的miR-382-5p表达降低,而与M2型比较,M1型巨噬细胞的miR-382-5p表达升高,差异均有统计学意义(P < 0.05);在Raw264.7细胞株中结果相同, 见图 1。
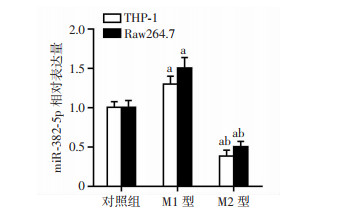
|
| a:P < 0.05,与对照组比较;b:P < 0.05,与M1型比较 图 1 miR-382-5p在不同极化巨噬细胞中的表达 |
2.2 过表达miR-382-5p对巨噬细胞极化表型的影响 2.2.1 miR-382-5p过表达慢病毒转染效率验证
转染miR-382-5p过表达慢病毒后,TAMs中miR-382-5p表达水平较空白对照组升高(9.62±0.42)倍,较阴性对照组升高(9.55±0.42)倍,差异具有统计学意义(P < 0.05,图 2)。

|
| a:P < 0.05,与空白对照组和阴性对照组比较 图 2 TAMs中miR-382-5p过表达慢病毒转染效率验证 |
2.2.2 miR-382-5p对巨噬细胞极化标志物mRNA表达的影响
与对照组比较,miR-382-5p组TNF-α、iNOS的mRNA表达升高;而Arg-1、IL-10的mRNA表达降低,差异具有统计学意义(P < 0.05,图 3)。
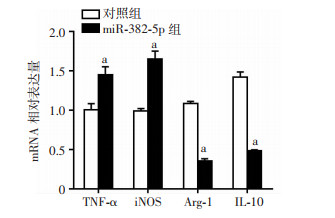
|
| a:P < 0.05,与对照组比较 图 3 miR-382-5p对极化标志物mRNA表达的影响 |
2.2.3 miR-382-5p对巨噬细胞极化标志物蛋白表达的影响
与对照组相比,miR-382-5p组TNF-α、IL-6的蛋白表达升高;而Arg-1、IL-10的蛋白表达降低,差异具有统计学意义(P < 0.05,图 4)。
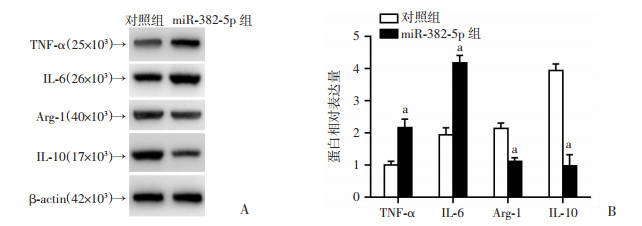
|
| A:Western blot检测结果;B:蛋白相对表达量 a:P < 0.05,与对照组比较 图 4 miR-382-5p对极化标志物蛋白表达的影响 |
2.2.4 流式细胞仪检测miR-382-5p对巨噬细胞极化的影响
与对照组比较,TAMs组CD86阳性细胞数比例降低,CD206阳性细胞数比例升高,差异有统计学意义(P < 0.05,表 2);与TAMs组比较,miR-382-5p组CD86阳性细胞数比例升高45.97%,CD206阳性细胞数比例降低47.64%,差异具有统计学意义(P < 0.05,表 2)。
| 组别 | CD86(M1型细胞) | CD206(M2型细胞) |
| 对照组 | 0.24±0.18 | 0.26±0.17 |
| TAMs组 | 0.12±0.04a | 49.51±3.14a |
| miR-382-5p组 | 46.09±4.81b | 1.87±0.37b |
| a:P < 0.05,与对照组比较;b:P < 0.05,与TAMs组比较 | ||
2.3 miR-382-5p对Akt/mTOR信号通路蛋白表达水平的影响
与对照组比较,过表达miR-382-5p组TAMs中p-Akt表达量降低0.74±0.14,p-mTOR降低0.96±0.23,差异具有统计学意义(P < 0.05,图 5);而Akt降低0.13±0.15,mTOR降低0.07±0.14,差异无统计学意义(图 5)。
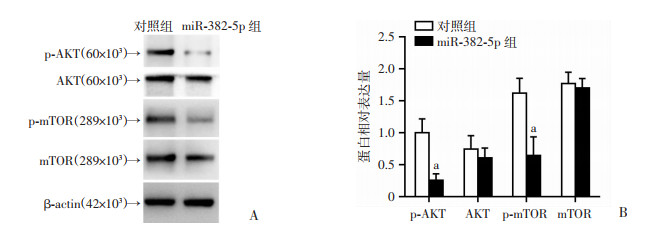
|
| A:Western blot检测结果;B:蛋白相对表达量 a:P < 0.05,与对照组比较 图 5 miR-382-5p对Akt/mTOR信号通路蛋白表达的影响 |
2.4 过表达miR-382-5p的巨噬细胞对乳腺癌细胞生物特性的影响 2.4.1 TAMs中过表达miR-382-5p对4T1细胞增殖能力的影响
细胞培养72 h时,与对照组比较,TAMs组在450 nm处光密度值升高0.63±0.17,差异具有统计学意义(P < 0.05,图 6);而与TAMs组比较,miR-382-5p组在450 nm处光密度值降低0.88±0.13,差异有统计学意义(P < 0.05,图 6)。
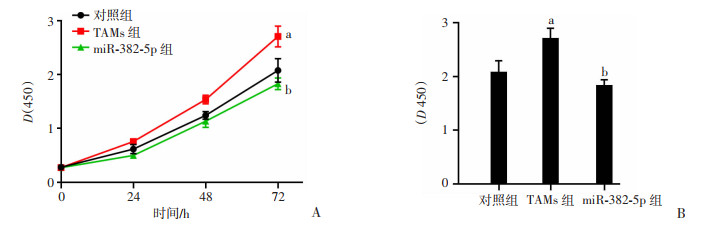
|
| A:CCK-8实验结果;B:72 h各组光密度值比较 a:P < 0.05,与对照组比较;b:P < 0.05,与TAMs组比较 图 6 CCK-8实验检测TAMs中过表达miR-382-5p对4T1细胞增殖能力的影响 |
2.4.2 TAMs中过表达miR-382-5p对4T1细胞侵袭能力的影响
如图 7所示,对照组、TAMs组和miR-382-5p组穿膜细胞数分别为(54.67±7.02)、(100.67±14.01)、(32.67±9.02)个。与对照组比较,TAMs组穿膜细胞数增加0.84倍,差异有统计学意义(P < 0.05);而与TAMs组比较,miR-382-5p组穿膜细胞数减少0.68倍,差异具有统计学意义(P < 0.05)。
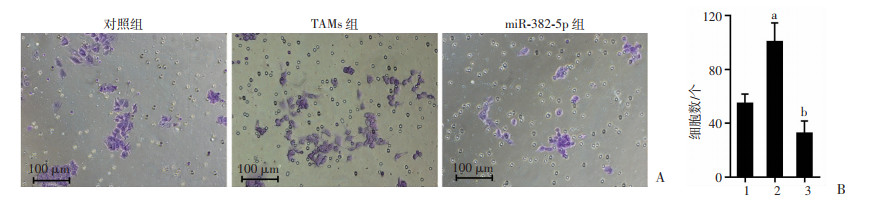
|
| A:Transwell侵袭实验(0.1%结晶紫);B:各组侵袭细胞数比较 1:对照组, 2: TAMs组, 3:miR-382-5p组;a:P < 0.05,与对照组比较;b:P < 0.05,与TAMs组比较 图 7 Transwell实验检测各组4T1细胞侵袭能力 |
2.4.3 TAMs中过表达miR-382-5p对4T1细胞迁移能力的影响
如图 8所示,对照组3个视野细胞的相对迁移率为1.00±0.14,TAMs组的相对迁移率为2.46±0.44,miR-382-5p组的相对迁移率为1.33±0.09;与对照组比较,TAMs组的细胞迁移率增加1.46倍,差异有统计学意义(P < 0.05);与TAMs组比较,miR-382-5p组细胞迁移率减少0.46倍,差异有统计学意义(P < 0.05)。

|
| 图 8 细胞划痕实验检测TAMs中过表达miR-382-5p对4T1细胞迁移能力的影响 |
3 讨论
miRNA是一类调节基因表达的小核糖核酸,目前已有多种miRNAs被证实参与巨噬细胞极化。例如,let7c通过靶向C/EBP-δ促进TAMs的M2极化[19];miR-21通过靶向STAT3抑制TAMs向M2极化[20];miR-222可抑制TAMs向肿瘤部位的募集等[21]。本研究通过检测临床乳腺癌标本及其配对癌旁组织,发现miR-382-5p在乳腺癌TAMs中的表达水平明显低于癌旁组织的巨噬细胞。由于TAMs多为M2型的巨噬细胞,本研究检测了miR-382-5p在不同极化表型巨噬细胞中的表达水平,结果显示在THP-1细胞和Raw264.7细胞中均出现了相同的变化趋势:与对照组比较,M1型巨噬细胞的miR-382-5p相对表达量升高,而M2型巨噬细胞的miR-382-5p相对表达量降低,这与在临床乳腺癌标本中观察到的现象一致。为探究miR-382-5p对巨噬细胞极化的影响,通过LV-miR-382-5p过表达慢病毒转染TAMs,发现过表达miR-382-5p后, TAMs中M1型细胞因子(TNF-α、iNOS等)的mRNA和蛋白表达水平增加,而M2型细胞因子(Arg-1、IL-10等)的mRNA和蛋白表达水平明显降低。同时,流式细胞分析结果显示过表达miR-382-5p的TAMs的CD206表达水平降低,CD86水平升高,提示miR-382-5p可能影响巨噬细胞中M1/M2型细胞因子的释放,诱导TAMs向M1型极化,并抑制M2型极化。
Akt/mTOR信号通路是一条高度进化和保守的信号通路,广泛参与细胞的增殖、凋亡、分化等过程[22]。研究表明,Akt/mTOR信号通路是影响巨噬细胞极化的重要通路之一:Akt/mTOR通路受到抑制后可诱导巨噬细胞向M1型极化,并释放促炎症因子;相反,Akt/mTOR通路的激活可导致M2型分化,并抑制促炎因子的分泌[23]。为进一步探究miR-382-5p调节巨噬细胞极化的分子机制,本研究检测过表达miR-382-5p后TAMs中Akt/mTOR信号通路相关蛋白的表达水平,结果显示,尽管Akt、mTOR蛋白表达变化差异无统计学意义,但p-Akt、p-mTOR蛋白表达水平被明显抑制,提示miR-382-5p可能抑制TAMs的Akt/mTOR通路磷酸化水平。因此,我们推测miR-382-5p可能通过Akt/mTOR信号通路介导了TAMs的可塑性调节。而在miR-382-5p的靶分子预测中,发现NKAP(nuclear factor-κB activating protein)可能是其潜在的靶基因。有报道NKAP是Akt/mTOR通路的重要调节分子,可促进Akt/mTOR通路及其下游分子激活[24]。有趣的是,NKAP同样可能参与Notch信号通路[25]、NF-κB的调节[26],而这些分子和信号通路在巨噬细胞极化中同样具有重要意义[27]。在后续的实验中,我们将针对这些分子和信号通路间的相互作用展开更深入的研究。
细胞的增殖、侵袭和转移能力是肿瘤细胞主要的恶性生物学行为。在肿瘤微环境中,TAMs可刺激血管生成,促进肿瘤转移,抑制免疫等[1-4]。本研究显示,TAMs能明显提高4T1细胞的增殖、侵袭和迁移能力。这些结果表明TAMs对乳腺癌细胞的恶性生物学行为具有促进作用,而过表达miR-382-5p能在一定程度上逆转这些改变,从而抑制乳腺癌细胞的进展。
综上,本研究显示,miR-382-5p在TAMs和M2极化的巨噬细胞中表达下调;其可能通过影响Akt/mTOR信号通路介导巨噬细胞极化状态的调节;而过表达miR-382-5p可以逆转TAMs的促乳腺癌增殖、迁移的作用。本研究揭示了miR-382-5p在TME中的作用和可能机制,为临床上开展以TAMs为靶点的抗癌策略提供新的数据支持和潜在目标分子。
| [1] |
KOMOHARA Y, FUJIWARA Y, OHNISHI K, et al. Tumor-associated macrophages: potential therapeutic targets for anti-cancer therapy[J]. Adv Drug Deliv Rev, 2016, 99(Pt B): 180-185. |
| [2] |
MANTOVANI A, MARCHESI F, MALESCI A, et al. Tumour-associated macrophages as treatment targets in oncology[J]. Nat Rev Clin Oncol, 2017, 14(7): 399-416. |
| [3] |
PINTON L, MASETTO E, VETTORE M, et al. The immune suppressive microenvironment of human gliomas depends on the accumulation of bone marrow-derived macrophages in the center of the lesion[J]. J Immunother Cancer, 2019, 7(1): 58. |
| [4] |
WEI C, YANG C, WANG S, et al. Crosstalk between cancer cells and tumor associated macrophages is required for mesenchymal circulating tumor cell-mediated colorectal cancer metastasis[J]. Mol Cancer, 2019, 18(1): 64. |
| [5] |
TANG X, MO C, WANG Y, et al. Anti-tumour strategies aiming to target tumour-associated macrophages[J]. Immunology, 2013, 138(2): 93-104. |
| [6] |
HONKANEN T J, TIKKANEN A, KARIHTALA P, et al. Prognostic and predictive role of tumour-associated macrophages in HER2 positive breast cancer[J]. Sci Rep, 2019, 9(1): 10961. |
| [7] |
EDELMAN M J, WANG X, HODGSON L, et al. Phase Ⅲ randomized, placebo-controlled, double-blind trial of celecoxib in addition to standard chemotherapy for advanced non-small-cell lung cancer with cyclooxygenase-2 overexpression: CALGB 30801 (Alliance)[J]. J Clin Oncol, 2017, 35(19): 2184-2192. |
| [8] |
BUTOWSKI N, COLMAN H, DE GROOT J F, et al. Orally administered colony stimulating factor 1 receptor inhibitor PLX3397 in recurrent glioblastoma: an ivy foundation early phase clinical trials consortium phase Ⅱ study[J]. Neuro Oncol, 2016, 18(4): 557-564. |
| [9] |
REID T, ORONSKY B, SCICINSKI J, et al. Safety and activity of RRx-001 in patients with advanced cancer: a first-in-human, open-label, dose-escalation phase 1 study[J]. Lancet Oncol, 2015, 16(9): 1133-1142. |
| [10] |
NASSAR F J, NASR R, TALHOUK R. MicroRNAs as biomarkers for early breast cancer diagnosis, prognosis and therapy prediction[J]. Pharmacol Ther, 2017, 172: 34-49. |
| [11] |
LIU G, ABRAHAM E. MicroRNAs in immune response and macrophage polarization[J]. Arterioscler Thromb Vasc Biol, 2013, 33(2): 170-177. |
| [12] |
ESSANDOH K, LI Y, HUO J, et al. MiRNA-mediated macrophage polarization and its potential role in the regulation of inflammatory response[J]. Shock, 2016, 46(2): 122-131. |
| [13] |
FENG J, QI B, GUO L, et al. miR-382 functions as a tumor suppressor against esophageal squamous cell carcinoma[J]. World J Gastroenterol, 2017, 23(23): 4243-4251. |
| [14] |
WANG J, CHEN C, YAN X, et al. The role of miR-382-5p in glioma cell proliferation, migration and invasion[J]. OncoTargets Ther, 2019, 12: 4993-5002. |
| [15] |
ZHENG S, LI M, MIAO K, et al. SNHG1 contributes to proliferation and invasion by regulating miR-382 in breast cancer[J]. Cancer Manag Res, 2019, 11: 5589-5598. |
| [16] |
杨芳, 伍菲凡, 王晓燕, 等. Ficoll和Percoll法分离结直肠癌相关巨噬细胞的比较[J]. 实用医学杂志, 2015(9): 1394-1398. YANG F, WU F F, WANG X Y, et al. A comparative study of tumor-associated macrophages isolation in colorectal carcinoma by Ficoll-Hy-paque density gradient centrifugation and Percoll density gradient centrifugation[J]. J Prac Med, 2015(9): 1394-1398. |
| [17] |
代朦, 靳鑫, 雷优扬, 等. 过表达miR-382的肿瘤相关巨噬细胞对三阴性乳腺癌生物学特性的影响[J]. 第三军医大学学报, 2018, 40(15): 1375-1382. DAI M, JIN X, LEI Y Y, et al. Effect of miR-382 overexpressing tumor-associated macrophages on biological properties of triple-negative breast cancer 4T1 cells[J]. J Third Mil Med Univ, 2018, 40(15): 1375-1382. |
| [18] |
靳鑫, 倪田根, 王宁, 等. PGC-1α通过线粒体介导巨噬细胞极化状态的机制研究[J]. 第三军医大学学报, 2019, 41(1): 56-62. JIN X, NI T G, WANG N, et al. Mechanism of mitochondria-mediated PGC-1α in macrophage polarization[J]. J Third Mil Med Univ, 2019, 41(1): 56-62. |
| [19] |
BANERJEE S, XIE N, CUI H, et al. MicroRNA let-7c regulates macrophage polarization[J]. J Immunol, 2013, 190(12): 6542-6549. |
| [20] |
WANG Z, BRANDT S, MEDEIROS A, et al. MicroRNA 21 is a homeostatic regulator of macrophage polarization and prevents prostaglandin E2-mediated M2 generation[J]. PLoS ONE, 2015, 10(2): e0115855. |
| [21] |
LI Y, ZHAO L, SHI B, et al. Functions of miR-146a and miR-222 in tumor-associated macrophages in breast cancer[J]. Sci Rep, 2015, 5: 18648. |
| [22] |
POPOVA N V, JUCKER M. The role of mTOR signaling as a therapeutic target in cancer[J]. Int J Mol Sci, 2021, 22(4): 1743. |
| [23] |
VERGADI E, IERONYMAKI E, LYRONI K, et al. Akt signaling pathway in macrophage activation and M1/M2 polarization[J]. J Immunol, 2017, 198(3): 1006-1014. |
| [24] |
MA Q, HOU L, GAO X, et al. NKAP promotes renal cell carcinoma growth via AKT/mTOR signalling pathway[J]. Cell Biochem Funct, 2020, 38(5): 574-581. |
| [25] |
PAJEROWSKI A G, NGUYEN C, AGHAJANIAN H, et al. NKAP is a transcriptional repressor of notch signaling and is required for T cell development[J]. Immunity, 2009, 30(5): 696-707. |
| [26] |
CHEN D, LI Z, YANG Q, et al. Identification of a nuclear protein that promotes NF-kappaB activation[J]. Biochem Biophys Res Commun, 2003, 310(3): 720-724. |
| [27] |
ZHOU D, HUANG C, LIN Z, et al. Macrophage polarization and function with emphasis on the evolving roles of coordinated regulation of cellular signaling pathways[J]. Cell Signal, 2014, 26(2): 192-197. |




