2. 400016 重庆,重庆医科大学附属第一医院: 消化内科;
3. 710032 西安,空军军医大学西京医院皮肤科
2. Department of Gastroenterology, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016;
3. Department of Dermatology, Xijing Hospital, Air Force Medical University, Xi'an, Shaanxi Province, 710032, China
白癜风是一种常见的皮肤色素脱失性疾病,严重影响患者的身心健康。黑素细胞的自我破坏和神秘消失是白癜风的发病特征。白癜风黑素细胞的破坏由一系列复杂的因素介导,一方面,多种内源性因素导致黑素细胞内活性氧(reactive oxygen free radicals,ROS)过量产生和积累,ROS通过黑素细胞功能障碍的相关途径参与黑素细胞的破坏。另一方面,外源性刺激,如紫外线辐射、细胞毒性化学物质、创伤、感染和药物应用等导致黑素细胞过度产生ROS并释放黑素体相关抗原,诱导CD8+T细胞聚集,进而导致表皮黑素细胞的最终破坏[1]。
一些非编码RNAs(ncRNAs),包括microRNA(miRNAs)、长非编码RNA(LncRNAs)和环状RNA(circRNAs),可以在转录水平上调控基因转化为功能蛋白。研究显示,miRNAs在白癜风发病中扮演重要作用。例如,血清miRNAs可以作为白癜风的血清生物标志物;氧化应激诱导miR-25过度表达促进黑素细胞变性;白癜风患者血清miRNAs调控的基因网络与氧化应激、自身免疫和内质网应激有关[2-3]。一项对小鼠不同发育阶段黑素细胞测序的研究中,研究人员通过构建CeRNA网络初步揭示了与皮肤和黑素细胞发育相关的ncRNA和mRNAs之间的复杂相互作用[4]。ncRNA在白癜风中的作用还未被广泛研究,其机制尚不清楚。在本研究中,我们对人类白癜风黑素细胞株PIG3V[5]和正常黑素细胞株PIG1[6]在Illumina NovaSeq 6000平台(美国Illumina)上进行高通量测序,然后进行了全面的生物信息学分析,预测差异表达RNA之间的相互作用,旨在为白癜风的发病机制提供新见解。
1 材料和方法 1.1 细胞培养将人白癜风黑素细胞株PIG3V和人正常黑素细胞株PIG1[7](均由空军军医大学西京医院李春英博士赠予)在添加5%胎牛血清和青霉素链霉素的人黑素细胞生长培养基254中,于37 ℃,5%CO2培养箱中培养。
1.2 RNA的分离纯化使用RNeasy Mini Kit(Qiagen,德国)或miRNeasy Mini Kit(50)217004(Qiagen,德国)分离总RNA,然后使用Qubit©2.0荧光计(Life Technologies,美国)和NanoDrop One分光光度计(Thermo Fisher Scientific,Inc.,美国)测量RNA浓度和质量。使用安捷伦2100生物分析仪(安捷伦科技公司,美国)评估总RNA的完整性,并使用RNA完整性数(RIN)值大于7.0的样品进行测序。一微克RNA被用作RNA样品制备的输入材料。
1.3 高通量测序根据制造商的说明,使用VAHTS总RNA-Seq(H/M/R)文库制备试剂盒(Vazyme,中国)构建RNA-Seq链特异性文库。miRNA-seq文库的构建和测序由中国上海鲸舟基因科技有限公司完成,产物经PCR纯化和富集得到最终的cDNA文库。使用QIAseq miRNA文库试剂盒(Qaigen,德国)合成成对文库。纯化的文库在Qubit©2.0荧光计和安捷伦2100生物分析仪上进行定量和验证,以确认插入物大小并计算摩尔浓度。将文库稀释至10 μm后,通过cBot产生簇,然后在Illumina NovaSeq 6000平台(美国Illumina)和Illumina Hiseq Xten(美国Illumina)上测序。
1.4 差异表达分析使用R软件包edgeR对mRNAs/lncRNAs进行差异表达分析。log2(FC)值>1和q < 0.05的mRNAs/lncRNAs被认为有显著差异表达。使用DESeq软件进行miRNAs的差异表达分析。log2(FC)值>1和P<0.05的差异表达的miRNAs被认为显著差异表达。
1.5 实时荧光定量PCR分析RT-qPCR检测lncRNAs、miRNAs和mRNAs的表达。本研究中使用的引物序列如表1所示。根据制造商的说明,使用PrimeScript RT试剂盒(Perfect Real Time;TaKaRa,Osaka,Japan)将样本中的总RNA反转录得到cDNA,然后使用2×SYBR Green qPCR Master Mix(Bimake)试剂盒在Bio-Rad CFX Manager实时PCR系统上对cDNA进行分析。每个RT-qPCR分析包括三个技术重复。
1.6 蛋白质相互作用(PPI)网络的构建利用互作基因的检索工具(STRING,11.0版)构建差异表达mRNAs(DE-mRNAs)的PPI网络。然后,使用Cytoscape软件(版本3.7.2)可视化PPI网络。同时,利用Cytoscape的分子复合物检测(MCODE,version 1.5.1)插件筛选PPI网络中最重要的功能模块。
1.7 lncRNA-miRNA-mRNA网络分析构建lncRNA-miRNA-mRNA(CeRNA)网络用以确定所选mRNAs与其他lncRNAs或miRNAs之间的相互作用。用生物信息学算法miRanda鉴定miRNA-mRNA和miRNA-lncRNA的相互作用环。使用Cytoscape软件(版本3.7.2)可视化top500的lncRNA-miRNA-mRNA(CeRNA)网络。最后,提取与top20枢纽基因有相互作用关系的lncRNAs,用这些LncRNAs取交集并获得7个关键lncRNAs。为进一步探索这些关键LncRNAs的相互作用机制,我们以这7个关键LncRNAs为主体预测了3个CeRNA子网络,并用enrich R包对子网络中的mRNAs进行了GO和KEGG通路分析(http://www.genome.ad.jp/kegg)。
1.8 统计分析用Graph-Pad-Prism 8.0.2软件进行Student t检验,计算RT-qPCR分析各参数差异的统计学意义。数据以x±s表示。P<0.05具有统计学意义。
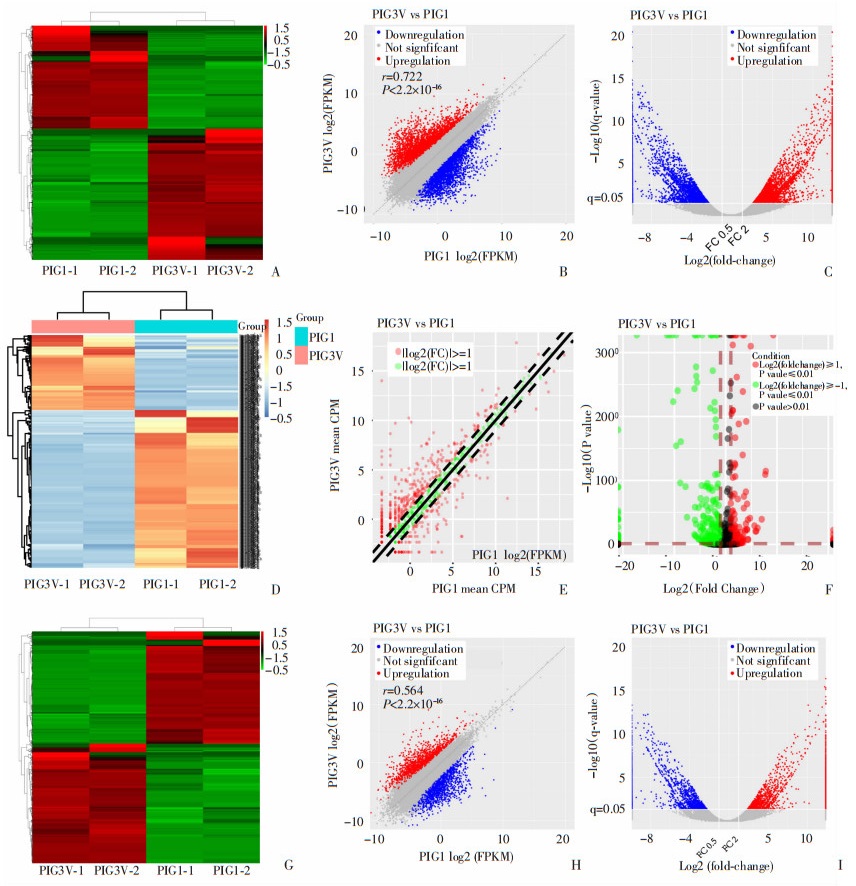
2 结果 2.1 高通量测序结果根据微阵列表达谱数据,与对照组相比,白癜风黑素细胞共检测到3 338个上调的mRNAs(56.03%),2 620个下调的mRNAs(43.97%)。DE mRNAs的F表达模式的二维层次聚类特征在热图中呈现(图 1A)。散点图和火山图用于评估两组之间的mRNA表达差异(图 1B、C)。同样,与对照组相比,白癜风黑素细胞中共鉴定出1 650个DE LncRNAs和450个DE miRNAs。DE LncRNAs和DE miRNAs的F表达模式的二维层次聚类特征在热图中呈现(图 1D、G)。使用散点图和火山图评估两组之间的LncRNAs和miRNAs表达变化(图 1E、F、H、I)。前10位上调和下调的LncRNAs、mRNAs和miRNAs如表2所示。
|
| A: 鉴定的差异表达mRNAs的热图; B: 鉴定的差异表达mRNAs的散点图; C: 鉴定的差异表达mRNAs的火山图; D:鉴定的差异表达LncRNAs的热图,E: 鉴定的差异表达LncRNAs的散点图;F: 鉴定的差异表达LncRNAs的火山图;G:鉴定的差异表达miRNAs的热图;H: 鉴定的差异表达miRNAs的散点图和; I: 鉴定的差异表达miRNAs的火山图 图 1 白癜风黑素细胞的微阵列表达谱分析结果 |
2.2 PPI网络构建
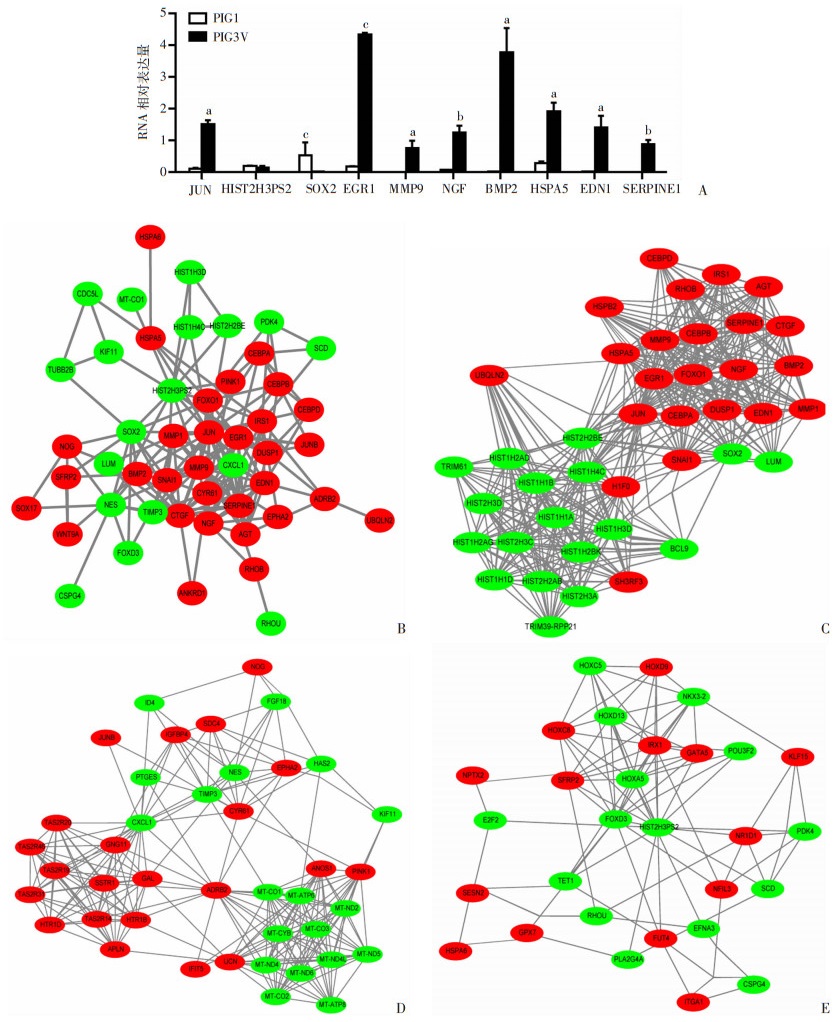
根据STRING数据库中的信息,DEGs的PPI网络包含382个节点和3 647个连接。在相应的核心基因列表中,排名前10位的高级枢纽节点包括Jun原癌基因(JUN),H3.2组蛋白(HIST2H3PS2),SRY-box转录因子2(SOX2),早期生长应答因子1(EGR1),基质金属肽酶9 (MMP9),神经生长因子(NGF),骨形态发生蛋白2(BMP2),热休克蛋白(HSP)家族A(HSP70)成员5(HSPA5),内皮素1(EDN1)和丝氨酸蛋白酶抑制剂家族E成员1(SERPINE1)。在这些基因中,JUN的连接程度最高,为128。我们调查并可视化了前50个高度集线器节点(图 2A)。用RT-qPCR验证了前10个枢纽基因的表达,结果与测序结果基本一致(图 2B)。为了深入了解PPI网络中互作蛋白质参与的主要生物过程,我们用MCODE对PPI网络进行了功能模块的筛选,并可视化了前三个重要模块(图 2C~E)。
|
| A:Top10枢纽基因的qPCR验证结果(x±s);a: P<0.01, b: P<0.001, c: P<0.000 1, 与PIG1比较; B:Top50的蛋白-蛋白相互作用网络;C~E分别为来自蛋白-蛋白相互作用网络的前三个重要功能模组module1,module2,module3;红色和绿色分别表示上调下调的DEG 图 2 蛋白-蛋白相互作用网络、枢纽基因的qPCR验证结果及重要的功能模组 |
2.3 CeRNA网络的构建
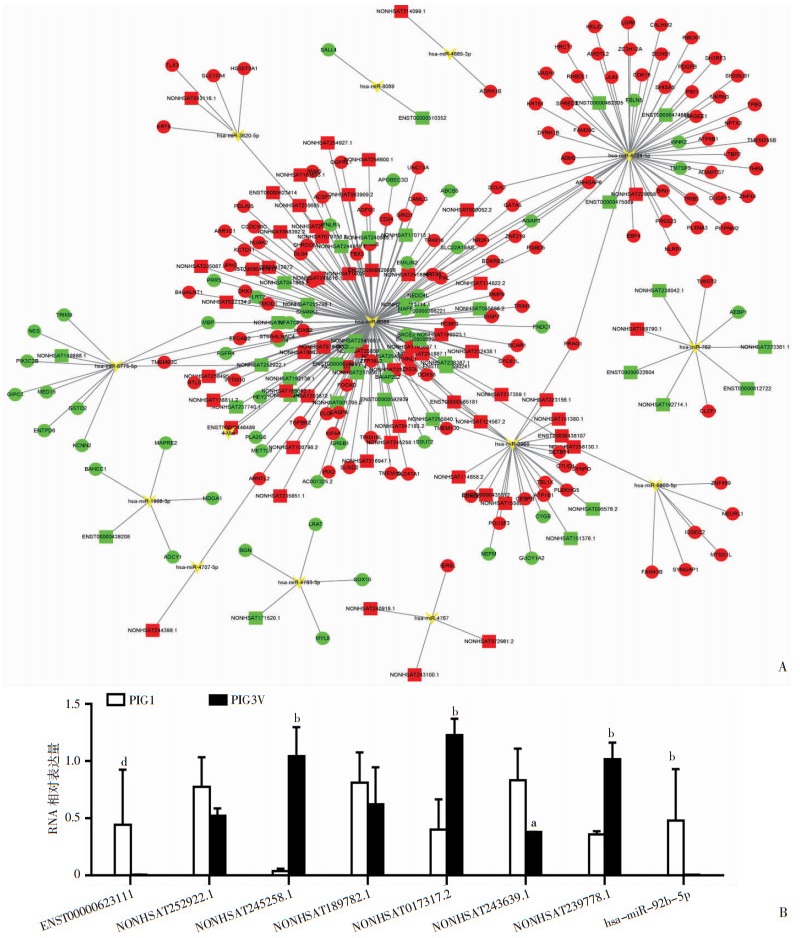
miRNA-mRNA调控环有163个DE-mRNAs和14个特异性miRNAs。lncRNA-miRNA调控环有94个DE-LncRNAs和14个特异性miRNA。然后,通过整合DE lncRNA-miRNA和DE mRNA-DE miRNA的关系,我们得到top500的CeRNA网络(图 3A)。另外,我们筛选的7个关键LncRNAs,分别为ENST00000623111, NONHSAT 252922.1, NONHSAT245258.1, NONHSAT 017317.2, NONHSAT239778.1, NONHSAT189782.1, and NONHSAT 243639.1和1个关键的miRNA即hsa-miR-92b-5p,并对它们进行了RT-qPCR验证,验证结果大致符合预期(图 3B)。
|
| A:ceRNA网络构建图,四边形代表lncRNAs,箭头代表miRNAs,圆形代表mRNAs,红色代表上调,绿色代表下调;B:lncRNAs和miRNAs的qPCR验证结果(x±s);a: P<0.05, b: P<0.01, d: P<0.0001, 与PIG1比较 图 3 CeRNA网络和lncRNAs、miRNAs的qPCR验证结果 |
2.4 CeRNA子网络的预测及富集
为了更深入挖掘LncRNA -miRNA-mRNA之间的“对话”机制,我们对7个关键LncRNAs均进行了富集,通过对富集的结果分析,最后筛选出分子功能和信号通路富集最丰富的3个LncRNAs(ENST0000 623111、NONHSAT245258.1和NONHSAT189782.1)并可视化其对应的CeRNA子网络(图 4A、B、C)。针对CeRNA子网络中的编码基因,我们分别从GO和KEGG富集来了解它们的功能。从富集的注释结果来看,这些基因对应的分子功能主要参与神经元分化的正调控、离子通道调节器活性、含胶原的细胞外基质、局灶黏附过程(图 4D~F)。对应的信号通路在VEGF信号通路、ECM-受体相互作用、MAPK信号通路和P13K-Akt信号等高度富集(图 4G~I)。

|
| A~C分别为3个CeRNA子网络,红色代表lncRNA,绿色代表miRNA,蓝色代表mRNA;D~F:对应于3个CeRNA子网的top10 GO富集结果;G~I:对应于3个CeRNA子网的top20 KEGG富集结果 图 4 3个CeRNA子网络及其相应的GO和KEGG富集分析 |
3 讨论
白癜风的发病机制主要包括天然免疫的激活、炎症体的激活、氧化应激和黑素细胞粘附的丧失[8],与白癜风发病相关的信号通路包括Wnt/β-catenin信号通路、Nrf2信号通路、PI3K-Akt信号通路,JAK-STAT信号通路[7, 9-11]。与白癜风发病相关的分子则更为广泛。
在我们构建的PPI网络中,top10枢纽基因中的JUN、HIST2H3PS2、SOX2和EGR1编码核蛋白,它们大多在基因的转录水平对其进行调控。其中,JUN是AP-1转录因子,被报道参与白癜风患者氧化应激和黑素生成的调节[12-13]。SOX2编码的蛋白被报道可能是参与黑素细胞发育过程的转录因子[14]。EGR1-STAT3轴被证明调节黑素细胞中α-黑素细胞刺激素诱导的酪氨酸酶基因的转录[15]。另外,其他一些枢纽基因在白癜风相关的研究中也被报道过,其中的HSPA5是HSP70家族的成员,突变HSP70被证明可以逆转白癜风患者自身免疫脱色[16-17]。BMP2被证明与色素沉着过程有关,它降低了表皮黑素细胞中酪氨酸酶的表达和活性[18]。MMP9被证明可以调节黑素细胞的迁移[19]。此外,EDN1、SERPINE1和NGF也被提出参与白癜风的发生发展[20-22],但具体机制需要进一步研究。综上所述,这些枢纽基因可能对白癜风黑素细胞的功能有重要影响。
既往报道中,关于ncRNAs在白癜风发生发展中的作用研究相对较少。近年来的积累证据表明,lncRNAs在各种疾病中广泛表达并在基因调控中起关键作用[23]。本研究也观察到一些LncRNAs在白癜风黑素细胞中差异表达显著。我们预测了3个候选LncRNAs (ENST0000623111,NONHSAT245258.1,NONHSAT189782.1),在其对应的CeRNA子网络中,hsa-miR-92b-5的表达量显著降低,并且与网络中的多个基因有相互作用。先前有少数研究证实hsa-miR-92b-5p在非综合征性单纯腭裂患者中表达下调[24],以及在房颤患者中表达明显改变[25],这些证据表明hsa-miR-92b-5p在白癜风黑素细胞中可能是有潜力的调控因子。另外,GO分析显示,CeRNA子网络中的编码基因参与了白癜风发病的重要途径,如参与细胞外基质(ECM)的形成过程,白癜风的色素沉着需要依赖于此过程[26];如影响钙离子通道的功能,通过影响线粒体钙的累积在氧化应激诱导的黑素细胞凋亡中起关键作用[27]。KEGG富集分析还显示,上述基因在MAPK信号转导途径、EMC受体相互作用,VEGF信号转导途径和粘附等过程中高度富集,其中MAPK信号都被研究证明参与调控黑素细胞的生存[28],粘着斑,VEGF信号转导途径和EMC受体信号也都被报道参与了白癜风发病过程[29-31]。这些结果为白癜风研究提供了理论支持,即lncRNAs、miRNAs可能在白癜风黑素细胞神秘消失涉及的生物过程和信号转导中扮演重要作用。
综上所述, 本研究筛选的Hub基因及ncRNAs可能为白癜风的发病机制提供新见解。同时, 基于本课题研究方法可操作性以及生物信息学技术的科学性, 可以为研究者提供新的研究思路和理论支持。除此之外,研究的样本相对较少给本研究带来了一定的局限性,在更深入的功能探索研究中,需要加大样本量以进一步验证ncRNA在白癜风中的重要作用。
| [1] |
WANG Y, LI S, LI C. Perspectives of new advances in the pathogenesis of vitiligo: from oxidative stress to autoimmunity[J]. Med Sci Monit, 2019, 25: 1017-1023. |
| [2] |
SHANG Z, LI H. Altered expression of four miRNA (miR-1238-3p, miR-202-3p, miR-630 and miR-766-3p) and their potential targets in peripheral blood from vitiligo patients[J]. J Dermatol, 2017, 44(10): 1138-1144. |
| [3] |
VAISH U, KUMAR A A, VARSHNEY S, et al. Micro RNAs upregulated in vitiligo skin play an important role in its aetiopathogenesis by altering TRP1 expression and keratinocyte-melanocytes cross-talk[J]. Sci Rep, 2019, 9(1): 10079. |
| [4] |
ZHU Z W, MA Y Y, LI Y, et al. The comprehensive detection of miRNA, lncRNA, and circRNA in regulation of mouse melanocyte and skin development[J]. Biol Res, 2020, 53(1): 4. |
| [5] |
LE POOLE I C, BOISSY R E, SARANGARAJAN R, et al. PIG3V, an immortalized human vitiligo melanocyte cell line, expresses dilated endoplasmic reticulum[J]. In Vitro Cell Dev Biol Anim, 2000, 36(5): 309-319. |
| [6] |
LE POOLE I C, VAN DEN BERG F M, VAN DEN WIJNGAARD R M, et al. Generation of a human melanocyte cell line by introduction of HPV16 E6 and E7genes[J]. In Vitro Cell Dev Biol Anim, 1997, 33(1): 42-49. |
| [7] |
MA J, LI S, ZHU L, et al. Baicalein protects human vitiligo melanocytes from oxidative stress through activation of NF-E2-related factor 2 (Nrf2) signaling pathway[J]. Free Radic Biol Med, 2018, 129: 492-503. |
| [8] |
SPEECKAERT R, VAN GEEL N. Vitiligo: an update on pathophysiology and treatment options[J]. Am J Clin Dermatol, 2017, 18(6): 733-744. |
| [9] |
KIM N H, LEE A Y. Reduced aquaporin 3 expression and survival of keratinocytes in the depigmented epidermis of vitiligo[J]. J Invest Dermatol, 2010, 130(9): 2231-2239. |
| [10] |
MONTILLA A M, GÓMEZ-GARCÍA F, GÓMEZ-ARIAS P J, et al. Scoping review on the use of drugs targeting JAK/STAT pathway in atopic dermatitis, vitiligo, and alopecia areata[J]. Dermatol Ther (Heidelb), 2019, 9(4): 655-683. |
| [11] |
SASTRY K S, NAEEM H, MOKRAB Y, et al. RNA-seq reveals dysregulation of novel melanocyte genes upon oxidative stress: implications in vitiligo pathogenesis[J]. Oxid Med Cell Longev, 2019, 2019: 2841814. |
| [12] |
KIM Y M, CHO S E, KIM S C, et al. Effects of extremely low frequency electromagnetic fields on melanogenesis through p-ERK and p-SAPK/JNK pathways in human melanocytes[J]. Int J Mol Sci, 2017, 18(10): 1-16. |
| [13] |
LIN M, LU SS, WANG A X, et al. Apigenin attenuates dopamine-induced apoptosis in melanocytes via oxidative stress-related p38, c-Jun NH2-terminal kinase and Akt signaling[J]. J Dermatol Sci, 2011, 63(1): 10-16. |
| [14] |
LAGA A C, LAI C Y, ZHAN Q, et al. Expression of the embryonic stem cell transcription factor SOX2 in human skin: relevance to melanocyte and merkel cell biology[J]. Am J Pathol, 2010, 176(2): 903-913. |
| [15] |
SHIN S Y, CHOI J H, JUNG E, et al. The EGR1-STAT3 transcription factor axis regulates α-melanocyte-stimulating hormone-inducedtyrosinase gene transcription in melanocytes[J]. J Investig Dermatol, 2019, 139(7): 1616-1619. |
| [16] |
JACQUEMIN C, RAMBERT J, GUILLET S, et al. Heat shock protein 70 potentiates interferon alpha production by plasmacytoid dendritic cells: relevance for cutaneous lupus and vitiligo pathogenesis[J]. Br J Dermatol, 2017, 177(5): 1367-1375. |
| [17] |
MOSENSON J A, ZLOZA A, NIELAND J D, et al. Mutant HSP70 reverses autoimmune depigmentation in vitiligo[J]. Sci Transl Med, 2013, 5(174): 174ra28. |
| [18] |
SINGH S K, ABBAS W A, TOBIN D J. Bone morphogenetic proteins differentially regulate pigmentation in human skin cells[J]. J Cell Sci, 2012, 125(pt 18): 4306-4319. |
| [19] |
SU M Y, MIAO F, JIANG S, et al. Role of the p53-TRPM1/miR-211-MMP9 axis in UVB-induced human melanocyte migration and its potential in repigmentation[J]. Int J Mol Med, 2020, 45(4): 1017-1026. |
| [20] |
VIDAL YUCHA S E, TAMAMOTO K A, KAPLAN D L. The importance of the neuro-immuno-cutaneous system on human skin equivalent design[J]. Cell Prolif, 2019, 52(6): e12677. |
| [21] |
AGIRBASLI M, EREN M, YASAR S, et al. Functionally stable plasminogen activator inhibitor-1 in a family with cardiovascular disease and vitiligo[J]. J Thromb Thrombolysis, 2014, 38(1): 50-56. |
| [22] |
LAN C C, KO Y C, TU H P, et al. Association study between keratinocyte-derived growth factor gene polymorphisms and susceptibility to vitiligo vulgaris in a Taiwanese population: potential involvement of stem cell factor[J]. Br J Dermatol, 2009, 160(6): 1180-1187. |
| [23] |
STATELLO L, GUO C J, CHEN L L, et al. Gene regulation by long non-coding RNAs and its biological functions[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 96-118. |
| [24] |
SCHOEN C, GLENNON J C, ABGHARI S, et al. Differential microRNA expression in cultured palatal fibroblasts from infants with cleft palate and controls[J]. Eur J Orthod, 2018, 40(1): 90-96. |
| [25] |
HOFFMANN S, CLAUSS S, BERGER I M, et al. Coding and non-coding variants in the SHOX2 gene in patients with early-onset atrial fibrillation[J]. Basic Res Cardiol, 2016, 111(3): 36. |
| [26] |
SRIVASTAVA N, BISHNOI A, MEHTA S, et al. Aberrant ETS-1signalling impedes the expression of cell adhesion molecules and matrix metalloproteinases in non-segmental vitiligo[J]. Exp Dermatol, 2020, 29(6): 539-547. |
| [27] |
KANG P, ZHANG W, CHEN X, et al. TRPM2 mediates mitochondria-dependent apoptosis of melanocytes under oxidative stress[J]. Free Radic Biol Med, 2018, 126: 259-268. |
| [28] |
SASTRY K S, IBRAHIM W N, CHOUCHANE A I. Multiple signaling pathways converge on proapoptotic protein BAD to promote survival of melanocytes[J]. Faseb J, 2020, 34(11): 14602-14614. |
| [29] |
WANG P, LI Y, NIE H, et al. The changes of gene expression profiling between segmental vitiligo, generalized vitiligo and healthy individual[J]. J Dermatol Sci, 2016, 84(1): 40-49. |
| [30] |
ALMASI-NASRABADI M, AMOLI M M, ROBATI R M, et al. Is the+405 G/C single nucleotide polymorphism of the vascular endothelial growth factor (VEGF) gene associated with late-onset vitiligo?[J]. Int J Immunogenet, 2019, 46(4): 241-246. |
| [31] |
IVANOVA K, LAMBERS B, VAN DEN WIJNGAARD R, et al. Immortalization of human melanocytes does not alter the de novo properties of nitric oxide to induce cell detachment from extra cellular matrix components via cGMP[J]. In Vitro Cell Dev Biol Anim, 2008, 44(8/9): 385-395. |




