2. 610083 成都, 中国人民解放军西部战区总医院: 重症医学科;
3. 610083 成都, 中国人民解放军西部战区总医院: 心内科
2. Department of Intensive Care Medicine, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China;
3. Department of Cardiology, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083, China
随着医疗水平的不断发展和进步,ICU危重症患者的早期救治成功率得到了显著提高,病死率明显下降。但危重症患者在疾病中后期的致残率和致死率并未进一步得到改善,这与多数危重症患者在中后期并发ICU获得性衰弱(ICU-acquired weakness, ICU-AW)有关[1]。ICU-AW是指危重症特别是严重创伤患者在疾病进程中出现的以神经肌肉功能障碍为病理基础、以全身疲乏无力为临床表现的综合征[2]。同时大量研究表明,在导致ICU-AW发展的众多危险因素中,脓毒症对ICU-AW的发生和发展起着关键作用[3]。无论患者是否被临床诊断为脓毒症,与脓毒症相同的生物学特征都能预测ICU-AW[4]。故目前针对ICU-AW发病机制的探索常常以脓毒症引发的肌肉萎缩为切入点进行研究。
细胞焦亡(pyroptosis)是一种新型的程序化细胞死亡方式[5]。最初,ZYCHLINSKY等[6]报道在已感染的巨噬细胞中首先观察到细胞焦亡,并因它有某些相似特征而将其称为细胞凋亡。后来进一步研究发现,它其实并不不同于细胞凋亡。直到2001年才正式将caspase-1依赖性细胞死亡命名为“细胞焦亡”[7]。细胞焦亡又被称为细胞炎性坏死,是一种由病原体感染或其他危险信号触发的、与炎症反应相关的新型程序化细胞死亡方式,其主要特征是细胞的肿胀、裂解导致胞质内容物释放。适当的细胞焦亡在宿主抵御外来病原微生物感染时有重要作用,它可保护宿主免受入侵致病菌及微生物的感染。然而,细胞焦亡过度激活也会引起脓毒症和脓毒性休克[8]。我国邵峰院士及其团队在2015年首次提出:GSDMD (gasdermin D)蛋白是细胞焦亡机制中的关键执行者[9]。他们通过研究证实:脂多糖(LPS)直接刺激激活非经典细胞焦亡途径或三磷酸腺苷(ATP)等物质作用各种炎性小体后激活的经典细胞焦亡途径均能使下游特定的Caspase活化, 其中Caspase-1的激活不仅能切割IL-1β和IL-18前体,使其转变为成熟的IL-1β、IL-18释放到胞外,而且能诱导GSDMD分解形成GSDMD氨基末端(gasdermin D-NT)转移到细胞膜上形成有活性的孔隙,该孔隙一方面允许成熟的IL-1β和IL-18释放,另一方面使得水分子等物质进入细胞内而引起细胞的肿胀裂解,最终导致细胞死亡。越来越多的研究表明GSDMD参与诸多炎症反应性疾病的发生、发展[10],然而,目前GSDMD介导的细胞焦亡在ICU-AW中的作用机制尚不清楚。
目前研究认为,ICU-AW病理生理机制可能包括[11]:①炎性细胞因子分泌增加、细胞缺血缺氧;②线粒体功能障碍引起氧化应激增强;③横纹肌细胞钙离子稳态失衡引起兴奋-收缩偶联改变等。但目前ICU获得性衰弱的发病机制在国际上尚未被明确定义,故在临床工作中尚缺乏针对性的治疗和预防措施[1]。我们前期通过盲肠结扎穿孔手术模拟脓毒症相关危重症肌病模型,发现与假手术组相比,手术组骨骼肌肌纤维横截面积显著减小,骨骼肌组织中萎缩基因的表达水平明显增加,说明大鼠脓毒症相关危重症肌病模型建立成功。通过检测其骨骼肌组织中NLRP3、Caspase-1、IL-18、IL-1β mRNA及蛋白的表达,发现手术组的含量显著高于假手术组。由此推测,NLRP3炎性小体及其下游细胞焦亡相关炎症因子可能参与危重症肌病的发生。而NLRP3炎性小体下游GSDMD蛋白介导的细胞焦亡如何导致脓毒症相关危重症肌病的发生发展还需进一步探索。基于此,本研究旨在探讨炎症刺激下骨骼肌肌管中肌肉萎缩和GSDMD介导的细胞焦亡发生情况,以期为进一步阐明ICU-AW的发病机制提供线索。
1 材料与方法 1.1 材料(实验对象、主要试剂和仪器)C2C12小鼠骨骼肌细胞系购自美国ATCC细胞库,DMEM(高糖)培养基、胎牛血清(FBS)、供体马血清、青霉素-链霉素溶液和磷酸盐缓冲液(PBS)购自美国HyClone公司,细胞培养瓶购自美国Corning公司,脂多糖(LPS,L2880)和腺苷-三磷酸二钠盐水合物(ATP,A7699)购自美国Sigma公司,RIPA裂解液和BCA蛋白定量试剂盒购自中国碧云天生物技术研究所,MHC、Myogenin、HDAC1、GSDMD和β-actin一抗购自美国Abcam公司,辣根过氧化物酶标记二抗购自北京中杉金桥生物技术有限公司。实时定量PCR(realtime quantitative PCR, RT-QPCR)试剂盒/SYBR Green Realtime PCR Master Mix购自美国Invitrogen公司,总RNA提取试剂盒购自北京天根生化科技有限公司。Atrogin-1、MuRF-1和IL-18的引物购于大连宝生物科技有限公司,IL-18 ELISA检测试剂盒购自深圳欣博盛生物科技有限公司。
实验主要仪器:细胞培养孵箱(美国Thermo公司)、倒置显微镜(日本Olympus公司)、全自动酶标仪(美国Tecan公司)、PCR仪(Bio-Rad公司,型号:BS97MyCycler)、Western blot电泳仪(Bio-Rad公司,型号:1658001)、ChemiDoc MP凝胶成像分析系统(Bio-Rad公司)。
1.2 方法及检测指标 1.2.1 小鼠骨骼肌肌管分化及培养将C2C12小鼠骨骼肌成肌细胞培养在含10%胎牛血清的DMEM高糖培养基中, 置于37 ℃、5%CO2的湿化培养箱中培养,直至细胞融合度达到80%~90%,更换含有2%马血清的DMEM分化培养基,每天换液1次直至第5天肌管形成[12]。
1.2.2 实验分组及处理将分化完成的肌管分为3组:① Control组:已分化肌管的培养基中加入无菌PBS溶液;② LPS组:分别以LPS(1、10、100 μg/mL)干预肌管;③ LPS+ATP组:以LPS组相同浓度梯度干预肌管后均添加ATP(5 mmol/L)刺激30 min。并分别在LPS干预6 h和12 h这两个时间点检测肌管内外发生的变化。LPS单独刺激仅激活细胞焦亡非经典途径,此处ATP的加入与激活细胞焦亡经典途径相关。
1.2.3 肌管形成标志蛋白MHC、Myogenin、HDAC1[13]及细胞焦亡标志蛋白GSDMD[14]检测采用蛋白质免疫印迹试验(Western blot)检测各组干预的肌管中MHC、Myogenin、HDAC1、GSDMD蛋白表达,以LPS干预12 h时间点为代表。裂解肌管提取总蛋白,采用BCA法进行蛋白定量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭后,加入一抗、二抗,洗膜后电化学发光(ECL)增强发光,电化学凝胶成像系统显影。
1.2.4 肌管萎缩基因Atrogin-1、MuRF-1及细胞焦亡相关炎性因子IL-18 mRNA表达量检测Atrogin-1和MuRF-1mRNA的相对表达上调是肌萎缩标志[15]。采用荧光定量PCR检测各组肌管中Atrogin-1、MuRF-1、IL-18 mRNA表达量。提取各组肌管中RNA,离心,RNA洗涤、再溶解和总RNA纯度及浓度测定。最后进行引物设计及PCR反应,见表 1。
| 基因 | 引物 | 片段大小/bp |
| Atrogin-1 | 5′-TGCTGGTGGGCAACATTAAC-3′ 5′-TTCCACAGTAGCCGGTCCTC-3′ |
238 |
| MuRF-1 | 5′-TGACCAAGGAGAATAGCCACC-3′ 5′-GTTCTCAAAGCCTTGCTCTGTC-3′ |
323 |
| IL-18 | 5′-CATGTCAGAAGACTCTTGCGTCAA-3′ 5′-GAGGGTCACAGCCAGTCCTCTT-3′ |
286 |
| β-actin | 5′-GTGACGTTGACATCCGTAAAGA-3′ 5′-GTAACAGTCCGCCTAGAAGCAC-3′ |
287 |
1.2.5 各肌管培养上清中细胞焦亡相关炎性因子IL-18浓度检测
采用ELISA法测定肌管培养上清中炎性因子IL-18浓度,操作按试剂盒说明书步骤进行。
1.3 统计学分析使用GraphPad Prism v8和SPSS 20.0统计软件进行制图及数据分析。实验数据以x±s示,计量资料组间比较采用单因素方差分析,组间多重比较采用Tukey post hoc检验。检验水准α=0.05。
2 结果 2.1 小鼠骨骼肌肌管分化及培养结果将C2C12小鼠骨骼肌细胞系在含10%胎牛血清的DMEM高糖培养基中培养时,400倍和1000倍光镜下可见细胞呈不规则的成纤维细胞样(图 1左)。细胞生长融合至80%~90%,更换含有2%马血清的DMEM分化培养基,每天换液1次直至第5天可见肌管形成(图 1右)。
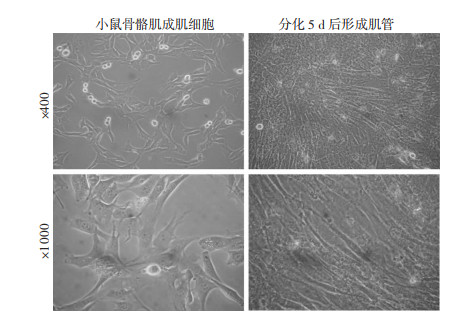
|
| 图 1 光镜观察小鼠骨骼肌肌管形成 |
2.2 肌管形成标志蛋白检测结果
采用蛋白质免疫印迹试验(Western blot)检测后可见,各组干预的肌管中肌管形成的标志蛋白MHC、Myogenin、HDAC1均能稳定表达。结果见图 2。
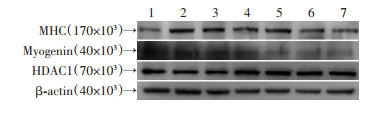
|
| 1:Control组;2:LPS(1 μg/mL)干预组;3:LPS(10 μg/mL)干预组;4:LPS(100 μg/mL)干预组;5:LPS(1 μg/mL)+ ATP(5 mmol/L)干预组;6:LPS(10 μg/mL)+ATP(5 mmol/L)干预组;7:LPS(100 μg/mL)+ATP(5 mmol/L)干预组 图 2 Western blot检测各分组中肌管形成标志蛋白MHC、Myogenin、HDAC1表达 |
2.3 肌管干预后萎缩基因Atrogin-1 mRNA表达量
如图 3示,各组肌管中Atrogin-1 mRNA表达量在LPS干预12 h后明显比干预6 h高,且在LPS干预时间同为12 h的各组中,与12 h Control组相比,LPS(1 μg/mL)干预组、LPS(1 μg/mL)+ATP(5 mmol/L)干预组和LPS(100 μg/mL)+ ATP(5 mmol/L)干预组3组肌管中Atrogin-1 mRNA表达量相对较高,差异有统计学意义(P < 0.05),同时各干预浓度分别在LPS组和LPS+ATP组内比较差异有统计学意义(P < 0.05)。
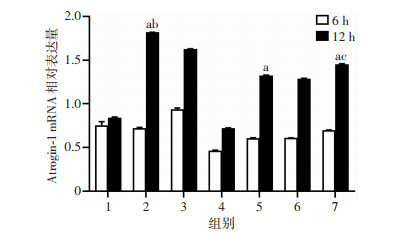
|
| 1:Control组;2:LPS(1 μg/mL)干预组;3:LPS(10 μg/mL)干预组;4:LPS(100 μg/mL)干预组;5:LPS(1 μg/mL)+ ATP(5 mmol/L)干预组;6:LPS(10 μg/mL)+ATP(5 mmol/L) 干预组;7:LPS(100 μg/mL)+ATP(5 mmol/L)干预组;a: P < 0.05, 与Control组比较;b: P < 0.05, 与LPS(10 μg/mL)组比较;c: P < 0.05, 与LPS(10 μg/mL)+ATP(5 mmol/L)干预组比较 图 3 各组肌管干预后萎缩基因Atrogin-1 mRNA表达量 |
2.4 肌管干预后萎缩基因MuRF-1 mRNA表达量
与上述萎缩基因Atrogin-1 mRNA表达趋势相同,LPS干预12 h后MuRF-1 mRNA表达量明显比干预6 h高;在LPS干预时间同为12 h的各组中,与Control组相比,LPS(1 μg/mL)干预组和LPS(1 μg/mL)+ATP(5 mmol/L)干预组,两组肌管中MuRF-1 mRNA表达量相对较高,差异有统计学意义(P < 0.05);在所有分组中12 h LPS(1 μg/mL)干预组表达量最高,与12 h LPS(10 μg/mL)干预组比较差异也具有统计学意义(P < 0.05,图 4)。
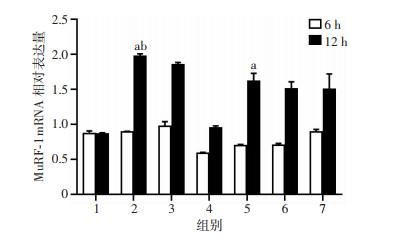
|
| 1:Control组;2:LPS(1 μg/mL)干预组;3:LPS(10 μg/mL)干预组;4:LPS(100 μg/mL)干预组;5:LPS(1 μg/mL)+ ATP(5 mmol/L)干预组;6:LPS(10 μg/mL)+ATP(5 mmol/L) 干预组;7:LPS(100 μg/mL)+ATP(5 mmol/L)干预组;a: P < 0.05, 与Control组比较;b: P < 0.05, 与LPS(10 μg/mL) 干预组比较 图 4 各组肌管干预后萎缩基因MuRF-1 mRNA表达量 |
2.5 各组肌管干预后细胞焦亡相关炎性因子IL-18在肌管内外的表达量
各组干预肌管中IL-18 mRNA表达趋势与萎缩基因(Atrogin-1和MuRF-1)表达趋势相同,在12 h LPS(1 μg/mL)干预组和12 h LPS(1 μg/mL)+ATP(5 mmol/L)干预组,两组肌管中IL-18 mRNA表达量相对较高,且两组肌管分别与Control组比较差异有统计学意义(P < 0.05,图 5A)。在LPS干预时间为6 h的各组肌管培养上清中IL-18浓度与Control组比较差异无统计学意义,结果见图 5B。延长LPS干预时间至12 h后,干预组肌管培养上清中IL-18浓度较Control组显著升高,差异有统计学意义(P < 0.05,图 5C)。
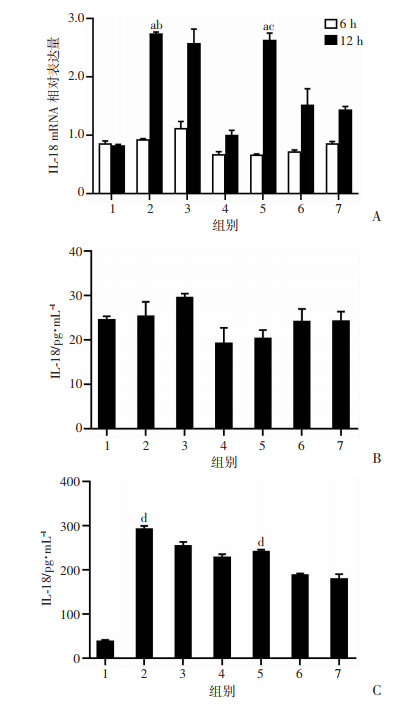
|
| 1:Control组;2:LPS(1 mg/mL)干预组;3:LPS(10 mg/mL)干预组;4:LPS(100 mg/mL)干预组;5:LPS(1 mg/mL)+ ATP(5 mmol/L)干预组;6:LPS(10 mg/mL)+ATP(5 mmol/L) 干预组;7:LPS(100 mg/mL)+ATP(5 mmol/L)干预组;a: 与12 h Control组比较,;b: P < 0.05,与12 h LPS(10 mg/mL) 干预组比较;c: P < 0.05, 与LPS(10 mg/mL)+ATP(5 mmol/L) 干预组比较;d: P < 0.05, 与Control组比较A:LPS干预6 h和12 h肌管内IL-18 mRNA表达量;B: LPS干预6 h肌管培养液IL-18浓度变化;C: LPS干预12 h肌管培养液IL-18浓度变化 图 5 各组肌管干预后炎性因子IL-18在肌管内外的表达量 |
2.6 细胞焦亡标志蛋白GSDMD蛋白检测结果
如图 6显示,LPS组在LPS浓度梯度干预下GSDMD蛋白表达量较Control组显著增加,增加ATP干预后GSDMD蛋白表达量较Control组也显著增加,但略小于LPS组。

|
| 1:Control组;2:LPS(1 μg/mL)干预组;3:LPS(10 μg/mL)干预组;4:LPS(100 μg/mL)干预组;5:LPS(1 μg/mL)+ ATP(5 mmol/L)干预组;6:LPS(10 μg/mL)+ATP(5 mmol/L) 干预组;7:LPS(100 μg/mL)+ATP(5 mmol/L)干预组;a: P < 0.05, 与Control组比较 图 6 各组干预肌管中GSDMD蛋白表达水平 |
3 讨论
ICU-AW是危重症患者的常见并发症,不仅影响患者的预后,严重降低了危重症幸存者的生活质量,延长ICU治疗和患者康复时间,并在世界范围内大大增加了重症监护治疗的成本[16-17]。但目前ICU获得性衰弱的发病机制尚未明确,在临床工作中尚缺乏有效的治疗和预防措施,故开展针对性研究并进一步阐明ICU-AW发病机制非常必要[18]。
前期研究中我们发现:危重症肌病是危重症患者发生ICU获得性衰弱最常见的表型,主要表现为横纹肌肌肉萎缩伴不同程度横纹肌细胞坏死,在普通ICU人群中占25%~58%,在某些亚群中占50%~100%[19-20]。故本研究以小鼠骨骼肌肌管为主要研究对象,在体外环境下,模拟危重症脓毒症患者肌体内LPS对骨骼肌的影响,观察骨骼肌肌管萎缩基因的表达。本研究发现,各分组实施干预前均首先完成小鼠骨骼肌肌管的分化及培育,其中Myogenin蛋白在LPS刺激后蛋白表达量略下降,这与ONO等[21]在肌管分化研究中所述结果相符,对肌管鉴定结果无影响。GRIFFITH等[22]发现,对出院时机械通气>48 h的72 223例ICU幸存者进行随访,于出院时抽血检测C反应蛋白(CRP)、人类嗜中性粒细胞弹性蛋白酶(HNE)、IL-1β、IL-6、分泌白细胞蛋白酶抑制剂(SLPI)等。结果显示多数患者3个月后出现持续性炎症反应(CRP >3 mg/Lin 59%;>10 mg /Lin 28%,促炎表型HNE、IL-6、IL-8、SLPI升高),推断危重症后全身炎症反应持续存在可能是ICU出院后3个月内身体恢复不良、肌肉萎缩的直接原因。而本研究中发现,在LPS/LPS+ATP刺激下小鼠骨骼肌肌管中Atrogin-1和MuRF-1 mRNA表达上调,说明炎性刺激下骨骼肌肌管发生萎缩,进一步在体外验证了国外研究者这一结论。同时,若以萎缩基因Atrogin-1和MuRF-1 mRNA表达量及肌管干预后受损程度为参考,本研究证实,小鼠骨骼肌肌管萎缩的最适干预条件为LPS 1 μg/mL(12 h)或LPS 1 μg/mL(12 h)+ATP 5 mmol/L(30 min),这为后续肌肉萎缩的研究提供了重要依据。
在验证了炎症与骨骼肌肌管萎缩的相关性后,本研究进一步探讨了细胞焦亡在骨骼肌萎缩过程中的影响。我们发现,在LPS/LPS+ATP炎性刺激下,小鼠骨骼肌肌管内细胞焦亡相关的标志性蛋白GSDMD表达显著升高。LPS干预12 h时各干预组(LPS组/LPS+ATP组)肌管中Atrogin-1、MuRF-1及IL-18 mRNA表达量较6 h时明显升高,而肌管培养液IL-18浓度在LPS干预12 h时也显著增加,说明该时间点的干预促进了肌管中IL-18的成熟及释放。IL-18这一细胞焦亡相关的炎性因子在肌管内和外的表达趋势进一步说明:LPS刺激下,肌管中不仅发生了细胞焦亡,且细胞焦亡的严重程度与肌管萎缩基因的表达量相关,进一步为炎症所致肌肉萎缩的发生机制提供理论依据。
越来越多的研究表明,细胞焦亡参与诸多炎症反应性疾病的发生、发展[23-26],但目前GSDMD介导的细胞焦亡在脓毒症相关性肌萎缩的作用机制研究中尚少见报道。本研究证实,以GSDMD表达为特征的细胞焦亡机制参与了脓毒症相关性肌萎缩。其中细胞焦亡对骨骼肌肌管中Atrogin-1和MuRF-1表达上调的机制可能有以下几个方面:一方面考虑与肌管蛋白稳态平衡的破坏有关。DOYLE等[27]研究者发现Tlr4介导的LPS信号通路通过协同激活泛素蛋白酶体和自噬通路可诱导肌肉分解代谢。泛素蛋白酶体系统(the ubiquitin proteasome system,UPS)是肌肉蛋白水解的主要调节因子,有研究表明,在危重症(脓毒症)动物模型中,以及在肌肉损失急性期的危重症患者中,UPS活性增加[2, 28]。其中关键的调控蛋白是泛素蛋白连接酶Atrogin-1和MuRF-1。在早期危重疾病中,FoxO1和FoxO3的表达被诱导,主要表现在Atrogin-1和MuRF-1 mRNA表达以及各自的蛋白表达上调[29]。另一方面,细胞焦亡对骨骼肌肌管萎缩的影响可能与LPS抑制肌再生相关。ONO等[21]研究者已证实:LPS可通过剂量依赖性下调肌生成蛋白(myogenin)和MyoD的表达,上调肌生成抑制素(myostatin)的表达。Myostatin过表达可通过激活FoxO1机制激活泛素蛋白酶体途径使Atrogin-1和MuRF-1表达上调,并促进肌肉质量的丧失和恶病质[30]。虽然肌生成抑制素的诱导被怀疑参与了ICU-AW相关的肌肉萎缩,但目前尚未在危重病人中得到证实[31]。因此,细胞焦亡在骨骼肌肌管中的作用机制还有待进一步研究,本研究的结果有望为ICU危重症肌病发病机制的探索提供潜在研究方向。
本研究存在一定局限性:尽管我们发现炎症刺激下细胞焦亡参与骨骼肌肌管萎缩过程,但尚未明确组织间炎性细胞是否加重骨骼肌肌管炎症反应。此外,本课题组正在进行的在体水平研究,将进一步阐明ICU获得性危重症肌病的发病机制。
综上,本研究发现LPS刺激下小鼠骨骼肌肌管中可发生细胞焦亡,导致肌管萎缩,为后续脓毒症相关ICU获得性危重症肌病的发病机制研究奠定基础。
| [1] |
VANHOREBEEK I, LATRONICO N, VAN DEN BERGHE G. ICU-acquired weakness[J]. Intens Care Med, 2020, 46(4): 637-653. |
| [2] |
FRIEDRICH O, REID M B, VAN DEN BERGHE G, et al. The Sick and the weak: Neuropathies/myopathies in the critically ill[J]. Physiol Rev, 2015, 95(3): 1025-1109. |
| [3] |
DE JONGHE B, LACHERADE J C, SHARSHAR T, et al. Intensive care unit-acquired weakness: risk factors and prevention[J]. Crit Care Med, 2009, 37(10 Suppl): S309-S315. |
| [4] |
STEVENS R D, ZINK E K. Inflammatory signatures in ICU- acquired weakness[J]. Crit Care Med, 2017, 45(6): 1098-1100. |
| [5] |
XU B, JIANG M Z, CHU Y, et al. Gasdermin D plays a key role as a pyroptosis executor of non-alcoholic steatohepatitis in humans and mice[J]. J Hepatol, 2018, 68(4): 773-782. |
| [6] |
ZYCHLINSKY A, PREVOST M C, SANSONETTI P J. Shigella flexneri induces apoptosis in infected macrophages[J]. Nature, 1992, 358(6382): 167-169. |
| [7] |
COOKSON B T, BRENNAN M A. Pro-inflammatory programmed cell death[J]. Trends Microbiol, 2001, 9(3): 113-114. |
| [8] |
PFALZGRAFF A, HEINBOCKEL L, SU Q, et al. Synthetic anti-endotoxin peptides inhibit cytoplasmic LPS-mediated responses[J]. Biochem Pharmacol, 2017, 140: 64-72. |
| [9] |
SHI J J, ZHAO Y, WANG K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665. |
| [10] |
ZHENG Z, LI G. Mechanisms and therapeutic regulation of pyroptosis in inflammatory diseases and cancer[J]. Int J Mol Sci, 2020, 21(4): 1456. |
| [11] |
TANG H B, SHRAGER J B. The signaling network resulting in ventilator-induced diaphragm dysfunction[J]. Am J Respir Cell Mol Biol, 2018, 59(4): 417-427. |
| [12] |
YAO X, YU T, ZHAO C, et al. Evodiamine promotes differentiation and inhibits proliferation of C2C12 muscle cells[J]. Int J Mol Med, 2018, 41(3): 1627-1634. |
| [13] |
ZHAO M J, XIE J, SHU W J, et al. MiR-15b and miR-322 inhibit SETD3 expression to repress muscle cell differentiation[J]. Cell Death Dis, 2019, 10(3): 183. |
| [14] |
XIA S, HOLLINGSWORTH LRT, WU H. Mechanism and regulation of gasdermin-mediated cell death[J]. Cold Spring Harb Perspect Biol, 2020, 12(3). |
| [15] |
WOLLERSHEIM T, WOEHLECKE J, KREBS M, et al. Dynamics of myosin degradation in intensive care unit-acquired weakness during severe critical illness[J]. Intens Care Med, 2014, 40(4): 528-538. |
| [16] |
HERRIDGE M S, CHU L M, MATTE A, et al. The RECOVER program: disability risk groups and 1-year outcome after 7 or more days of mechanical ventilation[J]. Am J Respir Crit Care Med, 2016, 194(7): 831-844. |
| [17] |
JOLLEY S E, BUNNELL A E, HOUGH C L. ICU-Acquired weakness[J]. Chest, 2016, 150(5): 1129-1140. |
| [18] |
BATT J, HERRIDGE M S, DOS SANTOS C C. From skeletal muscle weakness to functional outcomes following critical illness: a translational biology perspective[J]. Thorax, 2019, 74(11): 1091-1098. |
| [19] |
STEVENS R D, MARSHALL S A, CORNBLATH D R, et al. A framework for diagnosing and classifying intensive care unit-acquired weakness[J]. Crit Care Med, 2009, 37(10 Suppl)): S299-S308. |
| [20] |
FRIEDRICH O, FINK R H, HUND E. Understanding critical illness myopathy: approaching the pathomechanism[J]. J Nutr, 2005, 135(7): 1813S-1817S. |
| [21] |
ONO Y, SAKAMOTO K. Lipopolysaccharide inhibits myogenic differentiation of C2C12 myoblasts through the Toll-like receptor 4-nuclear factor-κB signaling pathway and myoblast-derived tumor necrosis factor-Α[J]. PLoS ONE, 2017, 12(7): e0182040. |
| [22] |
GRIFFITH D M, LEWIS S, ROSSI A G, et al. Systemic inflammation after critical illness: relationship with physical recovery and exploration of potential mechanisms[J]. Thorax, 2016, 71(9): 820-829. |
| [23] |
KAYAGAKI N, STOWE I B, LEE B L, et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J]. Nature, 2015, 526(7575): 666-671. |
| [24] |
XIAO J, WANG C, YAO J C, et al. Gasdermin D mediates the pathogenesis of neonatal-onset multisystem inflammatory disease in mice[J]. PLoS Biol, 2018, 16(11): e3000047. |
| [25] |
LI S, WU Y, YANG D, et al. Gasdermin D in peripheral myeloid cells drives neuroinflammation in experimental autoimmune encephalomyelitis[J]. J Exp Med, 2019, 216(11): 2562-2581. |
| [26] |
KANNEGANTI A, MALIREDDI RKS, SAAVEDRA PHV, et al. GSDMD is critical for autoinflammatory pathology in a mouse model of Familial Mediterranean Fever[J]. J Exp Med, 2018, 215(6): 1519-1529. |
| [27] |
DOYLE A, ZHANG G, ABDEL FATTAH E A, et al. Toll-like receptor 4 mediates lipopolysaccharide-induced muscle catabolism via coordinate activation of ubiquitin-proteasome and autophagy-lysosome pathways[J]. FASEB J, 2011, 25(1): 99-110. |
| [28] |
PETROF B J. Diaphragm weakness in the critically ill: basic mechanisms reveal therapeutic opportunities[J]. Chest, 2018, 154(6): 1395-1403. |
| [29] |
HOOIJMAN P E, BEISHUIZEN A, WITT C C, et al. Diaphragm muscle fiber weakness and ubiquitin-proteasome activation in critically ill patients[J]. Am J Respir Crit Care Med, 2015, 191(10): 1126-1138. |
| [30] |
MCFARLANE C, PLUMMER E, THOMAS M, et al. Myostatin induces cachexia by activating the ubiquitin proteolytic system through an NF-kappaB-independent, FoxO1-dependent mechanism[J]. J Cell Physiol, 2006, 209(2): 501-514. |
| [31] |
PUTHUCHEARY Z A, RAWAL J, MCPHAIL M, et al. Acute skeletal muscle wasting in critical illness[J]. JAMA, 2013, 310(15): 1591-1600. |




