阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是临床上常见的睡眠障碍性疾病,可引起全身多脏器功能障碍。认知功能障碍是其累及神经系统的一个常见表现[1]。间歇性缺氧(intermittent hypoxia,IH)是OSA主要的病理生理特征,通过引起氧化应激、钙超载以及线粒体功能障碍导致细胞损伤甚至死亡,被认为是引起神经元损伤的潜在因素[2-4]。有研究表明,IH诱导海马神经元自噬增加与神经元损伤有关[5]。自噬是一种广泛存在于真核细胞中的现象,它可以为细胞合成新蛋白和更新细胞器提供所需的起始材料,以维持细胞的稳态[6]。但是IH诱导自噬增多的具体机制尚未阐明。研究显示,TGF-β1发挥显著的神经生物学作用,除了参与免疫应答和炎症反应外,还在神经元发生和死亡过程中发挥重要作用,其信号传导失调与认知功能受损有关[7]。近期一项研究表明,TGF-β1可以减弱过氧化氢诱导的大鼠纤维环细胞自噬[8]。因此我们推测自噬累积导致的海马神经元损伤可能与IH减少TGF-β1的表达有关。本研究通过构建间歇性缺氧大鼠和HT22细胞模型,观察海马神经元自噬改变及TGF-β1水平,通过外源性给予TGF-β1及TGF-β1受体抑制剂(SB431542),探讨TGF-β1对神经元自噬的影响,以期为临床治疗OSA继发的认知功能障碍提供新的药物靶点及临床思路。
1 材料与方法 1.1 材料 1.1.1 动物与分组选取4~5周龄的健康雄性SD大鼠(体质量150~200 g,由重庆医科大学实验动物中心提供),以国家标准啮齿类动物饲料喂养,自由饮食。适应性喂养1周后,将大鼠按照完全随机分组方法分为对照组(N组,n=6)和间歇性缺氧组(IH组,n=6)。
1.1.2 细胞与分组小鼠海马神经元细胞系HT22细胞由重庆医科大学神经内科惠赠。将HT22细胞放入含有10%胎牛血清的DEME普通培养基中,在37 ℃,5% CO2的潮湿环境常规培养,并在达到80%~90%汇合时进行传代培养。将细胞分为N组,IH组,IH+TGF-β1组(15 ng/mL)和IH+SB431542(100 nmol/L)组。
1.1.3 试剂DMEM培养液和特级胎牛血清购自荣达普麦生物公司;兔抗TGF-β1抗体购自Abcam公司;兔抗LC3B、P62抗体购自bimake公司;鼠抗β-actin抗体购自武汉三鹰生物公司;HRP标记山羊抗鼠IgG、山羊抗兔IgG购自正能生物公司;RIPA裂解缓冲液、蛋白酶抑制剂、BCA蛋白浓度测定试剂盒及SDS-PAGE配胶试剂盒购自碧云天生物技术研究所,ECL化学发光试剂盒购自Advansta公司。
1.2 方法 1.2.1 动物模型建立N组在空气环境下常规饲养。将IH组的大鼠放置于间歇性低氧动物舱模型装置(本项目组专利ZL 2016 2 0110012.4)持续8 h(08:00-16:00),内循环交替向低氧舱输入空气和氮气,保持每个循环周期内装置的氧气最低浓度达到7%~10%,持续3~5 s,然后渐渐恢复到21%。
1.2.2 细胞模型建立N组正常氧暴露。IH组、IH+TGF-β1组和IH+SB431542组进行间歇性缺氧暴露,缺氧条件37 ℃,5% CO2,1.5% O2,缺氧5 min,之后复氧10 min[5]。
1.2.3 Morris水迷宫实验构建间歇性缺氧模型4周后进行Morris水迷宫测试。在平台实验期间,将大鼠从准随机起点放置在池中,最多允许60 s的时间找到逃生平台,并被允许在平台停留30 s。60 s末未能找到平台的大鼠被手动引导至平台,并允许其停留30 s,平台的位置始终保持恒定。平台实验进行5 d,并分析平均逃逸潜伏期。第6天进行60 s的测试,移除平台,分析60 s测试期间目标象限的停留时间及穿越目标平台次数。
1.2.4 免疫组织化学分析大鼠麻醉后通过心脏灌注NS,随后4%多聚甲醛固定。解剖分离海马组织制作石蜡切片以检测LC3蛋白表达。组织切片脱蜡和水合后,置于盛满柠檬酸抗原修复缓冲液(pH=6.0)的修复盒中于微波炉内进行抗原修复,洗涤后将切片放入3%双氧水溶液以消除内源性过氧化物酶的活性。3%BSA室温封闭后,在切片上滴加一抗,切片平放于湿盒内4 ℃孵育过夜。次日将玻片洗涤后,在圈内滴加与一抗相应种属的二抗覆盖组织,室温孵育50 min,PBS洗涤切片。在圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。苏木精复染3 min左右,自来水洗,苏木精分化液分化数秒,自来水冲洗,苏木精返蓝液返蓝,流水冲洗,随后脱水封片。
1.2.5 透射电镜观察大鼠麻醉后,通过心脏灌注NS,注入200 mL 2.5%戊二醛固定,快速分离大鼠海马组织。将样品浸泡在2.5%的戊二醛中。再将样品用1%锇酸固定,梯度酒精脱水后进行包埋制片,最后在电子显微镜下观察分析。
1.2.6 Western blot剪碎海马组织或刮下细胞后,加入RIPA裂解缓冲液和蛋白酶抑制剂按100∶1配成混合液,从样品中提取蛋白质,使用BCA试剂盒测定蛋白浓度。通过浓度为12%的SDS-PAGE凝胶电泳分离蛋白质(30 μg/条带),并将其转移到0.45 μm或0.22 μm的PVDF上。在室温下,将膜在TBST稀释的5%脱脂奶粉中封闭2 h。随后将膜与一抗孵育过夜。次日,将膜与偶联有辣根过氧化物酶的二抗在室温下孵育1 h,再用超敏发光试剂盒显影分析。
1.3 统计学分析使用SPSS22.0对实验数据进行统计分析,并以x±s表示。逃逸潜伏期采用方差分析进行重复测量,事后检验选择LSD检验,其他行为学指标及生物学实验结果采用独立样本t检验。P < 0.05被认为差异有统计学意义。使用GraphPad Prism v 6.0绘制图形。
2 结果 2.1 间歇性缺氧导致大鼠学习记忆障碍平台实验中,与N组相比,IH组大鼠第4天和第5天的逃逸潜伏期明显延长(P < 0.05)。空间探索实验中,N组实验轨迹平均热图显示热区富集在目标象限附近,而IH组较为分散;IH组穿越平台次数较N组减少(P < 0.05),且IH组在目标象限停留时间缩短(P < 0.05)。见图 1。
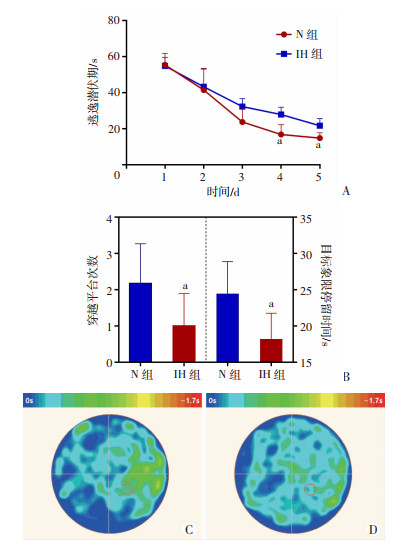
|
| A:平均逃逸潜伏期;B:穿越平台次数和目标象限停留时间;C:N组轨迹平均热图;D:IH组轨迹平均热图;a:P < 0.05,与N组比较;○示逃生平台 图 1 间歇性缺氧对大鼠认知功能的影响 |
2.2 间歇性缺氧诱导自噬小体增多
透射电镜结果显示N组海马神经元胞体中偶见单个自噬小体(图 2A、B)。IH组海马神经元胞体内细胞器数量减少,线粒体嵴肿胀消失,可见明显增多的双层或多层磷脂双分子层包裹的自噬小体(图 2C、D)。

|
| A:N组神经元自噬体(×10 000);B: N组神经元自噬体(×30 000);C: IH组神经元自噬体(×10 000);D: IH组神经元自噬体(×30 000);箭头示自噬体 图 2 透射电镜观察大鼠海马神经元自噬 |
2.3 歇性缺氧诱导自噬相关蛋白表达上调
为了确认在透射电镜观察到的自噬小体的增加,利用免疫组织化学检测了LC3的水平。LC3蛋白主要表达于大鼠海马区神经元的胞质中,与N组相比,IH组大鼠海马区阳性细胞显著增多,染色加深,免疫反应性显著增强(图 3)。通过Western blot分析LC3和P62的水平来检测自噬过程。与N组比较,大鼠IH组LC3-Ⅱ/LC3-Ⅰ表达增加(P < 0.05),P62表达上调(P < 0.05,图 4A);在细胞实验中,IH组LC3-Ⅱ/LC3-Ⅰ表达增加(P < 0.05),P62表达上调(P < 0.05,图 4B),结果与体内实验一致。
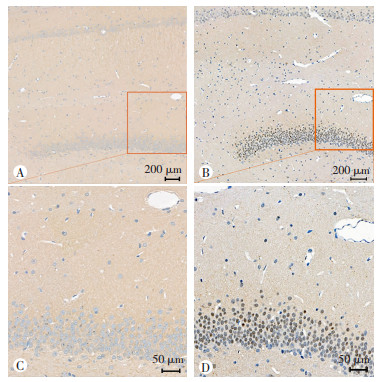
|
| A、C:N组LC3的表达;B、D: IH组LC3的表达 图 3 免疫组化检测LC3在大鼠海马组织中的表达 |

|
| A:大鼠海马神经元LC3和P62的相对表达量;B:HT22细胞LC3和P62的相对表达量;a:P < 0.05,与N组比较 图 4 间歇性缺氧对神经元自噬相关蛋白LC3和P62表达的影响 |
2.4 TGF-β1减轻间歇性缺氧诱导的自噬激活
Western blot分析发现与N组比较,IH组大鼠海马组织TGF-β1的表达减少(P < 0.05,图 5A),在细胞实验中,IH组TGF-β1的表达同样下调(P < 0.05,图 5B)。为了进一步验证TGF-β1是否会影响自噬,在暴露于间歇性缺氧的细胞(HT22)中分别加入TGF-β1和SB431542,结果表明与IH组比较,IH+TGF-β1组自噬相关蛋白LC3-Ⅱ/LC3-Ⅰ表达下调(P < 0.05),P62表达减少(P < 0.05),而IH+SB431542组LC3-Ⅱ/LC3-Ⅰ表达增加(P < 0.05),P62表达上调(P < 0.05)。见图 6。
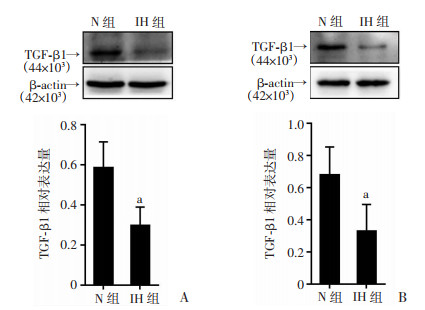
|
| A:大鼠海马神经元TGF-β1的相对表达量;B:HT22细胞TGF-β1的相对表达量;a:P < 0.05,与N组比较 图 5 间歇性缺氧对神经元TGF-β1表达的影响 |

|
| A:Western blot检测加入TGF-β1和SB431542后LC3、P62和TGF-β1的表达;B:LC3-Ⅱ/LC3-Ⅰ相对表达量;C:TGF-β1相对表达量;D:P62相对表达量;1: N组; 2: IH组; 3: IH+TNF-β1组; 4: IH+SB431542组; a:P < 0.05,与N组比较;b:P < 0.05,与IH组比较 图 6 TGF-β1对间歇性缺氧诱导HT22细胞自噬的作用 |
3 讨论
OSA是常见的睡眠障碍性疾病,表现为睡眠结构紊乱、间断低氧血症和/或高碳酸血症[9],累及神经系统时表现为白天嗜睡、易激惹、抑郁情绪及认知功能障碍等临床症状[10-11]。OSA患者通常存在不同程度的认知功能障碍,集中表现在记忆力、注意力、警觉性、执行能力、学习能力等方面的功能受损[12]。在本研究中,我们利用Morris水迷宫评估大鼠的认知功能,随着大鼠探索时间的增加,逃逸潜伏期的时间也越来越短,第1天和第2天两组的逃逸潜伏期均无统计学差异,这意味着所有大鼠的运动和视觉功能均相似。IH组大鼠第4天和第5天的逃逸潜伏期明显延长,并且空间探索实验IH组穿越平台次数减少和目标象限停留时间也明显缩短,这些数据都证实了间歇性缺氧导致大鼠学习记忆受损。
自噬广泛存在于真核细胞中,是除坏死和凋亡外的第3种死亡方式[13]。研究表明,IH致大鼠神经元损伤与细胞超微结构改变有关,神经细胞自噬异常可能参与其发生、发展过程[14]。为了确认间歇性缺氧是否可以激活神经元自噬,我们结合自噬相关标记物(LC3和P62)进行检测。自噬小体的形成涉及LC3从LC3-Ⅰ到LC3-Ⅱ的转化,胞质中LC3-Ⅰ与磷脂酰乙醇胺结合形成小分子量的LC3-Ⅱ,当自噬小体形成增多时LC3-Ⅱ的表达量增多,LC3-Ⅱ/LC3-Ⅰ比值的增加可作为自噬增加的标志[15]。P62被称为选择性自噬受体,连接LC3与待降解泛素化底物,当自噬流受阻时P62含量增加[16],例如早期IH诱导大鼠线粒体自噬形成及自噬相关蛋白LC3表达增多[17]。自噬的过度激活可能损伤神经细胞。IH是缺氧-再复氧不断重复的过程,在缺氧条件下,自噬过程被激活,通过清除多余或受损的细胞内结构保护细胞免受损伤;然而在复氧过程中,如炎性反应会导致自噬的大量增加,过度的自噬激活可能会损伤细胞[18]。研究发现,IH的程度和持续时间对海马神经元自噬影响不同,更严重和持续时间长的IH会造成明显的细胞损伤,表现为结构破坏和数量减少[5]。有研究表明,IH加重全脑缺血/再灌注导致的神经损伤,其机制可能与自噬激活和神经细胞损失增加有关[19]。ZHANG等[20]研究发现肾脏功能受损可能与IH上调小鼠肾脏组织自噬相关蛋白的表达有关。本研究发现IH组大鼠海马神经元胞体中自噬小体增多,自噬相关蛋白表达上调,表明间歇性缺氧可激活自噬。在HT22细胞模型得到与大鼠体内实验一致的结论,间歇性缺氧使自噬过度激活,但自噬底物增加,自噬流受阻,使得自噬累积。我们推断可能是由于IH缺氧引起自噬累积,使得神经元受损,从而导致认知功能障碍。
转化生长因子TGF-β1是一种能够滋养和保护神经元的抗炎性细胞因子,其活性主要通过多种蛋白酶将TGF-β1转化为活性TGF-β1来调节[21]。DING等[22]研究表明,TGF-β1可以显著抑制由Aβ1-42诱导的小胶质细胞激活引起的炎性细胞因子的增加和神经营养因子的减少,其缺陷在认知受损疾病中起重要作用。CARACI等[23]研究发现神经炎性疾病和认知功能障碍性疾病可能与TGF-β1途径异常有关。在本研究中,体内实验和体外实验均证实了间歇性缺氧减少TGF-β1的表达,间歇性缺氧HT22细胞中加入TGF-β1后,Western blot检测发现LC3-Ⅱ/LC3-Ⅰ表达减少,P62表达下调,自噬通路流畅,自噬被抑制。SB431542是一种TGF-β1受体激酶抑制剂,TRA等[24]通过用SB431542处理人类胚胎干细胞,发现自噬被上调。我们发现间歇性缺氧HT22细胞中加入SB431542后,LC3-Ⅱ/LC-Ⅰ表达增加,P62表达上调,表明其通过减少TGF-β1的保护作用增加了海马神经元的自噬。目前TGF-β1如何调控神经元自噬尚不清楚,有研究报道,PI3K/AKT/mTOR通路的激活抑制自噬并促进神经元存活[25],而该通路又受到TGF-β1的调控,因此, 我们推测TGF-β1可能通过调控PI3K/AKT/mTOR信号通路参与间歇性缺氧致神经元自噬发生, 这一推测仍有待于进一步研究探索。此外,本研究仅在细胞层面探讨TGF-β1对神经元自噬的影响,针对大鼠体内TGF-β1与神经元自噬之间的潜在机制,将在后续进行深入研究。
综上所述,本研究发现间歇性缺氧导致大鼠认知功能障碍,可能与神经元自噬累积有关,TGF-β1可减轻间歇性缺氧诱导的自噬增多。TGF-β1表达减少引起自噬累积可能是间歇性缺氧导致认知功能障碍的重要机制。
| [1] |
RALLS F, CUTCHEN L. A contemporary review of obstructive sleep apnea[J]. Curr Opin Pulm Med, 2019, 25(6): 578-593. |
| [2] |
明红, 陈锐, 王婧, 等. 海马神经元细胞内钙超载对慢性间歇低氧小鼠认知功能的损伤及盐酸美金刚的保护作用[J]. 中华结核和呼吸杂志, 2014, 37(12): 893-897. MING H, CHEN R, WANG J, et al. Role of hippocampal neuronal intracellular calcium overload in modulating cognitive dysfunction and the neuronprotective effect of mematine in a mouse model of chronic intermittent hypoxia[J]. Chin J Tuberc Respir Dis, 2014, 37(12): 893-897. |
| [3] |
ZHANG P P, WANG Y H, WANG H Y, et al. Sesamol alleviates chronic intermittent hypoxia-induced cognitive deficits via inhibiting oxidative stress and inflammation in rats[J]. Neuroreport, 2021, 32(2): 105-111. |
| [4] |
LAOUAFA S, ROUSSEL D, MARCOUILLER F, et al. Roles of oestradiol receptor alpha and beta against hypertension and brain mitochondrial dysfunction under intermittent hypoxia in female rats[J]. Acta Physiol (Oxf), 2019, 226(2): e13255. |
| [5] |
SONG S, TAN J, MIAO Y, et al. Effect of different levels of intermittent hypoxia on autophagy of hippocampal neurons[J]. Sleep Breath, 2017, 21(3): 791-798. |
| [6] |
GUO X F, ZHAO Y N, LI J M, et al. Activation of autophagy pathway in hippocampus and deterioration of learning and memory ability by intermittent hypoxia in rats after cerebral ischemia[J]. Chin J Cell Mol Immunol, 2016, 32(9): 1212-1216. |
| [7] |
ARKHIPOV V I, PERSHINA E V, LEVIN S G. Deficiency of transforming growth factor-β signaling disrupts memory processes in rats[J]. Neuro Report, 2018, 29(5): 353-355. |
| [8] |
NI B B, SHEN H, WANG W, et al. TGF-β1 reduces the oxidative stress-induced autophagy and apoptosis in rat annulus fibrosus cells through the ERK signaling pathway[J]. J Orthop Surg Res, 2019, 14(1): 1-13. |
| [9] |
OLAITHE M, BUCKS R S, HILLMAN D R, et al. Cognitive deficits in obstructive sleep apnea: Insights from a meta-review and comparison with deficits observed in COPD, insomnia, and sleep deprivation[J]. Sleep Med Rev, 2018, 38: 39-49. |
| [10] |
ESPOSITO M, ANTINOLFI L, GALLAI B, et al. Executive dysfunction in children affected by obstructive sleep apnea syndrome: an observational study[J]. Neuropsychiatr Dis Treat, 2013, 9: 1087-1094. |
| [11] |
KERNER N A, ROOSE S P. Obstructive sleep apnea is linked to depression and cognitive impairment: evidence and potential mechanisms[J]. Am J Geriatr Psychiatry, 2016, 24(6): 496-508. |
| [12] |
STRANKS E K, CROWE S F. The cognitive effects of obstructive sleep apnea: an updated meta-analysis[J]. Arch Clin Neuropsychol, 2016, 31(2): 186-193. |
| [13] |
LAMARK T, SVENNING S, JOHANSEN T. Regulation of selective autophagy: the p62/SQSTM1 paradigm[J]. Essays Biochem, 2017, 61(6): 609-624. |
| [14] |
DEGUIL J, RAVASI L, LANTEAUME L, et al. Translational challenge models in support of efficacy studies: effect of cerebral hypoxia on cognitive performances in rodents[J]. CNS Neurol Disord Drug Targets, 2016, 15(7): 765-776. |
| [15] |
KABEYA Y, MIZUSHIMA N, UENO T, et al. LC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J]. EMBO J, 2000, 19(21): 5720-5728. |
| [16] |
SU H B, WANG X J. p62 Stages an interplay between the ubiquitin-proteasome system and autophagy in the heart of defense against proteotoxic stress[J]. Trends Cardiovasc Med, 2011, 21(8): 224-228. |
| [17] |
王玲, 张盼盼, 王红阳, 等. 线粒体自噬对间歇低氧早期大鼠认知功能影响的初探[J]. 中华结核和呼吸杂志, 2014, 37(11): 840-844. WANG L, ZHANG P P, WANG H Y, et al. A preliminary study of the effect of mitochondrial autophagy on cognitive function in rats of early intermittent hypoxia[J]. Chin J Tuberc Respir Dis, 2014, 37(11): 840-844. |
| [18] |
LIN X L, XIAO W J, XIAO L L, et al. Molecular mechanisms of autophagy in cardiac ischemia/reperfusion injury (Review)[J]. Mol Med Rep, 2018, 18(1): 675-683. |
| [19] |
GUO X, LIU Y, ZHAO Y N, et al. Role of the PI3K-mTOR autophagy pathway in nerve damage in rats with intermittent hypoxia-aggravated whole brain ischemia[J]. Mol Med Rep, 2019, 20(2): 1411-1417. |
| [20] |
ZHANG X B, CAI J H, YANG Y Y, et al. Telmisartan attenuates kidney apoptosis and autophagy-related protein expression levels in an intermittent hypoxia mouse model[J]. Schlaf Atmung, 2019, 23(1): 341-348. |
| [21] |
ANNES J P, MUNGER J S, RIFKIN D B. Making sense of latent TGFβ activation[J]. J Cell Sci, 2003, 116(2): 217-224. |
| [22] |
DING Y, KIM J K, KIM S I, et al. TGF-β1 protects against mesangial cell apoptosis via induction of autophagy[J]. J Biol Chem, 2010, 285(48): 37909-37919. |
| [23] |
CARACI F, SPAMPINATO S F, MORGESE M G, et al. Neurobiological links between depression and AD: The role of TGF-β1 signaling as a new pharmacological target[J]. Pharmacol Res, 2018, 130: 374-384. |
| [24] |
TRA T, GONG L, KAO L P, et al. Autophagy in human embryonic stem cells[J]. PloS ONE, 2011, 6(11): e27485. |
| [25] |
HERAS-SANDOVAL D, PÉREZ-ROJAS J M, HERNÁNDEZ-DAMIÁN J, et al. The role of PI3K/AKT/mTOR pathway in the modulation of autophagy and the clearance of protein aggregates in neurodegeneration[J]. Cell Signal, 2014, 26(12): 2694-2701. |




