2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系临床微生物与免疫学教研室
2. Department of Clinical Microbiology and Immunology, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038. China
结直肠癌(colorectal cancer, CRC)是常见的癌症之一,无论是发病率还是死亡率在恶性肿瘤中均位于前三位[1]。研究表明,结直肠癌的发病过程涉及遗传、环境、饮食和肠道菌群等多种因素。肠道菌群在消化系统恶性肿瘤的发生发展中扮演着重要角色,尤其是具核梭杆菌(Fusobacterium nucleatum, F.nucleatum),在包含口腔癌、食管癌、结直肠癌等在内的消化道恶性肿瘤患者中被检测到显著富集,并提示不良预后。F.nucleatum是一种革兰阴性、厌氧、梭型杆菌,通过黏附定植、诱发炎症、抑制免疫、促进肿瘤增殖、增强肿瘤侵袭等多种方式参与到相关消化系统恶性肿瘤的进程中[2-3]。因此,分析F.nucleatum诱导CRC基因差异表达的显著性对研究其致病机制尤为重要。
MUC1是一种高糖基化的单向Ⅰ型跨膜糖蛋白[4],广泛存在于人体上皮细胞膜上。MUC1糖残基因带负电荷而形成具有润滑性能的黏液凝胶,保护上皮细胞免受干燥、pH值变化和微生物感染[4]。MUC1在正常组织中高度糖基化,而在肿瘤组织中过度表达并异常糖基化[5]。研究表明肠道微生物诱发的结直肠癌与MUC1的过度表达密切相关。沙门氏菌效应蛋白分泌到宿主细胞中,诱导MUC1过度表达从而激活AKT/ERK等信号通路导致结直肠癌的发生[6-7]。此外,MUC1与NF-κB的亚单位p65相互作用可上调上皮-间充质转化(EMT)标记物ZEB1的表达,进而促进结直肠癌细胞侵袭[8]。
本研究利用生物信息学对微阵列数据进行分析,通过对比多个数据集,从中筛选出F.nucleatum诱导的CRC差异表达基因,并鉴定了Hub基因MUC1在F.nucleatum感染CRC细胞系中转录水平和蛋白水平的表达。
1 材料与方法 1.1 微阵列数据从GEO数据库下载GSE110223,GSE110224,GSE113513和GSE122183的生物微阵列数据。GSE110223基于GPL96平台,包含26个样本:13个CRC样本和13个正常结肠样本;GSE110224基于GPL570平台,总共34个样品:17个癌组织标本和17个正常对照;GSE113513的平台为GPL15207,包含14个结肠直肠肿瘤样本和相同数量的正常样本;GSE122183数据集基于GPL17586平台,包含25个样本(15个结直肠癌,10个正常对照)。
1.2 微阵列数据的处理所有样本信息分为肿瘤组和正常组,R studio软件中LIMMA软件采用t检验计算差异倍数(FC)值和调整后的P值。调整后的P值(adj.P.Val) < 0.01和|log FC|>2被定义为DEGs判定标准。运行R studio中的pheatmap,ggplot2,ggthemes和Cairo软件创建热图和火山图。
1.3 功能和途径富集分析对于DEGs的功能注释,我们将差异表达基因提交给DAVID (https://DAVID.abcc.ncifcrf.gov/)进行基因本体论分析。KEGG分析采用KOBAS 3.0 (http://kobas.cbi.pku.edu.cn/kobas3)。P值< 0.05被设定为具有统计学意义的阈值。
1.4 PPI网络的构建和中枢基因鉴定STRING数据库可以预测蛋白质的相互作用[9]。我们采用STRING在线数据库筛选了相互作用得分≥0.4的基因,并建立了PPI网络。通过Cytoscape软件(版本3.6.1)输出PPI网络的可视化结果,并采用CytoHubba插件根据“degree”的排序规则对DEGs进行排序,最终筛得6个DEGs。
1.5 细菌菌株和细胞系具核梭杆菌亚种(ATCC 25586)购自ATCC[2],使用厌氧培养工作站(Ruskinn In vivo 2400,英国贝克)在专性厌氧环境(5%CO2、10%H2和85%N2)中37 ℃培养细菌24 h。人正常结直肠上皮细胞系(NCM460)和结直肠癌细胞系(HCT116,SW620和SW480)由中国科学院(CAS)的细胞库提供。将其在含有10%胎牛血清(FBS,Gibco,美国)的DMEM(美国Gibco)中于36.5 ℃的潮湿环境中(含5%CO2)进行培养。细胞感染模型:将细胞接种在6孔板中,然后用具核梭杆菌(MOI =100 ∶1)感染肠上皮细胞系4、12和24 h[10]。
1.6 实时定量PCR分析TRIzol试剂(Invitrogen,USA)提取细胞总RNA,并通过PrimeScriptTM RT试剂盒(TaKaRa,Tokyo, Japan)将总RNA反转录为cDNA。实时定量PCR反应条件为:95 ℃下30 s,95 ℃下5 s,60 ℃下30 s,40个循环,用2-ΔΔCt法计算mRNA的相对表达量,以GAPDH为实验内参。
1.7 免疫印迹分析采用蛋白提取液(Beyotime,China)提取细胞总蛋白,将等量的蛋白质在5×SDS缓冲液中变性,12% SDS-PAG电泳,恒电流转移到PVDF膜上;在5% BSA的TBST中封闭2 h,在4 ℃一抗孵育过夜后,室温下二抗孵育2 h,BeyoECL Plus试剂盒(Beyotime)显色。一抗MUC1(ab45167)和GAPDH(ab8245)抗体由Abcam生物技术公司获得,二抗(7074S)由CST生物技术公司提供。
1.8 统计学分析所有实验数据以x±s表示,定量检测结果采用t检验,使用GraphPad Prism 6.01进行数据分析。检验水准α=0.05。
2 结果 2.1 F.nucleatum诱导CRC差异表达基因的筛选对GEO的生物芯片数据进行标准化,利用R studio软件在GSE110223中筛选出与结直肠癌相关的DEGs共82个,在GSE110224和GSE113513中分别获得132个和199个。此外,在GSE122183中筛选获得F.nucleatum感染致显著差异表达的结直肠癌基因139个。鉴于各芯片数据中的临床样本量较小,将4个数据集重叠以获得F.nucleatum介导的结直肠癌差异表达基因。GSE122183数据集的非重叠区域代表了上述DEGs,该区域筛选出118个基因,维恩图(图 1A)对其进行可视化;其中,有20个表达上调基因和98个表达下调基因(图 1B)。热图和火山图分别显示了118个DEGs(图 1C、D)。
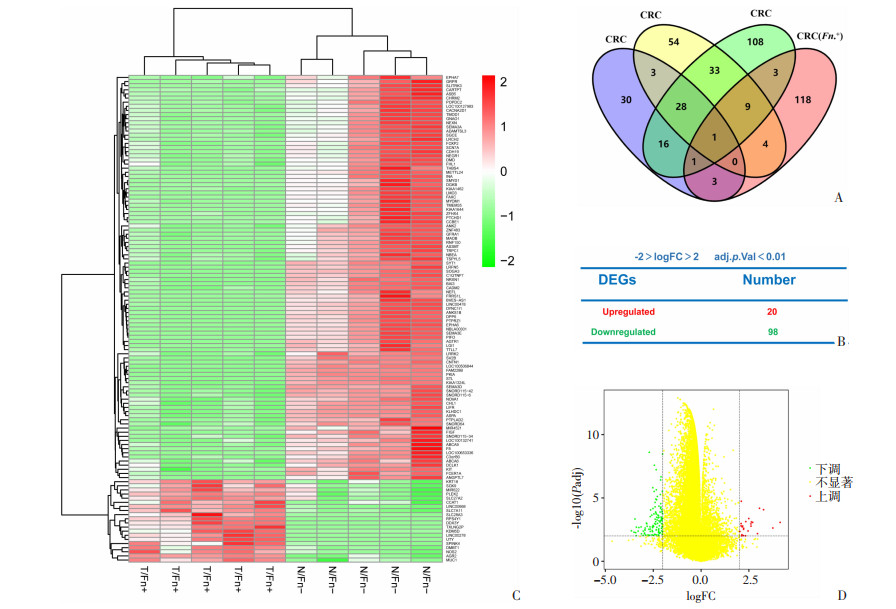
|
| A: 重叠4个数据集获得F.nucleatum诱导结直肠癌的差异表达基因数量;B: F.nucleatum感染下CRC组织中DEGs的上调表达基因数量和下调表达基因数量;C: 118个DEGs的热图;红色表示上调;绿色表示下调,而无显著差异表达的基因则用白色表示;D: CRC的DEGs火山图;红点,代表F.nucleatum感染致明显上调的DEGs;绿点,代表F.nucleatum感染致显著下调的DEGs;黄点表示差异不显著;显著性定义为adj.P.Val < 0.01和|log FC|> 2 图 1 GSE110223、GSE110224、GSE113513和GSE122183数据集中DEGs的筛选 |
2.2 GO和KEGG富集分析
为了分析DEGs的关键功能分类,本研究采用DAVID进行GO分析。GO注释和分类的基因功能主要分为:生物过程(BP)、细胞成分(CC)和分子功能(MF)。如图 2所示,差异表达基因涉及的生物过程主要在化学突触传递和细胞增殖调节等方面;细胞成分富集分析显示DEGs主要涉及膜、细胞外空间和质膜的组成部分;而分子功能分析上最显著富集是蛋白质二聚体活性和受体结合功能。此外,我们通过KOBAS 3.0软件在KEGG中分析了差异表达基因。这些差异表达基因主要富集于以下信号途径:轴突引导(hsa04360)、磷脂酶D信号传导途径(hsa04072)、钙信号传导途径(hsa04020)、组氨酸代谢(hsa00340)和血清素能突触(hsa04726)。上述KEGG富集分析结果可视化显示在图 3中。
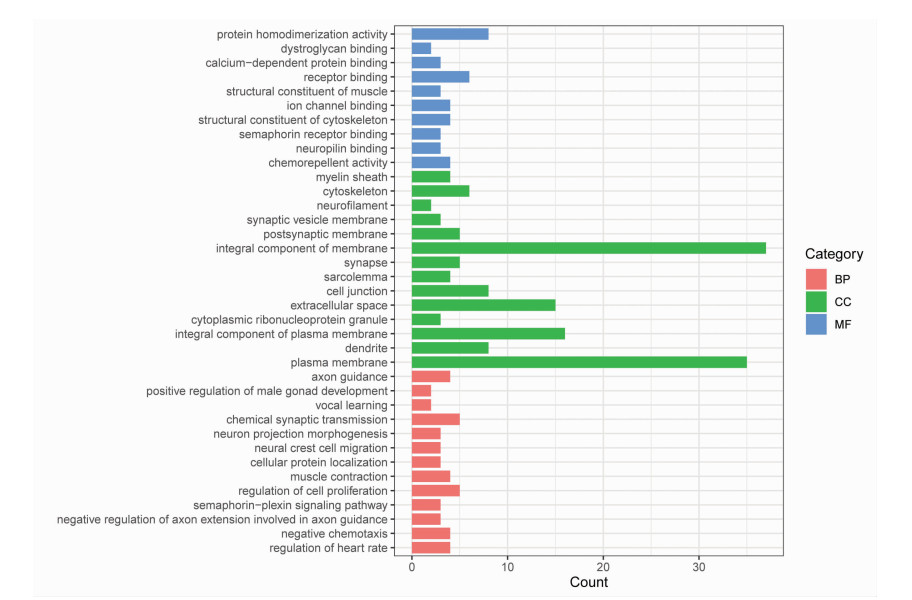
|
| X轴代表基因功能;Y轴代表基因数量;3种不同颜色分别表示BP、CC和MF 图 2 DEGs的GO注释 |
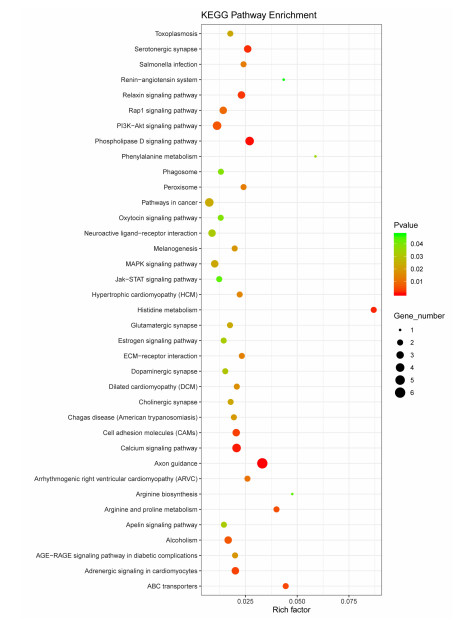
|
| X轴显示富集系数;富集系数指筛选所得参与该通路基因与通路总基因的比值;Y轴显示了DEGs富集通路;点的大小表示该通路中靶基因的数量,点的颜色反映了不同的P值(P < 0.05) 图 3 DEGs的KEGG富集分析 |
2.3 通过构建PPI网络进行目的基因筛选
为了预测差异表达基因的蛋白质之间的相互作用,本研究在STRING中提交了118个靶基因。随后,使用Cytoscape 3.8.0软件中CytoHubba插件进行了PPI网络分析。网络的Hub基因通过“degree”法排序。最后,从网络中筛选出在CRC中过表达的MUC1,及其5个与MUC1相互作用的DEGs:SLC7A11,AGR2,KRT18,CARTPT和TSPYL5(图 4A)。此模块中有4个上调基因(MUC1,SLC7A11,AGR2和KRT18)和2个下调基因(CARTPT和TSPYL5,图 4B)。
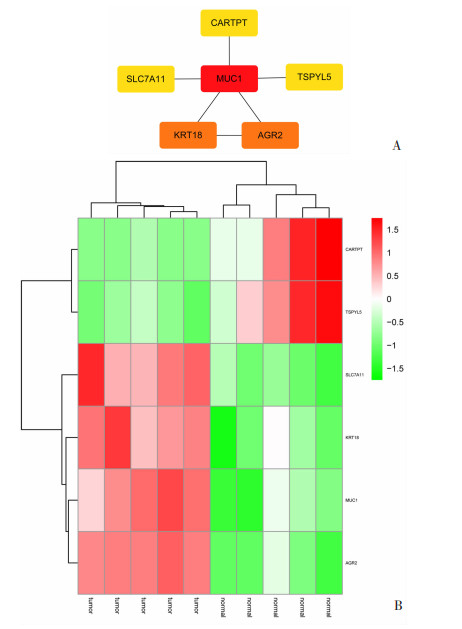
|
| A: F.nucleatum调控CRC显著差异表达基因的PPI网络,即MUC1和其他5个相互作用的DEGs的PPI网络;B: MUC1和5个相互作用DEGs的热图 图 4 通过构建PPI网络筛选关键基因 |
2.4 F.nucleatum感染与目的基因的差异表达显著相关
为了验证F.nucleatum感染对Hub基因表达影响,时间依赖实验分析F.nucleatum感染结直肠细胞系对MUC1的转录水平和蛋白质水平表达。RT-qPCR和Western blot分析表明,在不同的F.nucleatum感染时间点(4,12 h和24 h),MUC1的转录水平表达和蛋白水平表达在4个细胞系中均逐渐增加(图 5A~C)。上述结果提示,F.nucleatum感染可能通过调节MUC1的表达促进结直肠癌的发生(图 5D)。

|
| A: HCT116细胞系MUC1 mRNA的表达;B: SW620细胞系MUC1 mRNA的表达;C: SW480细胞系MUC1 mRNA的表达;D: 正常及CRC细胞中MUC1蛋白表达 图 5 感染F.nucleatum不同时间后正常及CRC细胞系中MUC1 mRNA及蛋白的表达变化 |
3 讨论
结直肠长期暴露于肠道微生物的环境下,肠道微生物菌群失调与结直肠癌的发生发展密不可分[11],甚至是其病因之一。具核梭杆菌(F.nucleatum) 是革兰阴性专性厌氧菌,常寄生于人类口腔及胃肠道。新进研究F.nucleatum在结直肠癌中明显富集,并与不良预后相关,更是作为一种加速结直肠癌进展和严重程度的“肿瘤细菌”而引起广泛关注[2, 12]。CASTELLARIN等[2]运用转录组学探测CRC组织中微生物菌群的变化,结果显示CRC组织内存在高丰度的具核梭杆菌。比对CRC癌组织和癌旁正常组织时发现,癌组织样本中具核梭杆菌的丰度明显高于癌旁组织,而且发现癌组织中高丰度的具核梭杆菌与淋巴结转移呈正相关,这项研究揭示了具核梭杆菌与CRC之间具有密切的相关性。本研究利用GEO的生物芯片数据,筛选出118个因F.nucleatum感染CRC引起的显著差异表达基因。基因本体论分析表明,这些DEGs在化学突触传递、细胞增殖转化、细胞膜组成、细胞外间隙、蛋白同源二聚体活性和受体结合等方面都有着显著富集。此外,DEGs显著富集的几种KEGG信号通路与CRC密切相关[13-16],包括PI3K-Akt、MAPK、Rap1和JAK-STAT等信号通路。利用CytoHubba插件进行了PPI网络分析,进一步筛选出在CRC中过表达的MUC1,及其5个与MUC1相互作用的DEGs,包括SLC7A11、AGR2、KRT18、CARTPT和TSPYL5。并验证了具有高中心性得分的关键MUC1的转录水平和蛋白水平表达,其结果与生物信息学分析结果一致,提示该基因可能是F.nucleatum特异并参与调控结直肠癌发生的关键基因。
MUC1在多种肿瘤组织中异常表达, 表现为量的增加和结构改变[5],其畸形糖基化或糖基化不全, 使MUC1暴露出新的蛋白表位或新的糖抗原,其同种型MUC1/Y具有肿瘤特异性。因此,MUC1已作为一种肿瘤生物学标志物运用于乳腺癌、卵巢癌、胃肠肿瘤等的诊断和微小淋巴结转移检测[17]。研究发现一些胃肠道细菌与MUC1的相互作用促进了消化道肿瘤的发生发展,而MUC1致癌作用的可能机制为: (1)直接促进肿瘤的生长和加速其转移;(2)通过分子间相互作用, 促进癌基因的表达和抑制抗癌基因的表达;(3)免疫逃逸机制[17]。例如,幽门螺杆菌诱导MUC1高表达通过NF-κB信号通路促进炎症反应导致胃癌发生[18]。本研究中,MUC1在F.nucleatum感染的结直肠癌组织中过度表达,以及该菌感染肠上皮细胞系诱导MUC1的高表达,提示MUC1可能在结直肠癌的发生发展中发挥重要作用,并可作为一种早期诊断结直肠癌的生物标志物提升临床价值。
而与MUC1相互作用的5个DEGs(AGR2、KRT18、TSPYL5、CARTPT和SLC7A11)在多种恶性肿瘤的发生、转移、侵袭和化疗耐药性中起重要作用。前梯度蛋白2(AGR2)具有促进肿瘤细胞生长和侵袭转移等生物学功能,与前列腺癌、胰腺癌、乳腺癌和食管癌等多种肿瘤转移密切相关。例如,AGR2通过上调Wnt11激活JNK和CaMKII从而促进CRC细胞迁移[19]。角蛋白18(KRT18)作为CRC患者的一个独立预测因子,其过度表达对整体生存率不利[20]。睾丸特异性蛋白Y编码样5(TSPYL5)是抑癌基因。HUANG等[21]报道miR-19-5p与TSPYL5相互作用,在CRC的发生和发展中起着至关重要的作用。溶质载体家族7成员11(SLC7A11)在抗氧化和分解谷氨酰胺方面发挥着关键作用。JU等[22]报道低剂量紫杉醇(PTX)诱导下,下调的SLC7A11的表达可以降低肿瘤微环境pH值,从而抑制肿瘤细胞的生长。尽管CARTPT在CRC的生物学进展过程中发挥的作用并不明确,但CARTPT与其他类型的癌症有着密切的联系。例如,CARTPT与乳腺癌发生密切相关[23],F.nucleatum引起的CARTPT的异常表达可能影响结直肠癌的发生和侵袭转移。虽然我们构建了上述6个DEGs的PPI网络,提示它们在结直肠癌的发生发展中的作用,但是其具体功能及其作用机制还有待于进一步的研究。
综上所述,生物信息学分析和细胞感染模型证实了MUC1在F.nucleatum感染的结直肠癌中过表达,为进一步研究其在结直肠癌中的作用机制奠定了基础,也有望成为抑制结直肠癌发生的分子靶标,为预防和治疗CRC开辟新的途径。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
CASTELLARIN M, WARREN R L, FREEMAN J D, et al. Fusobacterium nucleatum infection is prevalent in human colorectal carcinoma[J]. Genome Res, 2012, 22(2): 299-306. |
| [3] |
BRENNAN C A, GARRETT W S. Fusobacterium nucleatum-symbiont, opportunist and oncobacterium[J]. Nat Rev Microbiol, 2019, 17(3): 156-166. |
| [4] |
NATH S, MUKHERJEE P. MUC1: a multifacetedonco-protein with a key role in cancer progression[J]. Trends Mol Med, 2014, 20(6): 332-342. |
| [5] |
LAN M S, BATRA S K, QI W N, et al. Cloning and sequencing of a human pancreatic tumor mucincDNA[J]. J Biol Chem, 1990, 265(25): 15294-15299. |
| [6] |
ALAM M, AHMAD R, RAJABI H, et al. MUC1-Concoprotein activates ERK→C/EBPβ signaling and induction of aldehyde dehydrogenase 1A1 in breast cancer cells[J]. J Biol Chem, 2013, 288(43): 30892-30903. |
| [7] |
HIRAKI M, SUZUKI Y, ALAM M, et al. MUC1-C stabilizes MCL-1 in the oxidative stress response of triple-negative breast cancer cells to BCL-2inhibitors[J]. Sci Rep, 2016, 6: 26643. |
| [8] |
RAJABI H, ALAM M, TAKAHASHI H, et al. MUC1-Conco-protein activates the ZEB1/miR-200c regulatory loop and epithelial-mesenchymal transition[J]. Oncogene, 2014, 33(13): 1680-1689. |
| [9] |
SZKLARCZYK D, FRANCESCHINI A, WYDER S, et al. STRING v10: protein-protein interaction networks, integrated over the tree of life[J]. Nucleic Acids Res, 2015, 43(database issue): D447-D452. |
| [10] |
MENDES R T, NGUYEN D, STEPHENS D, et al. Endothelial cell response to Fusobacterium nucleatum[J]. Infect Immun, 2016, 84(7): 2141-2148. |
| [11] |
HAUSEN H Z. The search for infectious causes of human cancers: where and why[J]. Virology, 2009, 392(1): 1-10. |
| [12] |
TJALSMA H, BOLEIJ A, MARCHESI J R, et al. A bacterial driver-passenger model for colorectal cancer: beyond the usual suspects[J]. Nat Rev Microbiol, 2012, 10(8): 575-582. |
| [13] |
BAHRAMI A, KHAZAEI M, HASANZADEH M, et al. Therapeutic potential of targeting PI3K/AKT pathway in treatment of colorectal cancer: rational and progress[J]. J Cell Biochem, 2018, 119(3): 2460-2469. |
| [14] |
UDDIN S, BAVI P P, HUSSAIN A R, et al. Leptin receptor expression in Middle Eastern colorectal cancer and its potential clinical implication[J]. Carcinogenesis, 2009, 30(11): 1832-1840. |
| [15] |
UDDIN S, HUSSAIN A R, KHAN O S, et al. Role of dysregulated expression of leptin and leptin receptors in colorectal carcinogenesis[J]. Tumor Biol, 2014, 35(2): 871-879. |
| [16] |
TANG Y, ZHAO Y, SONG X, et al. Tumor-derivedexosomal miRNA-320d as a biomarker for metastatic colorectal cancer[J]. J Clin Lab Anal, 2019, 33(9): e23004. |
| [17] |
高志强, 丁志强, 陈勇军, 等. 胰腺癌组织黏蛋白MUC1表达的意义[J]. 世界华人消化杂志, 2006, 14(9): 923-926. GAO Z Q, DING Z Q, CHEN Y J, et al. Significance of mucin 1 expression in pancreatic cancer tissues[J]. World Chin J Dig, 2006, 14(9): 923-926. |
| [18] |
SHENG Y H, TRIYANA S, WANG R, et al. MUC1 and MUC13 differentially regulate epithelial inflammation in response to inflammatory and infectious stimuli[J]. Mucosal Immunol, 2013, 6(3): 557-568. |
| [19] |
TIAN S, HU J, TAO K, et al. Secreted AGR2 promotes invasion of colorectal cancer cells via Wnt11-mediated non-canonical Wnt signaling[J]. Exp Cell Res, 2018, 364(2): 198-207. |
| [20] |
ZHANG J, HU S, LI Y. KRT18 is correlated with the malignant status and acts as an oncogene in colorectal cancer[J]. Biosci Rep, 2019, 39(8): BSR20190884. |
| [21] |
HUANG C, LUO H. miR-19-5p enhances tumorigenesis in human colorectal cancer cells by targeting TSPYL5[J]. DNA and Cell Biology, 2018, 37(1): 23-30. |
| [22] |
JU H Q, LU Y X, CHEN D L, et al. Redox regulation of stem-like cells though the CD44v-xCT axis in colorectal cancer: mechanisms and therapeutic implications[J]. Theranostics, 2016, 6(8): 1160-1175. |
| [23] |
Slattery M L, Lundgreen A, Hines L, et al. Energy homeostasis genes and breast cancer risk: The influence of ancestry, body size, and menopausal status, the breast cancer health disparities study[J]. Cancer Epidemiol, 2015, 39(6): 1113-1122. |




