2. 330000 南昌, 南昌大学第二附属医院:核医学科
2. Department of Nuclear Medicine, Second Affiliated Hospital of Nanchang University, Nanchang, Jiangxi Province, 330000, China
肝细胞癌(hepatocellular carcinoma,HCC)是世界范围内最普遍的恶性肿瘤之一,也是癌症致死率的第3大原因[1]。尽管在早期HCC诊断和新疗法开发方面已经取得了一定的进步,但是该疾病的预后依然较差,尤其是它的复发率较高[2]。因此,了解HCC的发病机制、确认分子在其中所起到的关键作用,对于该疾病的早期诊断与治疗来说尤为重要。
长链非编码RNA(long noncoding RNA,LncRNA)是一类转录本长度超过200nt的RNA分子,它们并不编码蛋白,而是以RNA的形式在多种层面上(表观遗传调控、转录调控以及转录后调控等)调控基因的表达水平。大量证据表明LncRNA可能在多种生物学过程中起到了重要的作用,LncRNA的失调可能在包括癌症在内的不同疾病发展过程中扮演了重要的角色[3-4]。尽管利用RNA测序技术已经发现了成千上万种LncRNA,但它们的功能在很大程度上仍尚不清楚。据报道,LncRNA SNHG12在包括胰腺癌、肾癌、宫颈癌在内的多种癌症中表达上调,并扮演致癌基因的角色[5-7]。尽管LncRNA SNHG12也被发现在HCC中出现表达上调现象[8-9],但是其在HCC的发展过程中的临床意义和生物学作用尚未阐明。在本研究中,我们研究了LncRNA SNHG12在HCC中的表达、临床意义、功能及作用机制。
1 材料与方法 1.1 组织样本与细胞培养在2010年1月到2018年12月期间,从南昌大学第二附属医院总共采集了90对HCC组织与匹配的正常肝脏组织。所有组织样本均由病理学医师展开了病理学和组织学检查。研究获得了南昌大学第二附属医院伦理委员会的批准,得到了所有患者的知情同意书(审批号:2020-023)。在添加了10%胎牛血清FBS,(Gibco,美国)和1%链霉素-青霉素(100 μg/mL链霉素、100单位/mL青霉素)的DMEM或RPMI1640培养基中,培养人类肝癌细胞系HepG2.2.15、SMMC-7721、Huh7、SMMC-7721,以及人类正常肝脏细胞系L02。细胞放入含有5% CO2的加湿箱中,在37℃下培养。实验中采用的所有细胞系均接受了防伪验证,培养过程中远离细菌和支原体感染。
1.2 RNA分离与RT-qPCR根据厂商说明,利用TRIzol试剂(Thermo Fisher Scientific,美国)从新鲜组织和培养细胞中分离出总RNA。通过ReadyScript© cDNA Synthesis Mix(Sigma-Aldrich,美国)合成cDNA。mRNA和LncRNA的水平通过FastStart Universal SYBR Green Master(ROX)(Roche,德国)来量化,利用β-actin作为内参实现mRNA水平的标准化。根据厂商说明,利用miRNA-specific TaqMan MiRNA实验试剂盒(miR-129-5p, ID 462051_mat, Thermo Fisher Scientific,美国)量化miRNA的水平。利用U6 snRNA(ID 001973, Thermo Fisher Scientific,美国)标准化miR-129-5p的表达。使用的PCR引物如下:LncRNA SNHG12正义链5′-CACCATGTTGGCCAGGCTGGT-3′;LncRNA SNHG12反义链5′-GGCCAAAGAGTGACCATCATC-3′;GTPBP4正义链5′-GGCAAGGACTGCCTGGTGCTGGTTT-3′;GTPBP4反义链5′-GGGCCCCCAAAGCCGCAGTGCAGGT-3′;β-actin正义链5′-ATCCACGAAACTACCTTCAACTC-3′;β-actin反义链5′-GAGGAGCAATGATCTTGATCTTC-3′。
1.3 细胞转染根据厂商说明,利用Lipofectamine 2000(Invitrogen,美国)将miRNA或质粒转染到肝癌细胞中。根据厂商说明,用携带空慢对照载体或LncRNA SNHG12敲除载体-shR-LncRNA SNHG12的慢病毒来感染肝癌细胞。
1.4 MTT细胞活性实验将3×103个Huh7或HepG2细胞转染上指定的质粒,然后种植到96孔板中,培育24 h。接下来,在加入MTT后的第24、48、72 h评估细胞增殖率,利用Quant通用微孔板分光光度计(BioTek,美国)测量490 nm处的光密度值D(490)。
1.5 细胞集落形成实验将Huh7或HepG2细胞转染上指定的质粒,然后种植到12孔板中(每孔300个细胞),培养12 d。接下来,用结晶紫让细胞染色,计数大于50个细胞(菌落)的细胞块。
1.6 细胞侵袭实验利用8 μm孔隙聚碳酸酯膜的Transwell小室来评估细胞的侵袭能力。上室涂有基质胶,用于侵袭分析或未涂覆基质胶进行迁移分析。上室每孔有1 000个/孔浓度的细胞以及无血清培养基,底部腔室为含有10% FBS的DMEM。48 h后,通过使用4%甲醇固定细胞,然后用0.1%结晶紫(Sigma-Aldrich,美国)染色。在5个不同的视野(×100倍)中,分别对迁移和侵袭的细胞进行计数。
1.7 划痕愈合迁移实验肝癌细胞种植到12孔板中,培养达到70%左右的融合度。接下来,利用一个50μL小管的管尖部分造成划痕。通过1×PBS除去没有附壁的细胞。再次将细胞放入含有10% FBS的DMEM中分别培养0、48、72 h。每孔随机选择3个观察范围。
1.8 荧光素酶报告基因实验使用GTPBP4野生型(wt)或突变型(mut)启动子报告子与LncRNA SNHG12或miR-129-5p进行重组后转染HuH-7和HepG2细胞系。转染48 h后,使用双荧光素酶报告检测系统(Promega,美国)检测荧光素酶活性。
1.9 Western blot检测用RIPA裂解液裂解转染后的细胞,然后采用蛋白酶抑制剂混合物(Roche,德国)提取总蛋白质。总蛋白质的浓度采用BCA法测定(Beyotime)。采用10% SDS-PAGE分离出蛋白质裂解物(30 μg/lane),然后转移到聚偏二氟乙烯薄膜上。按照厂商说明,将薄膜与一抗在4 ℃下过夜培养:用来抵抗GTPBP4抗体ab104017), 、Survivin蛋白抗体(ab469)、E-钙黏蛋白抗体(ab1416)、GAPDH抗体(EPR16891),抗体购自Abcam(Eugene,美国)。接下来,将薄膜放在HRP相关二抗(Jackson,美国)中培养,然后用Alpha Innotech(美国)成像软件量化Western blot的数据。
1.10 免疫组织化学染色分析(IHC)GTPBP4抗体稀释比例为1 ∶6 000,以PBS做阴性对照,免疫组织化学采用S-P法。原始实验数据的判读方式:判读GTPBP4的染色强度(0/1+/2+/3+)和染色阳性率,癌组织和癌旁组织分别判读。原始实验数据的标准化方案:染色强度评分:0分(阴性),1分(1+),2分(2+),3分(3+)。染色阳性率评分:0分(阴性),1分(1%~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。总评分和分组:以“染色强度评分”和“染色阳性率评分”的乘积为总评分进行分组,≤3分为抗体低表达组,>3分为抗体高表达组。
1.11 体内裸鼠实验所采用的动物计划得到了南昌大学第二附属医院动物管理委员会的批准(审批号:2020-671)。获取6周龄BALB/c无胸腺雌性裸鼠(中国上海中科院动物学学院),用于体内研究。在开始接种肿瘤细胞之前,将动物通过完全随机化分组。将转染了慢病毒或lenti-shR-LncRNA SNHG12的Huh7细胞(1×107)以皮下注射方式接种到裸鼠的腋窝。每1组内包括6只小鼠。利用电子秤和游标卡尺分别测定肿瘤的重量与大小,用t检验来比较各组之间的肿瘤生长情况。每个实验重复3次。
1.12 统计学分析数据分析采用Student’s t检验、单向ANOVA、双向ANOVA检验进行。用Kaplan-Meier法构建生存曲线,然后用的对数秩分析该曲线。LncRNA SNHG12表达与临床病理特征之间的关联采用Pearson卡方检验来分析。检验水准α=0.05。
2 结果 2.1 HCC中的LncRNA SNHG12表达与临床病理特征之间的关系按照癌症基因组图谱(TCGA),我们首先分析了LncRNA SNHG12在HCC患者中的表达水平和预后值。发现与正常肝脏组织相比(正常组;n=50),LncRNA SNHG12在HCC组织中被上调(肿瘤组;n=374)(P < 0.05,图 1A)。随后的Kaplan-Meier生存曲线分析表明对于LncRNA SNHG12表达水平较高的HCC患者,其10年整体生存率要低于那些LncRNA SNHG12表达水平低的患者(P < 0.05,图 1B)。接着,我们对LncRNA SNHG12在90对HCC肿瘤组织和相邻正常组织中的表达水平进行评估。与TCGA数据一致,我们发现相比于相邻正常组织,LncRNA SNHG12的表达水平在HCC组织中出现显著上调(P < 0.05,图 1C)。此外,我们发现LncRNA SNHG12表达水平较高的HCC患者,其5年整体生存率要低于那些LncRNA SNHG12表达水平较低的患者(P < 0.05,图 1D)。我们还对正常人类肝脏细胞系L02和4个肝癌细胞系Huh7、HepG2、SMMC-7721、HepG2.2.2.15中的LncRNA SNHG12表达展开比较。我们发现在4个肝癌细胞系中的LncRNA SNHG12表达水平要高于正常人类肝脏细胞系(P < 0.05,图 1E)。最后,我们分析了LncRNA SNHG12表达水平与其他临床病理特征之间的关联,发现LncRNA SNHG12表达水平与肿瘤大小、TNM分期、淋巴结转移存在正相关的关系(P < 0.05)。
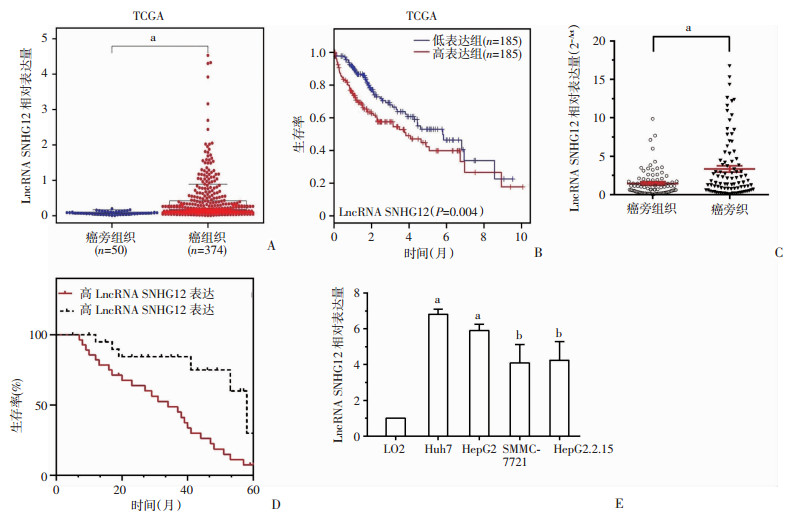
|
| A:根据癌症基因图谱(TCGA)中的微阵列数据集合,相比于正常肝脏组织(正常组;n=50),LncRNA SNHG12在HCC组织中被上调(肿瘤组;n=374);B:按照TCGA的数据集合,利用Kaplan-Meier生存曲线来评估LncRNA SNHG12表达较高和较低HCC患者的预后情况;C:利用RT-qPCR来检测90对HCC和相邻正常组织中的LncRNA SNHG12表达;D:基于90对HCC患者的数据集合,利用Kaplan-Meier生存曲线来评估LncRNA SNHG12表达较高和较低的HCC患者预后情况;E:正常人类肝脏细胞系L02和4种肝癌细胞系中的LncRNA SNHG12表达水平 a: P < 0.01; b: P < 0.001 图 1 LINC00346在HCC中表达上调并与患者预后有关 |
2.2 LncRNA SNHG12对肝癌细胞增殖与侵袭的影响
为了观察LncRNA SNHG12表达对肝癌细胞恶性行为的影响,我们首先测定了LncRNA SNHG12在Huh7和HepG2细胞在转染后的表达水平,以确认LncRNA SNHG12过表达与敲除质粒的有效性(P < 0.05, 图 2A)。接下来,展开MTT、集落形成实验、Transwell实验、划痕愈合实验。我们发现LncRNA SNHG12的过表达能够增强HCC的细胞活性、增殖、迁移及侵袭,而LncRNA SNHG12表达沉默则可抑制HCC的细胞活性、增殖、迁移及侵袭(P < 0.05, 图 2B~E)。因此,我们认为,LncRNA SNHG12在HCC的细胞中扮演了致癌基因的角色。

|
| A:RT-qPCR检测肝癌细胞中的LncRNA SNHG12过表达或敲除效力;B~D:MTT和集落形成实验检测HCC的细胞活性和增殖能力(×100);E~J:Transwell和划痕愈合实验分别检测HCC的细胞侵袭和迁移 a: P < 0.0001,b: P < 0.05,c: P < 0.001, d: P < 0.01 图 2 LncRNA SNHG12促进肝癌细胞的增殖与侵袭 |
| 临床及病理特征 | 例数 | LncRNA SNHG12表达水平 | P值 | |
| 高 | 低 | |||
| 年龄(岁) | ||||
| ≥50 | 52 | 8 | 44 | P=0.911 |
| <50 | 48 | 7 | 41 | |
| 性别 | ||||
| 男 | 74 | 10 | 61 | P=0.202 |
| 女 | 16 | 5 | 11 | |
| 肿瘤大小 | ||||
| ≥5 cm | 46 | 4 | 42 | P=0.038 |
| <5 cm | 44 | 11 | 33 | |
| TNM分期 | ||||
| Ⅰ-Ⅱ | 60 | 14 | 46 | P=0.016 |
| Ⅲ-Ⅳ | 30 | 1 | 29 | |
| 淋巴结转移 | ||||
| 有 | 49 | 13 | 36 | P=0.006 |
| 无 | 41 | 2 | 39 | |
2.3 LncRNA SNHG12在肝癌细胞中与miR-129-5p的相互作用
利用在线软件程序starBase v3.0(http://starbase.sysu.edu.cn/)预测miR-129-5p是LncRNA SNHG12的潜在下游靶标(图 3A)。为了确认LncRNA SNHG12直接靶向作用于miR-129-5p的假设,将野生型或变异型LncRNA SNHG12序列插入荧光素酶报告基因质粒中。随后的荧光素酶报告基因实验表明miR-129-5p确实能够直接与LncRNA SNHG12结合(P < 0.05, 图 3B、3C)。此外,我们发现miR-129-5p可以影响内源性LncRNA SNHG12表达水平(P < 0.05, 图 3D)。相反,我们发现内源性miR-129-5p表达水平受LncRNA SNHG12过表达或敲低的影响(P < 0.05, 图 3E)。我们还发现,miR-129-5p表达在HCC组织中被显著下调,而且展示出与LncRNA SNHG12表达之间的负相关关系(P < 0.05, 图 3F、3G)。结合起来看,这些结果显示LncRNA SNHG12可能充当miR-129-5p的分子海绵,从而下调miR-129-5p的表达水平。
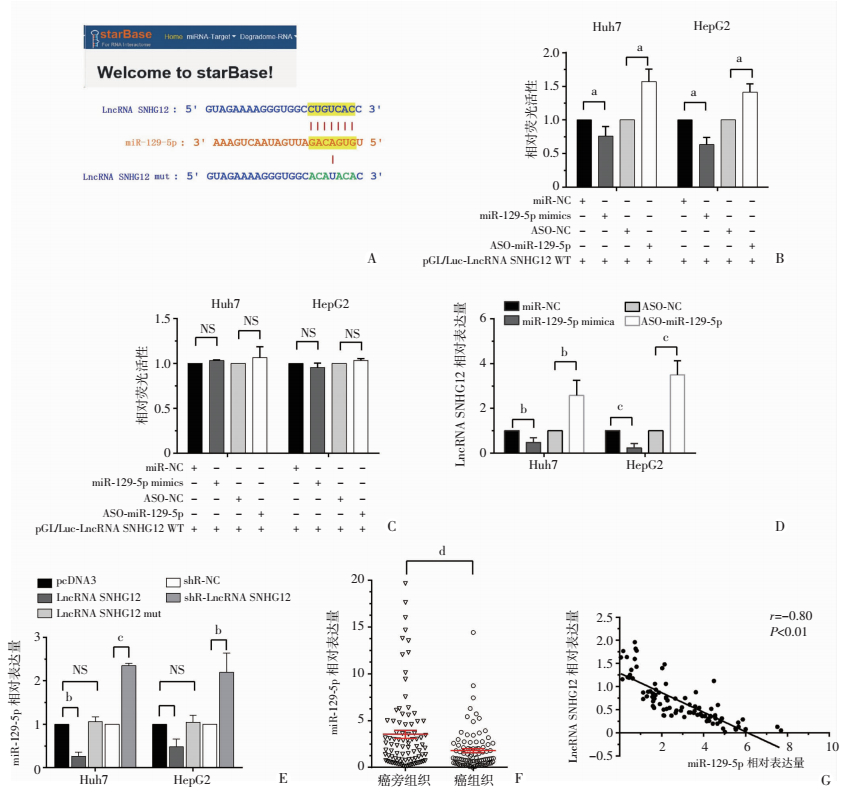
|
| A:使用StarBase v3.0软件来预测潜在LncRNA SNHG12 miRNA靶标;B、C:荧光素酶报告基因实验验证miR-129-5p是LncRNA SNHG12的一个靶向目标;D:RT-qPCR检测miR-129-5p影响内源性LncRNA SNHG12的水平;E:RT-qPCR检测LncRNA SNHG12影响内源性miR-129-5p的水平;F:RT-qPCR测定90对HCC和相邻正常组织中的miR-129-5p水平;G:LncRNA SNHG12与miR-129-5p表达之间相关性分析 a: P < 0.05,; b: P < 0.01,; c: P < 0.001,; d: P < 0.0001,NS:无统计学意义 图 3 LncRNA SNHG12靶向miR-129-5p的情况 |
2.4 LncRNA SNHG12通过miR-129-5p调控肝癌细胞的增殖与侵袭
我们通过RT-qPCR确认了miR-129-5p模拟物及其抑制剂的转染效率(P < 0.05, 图 4A),并利用MTT、集落形成、Transwell、划痕愈合实验,评估了miR-129-5p对HCC的细胞活性、增殖、迁移及侵袭中的影响。我们发现肝癌细胞在转染miR-129-5p模拟物之后,HCC的细胞活性、增殖、迁移、侵袭都出现了下降,而这些能力在转染了miR-129-5p抑制剂之后都出现了上升(P < 0.05, 图 4B~E)。接下来,通过展开挽救实验,验证LncRNA SNHG12是否在肝癌细胞中通过miR-129-5p发挥自己的生物学功能。我们发现miR-129-5p能够阻遏LncRNA SNHG12对肝癌细胞活性、增殖、迁移、侵袭的促进作用(P < 0.05, 图 5A~D)。因此,我们认为LncRNA SNHG12可通过调控miR-129-5p来促进肝癌细胞的活性、增殖、迁移与侵袭。

|
| A:RT-qPCR检测miR-129-5p的表达水平;B~D:MTT法和集落形成实验检测细胞活力和增殖能力;E~J:Transwell实验和划痕实验分别评价细胞侵袭和迁移(×100) a: P < 0.0001;b: P < 0.01;c: P < 0.001; d: P < 0.05 图 4 miR-129-5p抑制肝癌细胞的增殖与侵袭 |

|
| A、B:MTT和集落形成实验分别评估肝癌细胞的活性与增殖能力;C、D:Transwell和划痕愈合实验分别评估HCC的细胞侵袭与迁移(×100) a : P < 0.05; b: P < 0.001;c : P < 0.01;d: P < 0.0001 图 5 miR-129-5p可部分阻遏由LncRNA SNHG12所诱导的肝癌细胞的恶性行为 |
2.5 LncRNA SNHG12通过miR-129-5p调控GTPBP4的表达
为了研究miR-129-5p在HCC中的作用机制,我们使用在线软件程序starBase v3.0(http://starbase.sysu.edu.cn/)来预测miR-129-5p靶向目标,发现GTPBP4是miR-129-5p的潜在下游靶标(图 6A)。我们通过荧光素酶报告基因实验,发现miR-129-5p能够与GTPBP4的野生型3'-UTR结合,但不能够与GTPBP4变异型3'-UTR结合(P < 0.05, 图 6B)。我们发现miR-129-5p模拟物的转染能够导致内源性GTPBP4 mRNA和蛋白质水平的下降(P < 0.05, 图 6C、6D)。相反,我们发现miR-129-5p抑制剂的转染会导致内源性GTPBP4 mRNA和蛋白质水平的上调(P < 0.05, 图 6C、6D)。Western blot分析结果显示,HCC组织中的GTPBP4蛋白质水平显著高于相邻正常组织(P < 0.05, 图 6E)。此外,我们还通过免疫组织化学(IHC)发现GTPBP4在HCC组织中的表达水平要明显高于正常肝脏组织(P < 0.05, 图 6F)。而且,我们发现相比于非肿瘤组织,90个成对HCC组织中的GTPBP4 mRNA水平被上调(P < 0.05, 图 6G),并且,这些组织中的GTPBP4 mRNA水平表现出与miR-129-5p存在负相关性(P < 0.05, 图 6H)。为了验证LncRNA SNHG12表达敲除是否通过靶向作用于miR-129-5p来限制GTPBP4的表达,我们发现GTPBP4表达水平在LncRNA SNHG12敲除后显著降低,但是在转染miR-129-5p抑制剂后,至少部分恢复了GTPBP4的表达水平(P < 0.05, 图 6I)。相反,我们发现miR-129-5p过表达能够阻遏肝癌细胞中外源性LncRNA SNHG12诱导的GTPBP4表达(P < 0.05, 图 6J)。因此总的来说,我们认为LncRNA SNHG12可能通过与miR-129-5p实现竞争性结合,从而实现对GTPBP4表达的调控。

|
| A:TargetScan 7.1预测GTPBP4的3'UTR中miR-129-5p靶向序列。miR-129-5p的野生型(wt)靶向序列和包含了6个改造后核苷酸(GTPBP4 3'UTR-变异)的变异型(mut)。;B:荧光素酶实验检测验证GTPBP4是miR-129-5p的一个靶向目标;C:RT-qPCR检测miR-129-5p模拟物影响内源性GTPBP4 mRNA的水平;D:Western blot检测miR-129-5p模拟物影响内源性GTPBP4的蛋白水平;E:Western blot检测10对HCC和相邻正常组织中的GTPBP4表达;F:IHC分析HCC和邻近正常组织中GTPBP4的表达(×200);G:RT-qPCR测定90对HCC和正常相邻组织中的GTPBP4 mRNA水平;H:GTPBP4 mRNA和miR-129-5p表达水平之间的相关分析;I:Western blot检测肝癌细胞中的GTPBP4表达;J:Western blot检测共转染miR-129-5p模拟物抵消了LncRNA SNHG12在肝癌细胞诱导的GTPBP4上调作用 a: P < 0.05; b: P < 0.001; c: P < 0.01; d: P < 0.0001,NS:差异无统计学意义 图 6 LncRNA SNHG12通过miR-129-5p促进肝癌细胞中GTPBP4的表达 |
2.6 GTPBP4对肝癌细胞增殖与侵袭的影响
为了确定GTPBP4表达对肝癌细胞的影响,我们构建了GTPBP4过表达和敲除质粒,并通过RT-qPCR来确认其效力(P < 0.05, 图 7A)。接下来,通过MTT实验来评估GTPBP4对肝癌细胞活性的影响。我们发现Huh7和HepG2细胞的活性在外源性GTPBP4过表达之后被提高,而且该活性在GTPBP4敲除之后受到了抑制(P < 0.05, 图 7B)。在集落形成实验、Transwell实验、划痕愈合实验中也观察到了类似的趋势,表明HCC的细胞活性、增殖、迁移、侵袭力在GTPBP4过表达后得到了增强,相反,在GTPBP4沉默后受到了抑制(P < 0.05, 图 7C-E)。这些数据表明GTPBP4可能在肝癌细胞中充当了致癌因子。

|
| A:RT-qPCR检测肝癌细胞中的GTPBP4过表达以及敲除效应;B、C:MTT和集落形成实验分别检测细胞活性与增殖能力;D~F:Transwell和划痕愈合实验分别评估肝癌细胞的侵袭与迁移(×100) a: P < 0.001;b: P < 0.01; c: P < 0.05 图 7 GTPBP4促进HCC的细胞增殖与侵袭 |
2.7 LncRNA SNHG12在体内对miR-129-5p和GTPBP4的表达以及HCC生长的影响
为了确认LncRNA SNHG12在体内对HCC发展的影响,将Huh7细胞稳定转染上pSilencer-shR-LncRNA SNHG12或对照载体,注射到裸鼠的皮下。与对照组相比,在LncRNA SNHG12下调的Huh7异种移植物中,肿瘤大小与重量显著下降(P < 0.05, 图 8A~C)。此外,我们通过RT-qPCR发现shR-LncRNA SNHG12组内,LncRNA SNHG12和GTPBP4的表达水平下降,而miR-129-5p的表达水平上升(P < 0.05, 图 8D)。后续Western blot分析显示在shR-LncRNA SNHG12组中,GTPBP4、Survivin蛋白的表达水平显著低于对照组,而shR-LncRNA SNHG12中的E-钙黏蛋白的表达水平显著提高(P < 0.05, 图 8E)。在shR-LncRNA SNHG12组的IHC染色实验中也观察到了类似的趋势(P < 0.05, 图 8F)。由此我们认为,在体内,LncRNA SNHG12也可能通过与miR-129-5p的竞争性结合,以抵抗miR-129-5p对GTPBP4表达的抑制作用。
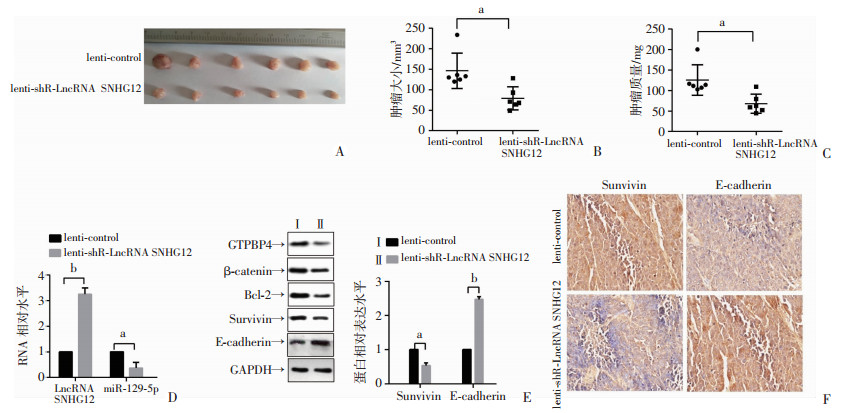
|
| A~C:LncRNA SNHG12下调抑制HCC肿瘤生长;D:RT-qPCR检测异种移植肿瘤中LncRNA SNHG12、miR-129-5p的表达;E、F:Western blot和IHC实验检测异种移植肿瘤中GTPBP4、Survivin蛋白、E-钙黏蛋白的蛋白表达水平(×200) a: P < 0.01; b: P < 0.001 图 8 LncRNA SNHG12通过miR-129-5p/GTPBP4促进体内HCC生长 |
3 讨论
LncRNA通常以转录或转录后方式调节关键基因的表达,包括致癌基因和肿瘤抑制基因,进而发挥生物学作用[10]。其可能充当竞争性内源RNA(competing endogenous RNA, ceRNA)来海绵化(sponging)microRNA(miRNA),从而影响miRNA的靶向基因表达[11]。本研究我们对HCC进展中LncRNA SNHG12所起的作用展开了研究。发现LncRNA SNHG12的表达在原发性HCC组织和肝癌细胞系中表达上调,这与TCGA以及RNA测序数据分析的结果一致[8-9]。我们发现LncRNA SNHG12充当了致癌的LncRNA,其可促进肝癌细胞活性、增殖、迁移与侵袭。机制上,我们发现LncRNA SNHG12可作为一种分子海绵,与miR-129-5p竞争性结合,从而缓解miR-129-5p对GTPBP4表达的抑制作用,最终促进HCC的进展。
最近报道表明LncRNA SNHG12在癌症发生、发展的调控中扮演了重要的角色。例如,WANG等[7]发现LncRNA SNHG12在宫颈癌中被上调,LncRNA SNHG12默化能够抑制膀胱癌细胞的增殖与迁移,并诱导细胞周期停滞与凋亡。LI等[5]报道称LncRNA SNHG12在胰腺癌中上调,它能够促进癌症细胞的生长与吉西他滨耐药,与miR-188-3p竞争性结合以及诱导BRD4能够机械地介导这一作用。此外,WANG等[12]发现LncRNA SNHG12作为一种致癌LncRNA,能够激活非小细胞肺癌(NSCLC)中的JAK-STAT3信号通道,促进细胞增殖,抑制细胞凋亡。LIU等[6]报道称LncRNA SNHG12的上调与肾癌患者的整体生存率不高有关。尽管TCGA和RNA测序数据已经表明LncRNA SNHG12在HCC中被上调[8-9],但是至今还没有详细的实验数据来阐明LncRNA SNHG12在HCC发生中的作用机制。
通过对作为连接载体的miR-129-5p展开生物信息学分析,发现它能够靶向作用于LncRNA SNHG12和GTPBP4的3'-UTR。报道称miR-129-5p可能通过靶向作用于Survivin蛋白来抑制肝癌细胞的增殖[13]。LI等[14]发现miR-129-5p可能通过激活TGF-β/Smad信号通道来促进HCC的转移。TAO等[15]发现miR-129-5p可能通过靶向作用于UBE3C来抑制HCC的转移和上皮间充质转化。ZHANG等[16]指出,miR-129-5p靶向作用于FZD7/Wnt信号通道,抑制肝癌细胞的生长。我们研究发现,miR-129-5p可能充当肿瘤抑制因子,抑制HCC的细胞活性、增殖、迁移及侵袭。
GTPBP4在胃癌、结直肠癌中表达显著上调,与肿瘤侵袭转移相关[17-18]。乳腺癌GTPBP4表达量高者的生存期较短[19]。在本研究中,我们发现GTPBP4在HCC组织中表达上调,并在肝癌细胞中发挥了致瘤的作用。
综上,我们发现LncRNA SNHG12在HCC作为一种致癌基因可与miR-129-5p的竞争性结合,从而充当分子海绵,阻遏miR-129-5p对促肝癌基因GTPBP4表达的抑制作用。我们的研究结果为理解肝癌中LncRNA SNHG12的致瘤作用机制提供了实验基础,将可能有助于确认新的HCC生物标记以及潜在的靶向疗法目标。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
PINATO D J, GUERRA N, FESSAS P, et al. Immune-based therapies for hepatocellular carcinoma[J]. Oncogene, 2020, 39(18): 3620-3637. |
| [3] |
GOODALL G J, WICKRAMASINGHE V O. RNA in cancer[J]. Nat Rev Cancer, 2021, 21(1): 22-36. |
| [4] |
HUANG Z, ZHOU J K, PENG Y, et al. The role of long noncoding RNAs in hepatocellular carcinoma[J]. Mol Cancer, 2020, 19(1): 77. |
| [5] |
LI Z R, YANG Q, ZHOU T, et al. Prognostic value of long noncoding RNA SNHG12 in various carcinomas: A meta-analysis[J]. Biomed Res Int, 2020, 2020: 8847401. |
| [6] |
LIU Y, CHENG G, HUANG Z, et al. Long noncoding RNA SNHG12 promotes tumour progression and sunitinib resistance by upregulating CDCA3 in renal cell carcinoma[J]. Cell Death Dis, 2020, 8;11(7): 515. |
| [7] |
WANG C, SHAO S, DENG L, et al. LncRNA SNHG12 regulates the radiosensitivity of cervical cancer through the miR-148a/CDK1 pathway[J]. Cancer Cell Int, 2020, 20(1): 554. |
| [8] |
ZHANG C, REN X, ZHANG W, et al. Prognostic and clinical significance of long non-coding RNA SNHG12 expression in various cancers[J]. Bioengineered, 2020, 11(1): 1112-1123. |
| [9] |
ZHANG J J, LOU W Y. A key mRNA-miRNA-lncRNA competing endogenous RNA triple sub-network linked to diagnosis and prognosis of hepatocellular carcinoma[J]. Front Oncol, 2020, 10: 340. |
| [10] |
PANNI S, LOVERING R C, PORRAS P, et al. Non-coding RNA regulatory networks[J]. Biochim Biophys Acta Gene Regul Mech, 2020, 1863(6): 194417. |
| [11] |
ZHAO Z, SUN W, GUO Z, et al. Mechanisms of lncRNA/microRNA interactions in angiogenesis[J]. Life Sci, 2020, 254: 116900. |
| [12] |
WANG P, CHEN D, MA H, et al. LncRNA SNHG12 contributes to multidrug resistance through activating the MAPK/Slug pathway by sponging miR-181a in non-small cell lung cancer[J]. Oncotarget, 2017, 8(48): 84086-84101. |
| [13] |
LIU Z, SUN J, WANG X, et al. MicroRNA-129-5p promotes proliferation and metastasis of hepatocellular carcinoma by regulating the BMP2 gene[J]. Exp Ther Med, 2021, 21(3): 257. |
| [14] |
LI Z, LU J, ZENG G, et al. MiR-129-5p inhibits liver cancer growth by targeting calcium calmodulin-dependent protein kinase Ⅳ (CAMK4)[J]. Cell Death Dis, 2019, 10(11): 789. |
| [15] |
TAO J, LIU Z, WANG Y, et al. MiR-129-5p inhibits metastasis and epithelial-mesenchymal transition of hepatocellular carcinoma by targeting UBE3C[J]. Biomed Pharmacother, 2017, 93: 420-428. |
| [16] |
ZHANG X, XU S, HU C, et al. LncRNA ST8SIA6-AS1 promotes hepatocellular carcinoma progression by regulating MAGEA3 and DCAF4L2 expression[J]. Biochem Biophys Res Commun, 2020, 533(4): 1039-1047. |
| [17] |
LI L, PANG X, ZHU Z, et al. GTPBP4 Promotes Gastric Cancer Progression via Regulating P53 Activity[J]. Cell Physiol Biochem, 2018, 45(2): 667-676. |
| [18] |
YU H, JIN S, ZHANG N, et al. Up-regulation of GTPBP4 in colorectal carcinoma is responsible for tumor metastasis[J]. Biochem Biophys Res Commun, 2016, 480(1): 48-54. |
| [19] |
LUNARDI A, DI MININ G, PROVERO P, et al. A genome-scale protein interaction profile of Drosophila p53 uncovers additional nodes of the human p53 network[J]. Proc Natl Acad Sci USA, 2010, 107(14): 6322-6327. |




