瘢痕的形成由各种原因的组织损伤引起,是组织自然修复的产物。目前常用的瘢痕治疗方法包括:药物、物理、激光、手术、放射等,对于明显的瘢痕畸形,手术松解仍是治疗首选,临床中可选择植皮、皮瓣或肌皮瓣移植改善瘢痕;但对于深部软组织损伤后继发的贴骨瘢痕,常规治疗方法因治疗时间长、治疗效果差或对供区组织损伤严重等因素,常不被患者接受,目前尚无合适的治疗方案。
脂肪组织内含干细胞及多种促再生因子,现已广泛用于面部年轻化治疗[1];也有研究指出脂肪移植对多种瘢痕的治疗有效[2-4],但尚未有脂肪组织对贴骨瘢痕的填充报道。传统的脂肪移植物内含较多成熟大颗粒脂肪,移植后脂肪吸收率较高,且不同部位吸收率存在明显差异。分析影响脂肪吸收的原因主要有:①注射的成熟脂肪细胞对缺氧、损伤的耐受力低,且不能增殖更新。②受区移植组织微血管重建缓慢。为了促使脂肪移植后具有更好的稳定性及可塑性,学者们对脂肪组织进行了不同方法的机械处理,通过破坏大颗粒脂肪细胞,希望获得的脂肪相关移植物内含有更多的血管基质组分(stromal vascular fraction,SVF)。SVF是一组异质性的细胞群,包含活性脂肪干细胞(adipose-derived stem cells,ADSCs)、脂肪前体细胞、内皮细胞及巨噬细胞等,它们围绕在脂肪细胞的周围,通过分泌生长因子、诱导分化等功能促进组织血管化,促使异常组织结构重塑,如瘢痕组织[5-6]。
为了在临床中进一步验证,笔者团队将抽吸的脂肪经机械乳化处理后得到含人源脂肪干细胞的SVF胶(SVF-gel)注射至贴骨瘢痕内,通过回顾性分析,结合图像资料、体外培养及检测鉴定、患者和观察者瘢痕评价量表以及客观的瘢痕硬度与厚度检测,探讨SVF-gel的制备及其对贴骨瘢痕组织修复重建中的临床应用可行性,同时尝试提出合理的治疗策略。
1 资料与方法 1.1 研究对象收集2018年6月至2020年6月西南医科大学附属医院整形烧伤外科收治的贴骨瘢痕患者。纳入标准:①各部位不同原因所致的贴骨瘢痕患者;②如患者存在其他功能障碍或抽脂填充需求,需不影响贴骨瘢痕SVF-gel注射治疗;③治疗时瘢痕病史超过1年,且自愿接受自体SVF-gel移植。排除标准:①贴骨瘢痕或其边缘以外2 cm内存在皮肤缺损或感染者;②贴骨瘢痕基底存在骨髓炎或其他感染者;③贴骨瘢痕近期已行激光、磨削等治疗者,或行激素注射等药物治疗者;④内科疾病处于活动期或存在相对手术禁忌者;⑤妊娠或哺乳期妇女。本研究通过西南医科大学附属医院伦理委员会审核[2020伦审(042)号]。
1.2 手术与操作 1.2.1 抽脂与SVF-gel制备选择患者腹部或大腿为供区,据患者总体病情及治疗方案选择局麻或全麻。术前检测抽脂区皮下脂肪厚度,并标记抽脂穿刺点及具体抽脂区域。配置肿胀麻醉液[3 000 mL生理盐水(37 ℃)+2%利多卡因30 mL+1‰肾上腺素3 mL],连接Body-jet水动力辅助吸脂系统(德国Human Med公司),以注水系统注射术区肿胀液适量,等待10 min左右;待肿胀液均匀分布后,选用直径为3 mm,侧孔2 mm的钝头多侧孔吸脂针,调节负压值为-50 kPa,选择适宜喷水强度,以连续、扇形、低负压模式抽吸脂肪与肿胀液的混合物。抽出的脂肪混悬液于专用储脂桶内同步静置,待抽脂完成后放去下层肿胀液,采用Coleman离心法将脂肪组织收集于50 mL螺纹注射器内,前置堵头,放入离心机内以1 200×g离心3 min,去除底层水分。将离心后的脂肪转移至10 mL注射器内,借鉴鲁峰团队报道的机械处理方法[7],通过孔径为1 mm的带刀头鲁尔转接器连接2个10 mL注射器,以每秒1次的速度来回推注10次,使脂肪乳糜化;将乳糜化的脂肪转移至20 mL螺纹注射器内,前置堵头,放入离心机内以2 000×g离心3 min,再次去除下层水分及上层油脂,剩余中层胶冻状组织则为SVF-gel。将离心后的SVF-gel转移至2 mL或1 mL注射器内备用。术后挤出供区皮下部分肿胀液,穿刺口修整后,以6-0单丝尼龙线缝合,无菌敷料覆盖,腹带或弹力绷带适度加压包扎。
1.2.2 瘢痕内腔隙准备术前瘢痕范围、注射穿刺点及穿刺隧道标记画线,如患者为局麻,则瘢痕注射区使用局麻药(2% 利多卡因10 mL+罗哌卡因5 mL+肾上腺素0.1 mL+灭菌注射用水15 mL);如患者全麻,则无需再次局麻。术区拟进针点以12号注射器针头刺破皮肤,应用前端呈“V”型的锐性剥离针对贴骨瘢痕进行多层面、多隧道的松解,为脂肪注射提供路径。预处理完成后,缓慢挤压出瘢痕腔隙内渗出的血液及组织液,适度压迫分离区域约5 min以止血。
1.2.3 SVF-gel移植将直径为1 mm的钝头注脂针与已经装好SVF-gel的1 mL或2 mL注射器共同连接于注脂枪上,调整刻度,使单次注入脂肪约0.02 mL。排除针头内的空气后进针,每个穿刺隧道内间隔2 mm注入0.02 mL SVF-gel,以凹陷处皮肤轻微隆起、注射点开始有脂肪外溢作为注射终点。观察进针处无明显活动性出血后,以7-0单丝尼龙线缝合关闭皮肤针孔。轻柔按摩SVF-gel注射区域,使其均匀分布在注射腔隙内。针孔处外涂红霉素眼膏,覆盖无菌敷料,术后1周内适度制动。
1.3 实验室培养及鉴定留取少量多余脂肪用于实验室消化后培养及鉴定,术前已取得患者同意,同时报医务部备案。体外实验分离培养脂肪源性间充质干细胞,由专职研究员在西南医科大学附属医院创面修复与再生实验室内进行。
1.3.1 细胞计数比较取同一患者等体积颗粒脂肪与SVF-gel进行同步体外消化培养,取同时间贴壁的原代细胞进行细胞计数,比较两种脂肪移植物内活性细胞数量。
1.3.2 细胞免疫表型鉴定间充质干细胞不表达特异性非间充质干细胞标志物,而不同干细胞之间存在部分相同标志物,选取间充质干细胞特异性标记物CD73、CD90、CD105,以及淋巴细胞标志物CD45、造血细胞标志物CD34、内皮细胞标志物CD31、巨噬细胞标志物CD14进行检测[8-9]。本研究取第3代培养细胞经消化分装后分别加入流式抗体CD14、CD31、CD34、CD45、CD73、CD90、CD105,设立阴性对照,使用流式细胞仪检测细胞表面抗原表达。
1.3.3 细胞成脂分化鉴定成体干细胞在一定的诱导条件下能够定向分化,为了检测ADSCs是否具有体外成脂分化潜能,本研究取第3代培养细胞经消化后再接种,待细胞融合时更换为成脂诱导液,成脂诱导2周后油红O染色观察成脂分化效果。
1.4 临床检测与评定 1.4.1 瘢痕厚度与硬度检测术前、术后7 d及术后6个月拍照记录贴骨瘢痕区图像资料,使用硬度计测量贴骨瘢痕组织硬度,使用20 MHz高频超声检测贴骨瘢痕皮肤厚度并与对侧同部位正常组织对比,分析超声声像图的特点。
1.4.2 患者和观察者瘢痕评价量表(patient and observer scar assessment scale, POSAS)及满意度评分术后6个月随访时,使用POSAS[10]评估瘢痕情况;其中,POSAS系统包括患者瘢痕评分系统(patient scar assessment scale, PSAS)和观察者瘢痕评分系统(observer scar assessment scale,OSAS)。PSAS评分是指观察者对患者瘢痕血管分布、色泽、厚度、粗糙度、柔软度、表面积进行评分,总分60分;OSAS评分是通过询问患者近期是否有瘙痒、疼痛;询问患者瘢痕颜色、厚度、硬度及规则度与正常皮肤差异情况,总分60分,评分越高表示瘢痕越严重。患者满意度评分分值范围为1~5分, 1分最差,5分最佳。
1.5 统计学分析采用SPSS 25.0统计软件进行分析,计量资料以x±s表示,采用配对t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 一般资料共入选8例贴骨瘢痕患者,累计10处贴骨瘢痕;其中男性3例,女性5例,年龄19~43(29.13±8.04)岁。缺损原因:烧伤4例,外伤2例,局部感染2例。病程1~22(6.38±8.25)年。瘢痕位置:胫骨前4处,前臂1处;头部1处;眉弓2处;胸骨1处,肋骨1处;凹陷区域面积最小1 cm×0.8 cm,最大5 cm×3 cm,为(5.56±4.50)cm2;SVF-gel质地均匀、细腻,贴骨瘢痕下SVF-gel注射量1~11(3.9±3.0)mL。
2.2 实验室检测 2.2.1 ADSCs培养及成脂诱导鉴定SVF-gel与颗粒脂肪经消化后均可见ADSCs生长,ADSCs呈成纤维细胞样的短梭形、涡旋状生长,形态饱满且折光性很强(图 1A、B);10 mL颗粒脂肪与10 mL SVF-gel消化培养, 同时间贴壁的原代细胞计数分别为1.8×105、2.7×105。
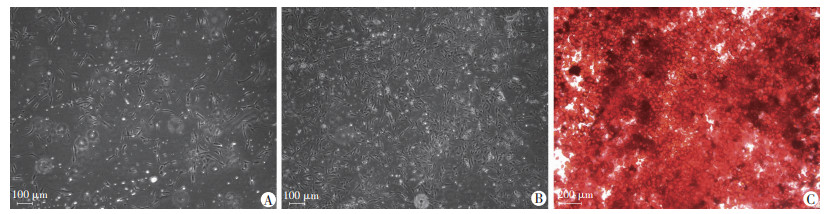
|
| A:颗粒脂肪内ADSCs体外培养第5天细胞形态;B:SVF-gel内ADSCs体外培养第5天细胞形态;C:成脂诱导2周油红O染色 图 1 倒置荧光显微镜观察ADSCs形态学、细胞数量与成脂诱导染色 |
体外诱导培养过程中,细胞由成纤维细胞样的短梭形、多角形或三角形逐渐变为圆形,胞质内出现细小脂滴、细胞排列无序。随着培养时间的延长,充脂细胞明显增多;继续培养,脂滴逐渐增大,脂滴融合,经成脂诱导2周后油红O染色呈阳性(图 1C)。
2.2.2 细胞表型鉴定所培养细胞对间充质干细胞特异性标志物CD73、CD90、CD105的表达率均大于95%,呈阳性表达(图 2A~C);而CD14、CD31、CD34、CD45呈阴性表达(图 2D~G)。
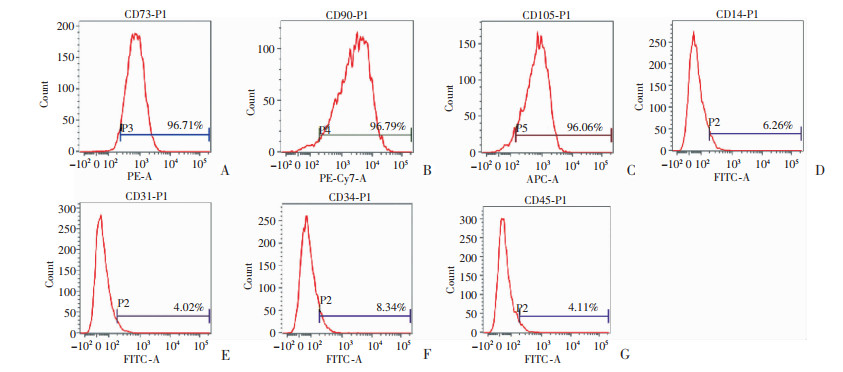
|
| A:CD73;B:CD90;C:CD105;D:CD14;E:CD31;F:CD34;G:CD45 图 2 流式细胞仪检测培养细胞表面标志物的表达 |
2.3 临床效果 2.3.1 瘢痕皮肤硬度与厚度检测
SVF-gel注射治疗贴骨瘢痕6个月后,瘢痕硬度明显降低,差异有统计学意义(P < 0.05);瘢痕皮肤厚度增加,差异有统计学意义(P < 0.05,表 1)。
| 时间 | 瘢痕硬度/邵氏单位 | 瘢痕皮肤厚度/mm |
| 术前 | 48.13±20.59 | 2.00±0.60 |
| 术后6个月 | 30.96±15.66 | 2.72±0.63 |
| t值 | 10.21 | -15.81 |
| P值 | <0.05 | <0.05 |
2.3.2 超声声像图的特点
20 MHz高频超声检测贴骨瘢痕提示各皮肤亚层分界不清楚,排列紊乱,真皮层回声强度不均一(图 3A);经SVF-gel注射术后7 d,瘢痕皮肤厚度增加,真皮内可见低回声组织结构(图 3B);术后6个月,瘢痕皮肤厚度均匀增加,真皮内散在低回声结构,回声强度较正常皮肤稍低(图 3C);对侧肢体同部位正常皮肤内各层组织结构完整,分界清楚(图 3D)。
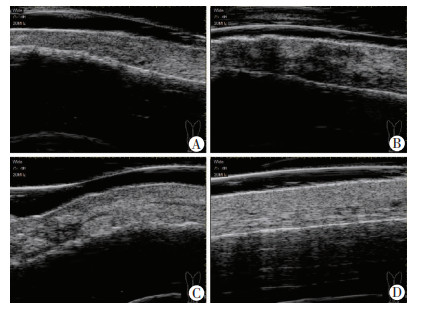
|
| A:贴骨瘢痕术前;B:贴骨瘢痕经SVF-gel注射术后7 d;C:贴骨瘢痕经SVF-gel注射术后6个月;D:贴骨瘢痕对侧肢体同部位正常皮肤 图 3 贴骨瘢痕治疗前后及同部位正常皮肤高频超声皮肤声像表现 |
2.3.3 瘢痕评分与满意度评分
治疗结束6个月后,患者评分量表(PSAS) 和观察者评分量表(OSAS) 分数分别为(12.0±2.8) 分和(13.7±3.9) 分。所有患者治疗后无血肿、结节、液化、感染、组织坏死等并发症发生,患者满意度评分为4~5分,平均4.6分。
2.3.4 典型病例男性患者,37岁,1年前因烧伤住院治疗,大部分创面于伤后2个月内愈合,右小腿胫骨前残余一大小约4 cm×1.2 cm胫骨外露创面,因周围均为瘢痕组织,患者要求保守换药,经门诊换药愈合,形成贴骨瘢痕,后局部出现凹陷萎缩畸形,且伴有瘙痒及疼痛,瘢痕面积约4 cm×1.5 cm。因患者同时存在腘窝瘢痕挛缩畸形及腹部抽脂需求,经腹部脂肪抽吸后取侧下腹全厚皮修复腘窝,抽吸的脂肪制备为SVF-gel,行胫骨前瘢痕注射治疗,注射量为3 mL,术后贴骨瘢痕处瘙痒疼痛不适消失,局部瘢痕外观质地改善(图 4)。患者对治疗效果非常满意,PSAS评分14分,OSAS评分18分。

|
| A:胫前骨外露;B:胫前贴骨瘢痕形成1年;C:贴骨瘢痕SVF-gel注射治疗6个月后随访 图 4 烧伤患者胫前贴骨瘢痕形成及SVF-gel注射治疗前后局部皮肤外观 |
3 讨论
脂肪移植不仅可填充局部组织容积,还可以用于面部年轻化、促进创面愈合、改善瘢痕质地等[11-12]。研究发现,不同组织成分及性状的脂肪移植物具有不同的移植效果;TONNARD[13]与OSINGA等[14]使用双向转换阀连接注射器,对脂肪进行机械处理,经滤网过滤,获得“纳米脂肪”,用于面部年轻化注射。国内学者认为“纳米脂肪”并非纳米级,故提出“乳糜脂肪”概念,但其仍含较多肿胀液及油脂,其内有效组织含量不高,且油脂易引起局部过度炎症反应,影响治疗效果。
笔者团队将脂肪离心-乳化-再离心并去掉肿胀液及油脂后,获得了凝胶状移植物SVF-gel。本研究发现SVF-gel与颗粒脂肪经消化后培养均可见短梭形细胞生长,经细胞表型鉴定,间充质干细胞特异性标志物CD73、CD90、CD105表达率均大于95%,证实所培养细胞为间充质干细胞;同时间同体积的SVF-gel经消化后培养的原代细胞数明显多于颗粒脂肪,证实SVF-gel内含更多间充质干细胞;此外,细胞经体外诱导培养可见脂肪样细胞生长,且油红O染色阳性;证实所培养细胞为活性ADSCs。
贴骨瘢痕常由各种严重软组织损伤修复后产生,其瘢痕粘连于骨质,皮下组织结构紊乱,组织量少,故骨外瘢痕组织薄弱,形成局部凹陷及组织萎缩畸形,易因轻微碰撞致皮肤破溃,迁延不愈,严重者可导致癌变。
已有研究将SVF用于瘢痕的治疗,并推测SVF改善瘢痕作用机制为促进细胞增殖及组织血管化,减少炎症并增加成纤维细胞活性,促进瘢痕向正常组织重塑[15]。因ADSCs多位于脂肪组织内脉管系统中[16],颗粒脂肪乳化离心去除油脂及肿胀液后,移植物内SVF与ADSCs同比例增加。相比于经典的颗粒脂肪或纳米脂肪,SVF-gel更加细腻,便于术者在深部(骨膜外) 和浅部(真皮内或皮下) 进行多平面、多隧道、多维度注射,术后吸收率更低,形态稳定性更好。
瘢痕的评价常用温哥华瘢痕量表(VSS),但其主观性较强,易影响结果的准确性。本研究中,笔者对贴骨瘢痕治疗前后进行了客观检测,使用硬度计直接检测瘢痕硬度,同时应用20 MHz高频超声检测贴骨瘢痕皮肤厚度,高频超声能清晰区分表皮、真皮及皮下组织层次结构,是目前诊断皮肤病变较佳的新型皮肤检测设备[17-18]。本研究发现,SVF-gel治疗6个月后,瘢痕硬度由(48.13±20.59)邵氏单位降低为(30.96± 15.66)邵氏单位,差异具有统计学意义(P < 0.05);瘢痕皮肤厚度由(2.00±0.60)mm增加至(2.72±0.63)mm,差异均有统计学意义(P < 0.05);同时超声声像图发现瘢痕真皮由回声强度不均一的紊乱结构逐渐转变为真皮内散在低回声结构,皮肤结构更接近正常皮肤。本研究中贴骨瘢痕均属于萎缩性瘢痕,其皮肤厚度均低于正常皮肤,而SVF-gel注射后瘢痕皮肤厚度增加,更接近正常皮肤厚度。因VSS同时存在瘢痕硬度及皮肤厚度评估,为避免重复,本研究使用POSAS评估瘢痕情况;治疗结束6个月后,PSAS和OSAS分数分别为(12.0±2.8)分和(13.7±3.9)分;对比患者术前术后图像资料发现,SVF-gel填充增加了瘢痕组织的容量,纠正了贴骨瘢痕凹陷,使瘢痕组织更柔软,瘢痕皮肤弹性增加,瘢痕挛缩疼痛及瘙痒不适明显减轻或消失;获得了满意的评价。
通过本研究结果及文献资料,我们推测SVF-gel治疗贴骨瘢痕的机制可能有以下几个方面:① SVF-gel内的胶原纤维等细胞外基质,对凹陷直接起到填充作用;②SVF-gel内的ADSCs、前脂肪细胞、内皮细胞和巨噬细胞等可参与分泌与再生密切相关的细胞因子[19-20],刺激受体区域的成纤维细胞再生和胶原纤维合成及重塑,使真皮增厚,且胶原排列更接近正常组织;③SVF-gel注射后可直接或间接使局部分化出皮肤附属器相关细胞[21],使瘢痕色泽和质地得到改善。
综上所述,颗粒脂肪经机械处理后形成的SVF-gel内含更多活性脂肪干细胞(ADSCs);贴骨瘢痕经SVF-gel注射治疗后局部凹陷减轻,瘢痕变软,皮肤厚度增加,皮肤结构接近正常皮肤;该疗法安全有效、创伤微小、操作简便,且患者易接受,值得临床推广。本研究不足之处为病例较少,随访期限尚短,缺乏病例对照研究,对其长期疗效及确切的作用机制尚需要进一步观察研究。
利益冲突声明 本文作者与论文刊登的内容无利益冲突
| [1] |
GAUR M, DOBKE M, LUNYAK V V. Mesenchymal stem cells from adipose tissue in clinical applications for dermatological indications and skin aging[J]. Int J Mol Sci, 2017, 18(1): 208. |
| [2] |
PICCOLO N S, PICCOLO M S, DE PAULA PICCOLO N, et al. Fat grafting for treatment of facial burns and burn scars[J]. Clin Plast Surg, 2020, 47(1): 119-130. |
| [3] |
WANG J, LIAO Y, DONG Z, et al. Treatment of nasal scars caused by skin necrosis from hyaluronic acid injections using stromal vascular fraction gel, a novel fat tissue-derived product[J]. Dermatol Surg, 2020, 46(7): 985-988. |
| [4] |
HE X, ZHANG J L, LUO L, et al. New progress of adipose-derived stem cells in the therapy of hypertrophic scars[J]. Curr Stem Cell Res Ther, 2020, 15(1): 77-85. |
| [5] |
GHIASLOO M, LOBATO R C, DÍAZ J M, et al. Expanding clinical indications of mechanically isolated stromal vascular fraction: a systematic review[J]. Aesthet Surg J, 2020, 40(9): NP546-NP560. |
| [6] |
MATTEI A, BERTRAND B, JOUVE E, et al. Feasibility of first injection of autologous adipose tissue-derived stromal vascular fraction in human scarred vocal folds: a nonrandomized controlled trial[J]. JAMA Otolaryngol Head Neck Surg, 2020, 146(4): 355-363. |
| [7] |
YAO Y, DONG Z Q, LIAO Y J, et al. Adipose extracellular matrix/stromal vascular fraction gel: a novel adipose tissue-derived injectable for stem cell therapy[J]. Plast Reconstr Surg, 2017, 139(4): 867-879. |
| [8] |
GONG C, WANG J H, CHENG Q, et al. Mesenchymal stromal cells in adipose tissue of breast cancer patients: a cross-sectional study[J]. Cell Mol Biol (Noisy-le-grand), 2020, 66(2): 71-73. |
| [9] |
PENG Q, ALIPOUR H, PORSBORG S, et al. Evolution of ASC immunophenotypical subsets during expansion in vitro[J]. Int J Mol Sci, 2020, 21(4): 1408. |
| [10] |
DRAAIJERS L J, TEMPELMAN F R, BOTMAN Y A, et al. The patient and observer scar assessment scale: a reliable and feasible tool for scar evaluation[J]. Plast Reconstr Surg, 2004, 113(7): 1960-1967. |
| [11] |
PLIKUS M V, GUERRERO-JUAREZ C F, ITO M, et al. Regeneration of fat cells from myofibroblasts during wound healing[J]. Science, 2017, 355(6326): 748-752. |
| [12] |
SHINGYOCHI Y, ORBAY H, MIZUNO H. Adipose-derived stem cells for wound repair and regeneration[J]. Expert Opin Biol Ther, 2015, 15(9): 1285-1292. |
| [13] |
TONNARD P, VERPAELE A, PEETERS G, et al. Nanofat grafting: basic research and clinical applications[J]. Plast Reconstr Surg, 2013, 132(4): 1017-1026. |
| [14] |
OSINGA R, MENZI N R, TCHANG L A H, et al. Effects of intersyringe processing on adipose tissue and its cellular components: implications in autologous fat grafting[J]. Plast Reconstr Surg, 2015, 135(6): 1618-1628. |
| [15] |
LEE J W, PARK S H, LEE S J, et al. Clinical impact of highly condensed stromal vascular fraction injection in surgical management of depressed and contracted scars[J]. Aesthetic Plast Surg, 2018, 42(6): 1689-1698. |
| [16] |
MAZINI L, ROCHETTE L, AMINE M, et al. Regenerative capacity of adipose derived stem cells (ADSCs), comparison with mesenchymal stem cells (MSCs)[J]. Int J Mol Sci, 2019, 20(10): 2523. |
| [17] |
MLOSEK R K, MIGDA B, MIGDA M. High-frequency ultrasound in the 21st century[J]. J Ultrason, 2021, 20(83): e233-e241. |
| [18] |
王雪, 杨茹茜, 杨雨婷, 等. 20 MHz高频超声对不同类型皮肤瘢痕的诊断价值[J]. 第三军医大学学报, 2020, 42(3): 282-287. WANG X, YANG R Q, YANG Y T, et al. Diagnostic value of 20 MHz high-frequency ultrasound for skin scars[J]. J Third Mil Med Univ, 2020, 42(3): 282-287. |
| [19] |
PALLUA N, KIM B S. Microfat and lipoconcentrate for the treatment of facial scars[J]. Clin Plast Surg, 2020, 47(1): 139-145. |
| [20] |
ZHAO S, QI W, ZHENG J, et al. Exosomes derived from adipose mesenchymal stem cells restore functional endometrium in a rat model of intrauterine adhesions[J]. Reprod Sci, 2020, 27(6): 1266-1275. |
| [21] |
DRISKELL R R, LICHTENBERGER B M, HOSTE E, et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair[J]. Nature, 2013, 504(7479): 277-281. |




