皮肤受损后形成的创面,一般4周内即可愈合,若持续数月不愈合则被定义为慢性创面。近年来,慢性创面的发病率逐渐升高,据报道,慢性创面患者占外科住院患者总数的1.5%~3.0%[1]。目前,对于慢性创面的处理常规有清创、换药等方法,以此促进创面愈合或进行创面床的准备,但对于不愈创面的最终手段是手术自体皮肤移植或皮瓣转移修复。部分患者因身体条件的限制不能进行手术修复,且多数慢性溃疡患者合并糖尿病、静脉曲张等基础疾病,若进行手术修复常存在供皮区不愈、易感染等问题。同时创面反复感染还可能导致癌变,甚至截肢,对患者身心健康造成巨大影响。对于此类患者,非侵入性、无明显疼痛的低频电刺激疗法不失为最佳选择。低频电刺激疗法是一种通过电极向靶组织输送低电流的疗法。在人体皮肤表面,由于钠离子分布完整使得皮肤表皮具有电势,表皮受损会引起电流的变化从而产生电场,而低频电刺激作为外源性电场,作用于皮肤创面,可加速损伤皮肤的修复[2-3]。而目前,国内外对于低频电刺激疗法的作用途径研究甚少。因此, 本研究通过低频电刺激(electrical stimulation,ES)治疗慢性创面,观察创面愈合速度、感染控制情况及血流灌注量的变化,探讨低频电刺激疗法对创面愈合的作用途径和潜在机制,为慢性创面的治疗提供新的思路。
1 资料与方法 1.1 一般资料选取2017年9月至2020年9月本院收治的48例慢性创面患者作为研究对象,患者病程31~65 d,溃疡部位:肩部3例,背部2例,小腿21例,足22例;其中感染性溃疡15例、糖尿病性溃疡27例、结缔组织病性溃疡6例。纳入标准:入院符合慢性创面诊断标准的患者。排除标准:合并严重的心、肺、肝、肾功能不全;合并肿瘤;CT血管造影(CTA)提示下肢血管闭塞;血糖波动≥15 mmol/L的糖尿病患者;外科清创后出现骨外露;除局部出现红肿热痛体征外,出现严重全身炎症反应患者;有已知的下肢深静脉血栓或血栓性静脉炎的患者。本研究通过本院伦理委员会批准(KY2017043),所有患者签订知情同意书。将患者按随机数字表法分为对照组和观察组,每组24例。两组患者在年龄、性别、创面面积、创面深度方面,差异无统计学意义(P>0.05,表 1),具有可比性。
| 组别 | n | 性别 | 年龄/岁 | 创面大小/cm2 | 创面深度/mm | |
| 男 | 女 | |||||
| 观察组 | 24 | 12 | 12 | 55.44±1.32 | 8.3±4.6 | 6.5±3.1 |
| 对照组 | 24 | 13 | 11 | 53.24±2.24 | 8.7±4.1 | 6.7±3.3 |
| 检验统计量 | χ2=0.960 | t=1.351 | t=0.108 | t=0.064 | ||
| P值 | 0.809 | 0.817 | 0.657 | 0.743 | ||
1.2 创面处理
对照组:每次更换敷料时伤口取分泌物培养,清洁伤口及其周围,用0.5%碘伏消毒创面及周围正常皮肤,伤口处理以TIME(评估伤口、控制感染、保持湿平衡、促进伤口边缘上皮化)原则,使用湿性敷料创造利于促进愈合的微环境,清除坏死组织;控制伤口感染,依据药敏结果调整抗生素;调整患者血糖,给予营养支持。
观察组:在对照组基础上,应用荷兰超声电疗工作站Myomed632VUX,参照文献[2-3]的方法,制定治疗参数:频率100 Hz,波升∶波降为3 s ∶3 s,电流强度15 mA,每次30 min,1次/d,5次/周。将2个电极跨越创面分别放置于边缘2个相对健康的皮肤上,对创面进行低频电刺激,直至创面愈合。
1.3 观察指标 1.3.1 创面愈合率观察两组患者治疗3、7、14、21 d时创面愈合情况,采用eKare-inSight 3D创面测量系统,利用红外信号获取创面的3D构型,测量治疗前后的创面面积,计算创面的愈合率。
创面愈合率=[(治疗前创面面积-治疗后创面面积)/治疗前创面面积]×100%
1.3.2 感染控制时间隔日更换创面敷料,每次更换敷料时,取创面分泌物送细菌培养,并依据药敏结果调整抗生素。若培养出细菌则为感染未愈,若未培养出细菌或创面已愈合,则为感染治愈,记录两组感染控制时间。
1.3.3 创面血流灌注使用PeriScan PIM Ⅱ型激光多普勒血流灌注成像仪(瑞典PERIMED公司生产),测量创面的血流灌注,激光波长为670 nm。该仪器与计算机联机,使用随机附带软件系统分析图像,该软件在计算机显示器上同步生成血流灌注图、强度图和彩色照片,系统的测量值为血流灌注单位(perfusion unit,PU),红色表示高灌注,蓝色表示低灌注,进行体表血流图的记录、分析、处理和存贮。所有测量由同一位研究者在恒定室温和恒定光照的专用室内完成。测量前完全暴露并清洁目标区域,平静休息15 min,LSCI器械的激光头尽可能平行于创面放置,瞄准激光的红点,定位于距创面中心距离为20 cm,采集帧率为5图,测量时要求患者屏吸,并固定体位5 s以减轻呼吸运动及体位移动对结果产生干扰。因14 d后部分患者创面已愈合,创面血流灌注的数据已无法采集,故采集在1、3、7、14 d每次电刺激前、电刺激治疗10、20、30 min后创面血流灌注情况。取创面内4个方向各10 mm2血流灌注量的平均值进行分析。
1.4 统计学分析收集整理临床所得数据,建立数据库。采用SPSS 19.0统计软件对数据进行分析。组间差异采用t检验,多组间比较采用单因素方差分析,不满足条件的数据采用四分位间距进行资料描述。采用双侧检验,检验水准α=0.05。
2 结果 2.1 创面愈合情况与对照组比较,在经过低频电刺激治疗后,观察组创面愈合加速,治疗21 d后,慢性溃疡愈合率能达到(97.18±2.76)%,两组不同时间点创面愈合差异均有统计学意义(P < 0.05,表 2)。
| 组别 | 3 d | 7 d | 14 d | 21 d |
| 观察组 | 19.75±3.47 | 38.72±3.88 | 87.59±5.81 | 97.18±2.76 |
| 对照组 | 15.41±1.58 | 24.80±4.13 | 54.91±6.24 | 71.09±6.82 |
| t值 | 13.573 | 21.592 | 33.207 | 8.691 |
| P值 | 0.010 | 0.001 | 0.001 | 0.001 |
2.2 创面感染控制情况
低频电刺激治疗后,观察组创面感染得到控制的时间较对照组明显减少[(8.83±5.75) vs (12.41±9.52)d,P < 0.05]。
2.3 创面血流灌注情况治疗前,两组血流灌注差异无统计学意义。经过低频电刺激治疗后,观察组不仅每次电刺激即刻创面血流灌注量较对照组明显增大(P < 0.05,表 3),且在脱离电刺激后,创面血流灌注从治疗后3 d起较对照组明显增加(P < 0.01),且随时间推移,此差异逐渐增大,并呈上升趋势(P < 0.01,表 4)。两组治疗前后创面愈合情况见图 1、2。
| 组别 | 电刺激前 | 电刺激后 | F值 | P值 | ||
| 10 min | 20 min | 30 min | ||||
| 观察组 | 183.47±29.24 | 299.69±16.39a | 341.95±28.68ab | 430.93±40.44abc | 471.80 | 0.001 |
| 对照组 | 155.71±5.73 | 155.85±5.64 | 154.30±6.18 | 156.24±5.49 | 0.947 | 0.419 |
| a:P < 0.05,与对照组比较;b: P < 0.05,与电刺激后10 min比较;c: P < 0.05,与电刺激后20 min比较 | ||||||
| 组别 | 1 d | 3 d | 7 d | 14 d | F值 | P值 |
| 观察组 | 160.94±9.64 | 287.22±13.14ab | 307.82±13.72abc | 372.46±14.76abcd | 466.654 | 0.001 |
| 对照组 | 154.70±6.49 | 155.20±5.62 | 153.56±6.72 | 156.00±4.53 | 0.328 | 0.805 |
| a:P < 0.05,与对照组比较;b:P < 0.05,与1 d比较;c:P < 0.05,与3 d比较;d:P < 0.05,与7 d比较 | ||||||
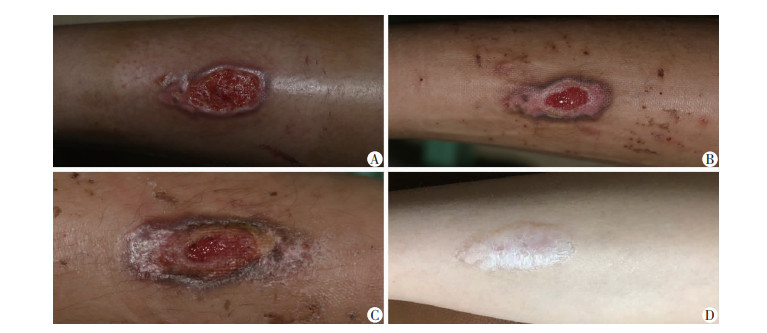
|
| A:治疗1 d 创面边缘无明显上皮化,创面血流灌注154.3 PU;B:治疗7 d 创面边缘上皮爬行,创面血流灌注374.3 PU,创面愈合60.3%;C:治疗14 d 创面边缘明显上皮化,创面血流灌注420.9 PU,创面愈合94.2%;D:创面愈合4+月 所形成瘢痕质软平整 图 1 观察组患者低频电刺激治疗后不同时间创面愈合情况 |
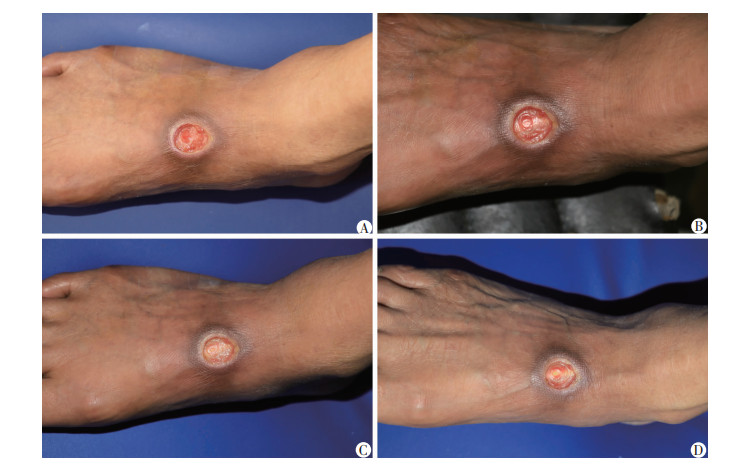
|
| A:治疗1 d 创面边缘无明显上皮化,基底无明显生长,创面血流灌注160.7 PU;B:治疗7 d 创面及基底无明显变化,创面血流灌注173.7 PU,创面愈合20.5%;C:治疗14 d 创面及基底无明显变化,创面血流灌注177.3 PU,创面愈合30.7%;D:治疗21 d 创面及基底无明显变化,创面血流灌注167.9 PU,创面愈合40.2% 图 2 对照组患者治疗后不同时间创面愈合情况 |
3 讨论
慢性创面的形成常见原因为血供缺乏、创面感染、血糖过高、压力损伤及结缔组织疾病等,若在未解决上述问题的情况下,贸然采用取皮植皮、游离皮瓣方式覆盖创面,不仅容易出现植皮皮片、皮瓣坏死,同时还会导致供区新的创面形成。能否在再通血供、治疗感染、平稳血糖的同时,使创面达到愈合,从而缩短整个治疗周期成为临床亟待解决的问题[1]。另外一方面,随着医学的发展,提供个性化治疗方案、减少患者痛苦并降低其费用、减轻社会负担是慢性创面未来的治疗趋势。而低频电刺激作为外源性电场,具有安全、有效、无创、无痛以及治疗费用低等优势,同时其作用于皮肤创面可兴奋损伤性内源性电场[2-3],增强创面的抗感染能力、增加创面的血流灌注、加速慢性创面的修复。
本实验证明,低频电刺激可以加快创面愈合速度。通过观察不同时间点低频电刺激疗效发现,14 d时低频电刺激创面愈合率接近90%,而对照组不到60%,极大地缩短了治疗时间。已有相关研究表明[4],生物电场促进创面愈合的方式主要是通过募集并指导角质形成细胞与成纤维细胞的定向运动。皮肤组织损伤后,创面电流立即形成,可持续数天直至创面愈合。也有实验证实[5],糖尿病创面电流与创面愈合速率有显著相关性,提示弱电可能是慢性伤口修复迟缓的原因之一。通过药物提高或降低离子泵来升高或降低角膜跨上皮电位和创面电流,会加快或延缓创面愈合速率。对于慢性创面,给予低频电刺激后,外源电场不仅可以增强成纤维细胞生长因子、多种类型胶原和玻连蛋白等细胞的趋电反应,使创面由炎症期向增殖期的转变,而且在后续过程中还可促进细胞内多种金属离子依赖酶如胆碱酯酶、组胺酶以及MMP-2、单核细胞趋化蛋白-1(MCP-1)和血红素加氧酶-1(HO-1)的表达,加速创面愈合[6]。
在创面愈合过程中,感染始终是制约创面愈合的重要因素。本研究结果显示,低频电刺激具有抗菌作用。研究表明,pH值为7.2~7.4时,有利于病原菌繁殖生长。而人体血液、组织液的酸碱度为7.2,皮肤屏障破坏后的创面,利于细菌的繁殖,加上慢性创面组织液长期渗出,细菌及其分泌物、代谢产物破坏创面组织稳态,改变创基微环境,为细菌的生长繁殖提供了良好的培养基。同时不规范的治疗,使创面合并耐药菌感染,导致感染顽固,且易反复。而本研究显示,给予低频电刺激的患者,创面感染得到控制的时间明显缩短。这与低频电刺激创面能吸引巨噬细胞和中性粒细胞趋向创面以增强杀菌过程有关[7-10]。当创面上出现炎症和渗出时,巨噬细胞和多形核粒细胞可通过自溶移除无活性组织。纤维蛋白及其降解物对中性粒细胞和单核细胞这些具有吞噬创面细菌和坏死组织作用的细胞有化学趋化作用。另外,由于电流改变了细菌细胞膜的结构,细胞膜蛋白在电流下产生电泳运动,导致细菌新陈代谢、生长受到影响。此外,电刺激过程中的电解产物如过氧化氢、氧自由基等也起到抗感染作用,它们不仅可以破坏细胞膜完整性,而且使细胞质基本成分从细胞膜渗漏,导致细菌呼吸频率也下降,最后导致细菌死亡[11]。
创面愈合过程中,充足的血流循环起着至关重要的作用。丰富的血流循环为慢性创面的修复提供所必需的氧含量及细胞活性物质,从而有利于创面愈合。而在慢性创面中,由于基础疾病及感染的原因,创面迁延不愈,创区出现毛细血管变细,使创面循环障碍,充血异常,长期处于低氧状态导致自身调节能力异常,影响中性粒细胞和巨噬细胞的吞噬和抗炎、抗感染的功能。本研究结果显示,经过低频电刺激,观察组创面的即刻血流灌注不仅每次电疗期间较对照组明显增强,且脱离电刺激后,该效应随时间推移逐渐增大,创面的血流灌注量较对照组持续增高。分析其原因:一方面是因为短时间的低频电刺激在创面周围皮肤感受器引起轴突反射,导致生物活性物质释放,如乙酰胆碱、组胺等物质,进而引起小动脉扩张及毛细血管扩张,引起更为持久的充血[6]。这与治疗中每次低频电刺激时,即刻血流灌注增加是呼应的。另一方面,也与低频电刺激促进新生血管形成有关。PAN等[12]及WANG等[13]认为,电刺激可以激活ERK1/2通路,从而促进FGF-2、VEGFR2、Tie-2分泌,而在体外试验中已证实,FGF-2、VEGFR2、Tie-2水平高低与血管生成的数量直接相关。这与本研究结论是一致的。
综上所述,本研究显示低频电刺激疗法能明显提高慢性创面愈合率。这与其增强创面抗菌作用,减少创面细菌感染,并可即刻和持续增加创面血流灌注有关。本研究结果为电刺激治疗慢性难愈创面的应用提供了实验依据,但电刺激后对创面细胞的影响及其具体作用的通路等更深层次机制还需要进一步实验研究。
| [1] |
姚泽欣, 付小兵, 程飚. 慢性创面愈合新理念: 姑息性创面治疗的研究进展[J]. 中华烧伤杂志, 2020, 36(8): 754-757. YAO Z X, FU X B, CHENG B. New concept of chronic wound healing: advances in the research of the management, palliative care[J]. Chin J Burns, 2020, 36(8): 754-757. |
| [2] |
RAMADAN A, ELSAIDY M, ZYADA R. Effect of low-intensity direct current on the healing of chronic wounds: a literature review[J]. J Wound Care, 2008, 17(7): 292-296. |
| [3] |
GALLI C, PEDRAZZI G, GUIZZARDI S. The cellular effects of pulsed electromagnetic fields on osteoblasts: a review[J]. Bioelectromagnetics, 2019, 40(4): 211-233. |
| [4] |
PULLAR C E, BAIER B S, KARIYA Y, et al. Beta4 integrin and epidermal growth factor coordinately regulate electric field-mediated directional migration via Rac1[J]. Mol Biol Cell, 2006, 17(11): 4925-4935. |
| [5] |
沈云芸. 生理电场在糖尿病创面愈合中的作用研究[D]. 杭州: 浙江大学, 2016. SHEN Y Y. The role of physiological electric field in diabetic wound healing[D]. Hangzhou: Zhejiang University, 2016. |
| [6] |
董琛, 余州, 袁华, 等. 脉冲电磁场促进创面愈合的作用机制研究进展[J]. 中华实验外科杂志, 2019, 36(12): 2298-2302. DONG C, YU Z, YUAN H, et al. Advances in the effect and mechanism for woundhealing promoted by pulsed electromagnetic field[J]. Chin J Exp Surg, 2019, 36(12): 2298-2302. |
| [7] |
赵彦瑞, 周君琳. 电刺激抗感染的研究进展[J]. 中华创伤骨科杂志, 2016, 18(4): 361-364. ZHAO Y R, ZHOU J L. Research on anti-infection effect of electricidal stimulation[J]. Chin J Orthop Trauma, 2016, 18(4): 361-364. |
| [8] |
DEL POZO J L, ROUSE M S, EUBA G, et al. Prevention of Staphylococcus epidermidis biofilm formation using electrical current[J]. J Appl Biomater Funct Mater, 2014, 12(2): 81-83. |
| [9] |
张丽, 付小兵. 电磁疗法治疗慢性创面的基础与临床研究[J]. 中华损伤与修复杂志(电子版), 2016, 11(1): 68-71. ZHANG L, FU X B. Clinical and experimental research of electromagnetic therapy on chronic wounds[J]. Chin J Inj Repair Wound Heal (Electron Ed), 2016, 11(1): 68-71. |
| [10] |
NODZO S R, TOBIAS M, AHN R, et al. Electrical stimulation combined with antibiotics treats periprosthetic joint infection[C]. Orlando: American Academy of Orthopaedic Surgeons, 2016.
|
| [11] |
ASHRAFI M, BAGUNEID M, ALONSO-RASGADO T, et al. Cutaneous wound biofilm and the potential for electrical stimulation in management of the microbiome[J]. Future Microbiol, 2017, 12: 337-357. |
| [12] |
PAN Y H, DONG Y S, HOU W G, et al. Effects of PEMF on microcirculation and angiogenesis in a model of acute hindlimb ischemia in diabetic rats[J]. Bioelectromagnetics, 2013, 34(3): 180-188. |
| [13] |
WANG Y L, ROUABHIA M, ZHANG Z. Pulsed electrical stimulation benefits wound healing by activating skin fibroblasts through the TGFβ1/ERK/NF-κB axis[J]. Biochim Biophys Acta, 2016, 1860(7): 1551-1559. |




