经尿道膀胱肿瘤电切(transurethral resection of the bladder tumor, TURBT)是非肌层浸润性膀胱癌(nonmuscle-invasive bladder cancer, NMIBC)治疗的金标准和肌层浸润性膀胱癌(muscle-invasive bladder cancer, MIBC)姑息治疗的重要方式[1]。其不稳定的术后复发率和复发后的病理进展越来越引起泌尿外科医生的关注[2-4]。究其机制,一方面电切术中膀胱尿路上皮癌瘤体形态改变,容易引起切除的不彻底;另一方面,电切时肿瘤组织破碎可引起肿瘤细胞在膀胱腔内播撒。从分子生物学机制出发,上述现象亦可能与肿瘤细胞热损伤所介导的恶性程度增加有关[5-7]。该机制已在多种肿瘤模型中被广泛证实,但在TURBT中尚少见报道。
近期研究表明,热损伤或缺氧可诱导肿瘤细胞产生转运RNA应激诱导的碎片(transfer RNA stress-induced fragments, tiRNAs or tRFs)以调节其自身的生物学行为[8-9]。例如,在与膀胱尿路上皮癌同样具有较强异质性的乳腺癌中[10-12],缺氧刺激可抑制高侵袭性乳腺癌细胞LM2表达tRFGln,且向LM2细胞内转染tRFGln可抑制其增殖与侵袭,而沉默低侵袭性乳腺癌细胞MDA中的tRFGln却增强了该细胞的增殖与侵袭[13]。类似的研究观察到,tRFLeu/miR-1280可通过干预JAG2/Notch通路抑制结肠癌干细胞的自我更新和转移[14]。以上研究提示,高度恶性的肿瘤细胞可以通过抑制自身tRNA裂解来抵抗环境变化,而低度恶性的肿瘤细胞产生的tRFs可能具有抗肿瘤效果。基于此种假设,本研究采用测序技术,筛选热损伤后在低度恶性的膀胱尿路上皮癌细胞(bladder urothelial carcinoma, BUC)中表达上调,但在热损伤后高度恶性的BUC细胞中表达下降的tRF,观察该tRF对BUC细胞增殖与侵袭能力的影响,以期达到探索TURBT术后复发和进展机制的目的,为临床中膀胱肿瘤基因治疗提供可能的靶点。
1 资料与方法 1.1 试验材料收集2017年9月至2020年9月间于重庆医科大学附属第二医院泌尿外科行第1次及第2次TURBT的NMIBC患者。纳入标准:原发性膀胱尿路上皮癌诊断明确;第1次TUBRT术前未接受放疗、静脉化疗、介入治疗;术后仅行常规方案吡柔比星膀胱灌注化疗;临床基线资料及瘤体标本保存完整。排除标准:转移性膀胱肿瘤或合并其他恶性肿瘤疾病;接受过纳入标准之外其他肿瘤治疗;TURBT术后行其他药物灌注化疗;临床基线资料或标本保存不完整。本实验通过重庆医科大学附属第二医院伦理委员会批准(2017-4-190)。参与试验的患者均签署知情同意书,其术后肿瘤标本液氮冻存。
主要试剂:RPMI1640培养基(美国Corning公司),胎牛血清(美国Gibco公司),miRNA Purification Kit试剂盒、miRNA cDNA Synthesis Kit试剂盒、miRNA qPCR Assay Kit试剂盒(北京康为世纪公司),Cell Counting Kit-8(CCK-8)试剂盒(武汉博士德公司),LipofectamineTM3000(美国Thermo公司),tRF-Ile-AAT-1的mimic和inhibitor(上海吉荧生物技术公司)。
1.2 实验方法 1.2.1 细胞培养、热损伤处理及细胞转染人高度恶性BUC细胞T24和低度恶性BUC细胞5637由重庆医科大学附属第二医院中心实验保存,购自中国科学院上海生科院细胞资源中心。所有细胞培养在含10%胎牛血清和青链霉素双抗的RPMI1640培养基中,置于37 ℃、5%CO2的培养箱中培养。细胞生长达90%时传代培养,此处标记为:T24组和5637组。当细胞生长至80%~90%时,更换新鲜培养基,将培养皿漂浮于48 ℃恒温水浴箱内水浴10 min[15]。然后重新置于37 ℃并含5% CO2的培养箱中培养24 h备用,此处标记为:T24Heat组和5637Heat组。转染前24 h,将细胞接种到6孔板中,并根据Lipofectamine 3000说明书进行转染。使用Lipofectamine 3000转染tRF-Ile-AAT-1合成单链模拟物(mimic)、反义链(inhibitor)和相应的载体对照序列(LNA寡核苷酸修饰),序列见表 1,此处分别标记为:T24Heat+Mimic组、T24Heat+Inhibitor组、T24Heat+载体对照组;5637Heat+Mimic组、5637Heat+Inhibitor组、5637Heat+载体对照组。根据说明书,每个孔对tRF-Ile-AAT-1的mimic及inhibitor的最佳终浓度为100 nmol/L。
| 核苷酸 | 序列 | 产物长度/bp |
| mimic | 5′-UCCCCGUACGGGCCACCA-3′ | 18 |
| mimic载体对照 | 5′-UCUACUCUUUCUAGGAGGUUGUGA-3′ | 24 |
| inhibitor | 5′-T+G+GTGGCCCGTA+CGGG+G+A-3′ | 18 |
| inhibitor载体对照 | 5′-UCUACUCUUUCUAGGAGGUUGUGA-3′ | 24 |
1.2.2 提取miRNA
将BUC组织在液氮中磨碎,贴壁细胞吸去培养液后,分别加入TRIzol,振荡混匀,静置后再次离心。取上清加入氯仿,剧烈振荡,室温放置后再次离心。将上层液体移入离心管中,加入无水乙醇混匀,加入吸附柱RM(Spin Columns RM)中离心。弃吸附柱RM,向流出液加入乙醇,并加入吸附柱RS(Spin Columns RS)。离心后将吸附柱RS重新放回收集管中,加入Buffer RWT,离心后倒掉废液。再向吸附柱RS中加入Buffer RW2并离心,重复2次。将吸附柱RS置于室温晾干。再置于无酶离心管中,加入无酶水并室温放置1 min,离心后收集RNA溶液冻存于-80 ℃中备用。
1.2.3 tiRNA及tRF测序用NanoDrop ND-1000测定总RNA样品的纯度和浓度。对总RNA样品进行预处理,以去除一些干扰小RNA-seq文库构建的RNA修饰。将每个样品的总RNA依次连接到3′和5′小RNA衔接子上。然后使用Illumina的专有反转录引物和扩增引物合成并扩增cDNA。随后,从PAGE凝胶中提取并纯化134~160 bp PCR扩增片段。最后,通过Agilent 2100生物分析仪对完成的文库进行定量。使文库变性并稀释至1.3 mL的加载体积和1.8 pmol/L的加载浓度。根据制造商的说明,使用NextSeq 500/550 V2试剂盒(#FC-404-2005,Illumina)将稀释的文库加载到试剂盒中,并在Illumina NextSeq 500系统上进行测序。然后收集数据并进行分析。
1.2.4 RT-PCR检测用TRIzol试剂从细胞系和组织中提取miRNA,使用随机引物和逆转录酶PCR试剂盒合成cDNA。通过实时PCR评估筛选出的2个差异表达的tRFs。U6表达用作内部对照。各分子引物序列如表 2所示(试剂盒自带tRF-chrM.Ser-GCT和tRF-Ile-AAT-1通用的下游引物,未展示)。
| 分子 | 引物序列 | 产物长度/bp |
| U6 | 上游:5′-CTCGCTTCGGCAGCACA-3′下游:5′-AACGCTTCACGAATTTGCGT-3′ | 96 |
| tRF-chrM.Ser-GCT | 上游:5′-GAGAAAGCTCACAAGAACTGCT-3′ | 24 |
| tRF-Ile-AAT-1 | 上游:5′-TCCCCGTACGGGCCACC-3′ | 18 |
1.2.5 CCK-8检测细胞增殖
将BUC细胞按照每孔(4~4.5)×103接种到96孔平底微孔板中,并在T24Heat组、T24Heat+载体对照组、T24Heat+Mimic组、T24Heat+ Inhibitor组;5637Heat组、5637Heat+载体对照组、5637Heat+ Mimic组、5637Heat+Inhibitor组设置3个重复孔。将处理后的细胞培养24、48、72 h后,添加CCK-8试剂,并在450 nm下测量光密度值D(450),绘制相应的生长曲线。
1.2.6 流式细胞术检测细胞凋亡采用Annexin V-PI双染色进行定量分析。首先将漂浮的细胞放入1.5 mL EP管中,然后再用0.25%胰蛋白酶将培养皿中的细胞消化成单个细胞,收集细胞悬液,并以1 000 r/min离心5 min,弃去上清液,PBS重新悬浮细胞沉淀,1 000 r/min离心5 min,弃去上清液,重复2次。最后,将1×106细胞重悬于500 μL PBS(pH=7.2) 缓冲液中,分别加入5 μL Annexin V-FITC与5 μL PI染液,避光孵育15 min,然后通过流式细胞仪检测各组细胞凋亡率。
1.2.7 Transwell实验评估细胞迁移和侵袭能力将细胞重悬于无血清RPMI1640(5×104/100 μL)中,并将Matrigel基质胶铺入上室。于下室加入包含750 μL含10% FBS的培养基。将T24和5637细胞系加入上室孵育时间48 h。用PBS洗涤后,用棉签除去小室上表面的细胞,将膜下表面上的细胞固定并用0.5%结晶紫溶液染色并计数。迁移能力检测于未铺基质胶的Transwell小室内进行,其步骤与侵袭能力检测一致。
1.3 统计学分析使用SPSS 18.0统计软件分析数据。计量资料以x±s表示,满足方差齐性及正态分布者采用独立样本t检验或单因素方差分析,不满足则采用秩和检验。计数资料采用卡方检验或秩和检验。检验水准α=0.05。
2 结果 2.1 测序及细胞RT-PCR筛选出两种差异表达tRFs5637和T24经热损伤处理后,通过small RNA-seq测序筛选出大量tRFs在5637中表达升高而在T24中表达降低(图 1A)。RT-PCR实验逆向验证后发现tRF-chrM.Ser-GCT在5637Heat组中升高至5637组的(8.33±0.25)倍,而在T24Heat组中下降至T24组的(0.51±0.09)倍(图 1B,P < 0.05)。此外,tRF-Ile-AAT-1在5637Heat组中升高至5637组的(6.04±0.84)倍,而在T24Heat组中下降至T24组的(0.37±0.18)倍(图 1C,P < 0.05)。因此,tRF-chrM.Ser-GCT和tRF-Ile-AAT-1将行RT-PCR实验进一步检测它们在临床样本中差异表达。
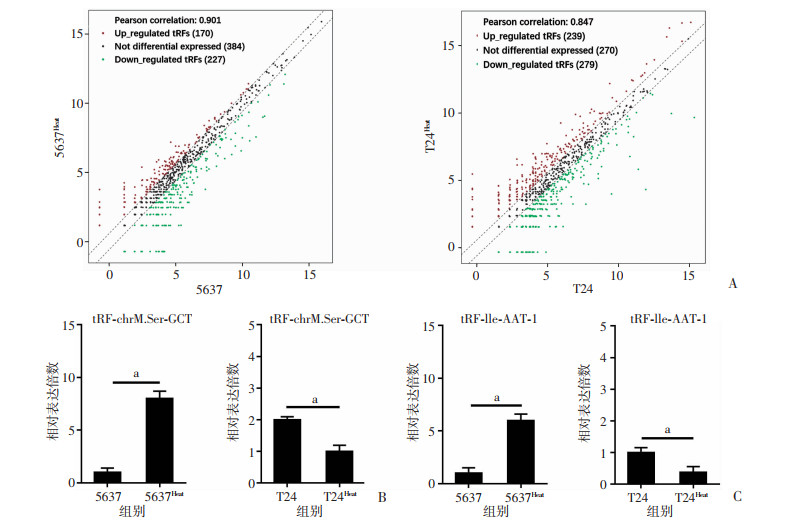
|
| A: small RNA-seq测序筛选结果;B: RT-PCR法检测tRF-chrM.Ser-GCT在不同BUC细胞热损伤前后的表达a: P < 0.05;C: RT-PCR法检测tRF-Ile-AAT-1在不同BUC细胞热损伤前后的表达 a: P < 0.05 图 1 热损伤后的不同恶性程度BUC细胞中tRFs的差异表达 |
2.2 RT-PCR检测不同级别BUC临床标本中tRF-Ile-AAT-1呈差异表达
共纳入BUC患者10例,其中男性6例,女性4例;年龄54~81岁,平均69.7岁;低级别BUC 5例,高级别BUC 5例;患者中第1次行TURBT时瘤体为单个的7例,多个的3例,瘤体直径0.8 ~1.7 cm;第2次行TURBT时瘤体为单个的9例,多个的1例,瘤体直径0.6~1.5 cm。
对同一患者2次TURBT术后标本RT-PCR检测显示,无论是高级别还是低级别的患者,tRF-chrM.Ser-GCT在2次TURBT术后标本中表达无明显差异(图 2A、C),而tRF-Ile-AAT-1在低级别BUC患者第2次TURBT术后BUC标本中的表达高于第1次TURBT(P < 0.05,图 2B),且在高级别BUC的表达又低于第1次TURBT(P < 0.05,图 2D)。因此,tRF-Ile-AAT-1为最终所筛选的目的tRF,用于后续细胞实验。
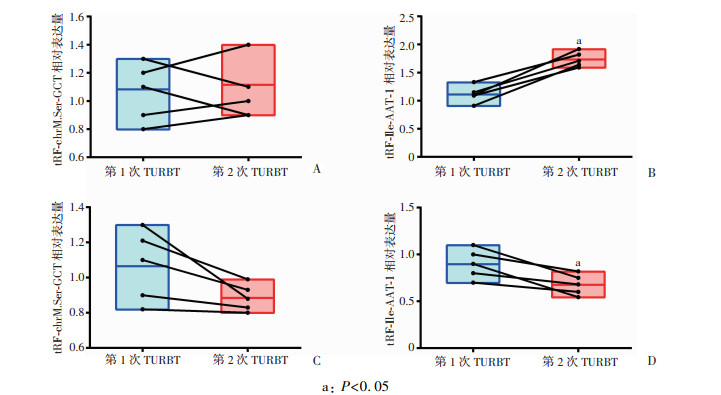
|
| a: P < 0.05 A: tRF-chrM.Ser-GCT在TURBT术后低级别BUC标本中的表达;B: tRF-Ile-AAT-1在TURBT术后低级别BUC标本中的表达;C: tRF-chrM.Ser-GCT在TURBT术后高级别BUC标本中的表达;D: tRF-Ile-AAT-1在TURBT术后高级别BUC标本中的表达;方框代表患者行TURBT所取肿瘤标本中tRFs相对于内参表达区间;2次TURBT的连线代表同1例患者的前后对应关系 图 2 tRFs在2次TURBT术后及不同分级BUC中的表达差异 |
2.3 tRF-Ile-AAT-1抑制BUC细胞的增殖
在热损伤后的5637细胞中,与5637Heat组相比,通过转染tRF-Ile-AAT-1 inhibitor抑制其表达水平可显著提高5637Heat+Inhibitor组的增殖能力(图 3A,P < 0.05)。在热损伤后的T24细胞中,通过转染tRF-Ile-AAT-1 mimic提高其在T24Heat+Mimic组中的表达,与T24Heat组相比,有效抑制了T24细胞的增殖能力(图 3B,P < 0.05)。
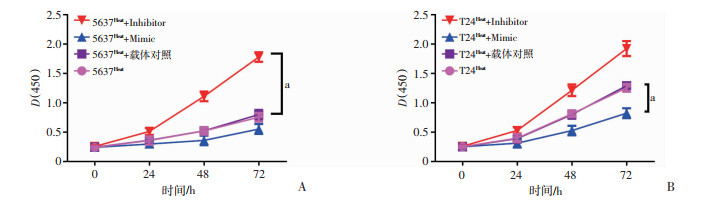
|
| A: 5637细胞 a: P < 0.05;B: T24细胞 a: P < 0.05 图 3 CCK-8实验检测tRF-Ile-AAT-1调控BUC细胞的增殖 |
2.4 tRF-Ile-AAT-1促进BUC细胞的凋亡
通过向热损伤后的5637细胞转染tRF-Ile-AAT-1 inhibitor,抑制其表达水平可显著降低5637Heat+Inhibitor组细胞的凋亡率至(8.06±1.82)%(如图 4A中Annexin V-PI双染色流式结果第2、3象限所示),与5637Heat组(72.83±3.21)%的凋亡率相比,差异有统计学意义(图 4B,P < 0.01)。而转染tRF-Ile-AAT-1 mimic有效提高了T24Heat+Mimic组细胞的凋亡率,达(76.78±3.95)%,与T24Heat组(13.35±2.72)%的凋亡率相比,差异有统计学意义(图 4C,P < 0.01)。
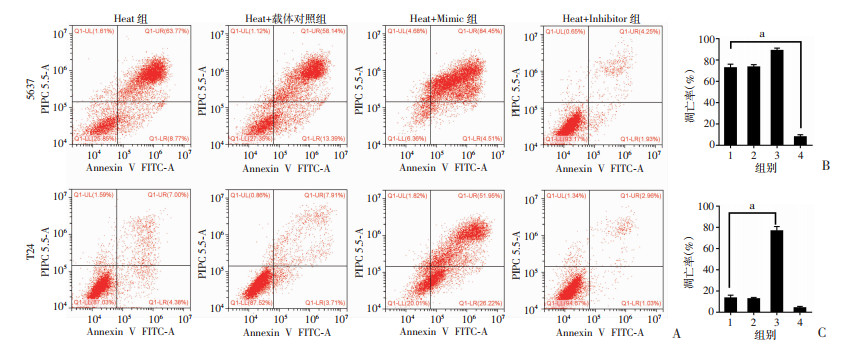
|
| A: 流式细胞术检测tRF-Ile-AAT-1的inhibitor和mimic干预热损伤后的BUC细胞的凋亡变化;B、C:流式细胞术检测tRF-Ile-AAT-1的inhibitor和mimic干预热损伤后的BUC细胞凋亡率的变化 1:Heat组;2:Heat+载体对照组;3:Heat+Mimic组;4:Heat+Inhibitor组;a:P < 0.01 图 4 tRF-Ile-AAT-1对BUC细胞凋亡的影响 |
2.5 tRF-Ile-AAT-1抑制BUC细胞的迁移与侵袭
在热损伤的5637细胞中转染tRF-Ile-AAT-1 inhibitor后,5637Heat+Inhibitor组细胞迁移数量为(314.67±18.88)个,显著高于5637Heat组的(175.33± 17.79)个(P < 0.01,图 5A、B);侵袭细胞数量为(557.00± 36.17)个,也高于5637Heat组的(194.33±20.40)个(P < 0.01,图 5D、E)。而转染tRF-Ile-AAT-1 mimic的T24Heat+Mimic组中细胞迁移数量,由T24Heat组的(191.00±17.09)个下降至(76.33±12.86)个,差异有统计学意义(P < 0.01,图 5A、C);侵袭的细胞数由T24Heat组的(366.33±19.86)个下降至(84.33±16.04)个,差异有统计学意义(P < 0.01,图 5D、F)。说明tRF-Ile-AAT-1可有效抑制BUC细胞的迁移与侵袭。

|
| A: tRF-Ile-AAT-1的mimic和inhibitor干预热损伤后的BUC细胞迁移能力的变化(×100);B、C: tRF-Ile-AAT-1的mimic和inhibitor干预热损伤后的BUC细胞迁移细胞数的变化 a: P < 0.01;D: tRF-Ile-AAT-1的mimic和inhibitor干预热损伤后的BUC细胞侵袭能力的变化(×100);E、F: tRF-Ile-AAT-1的mimic和inhibitor干预热损伤后的BUC细胞侵袭细胞数的变化;1:Heat组;2:Heat+载体对照组;3:Heat+Mimic组;4:Heat+Inhibitor组;a: P < 0.01 图 5 Transwell实验检测tRF-Ile-AAT-1对BUC细胞迁移与侵袭能力的影响 |
3 讨论
尽管TURBT被认为是NMIBC手术治疗的金标准[1],但术后高复发率和肿瘤进展现象时有报道:NMIBC患者中有27%~78%在术后出现肿瘤复发;并且10.3%~35%的NMIBC在TURBT术后表现出病理进展或升级[2-4]。由此可见,即使采用相同的治疗策略,BUC患者之间的预后仍存在很大差异。大量研究证实,热损伤可诱导肿瘤细胞恶性程度进展[5-7]。膀胱肿瘤等离子电切的组织切割面温度为40~70 ℃,此原理同样可以对膀胱肿瘤细胞造成热损伤。然而,热损伤可诱导肿瘤细胞恶性程度进展的机制在TURBT术后肿瘤复发和进展中却未获证实。
tRFs即应激诱导型tRNA片段,是细胞内最丰富的非编码RNA(non-coding RNA, ncRNA)来源之一[8]。细胞受到外界刺激时,tRNA裂解成为多种tRFs。tRFs可与细胞内AGO蛋白(argonaute proteins)结合,通过调节目的mRNA的翻译活性,调控应激蛋白的合成以适应微环境的变化[8]。研究表明,热损伤或缺氧可以刺激肿瘤细胞产生tRFs,从而调节癌细胞的生物学行为[16]。现已证实,高度恶性的肿瘤细胞可以通过抑制自身tRNA裂解来减少tRFs产生,从而维持其恶性生物学行为[13-14]。在此基础上,本研究对所有BUC细胞行热损伤处理后,筛选出于低度恶性BUC细胞中表达增加,但于高度恶性BUC细胞中表达减少的tRFs:tRF-chrM.Ser-GCT和tRF-Ile-AAT-1。本研究在进一步的临床验证中,分别检测了低级别与高级别BUC在第1次和第2次行TURBT所取临床标本中tRF-chrM.Ser-GCT和tRF-Ile-AAT-1表达差异。根据上述理论,低级别BUC在经过第1次TURBT热损伤后,残余或复发的瘤体经由第2次电切获取,其可能高表达目的tRF。而高级别BUC经过第1次TURBT热损伤后,残余或复发的瘤体经由第2次电切获取,标本中目的tRF表达则应下降。这即是目的tRF在不同级别BUC电切后表达差异的原因。因此,本试验在排除了两次TURBT术后标本中表达差异无明显变化的tRF-chrM.Ser-GCT之后,最终筛选出来的目的tRF为tRF-Ile-AAT-1。而目前学术界对于tRF-Ile-AAT-1的研究尚处于空白状态,其分子生物学功能均少见报道。本研究使用tRF-Ile-AAT-1的mimic和inhibitor来调节其在热损伤BUC细胞模型中的表达水平,从增殖、凋亡、迁移和侵袭4个角度证实tRF-Ile-AAT-1具有抑制膀胱尿路上皮癌细胞的作用。
综上,本研究初步探讨TURBT术后BUC复发和恶性程度进展的部分机制。因TURBT可进一步诱导低级别BUC细胞产生tRF-Ile-AAT-1以抑制肿瘤进展,所以TURBT可能更适用于低级别BUC。相反,对高级别BUC行TURBT可能更具有促进肿瘤进展的潜在风险。同时,本研究认为调控tRFs可能成为一种有前途的肿瘤基因治疗策略,尤其是用于辅助某些特定治疗,如引起细胞应激的物理治疗等。
众所周知,BUC是一种具有高异质性的恶性肿瘤[17, 10]。近年来BUC的分子分型相关研究方兴未艾。这些研究进一步阐释了不同BUC病例之间、同一病例不同时期、甚至同一病例不同细胞之间分子分型的内在差异[18-19]。然而,由于种种原因,本研究无法将BUC固有分子分型的潜在差异纳入考量。如果能根据BUC不同的分子分型,将应激后tRFs在BUC发生、发展中扮演的角色进行严谨和深入的分析,这对于进一步探索BUC的精准治疗将大有裨益。
| [1] |
BABJUK M, BURGER M, COMPÉRAT E M, et al. European association of urology guidelines on non-muscle-invasive bladder cancer (TaT1 and carcinoma in situ)-2019 update[J]. Eur Urol, 2019, 76(5): 639-657. |
| [2] |
BABJUK M. Second resection for non-muscle-invasive bladder carcinoma: current role and future perspectives[J]. Eur Urol, 2010, 58(2): 191-192. |
| [3] |
SHIM J S, CHOI H, NOH T I, et al. The clinical significance of a second transurethral resection for T1 high-grade bladder cancer: Results of a prospective study[J]. Korean J Urol, 2015, 56(6): 429-434. |
| [4] |
MISTRETTA F A, CARRION D M, NAZZANI S, et al. Bladder recurrence of primary upper tract urinary carcinoma following nephroureterectomy, and risk of upper urinary tract recurrence after ureteral stent positioning in patients with primary bladder cancer[J]. Italian J Urol Nephrol, 2019, 71(3): 191-200. |
| [5] |
CHEN H, MA G, WANG X Y, et al. Time interval after heat stress plays an important role in the combination therapy of hyperthermia and cancer chemotherapy agents[J]. Int J Hyperthermia, 2020, 37(1): 254-255. |
| [6] |
CHEN S Y, LIU M Y, HUANG H M, et al. Heat stress- induced multiple multipolar divisions of human cancer cells[J]. Cells, 2019, 8(8): E888. |
| [7] |
BLESSING N A, KASTURIRANGAN S, ZINK E M, et al. Osmotic and heat stress-dependent regulation of MLK4β and MLK3 by the CHIP E3 ligase in ovarian cancer cells[J]. Cell Signal, 2017, 39: 66-73. |
| [8] |
KIM H K, FUCHS G, WANG S C, et al. A transfer-RNA-derived small RNA regulates ribosome biogenesis[J]. Nature, 2017, 552(7683): 57-62. |
| [9] |
SCHORN A J, GUTBROD M J, LEBLANC C, et al. LTR-retrotransposon control by tRNA-derived small RNAs[J]. Cell, 2017, 170(1): 61-71. e11. |
| [10] |
TORAB P, YAN Y, YAMASHITA H, et al. Three-dimensional microtumors for probing heterogeneity of invasive bladder cancer[J]. Anal Chem, 2020, 92(13): 8768-8775. |
| [11] |
ZHANG L J, WU B, ZHA Z L, et al. Clinicopathological factors in bladder cancer for cancer-specific survival outcomes following radical cystectomy: a systematic review and meta-analysis[J]. BMC Cancer, 2019, 19(1): 716. |
| [12] |
LOPEZ-BELTRAN A, HENRIQUES V, MONTIRONI R, et al. Variants and new entities of bladder cancer[J]. Histopathology, 2019, 74(1): 77-96. |
| [13] |
GOODARZI H, LIU X H, NGUYEN H C, et al. Endogenous tRNA-derived fragments suppress breast cancer progression via YBX1 displacement[J]. Cell, 2015, 161(4): 790-802. |
| [14] |
HUANG B Q, YANG H P, CHENG X X, et al. tRF/miR-1280 suppresses stem cell-like cells and metastasis in colorectal cancer[J]. Cancer Res, 2017, 77(12): 3194-3206. |
| [15] |
CHENG J W, LI M X, LV Y. Sublethal heat treatment promotes epithelial-mesenchymal transition and enhances the malignant potential of hepatocellular carcinoma[J]. Hepatology, 2014, 59(4): 1650. |
| [16] |
CHEN Y Y, SHEN J. Mucosal immunity and tRNA, tRF, and tiRNA[J]. J Mol Med (Berl), 2021, 99(1): 47-56. |
| [17] |
HUANG H M, LI H X. Tumor heterogeneity and the potential role of liquid biopsy in bladder cancer[J]. Cancer Commun (Lond), 2021, 41(2): 91-108. |
| [18] |
MORERA D S, HASANALI S L, BELEW D, et al. Clinical parameters outperform molecular subtypes for predicting outcome in bladder cancer: results from multiple cohorts, including TCGA[J]. J Urol, 2020, 203(1): 62-72. |
| [19] |
SJÖDAHL G, JACKSON C L, BARTLETT J M, et al. Molecular profiling in muscle-invasive bladder cancer: more than the sum of its parts[J]. J Pathol, 2019, 247(5): 563-573. |




