多发性硬化(multiple sclerosis,MS)是中枢神经系统最常见的自身免疫性炎性脱髓鞘疾病,具有典型的灰、白质髓鞘丢失等特点[1]。常规MRI如T1WI及T2WI虽可作为MS非生物学特异性的定性依据[2],但难以对病灶进行客观定量分析。近年来,有学者提出T1W/T2W即信号强度比(signal intensity ratio,SIR)可作为衡量脑组织灰、白质髓鞘髓磷脂的生物学特异性候选指标[3]。同时,扩散张量成像(diffusion tensor imaging,DTI) 可敏感检测脑组织灰、白质微观结构的完整性,评估组织受损改变[4-5]。因人脑MS病理组织难以获得,对于MR多参数定量评估髓鞘含量结果缺乏组织病理学结论支持,而小鼠双环己酮草酰二腙(cuprizone,CPZ)诱导模型能够模拟MS典型脱髓鞘病理机制[6-7];由于3.0T MRI对小鼠脑结构等较小体积的组织存在分辨率不足及图像对比度较低等问题,本研究使用具有更高空间分辨率及更高图像对比的超高场7.0T MRI对CPZ模型行T1WI、T2WI及DTI序列扫描,通过仿射变换线性配准图像空间的方式获取SIR图,结合DTI扩散张量参数并通过病理组织学验证,定量分析CPZ模型脱髓鞘组织和正常组织的差异,同时行影像与病理指标相关性分析及线性拟合,以期提供SIR联合DTI检测MS脱髓鞘的理论依据。
1 材料与方法 1.1 实验动物模型动物实验及相关研究符合国家《实验动物管理条例》,并获得重庆医科大学动物伦理委员会批准[2019年科研伦理(2019-065)号]。实验动物使用重庆医科大学实验动物中心提供的无特定病原体级6~8周龄C57BL/6雄性小鼠(共20只),以随机数字表法分为对照组(n=10)及实验组(n=10)。所有动物饲养于重庆医科大学实验动物中心独立通气笼具,维持12 h昼夜循环及24 ℃室温。小鼠适应环境1周后开始实验。
适应结束后,实验组小鼠使用CPZ与羧甲基纤维素钠(sodium carboxymethyl cellulose, CMCNa)均匀混合后配置的CPZ-CMCNa悬浊液连续灌胃6周以诱导脱髓鞘。具体做法参照ZHEN等[7]的方法,即按照含0.2%质量分数(CPZ/总饲料质量)的CPZ饲料喂养小鼠所需剂量进行换算及剂量优化,将400 mg/kg CPZ(Sigma-Aldrich公司, 美国)加入0.5%CMCNa(Solarbio公司,北京)溶液中,使用超声振荡仪振荡为均质悬浊液,再按照造模所需最低安全摄入量(10 mL/kg)对实验组小鼠进行每日1次、连续6周的强饲灌胃。对照组小鼠使用0.5%CMCNa溶液以相同剂量连续灌胃6周。造模结束后,两组小鼠分别进行7.0T MRI扫描及病理取材。造模期间观察并记录小鼠一般情况及体质量变化。
1.2 7.0T MR扫描MR扫描采用陆军军医大学大坪医院放射科Bruker 7.0T小动物磁共振仪(Bruker BioSpec USR 70/20,Paravision 6.0.1,德国)。小鼠使用4%异氟烷气体麻醉以后,采用四通道头部线圈进行头部定位扫描,并行T1WI、T2WI及DTI扫描。扫描参数如下,①T1WI(RARE序列):RARE factor=4,TR=693.0 ms,TE=6.0 ms,翻转角90°,FOV =25 mm×25 mm,矩阵256×256,层厚0.6 mm,层数=22,扫描时间10 min;②T2WI (TurboRARE序列):RARE factor=6,TR=3 000 ms,TE=45 ms,翻转角90°,FOV=25 mm×25 mm,矩阵256×256,层厚0.6 mm,层数=22,扫描时间10 min;③DTI(EPI序列):TR=3 000 ms,TE=40 ms,FOV=20 mm×20 mm,矩阵128×128,层厚1.0 mm,层数=22,b值=0、800 s/mm2,取30个不同方向,扫描时间30 min。各组扫描期间使用1.5%异氟烷持续麻醉,并使用生命检测仪监测生命体征。两组扫描方法及扫描参数一致。
1.3 MR图像后处理及计算对于SIR的处理,首先使用ITK-snap软件(http://www.itksnap.org/;ITK-snap,v3.8.0)对同一只小鼠的T1WI及T2WI分别手动制作脑组织掩模,再使用FSL软件(https://fsl.fmrib.ox.ac.uk/;FMRIBSoftwareLibrary,v5.0.10)分别对小鼠T1WI及T2WI图像计算掩模去除颅骨及脑外组织,提取脑组织图像;然后通过仿射变换将去除脑外组织的T1WI图像线性配准到同样去除脑外组织后的T2WI图像,使得两者空间对齐,再使用fslmaths程序根据公式(SIR=T1W/T2W)得到SIR。对于DTI图像,则使用FSL进行头动矫正及扩散梯度方向矫正预处理,获得b0相及基于b0相的脑组织掩模,并使用FSL Diffusion Toolkit程序计算各向异性分数(fractional anisotropy,FA)及平均扩散率(mean diffusivity,MD)。
最后在获得的SIR图、b0相上使用基于感兴趣区(regions of interest,ROI)的方法提取各脑区SIR值及FA值、MD值。ROI的勾画由1名5年以上MR研究经验的医师重复进行3次勾画,并由另1名10年以上MR研究经验的医师进行复核。由于序列分辨率不同,各ROI在SIR图及b0相的体积不会完全一致,参照小鼠标准立体定位解剖图谱,在SIR图及b0相上选取最大病灶层面及相邻两层图像手动勾画胼胝体(corpus callosum,CC)、双侧大脑皮层(cortex,CTX)、双侧丘脑(thalamus,THA)以及双侧海马体(hippocampus,HIP),并使用fslmaths程序计算各参数图ROI内的SIR值、FA值及MD值。各序列所选ROI体积见表 1。所有数据测量重复3次并取平均值。
| 指标 | CC | CTX | THA | HIP |
| SIR | 1.5 | 8.5 | 6.5 | 4.0 |
| b0 | 0.8 | 8.0 | 5.8 | 3.4 |
| CC:胼胝体;CTX:双侧大脑皮层;THA:双侧丘脑;HIP:双侧海马体 | ||||
1.4 实验动物脑组织提取与病理学染色
小鼠扫描后使用过量异氟烷气体深度麻醉,手术暴露心脏,穿刺心尖并剪开右心耳,依次泵入150 mL磷酸缓冲盐溶液及150 mL 4%多聚甲醛溶液冲洗血液及内固定组织。内固定完成后,立即剥除颅骨并取出完整的脑组织,然后在4%多聚甲醛溶液外固定48 h,后续采用酒精梯度脱水及石蜡包埋。基于MRI图像结果对照,在距离前囟-1.0 mm处以5 μm厚度进行连续切片,将切片脱蜡、水化后,使用预热8 h至60 ℃的牢固蓝染液(luxol fast blue,LFB;Sigma-Aldrich公司,美国)进行髓鞘染色6 h,并使用伊红染液复染5 min。完成染色后使用酒精梯度脱水,二甲苯透明,中性树脂封片。
1.5 病理指标分析使用Axioscope5显微镜(Carl Zeiss公司,德国)对小鼠切片以相同光学参数进行×100倍拍摄,并使用Fiji软件(https://imagej.net/Welcome;ImageJFiji,Java8)将图像转换为8-bit灰度图像后,对照在线小鼠脑组织病理学图谱(http://mouse.brain-map.org/static/atlas/),按照上述ROI对每只小鼠脑组织切片进行逐张勾画,使用软件内置算法矫正面积并计算各小鼠LFB染色灰度图中各ROI的平均灰度值(mean grayscale value, MGSV)。
1.6 统计学分析使用SPSS 24.0统计软件。正态分布计量资料以x±s表示,组间差异比较采用独立样本t检验,并使用Pearson相关分析(采用单尾检验)对各影像指标及MGSV进行两两相关性分析及线性拟合。P < 0.05表示差异有统计学意义。
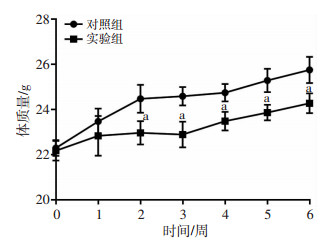
2 结果 2.1 一般情况造模期间,对照组小鼠体质量正常增加,未见明显神经病学异常改变。实验组小鼠随着造模时间延长,体质量先缓慢增加,2~3周下降,然后再继续增长,体质量增长较对照组滞后;小鼠精神逐渐萎靡,活动度降低,部分严重个体偶见拒食现象,但无其他明显神经病学症状改变(图 1)。实验期间未出现小鼠个体死亡。
|
| <1周为适应期;1~6周为实验阶段;a:P < 0.05,与对照组比较 图 1 对照组与实验组小鼠体质量变化 |
2.2 7.0T MRI图像结果与参数比较
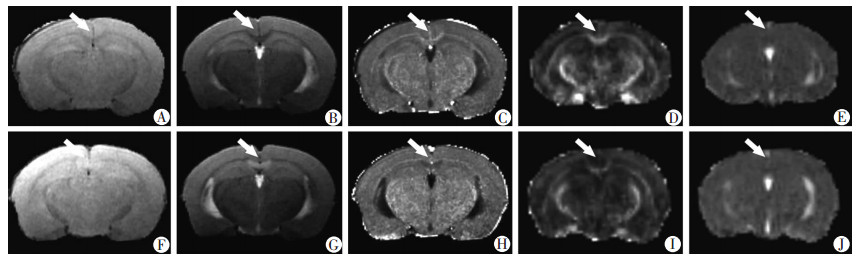
对照组常规MRI CC呈弓形,T1WI为稍低信号(图 2A),T2WI为低信号(图 2B),而SIR为高信号(图 2C),在FA图(图 2D)和MD图(图 2E)形态、信号均未见明显异常。实验组CC呈月牙形,T1WI为稍高/等信号(图 2F),T2WI为高信号(图 2G),而SIR为明显低信号(图 2H),FA图可观察到白质纤维破坏且形态不规整(图 2I),MD图肉眼未见明显异常表现(图 2J)。有趣的是,实验组CTX、THA及HIP等各图像均未见明显异常信号、形态改变。
|
| A~E:对照组小鼠MRI图像,全脑未见明显异常信号改变;A:T1WI,正常组织胼胝体呈稍低信号(箭头示);B:T2WI,正常组织胼胝体呈低信号(箭头示);C:SIR图,正常组织胼胝体呈高信号(箭头示);D:FA图,正常组织胼胝体形态,结构完整(箭头示);E:MD图,全脑未见明显异常信号改变(箭头示);F~J:实验组小鼠MRI图像,与对照组相比,胼胝体呈现异常信号变化;F:T1WI,病变胼胝体呈稍高/等信号(箭头示);G:T2WI,病变胼胝体呈高信号(箭头示);H:SIR图,病变胼胝体呈低信号(箭头示);I:FA图,病变胼胝体结构破坏(箭头示);J:MD图,病变胼胝体未见明显异常信号改变(箭头示) 图 2 对照组与实验组MR图像 |
与对照组SIR比较,实验组CC的SIR值显著降低(t=4.167,P < 0.01),而CTX、THA及HIP等的SIR值差异无统计学意义(表 2)。
| 组别 | n | CC | CTX | THA | HIP |
| 对照组 | 10 | 2.044±0.119 | 1.979±0.151 | 2.237±0.110 | 1.961±0.183 |
| 实验组 | 10 | 1.851±0.086 | 1.947±0.102 | 2.220±0.113 | 1.975±0.113 |
| t值 | 4.167 | 0.542 | 0.333 | -0.207 | |
| P值 | 0.001 | 0.594 | 0.743 | 0.838 | |
| SIR:信号强度比;CC:胼胝体;CTX:双侧大脑皮层;THA:双侧丘脑;HIP:双侧海马体 | |||||
与对照组DTI扩散张量参数比较,实验组CC的FA值显著降低(t=2.916,P < 0.01),而CTX、THA及HIP等的FA值差异无统计学意义。两组CC、CTX、THA及HIP等的MD值差异均无统计学意义(表 3)。
| 组别 | n | FA | MD (×10-3 mm2/s) | |||||||
| CC | CTX | THA | HIP | CC | CTX | THA | HIP | |||
| 对照组 | 10 | 0.349±0.033 | 0.165±0.029 | 0.201±0.025 | 0.160±0.018 | 0.589±0.039 | 0.589±0.036 | 0.577±0.040 | 0.579±0.037 | |
| 实验组 | 10 | 0.307±0.032 | 0.156±0.018 | 0.206±0.017 | 0.157±0.023 | 0.608±0.057 | 0.598±0.032 | 0.591±0.028 | 0.611±0.023 | |
| t值 | 2.916 | 0.828 | -0.644 | 0.322 | -0.831 | -0.577 | -0.919 | -2.237 | ||
| P值 | 0.009 | 0.419 | 0.527 | 0.751 | 0.417 | 0.571 | 0.370 | 0.388 | ||
| FA:各项异性分数;MD:平均扩散率;CC:胼胝体;CTX:双侧大脑皮层;THA:双侧丘脑;HIP:双侧海马体 | ||||||||||
2.3 病理染色结果与病理学指标比较
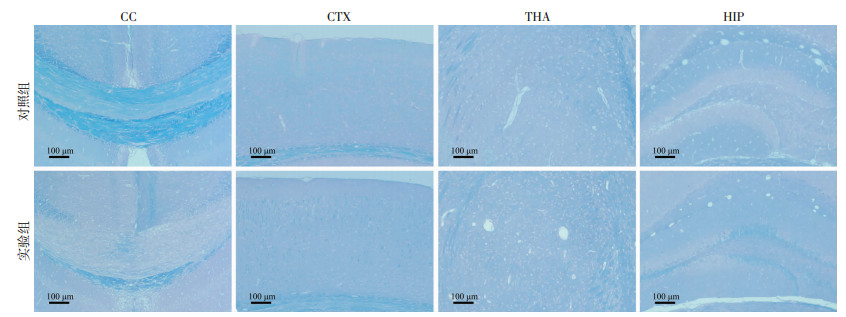
对照组小鼠LFB染色脑内未见明显病理改变,其中CC处髓鞘被LFB染料染为蓝色,髓鞘包裹下的神经元轴突胞质未见明显暴露,其余神经胞质被伊红染液染为淡红色,纤维排列规律紧密,走行正常;CTX、THA及HIP灰、白质LFB髓鞘染色均一,胞质被伊红复染为淡红色(图 3)。实验组小鼠LFB染色可见CC呈明显脱髓鞘改变,大片蓝色染色的髓鞘纤维丢失,暴露出的轴突胞质被伊红染为淡红色,其中可见部分尚未完全丢失的髓鞘碎片;而CTX、THA及HIP等LFB染色均一,未见明显脱髓鞘改变,胞质伊红复染为淡红色(图 3)。
|
| 对照组髓鞘染为蓝色,细胞质染为淡红色,各区域染色未见明显异常;与对照组相比,实验组胼胝体蓝染髓鞘大片丢失,暴露的神经轴突细胞质染为淡红色,其余区域未见明显髓鞘失;CC:胼胝体;CTX:大脑皮层;THA:丘脑;HIP:海马体 图 3 LFB染色观察两组小鼠大脑各区域病理学变化 |
与对照组比较,实验组CC的MGSV显著升高(t=-5.323,P < 0.001);两组CTX、THA及HIP的MGSV差异无统计学意义(表 4)。
| 组别 | n | CC | CTX | THA | HIP |
| 对照组 | 10 | 182.404±8.268 | 199.459±3.652 | 188.003±5.560 | 196.987±7.353 |
| 实验组 | 10 | 198.139±4.358 | 197.842±4.965 | 189.681±6.696 | 197.409±4.293 |
| t值 | -5.323 | 0.830 | -0.610 | -0.157 | |
| P值 | < 0.001 | 0.417 | 0.550 | 0.877 | |
| MGSV:平均灰度值;CC:胼胝体;CTX:双侧大脑皮层;THA:双侧丘脑;HIP:双侧海马体 | |||||
2.4 影像、病理学指标相关性分析
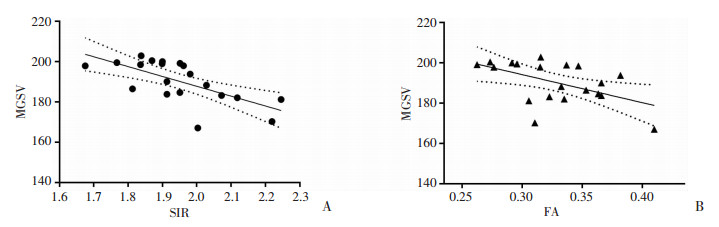
影像及病理结果表明CC存在明显脱髓鞘改变,两组SIR及FA值差异具有统计学意义,因此对SIR、FA与MGSV分别进行Pearson相关分析及线性拟合。Pearson相关分析表明SIR、FA分别与MGSV之间具有负相关关系(P < 0.05),且|rSIR| > |rFA|,线性拟合也表明SIR、FA与MGSV分别存在线性关系(图 4)。线性拟合参数见表 5。其中拟合方程y=MGSV取值范围为0~255。
|
| A:SIR与MGSV拟合;B:FA与MGSV拟合 图 4 胼胝体SIR、FA与MGSV的线性关系 |
| 线性拟合方程 | SIR | FA |
| Pearson相关系数(r, P) | -0.670, 0.001 | -0.521, 0.009 |
| 拟合方程(y=ax+b) | y =-48.839x+285.400 | y =-139.166x+235.940 |
| 截距(b) | 285.400±24.921 | 235.940±17.756 |
| 斜率(a) | -48.839±12.762 | -139.166±53.752 |
| 95%CI(b) | 233.043, 337.757 | 198.637, 273.243 |
| 95%CI(a) | -75.652, -22.027 | -252.094, -26.238 |
| 决定系数(r2) | 0.449 | 0.271 |
| 调整后决定系数(r2) | 0.418 | 0.231 |
3 讨论
MS是中枢神经系统典型的白质脱髓鞘疾病之一,常规MRI对于脑组织具有较好的组织分辨率,成像时间较短,在临床上广泛应用于MS患者的辅助诊断及随访[8]。近年来,超高场7.0T MRI逐渐被广泛地应用在中枢神经系统影像临床及科研上。相较于3.0T MRI而言,7.0T MRI具有更高的空间分辨率,对于MS小易感性病灶识别更具优势,同时对于小动物疾病模型中较小体积的脑组织结构能够产生更高的信噪比和对比度噪声比,对于细小解剖结构及病灶有着更高的敏感性[9]。因此7.0T MRI在MS等中枢神经系统疾病诊断及研究中具有重要的作用。近年来,GLASSER等[3]提出T1W/T2W即SIR可能是定量髓鞘含量的潜在影像学指标;同时DTI可利用FA及MD等扩散张量参数敏感地检测脑组织灰、白质结构改变[10-11],但对于以上各项指标与病理组织学的关系还需要进一步研究。
由于MS患者脑组织病理标本难以获得,本研究使用CPZ模型用于模拟MS患者脱髓鞘病理机制。CPZ是一种铜离子螯合剂,通过选择性影响形成髓鞘的少突胶质细胞的代谢,使其发生凋亡,继而发生典型的MS Ⅲ型脱髓鞘改变[12],在研究MS中具有重要的意义。传统CPZ模型使用含0.2%质量分数的CPZ毒性饲料造模,但存在诸如小鼠间的摄食差异导致的模型个体差异大、造模周期差异大、普遍造模时间较长(6~12周)[13-15],以及常规MRI病灶不典型等问题。因此,本研究参考等剂量换算CPZ有效剂量及强饲法造模的方法[7],在经过6周改良CPZ-CMCNa悬浊液灌胃造模后,结合MR及病理结果发现实验组CC发生了典型的白质脱髓鞘改变,而CTX、THA及HIP等皮层及深部灰质尚未发现明显异常。这种脱髓鞘模式可能与CPZ的作用部位具有选择性有关,与多项研究结果类似[16-18]。
常规T1WI及T2WI信号强度主要受组织水成分的影响,同时也与髓鞘含量、脂质成分、组织铁磁性物质等有关。一般认为T1WI及T2WI难以区分组织病灶内水成分的来源,且信号强度受扫描参数及序列影响,不具有生物学特异性[19],难以有效地进行定量分析。近年来部分中枢神经系统研究提出了使用T1W/T2W定量绘制人脑皮层髓鞘髓磷脂定量图的方法[20-21]。GLASSER等[3]提出可以使用T1W/T2W图像强度的比率来消除与MR相关的图像强度偏差并增强髓磷脂的对比度与信噪比。在T1WI序列中,信号强度与髓鞘含量成正比,在T2WI序列中,信号强度与髓鞘含量成反比,因此信号之间的比率(SIR)可突出正常髓鞘成分的信号,使其在SIR图中呈现高信号[21];而在脱髓鞘与炎症浸润导致的如纤维方向、组织水肿和细胞密度等变化则会改变T1WI和T2WI的强度,使得在SIR中病灶呈现出低信号改变[22-23]。本研究表明实验组CC脱髓鞘组织SIR图呈低信号,而对照组CC正常组织SIR图呈高信号,呈现明显图像信号对比,且实验组CC的SIR值较对照组明显降低,两组差异具有统计学意义。表明该区域髓鞘丢失,提示SIR可敏感地用于检测组织脱髓鞘改变,与之前的研究结果[3, 21-23]基本一致。
DTI通过检测组织内水分子扩散来推断组织结构损伤变化,其中FA用于评价组织微观完整性,MD反映组织内与扩散方向无关的水分子扩散率[18, 24]。在白质纤维密集区(如CC等),FA值降低可能代表该区域发生了髓鞘丢失及炎症水肿等改变,MD值增加可能表明该区域出现细胞膜结构损伤、细胞外间隙扩大和组织细胞外水扩散增多等改变[10]。本研究结果显示:实验组小鼠CC脱髓鞘后FA值较对照组降低,差异具有统计学意义,而MD值较对照组升高,但差异不具有统计学意义。提示FA可以敏感反映脱髓鞘组织微观完整性受到破坏,而MD对于脱髓鞘组织的检测可能不如FA敏感。
基于MRI结果的比较,为了进一步判断SIR及FA与髓鞘的关系,本研究对病理LFB染色进行了定量分析,并对CC病灶SIR、FA值分别与MGSV进行了相关性分析及线性拟合。在组织病理学中,髓鞘主要是由包裹神经轴突的富含髓磷脂的磷脂双分子膜构成的,LFB染色可以特异性地将髓鞘髓磷脂染为蓝色,用于定性分析髓鞘组织变化[25]。本研究使用LFB髓鞘特异性染色并采用平均灰度法对彩色图像进行灰度转化,从而使用MGSV定量比较脱髓鞘组织和正常组织的髓鞘含量。在灰度图中,MGSV取值范围为0~255,MGSV越接近255则灰度越浅,越接近0则灰度越深,即脱髓鞘组织表现为更浅的灰度,而正常髓鞘组织表现为更深的灰度[26]。本研究结果表明:CC病灶脱髓鞘区域MGSV高于正常髓鞘组织,且差异具有统计学意义。证实SIR联合FA可以用于评估MS脱髓鞘改变[21]。同时根据线性拟合参数,SIR与MGSV的相关系数、校正后决定系数等线性拟合参数均较FA更高,表明SIR可能在评价髓鞘改变方面更优于FA。
本研究也存在一定的局限性。本研究是基于动物模型超高场MRI扫描仪及序列参数,得到的是较为理想化条件的结果,而临床使用不同的扫描仪器和扫描参数,使用的场强也多为3.0T MRI,且MS患者临床情况复杂,仍需要进一步开展临床研究。同时结合影像及病理结果,本研究仅表明了白质脱髓鞘变化,尚未检测出典型的灰质脱髓鞘改变,仍需要进一步研究。
综上所述,本研究通过超高场MRI扫描常规T1WI、T2WI及DTI序列,获得SIR、FA及MD等影像学参数,结合病理学指标综合分析CPZ脱髓鞘模型,发现胼胝体发生了显著的髓鞘丢失,组织微观完整性受损,表明SIR及DTI FA可以定量反映脑组织脱髓鞘改变。同时相关分析表明SIR与髓鞘的关系可能更强于FA,提示SIR在MS中具有良好的临床应用前景,值得进一步研究。
| [1] |
FILIPPI M, BAR-OR A, PIEHL F, et al. Multiple sclerosis[J]. Nat Rev Dis Primers, 2018, 4(1): 43. |
| [2] |
FILIPPI M, PREZIOSA P, ROCCA M A. MRI in multiple sclerosis: what is changing?[J]. Curr Opin Neurol, 2018, 31(4): 386-395. |
| [3] |
GLASSER M F, VAN ESSEN D C. Mapping human cortical areas in vivo based on myelin content as revealed by T1-and T2-weighted MRI[J]. J Neurosci, 2011, 31(32): 11597-11616. |
| [4] |
KLISTORNER A, WANG C, YIANNIKAS C, et al. Evidence of progressive tissue loss in the core of chronic MS lesions: a longitudinal DTI study[J]. Neuroimage Clin, 2018, 17: 1028-1035. |
| [5] |
BEZUKLADOVA S, TUISKU J, MATILAINEN M, et al. Insights into disseminated MS brain pathology with multimodal diffusion tensor and PET imaging[J]. Neurol Neuroimmunol Neuroinflamm, 2020, 7(3): e691. |
| [6] |
雷楚, 黄嘉璐, 陈昊炜, 等. 双环己酮草酰二腙诱导脱髓鞘模型小鼠情绪及神经递质的变化[J]. 第三军医大学学报, 2016, 38(11): 1263-1269. LEI C, HUANG J L, CHEN H W. Correlation between emotional changes and neurotransmitters in cuprizone-induced demyelination mice[J]. J Third Mil Med Univ, 2016, 38(11): 1263-1269. |
| [7] |
ZHEN W, LIU A, LU J, et al. An alternative cuprizone-induced demyelination and remyelination mouse model[J]. ASN Neuro, 2017, 9(4): 1759091417725174. |
| [8] |
MINNEBOO A, UITDEHAAG B M, JONGEN P, et al. Association between MRI parameters and the MS severity scale: a 12 year follow-up study[J]. Mult Scler, 2009, 15(5): 632-637. |
| [9] |
TREABA C A, GRANBERG T E, SORMANI M P, et al. Longitudinal characterization of cortical lesion development and evolution in multiple sclerosis with 7.0-T MRI[J]. Radiology, 2019, 291(3): 740-749. |
| [10] |
周津如, 李咏梅, 时晓清, 等. 7.0T磁共振扩散张量成像在实验性自身免疫性脑脊髓炎大脑皮层及胼胝体病变中的应用[J]. 中国医学影像学杂志, 2017, 25(3): 169-173. ZHOU J R, LI Y M, SHI X Q, et al. Diffusion tensor imaging of 7.0T magnetic resonance on cerebral cortex and corpus callosum lesions in experimental autoimmune encephalomyelitis[J]. Chin J Med Imaging, 2017, 25(3): 169-173. |
| [11] |
熊华, 唐茁月, 李晓姣, 等. 多发性硬化患者皮质及白质受累的相关性[J]. 中国医学影像学杂志, 2020, 28(7): 499-503. XIONG H, TANG Z Y, LI X J, et al. Correlation between cortical and white matter in patients with multiple sclerosis[J]. Chin J Med Imaging, 2020, 28(7): 499-503. |
| [12] |
VEGA-RIQUER J M, MENDEZ-VICTORIANO G, MORALES-LUCKIE R A, et al. Five decades of cuprizone, an updated model to replicate demyelinating diseases[J]. Curr Neuropharmacol, 2019, 17(2): 129-141. |
| [13] |
OAKDEN W, BOCK N A, AL-EBRAHEEM A, et al. Early regional cuprizone-induced demyelination in a rat model revealed with MRI[J]. NMR Biomed, 2017, 30(9): e3743. |
| [14] |
PETIET A, AIGROT M S, STANKOFF B. Gray and white matter demyelination and remyelination detected with multimodal quantitative MRI analysis at 11.7T in a chronic mouse model of multiple sclerosis[J]. Front Neurosci, 2016, 10: 491. |
| [15] |
GUGLIELMETTI C, BOUCNEAU T, CAO P, et al. Longitudinal evaluation of demyelinated lesions in a multiple sclerosis model using ultrashort echo time magnetization transfer (UTE-MT) imaging[J]. Neuroimage, 2020, 208: 116415. |
| [16] |
ACS P, SELAK M A, KOMOLY S, et al. Distribution of oligodendrocyte loss and mitochondrial toxicity in the cuprizone-induced experimental demyelination model[J]. J Neuroimmunol, 2013, 262(1/2): 128-131. |
| [17] |
WERGELAND S, TORKILDSEN ∅, MYHR K M, et al. The cuprizone model: regional heterogeneity of pathology[J]. APMIS, 2012, 120(8): 648-657. |
| [18] |
WOOD T C, SIMMONS C, HURLEY S A, et al. Whole-brain ex-vivo quantitative MRI of the cuprizone mouse model[J]. PeerJ, 2016, 4: e2632. |
| [19] |
MILLER D H, GROSSMAN R I, REINGOLD S C, et al. The role of magnetic resonance techniques in understanding and managing multiple sclerosis[J]. Brain, 1998, 121(Pt 1): 3-24. |
| [20] |
GLASSER M F, COALSON T S, ROBINSON E C, et al. A multi-modal parcellation of human cerebral cortex[J]. Nature, 2016, 536(7615): 171-178. |
| [21] |
RIGHART R, BIBERACHER V, JONKMAN L E, et al. Cortical pathology in multiple sclerosis detected by the T1/T2-weighted ratio from routine magnetic resonance imaging[J]. Ann Neurol, 2017, 82(4): 519-529. |
| [22] |
UDDIN M N, FIGLEY T D, SOLAR K G, et al. Comparisons between multi-component myelin water fraction, T1w/T2w ratio, and diffusion tensor imaging measures in healthy human brain structures[J]. Sci Rep, 2019, 9(1): 2500. |
| [23] |
CACCIAGUERRA L, ROCCA M A, STORELLI L, et al. Mapping white matter damage distribution in neuromyelitis optica spectrum disorders with a multimodal MRI approach[J]. Mult Scler, 2021, 27(6): 841-854. |
| [24] |
ARM J, RIBBONS K, LECHNER-SCOTT J, et al. Evaluation of MS related central fatigue using MR neuroimaging methods: scoping review[J]. J Neurol Sci, 2019, 400: 52-71. |
| [25] |
ALLNOCH L, BAUMGÄRTNER W, HANSMANN F. Impact of astrocyte depletion upon inflammation and demyelination in a murine animal model of multiple sclerosis[J]. Int J Mol Sci, 2019, 20(16): 3922. |
| [26] |
MCGAVIN M D. Factors affecting visibility of a target tissue in histologic sections[J]. Vet Pathol, 2014, 51(1): 9-27. |




