2. 400038 重庆,陆军军医大学(第三军医大学):基础医学院学员五大队十五中队;
3. 400038 重庆,陆军军医大学(第三军医大学):生物医学工程与影像医学五大队十七队;
4. 400038 重庆,陆军军医大学(第三军医大学):基础医学院组织胚胎学教研室;
5. 400038 重庆,陆军军医大学(第三军医大学):附属第一医院病理科;
6. 400037 重庆,陆军军医大学(第三军医大学)附属第二医院肝胆科
2. Squadron 15, Team 5, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Squadron 17, Team 5, College of Biomedical Engineering and Medical Imaging, Army Medical University (Third Military Medical University), Chongqing, 400038;
4. Department of Histology and Embryology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
5. Institute of Pathology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
6. Department of Hepatobilliary Surgery, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
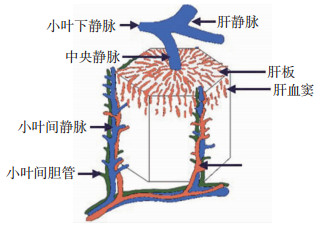
肝脏是人体最重要的代谢器官,肝炎、肝硬化、肝癌等各种疾病会破坏肝脏微观结构如肝功能单元,导致肝功能衰竭,甚至危及生命,因此,肝移植成为此时治疗的主要手段[1-3]。然而,由于供体来源匮乏,人们只好寄希望于生物人工肝,特别是采用生物3D打印技术打印活的肝细胞,以期用3D打印肝脏替代人体肝脏。基于这一设想,已有不少关于肝活细胞3D打印的研究[4-8]。然而,3D打印亟须详细了解人体肝脏的微细结构——肝功能单元,肝功能单元必须要有成千上万的肝细胞按照人体肝脏组织特定的三维空间细胞构筑规律进行科学有序的排列,形成特定的人体肝脏组织三维空间结构,包括和血管、门管区、肝小叶之间形成特定的立体空间关系,构成一个基本的功能单元。比较遗憾的是,人们对肝功能单元的了解主要依赖于传统的二维组织学切片和三维空间想象,而不是很严谨的基于组织学图片的精确配准和三维重建。传统组织学图谱和教材上,将肝脏的功能单元称为“肝小叶”,对典型肝小叶的描述为:肝细胞排列为肝板,由若干肝板排列为一个多面棱柱体,称为肝小叶[9]。这些描述,看起来已经对肝小叶的三维结构非常清楚,然而其形态结构的获得,来自组织学家的二维组织学切片的二维组织学观察和人为三维主观想象,国内外所有教科书展示的肝小叶三维结构都为肝小叶“模式图”(图 1)。到目前为止,尚没有通过一个人体肝组织结构的三维重建,客观展示肝小叶实际三维结构。本文主要通过对人体肝组织学切片,HE染色并扫描,对肝组织学图像上肝功能单元结构进行配准、分割及三维重建,熟悉掌握肝功能单元结构包括肝血窦、中央静脉、小叶间静脉、动脉、胆管的三维形态和空间位置关系,进而分析测量其形态结构,探索肝功能单元的三维立体构筑规律。
|
| 图 1 肝小叶模式图 |
1 材料与方法 1.1 材料
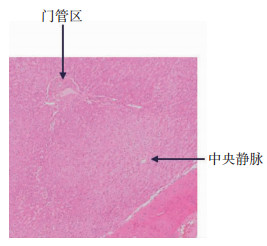
收集了人体正常肝组织,经4%多聚甲醛、无水乙醇等处理后,进行石蜡包埋。使用莱卡切片机进行连续切片,层厚4 μm,连续切片500张,采用常规HE染色,在奥林巴斯全景扫描仪下进行扫描,大小10×40(目镜×物镜),采集数据包含1个完整的肝功能单元彩色图像(图 2)。
|
| 图 2 人体肝脏组织学切片 |
1.2 方法 1.2.1 图像配准
利用Photoshop软件以中央静脉和门管区中小叶间静脉和小叶间胆管为基准点进行手工图像配准,包括图像平移、旋转、拉伸等刚性配准,以门管区和肝小叶中央静脉为中心点,手工进行配准,也包括处理扭曲形变的非刚性配准,非刚性配准方法主要有基于空间变换和基于伪物理模型两大类[10]。初步获得了细胞级配准的连续断层肝小叶图像。
1.2.2 数据导入选取已配准好的肝小叶图像130张,这130张图片的选择是根据肝小叶位于结缔组织和门管区之间的位置进行的,每张图像层厚为4 μm,分辨率为6 169×6 503像素,每张图像大小为83 MB,将其导入Amira软件中,在“VoxelSize”中输入相关体素参数,运用“Compute”中的“Cast Field”功能模块将彩色图像集转换为灰阶图像集,对灰阶图像集运用“Labeling”中的“Label Field”功能模块生成与之对应的分割文件[10-13]。
1.2.3 图像连续解剖学观察使用Acdsee和Amira图像软件,我们将配准后肝小叶图像进行连续断层播放,进行肝小叶结构的断层解剖学观察,并对肝功能单元的各结构进行断层测量和解剖学观察。
1.2.4 数据分割进入“Segmentation Editor”界面中使用“Lasso”或“Magic Wand”工具逐层进行肝小叶细微结构包括小叶间动脉、小叶间静脉、小叶间胆管、中央静脉、肝血窦和肝小叶等结构的手动分割,每手工分割一张约耗费30min。不同结构需使用不同的“Label”进行表示,避免三维重建后的结构无法分离。
1.2.5 三维重建分割完成后对分割文件使用“Compute”中的“Resample”功能模块按照2 ∶2 ∶1进行数据重样,以减少体素数量,节省计算机使用空间,提高后期计算机三维运算速度,利用“Surface Gen”功能模块进行不平滑三维重建,获得各肝小叶结构的三角面片模型文件。
1.2.6 平滑简化在不破坏模型表面原始形状的基础上,利用“Simplifier”功能模块对“Faces”参数进行调节,以减少模型的三角面片数量,达到三维模型简化的目的,同时“Smooth Surface”功能对模型进行平滑,达到模型平滑的目的(图 3、图 4、图 5)。
|
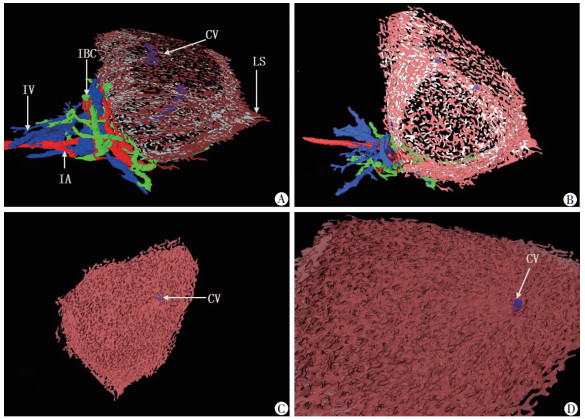
| A:肝血窦及其门管区的三维重建(侧面观);B:肝血窦及其门管区的三维重建(上面观);C:肝血窦及中央静脉的三维重建(上面观);D.肝血窦的局部放大图与图C相对应 IA: 小叶间动脉;IV: 小叶间静脉;IBC: 小叶间胆管;LS: 肝血窦;CV: 中央静脉 图 3 肝血窦及其门管区的三维重建 |
|
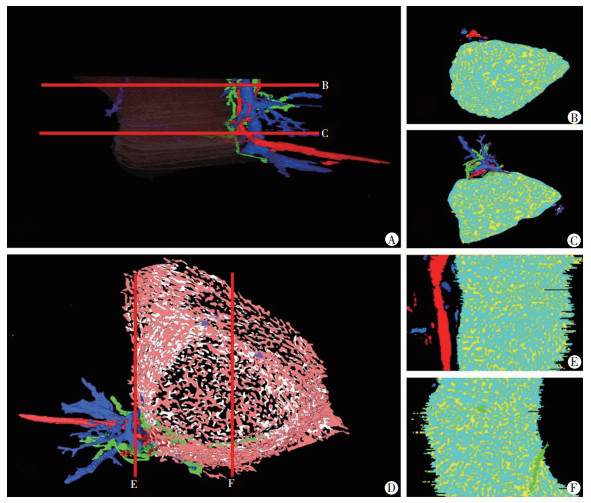
| A:肝小叶的三维重建的不同位置的横截面;B、C:肝小叶的横断面;D:肝小叶不同位置矢状面;E:门管区矢状面;F:肝小叶矢状面 图 4 肝组织不同位置横断面截图 |
|
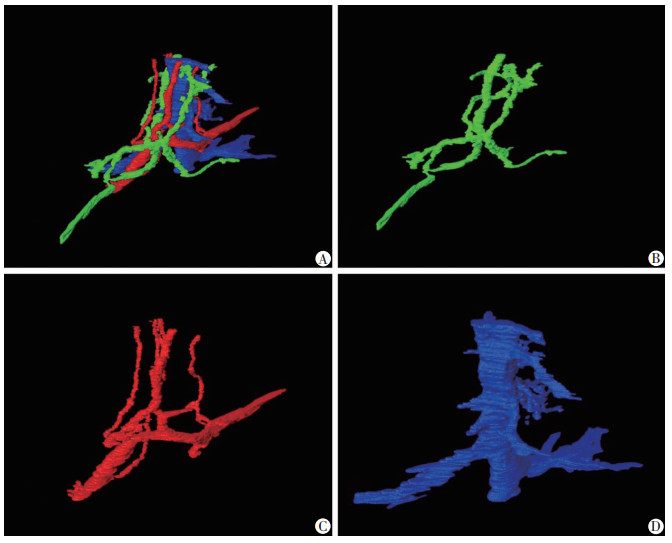
| A:门管区的小叶间静脉、小叶间动脉和小叶间胆管的三维重建;B:小叶间胆管的三维重建;C:小叶间动脉的三维重建;D:小叶间静脉的三维重建 图 5 门管区的三维重建 |
1.2.7 数据的分析测量
通过Amira软件中“3D length”功能键对三维重建的肝功能单元结构进行长度和管腔直径的数据测量,肝血窦体积占比的计算。
2 结果 2.1 肝小叶的三维重建我们完成了130张肝血窦组织学图像的人工配准与分割,三维建模肝小叶纵向长度为621.03 μm,约占肝小叶整体纵向长度的1/4。通过三维重建我们发现:肝小叶的外轮廓较为圆润,肝小叶的形状呈不规则五边形(图 3A),长度不等,最大直径可达1 495.27 μm,最小直径为1 036.96 μm,进一步表明肝小叶的外部轮廓为一个较为圆润的形状。每个肝小叶周围约有3~5个门管区。以中央静脉为中心点,隐约可见其周围分布有不规则的肝细胞索,并呈现非放射状排列,肝细胞索之间存在肝血窦,肝血窦的排列表现为不规则的相互交织的血管网(图 3C、3D)[14-16]。比较遗憾的是,由于工作量巨大,我们所重建的肝小叶并不完整,约为完整肝小叶的1/4。
2.2 中央静脉肝小叶的中央静脉(图 3A)长度为436 μm,管径直径平均约为57.35 μm。中央静脉中心距周围门管区边缘的距离也不同(图 3D),依次表现为322.38 μm;474.05 μm;878.7 μm;880.16 μm,从(图 3D)可以看出,中央静脉的形态位置靠近肝小叶的边缘地区,中央静脉起源于肝小叶中间位置,并非从头到尾穿梭于肝小叶。
2.3 肝血窦肝血窦是位于肝细胞索之间相互吻合成网状的毛细血管(图 3C、3D)[16],从(图 3D)中可以看出,肝血窦的主要部分为扁柱状,形状不规则,表面积较大,根据三维重建图,肝血窦的体积为0.106 3 mm3, 肝小叶的体积为0.204 1 mm3,肝血窦的体积约占肝小叶体积的52%。通过(图 4)看出靠近中央静脉的肝血窦较多且连贯,远离中央静脉的肝血窦较为稀疏且分散,(图 4B、4C)为肝小叶的横截面,我们可以看出肝血窦的排列并不是呈放射状位于中央静脉周围,而是相互交织的血管网。
2.4 门管区通过(图 5)可以看出,门管区的小叶间胆管(图 5B)和小叶间动脉(图 5C)的分支非常丰富,门管区各个结构的长度,管径大小见表 1。由图 5可知门管区的小叶间胆管和小叶间动脉分支丰富,其最长长度都可以达到1 100 μm;小叶间静脉的管腔较大,为127.73 μm,小叶间胆管和小叶间动脉管腔较小,小叶间胆管管经35.17 μm,小叶间动脉管径20.27 μm。从分割界面图(图 6D)可以看出一个肝小叶附近约有3~5个门管区,而1个门管区的小叶间胆管和小叶间动脉的分支约为4~5条,小叶间静脉分支约为2~3条。小叶间动脉、静脉和胆管分支较多,其分支与FMOST系统分割重建的肝小叶图像相互吻合,分布于肝小叶外周(图 6A)。
| 最长长度 | 最大管径 | 最小管径 | 管径直径 | |
| 肝小叶 | 1 495.27 | 1 036.96 | 1 127.38±20.15 | |
| 中央静脉 | 436 | 101.61 | 38.71 | 57.35±14.80 |
| 小叶间胆管 | 1 193.48 | 228.54 | 11.24 | 35.17±17.36 |
| 小叶间动脉 | 1 148.84 | 462.33 | 11.9 | 20.27±6.95 |
| 小叶间静脉 | 543.42 | 646.96 | 19.52 | 127.73±30.54 |
| 肝血窦 | 49.63 | 7.57 | 29.92±10.26 |

|
| A:通过FMOST系统分割重建的完整肝小叶图像;B:图A的相同位置的肝血窦三维重建,通过HE染色切片重建的肝血窦及其门管区的三维重建;C:FMOST系统下的肝小叶分割界面图像;D:HE染色下的肝血窦分割界面 图 6 肝小叶的三维重建与肝血窦的三维重建比较 |
我们通过FMOST系统切片染色分割三维重建的完整肝小叶图像(图 6A)[17]与HE染色切片重建的肝小叶三维重建图(图 6B)为不同的肝组织,FMOST是致力于亚微米分辨的三维组织成像及重构技术的相关研究,能够实现肝小叶的三维精细成像。从图 6A可以看出肝小叶的外轮廓为不规则的多边形,与我们通过肝血窦三维重建图一致。将两个不同肝组织的肝小叶重建出来更好的验证本文提出的肝小叶的外轮廓为不规则的较圆润的多边形。
3 讨论通过常规肝小叶组织学切片HE染色和FMOST系统的切片染色获得图像,肝小叶的外轮廓为不规则的多边形,各边长度不均等,并不是传统的六边形。这可能是肝小叶在生长发育过程中存在轮廓塑造和再塑造的过程,相邻肝小叶在生长发育过程中相互挤压,使边界变形,引起肝小叶外轮廓形态不规则;同时,人体肝小叶之间不存在小叶间致密结缔组织间隔,人体肝小叶轮廓并不清楚,不同于猪肝和牛肝的肝小叶,发育过程中相邻肝小叶轮廓的相互挤压,会导致肝小叶形态的变形,而非规整的六边形;中央静脉并不位于肝小叶中央位置,也跟肝小叶内部肝细胞的塑形与再塑形有关;肝血窦并非呈放射状排列于中央静脉四周,而是在中央静脉周围呈现出相互交织的血管网,并且肝血窦越靠近中央静脉,密度越大,反之,越稀疏。
通过连续肝组织切片染色获得的数字化组织学图像,对图像进行了细胞级的配准,分割和三维重建,真实度和精准度远远高于传统的组织学图谱和教材;为人体组织学教科书提供来源于真实人体的完整肝小叶细胞立体构筑的三维可视化图像资料;想比较于传统模式示意图,完成了真实人体肝小叶的三维重建图,无论是学生针对肝功能单元的学习和理解还是老师在整体授课上都有真实立体的感知和对微观结构整体的把握[19-20]。文献[18]报道通过分析人体肝组织管道铸形和高分辨率微CT扫描与图像处理相结合,为人类肝脏循环提供了独特的数据,这能够对复杂的肝血管进行数字可视化,并收集高分辨率数据进行定量形态学分析,建立的人肝脏电模拟模型,可以根据生理数据预测整个肝血管的血流参数,然而该模型难以清晰展示肝功能单位内部和外部的精细三维结构;而本研究中的三维重建图能够精准反映肝功能单元的三维形态和空间毗邻关系,为建立肝脏微血管系统提供研究基础,在组织微细结构的形态学研究领域具有广阔的应用前景。肝功能三维重建图也为肝脏组织细胞的3D打印提供首要的计算机模型,同时,也在组织学上用计算机三维模型阐明肝小叶的真实三维空间细胞构筑规律,有助于未来肝细胞培养和活细胞打印。
本研究不足:由于肝功能单元三维重建数据量和工作量巨大,图像由于目前重建的只有130张肝小叶的切片,总长度为0.52 mm,而一个完整的肝小叶为2 mm,还不能完整的展示整个肝小叶的肝血窦三维重建;下一步工作我们已通过FMOST系统重构一个完成肝小叶的显微结构。肝组织断层切片在切片、染色过程中存在一定程度的形变,对后续的图像配准和三维重建有着细微的影响。
| [1] |
YAMAGUCHI T, MATSUZAKI J, KATSUDA T, et al. Generation of functional human hepatocytes in vitro: current status and future prospects[J]. Inflamm Regen, 2019, 39(1): 1-9. |
| [2] |
BURRA P, FREEMAN R. Trends in liver transplantation 2011[J]. J Hepatol, 2012, 56(Suppl 1): S101-S111. |
| [3] |
TONIUTTO P, ZANETTO A, FERRARESE A, et al. Current challenges and future directions for liver transplantation[J]. Liver Int, 2017, 37(3): 317-327. |
| [4] |
PAN X P, LI L J. Advances in cell sources of hepatocytes for bioartificial liver[J]. Hepatobiliary Pancreat Dis Int, 2012, 11(6): 594-605. |
| [5] |
KASHTE S, MARAS J S, KADAM S. Bioinspired engineering for liver tissue regeneration and development of bioartificial liver: a review[J]. Crit Rev Biomed Eng, 2018, 46(5): 413-427. |
| [6] |
SAKIYAMA R, BLAU B J, MIKI T. Clinical translation of bioartificial liver support systems with human pluripotent stem cell-derived hepatic cells[J]. World J Gastroenterol, 2017, 23(11): 1974-1979. |
| [7] |
王英杰. 生物人工肝: 进展、难点与发展方向[J]. 中国继续医学教育, 2010, 2(3): 50-54. WANG Y J. Bioartificial liver: progress, difficulties and development direction[J]. Chin Cont Med Edu, 2010, 2(3): 50-54. |
| [8] |
丁舒, 崔元璐, 叶磊, 等. 基于微载体技术的生物人工肝研究进展[J]. 科学通报, 2012, 57(14): 1195-1203. DING S, CUI Y L, YE L, et al. Recent developments in bioartificial livers based on microcarrier technology[J]. Chin Sci Bull, 2012, 57(14): 1195-1203. |
| [9] |
李雪丽, 江新青, 崔嵩, 等. 基于CT图像的人体肝脏血管系统三维可视化的实现[J]. 生物医学, 2017, 7(2): 13-19. DOI: 10.12677/HJBM.2017.72003. LI X L. The realization of three dimensional visualization of human liver's vascular systems based on ct scan images[J]. Hans J Biomed, 2017, 7(2): 13-19. DOI: 10.12677/HJBM.2017.72003. |
| [10] |
汪军, 梁凤梅. 基于P样条和局部互信息的非刚性医学图像配准[J]. 计算机应用研究, 2017, 34(8): 2538-2541. WANG J, LIANG F M. Nonrigid medical image registration based on P-spline and regional mutual information[J]. Appl Res Comput, 2017, 34(8): 2538-2541. |
| [11] |
ZHAI X Y, BIRN H, JENSEN K B, et al. Digital three-dimensional reconstruction and ultrastructure of the mouse proximal tubule[J]. J Am Soc Nephrol, 2003, 14(3): 611-619. |
| [12] |
ZHAI X Y. Three-dimensional reconstruction of the mouse nephron[J]. J Am Soc Nephr, 2006, 17(1): 77-88. |
| [13] |
ZHANG S X, HENG P A, LIU Z J, et al. Creation of the Chinese visible human data set[J]. Anat Rec Part B New Anat, 2003, 275(1): 190-195. |
| [14] |
曾昊, 孙亚楠, 何慧芬, 等. 中华竹鼠肺脏的组织结构[J]. 经济动物学报, 2019, 23(4): 227-230. ZENG H, SUN Y N, HE H F, et al. Histological structure of lung of Rhizomys sinensis[J]. J Econ Animal, 2019, 23(4): 227-230. |
| [15] |
WU M C. Experimental and clinical study on hepatobiliary surgery in China[J]. Chin Med J, 1996, 109(2): 35-37. |
| [16] |
王嘉睿, 詹淑华, 马世武. 肝血窦作为肝脏发育驱动因素的新认识[J]. 肝脏, 2019, 24(12): 1378-1379. CNKI: SUN: ZUAN.0.2019-12-006. WANG J R, ZHAN S H, MA S W. A new understanding of hepatic sinusoids as a driver of liver development[J]. Chin Hepatol, 2019, 24(12): 1378-1379. |
| [17] |
LI A, GONG H, ZHANG B, et al. Micro-optical sectioning tomography to obtain a high-resolution atlas of the mouse brain[J]. Science, 2010, 330(6009): 1404-1408. |
| [18] |
ZHANG S X, HENG P A, LIU Z J, et al. The Chinese Visible Human (CVH) datasets incorporate technical and imaging advances onearlier digital humans[J]. J Anat, 2010, 204(Pt 3): 165-173. |
| [19] |
ZHANG X Q, XU Z, TAN L W, et al. Application of three-dimensional reconstruction and printing as an elective course for undergraduate medical students: an exploratory trial[J]. Surg Radiol Anat, 2019, 41(10): 1193-1204. |
| [20] |
DEBBAUT C, SEGERS P, CORNILLIE P, et al. Analyzing the human liver vascular architecture by combining vascular corrosion casting and micro-CT scanning: a feasibility study[J]. J Anat, 2014, 224(4): 509-517. |




