创伤是世界上导致死亡与残疾的主要原因之一。据全球最新疾病负担研究报告,因创伤死亡者占世界死亡人口的8%,其中,道路交通伤害位列死因排序前10[1]。我国情况也不容乐观,近30年来,创伤在国内死因排序中明显上升,截至2017年,道路交通伤害已跃升成为国内第5大死因[2]。关于创伤死亡的经典“三峰曲线理论”已经指出,创伤后发生多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS) 等严重并发症是导致“第三峰死亡”的主要原因[3]。因此,在预防严重创伤发生的前提下,对创伤后MODS进行早期预测和干预,是降低后期死亡率的主要发力点。
近年来,生物标志物可溶性尿激酶型纤溶酶原激活物受体(soluble urokinase-type plasminogen activator receptor, suPAR)在疾病严重程度评估和预后预测等方面展现出了良好的临床应用价值,它是当机体受到炎症刺激和免疫激活时,尿激酶型纤溶酶原激活物受体(urokinase-type plasminogen activator receptor, uPAR) 在蛋白酶的作用下从多种活化免疫细胞和血管内皮细胞等细胞表面脱落下来形成的可溶形式[4]。大量研究表明,当机体处于病原体感染及某些无菌性炎症疾病状态时,血浆suPAR水平会显著升高,能充分反映疾病发生、发展、严重程度以及器官功能损害等情况[5-6]。但在以局部及全身免疫炎症反应为重要病理生理特点的严重创伤中[7],suPAR与创伤后MODS等炎症相关性并发症的关系尚未明确。因此,本研究将探讨创伤早期血浆suPAR水平与MODS的关系,评估suPAR在创伤后MODS中的预测价值,以期为严重创伤后炎症相关性并发症的早期预测与评估提供新的思路。
1 资料与方法 1.1 研究对象纳入2019年12月至2020年12月我院急救部收治的严重创伤患者。纳入标准:①创伤后1 d内入院并住院治疗;②损伤严重度评分(injury severity score, ISS)≥16分;③年龄≥18周岁。排除标准:①拒绝参加研究;②孕妇或哺乳期女性;③感染人类免疫缺陷病毒或2019新型冠状病毒;④既往患中性粒细胞减少症;⑤合并已知恶性肿瘤;⑥长期使用免疫调节剂。本研究经本院伦理委员会批准(KY2019160)并征得了所有受试患者的知情同意。
1.2 标本采集与suPAR检测患者入院后,由采血护士采集2 mL静脉血至标准EDTA真空抗凝采血管,轻柔摇匀,静置10~20 min后1 200×g离心15 min,取上清液(约1 mL血浆)置于EP管中,密封管口。为便于检测,标本均保存于-70 ℃环境中直至检测,检测方法采用酶联免疫吸附测定法(ELISA)。suPAR性质稳定,其血浆水平不受采样时间及外界因素影响,即使在反复冻融的情况下也能保持相对恒定[8]。
1.3 资料收集由1名通过培训的人员专门从医院电子病历系统前瞻性收集相关数据,另外1名人员进行审核。收集的数据包括年龄、性别、合并的慢性疾病、致伤因素、损伤部位、ISS、生命体征(体温、心率、呼吸、血压、意识,包括是否使用血管活性药物、是否机械通气等)、常规实验室检查结果(血常规、肝功能、肾功能、动脉血气等),以及随访观察期内是否合并休克、是否并发感染、是否接受手术和是否进行血液净化等。
1.4 终点指标及分组本研究的观察随访期为患者入院后14 d内,终点指标为发生MODS,诊断标准为创伤发生48 h后序贯器官衰竭评分(sequential organ failure assessment, SOFA)≥5分且持续至少2 d[9]。患者在随访期内发生终点事件或未发生终点事件但随访期已满的则结束研究,未满随访期且未出现终点事件而非医嘱出院的患者自动退出研究。根据是否发生MODS,将患者分为MODS组和非MODS组。
1.5 统计学分析应用SPSS 26.0和MedCalc 19.0统计软件进行分析。计量资料经Shapiro-Wilk检验确定分布情况,符合正态分布的以x±s表示,组间比较采用t检验;非正态分布的以M(Q1, Q3)表示,采用Mann-Whitney U检验。计数资料以例(%)表示,采用χ2检验进行组间比较。利用逐步回归法对相应变量进行多因素Logistic回归分析,筛选出创伤后MODS的独立预测因素,采用受试者工作特征曲线(ROC)分析各指标的预测价值。检验水准α=0.05。
2 结果 2.1 一般资料研究期间共纳入108例符合研究标准的严重创伤患者,其中男性86例(79.6%),女性22例(20.4%);年龄(48.1±14.4)岁;合并已知慢性疾病者17例(15.7%);致伤因素分布为坠落伤46例(42.6%),交通伤41例(38.0%),重物砸伤13例(12.0%),摔伤6例(5.6%),爆炸伤1例(0.9%),枪击伤1例(0.9%);损伤部位按ISS分区法分布为合并头颈部损伤67例(62.0%),合并面部损伤19例(17.6%),合并胸部损伤98例(90.7%),合并腹部损伤42例(38.9%),合并四肢或骨盆损伤49例(45.4%);入院ISS中值29 (22, 33) 分;住院14 d内共有34例患者发生MODS,发生率为31.5%。MODS组患者的年龄、合并慢性疾病率和ISS显著高于非MODS组(P < 0.05),两组的性别、致伤因素和损伤部位差异无统计学意义(表 1)。
| 组别 | n | 年龄(x±s)/岁 | 性别[例(%)] | 慢性疾病[例(%)] | 致伤因素[例(%)] | ||||||
| 男 | 女 | 有 | 无 | 坠落伤 | 交通伤 | 其他 | |||||
| MODS组 | 34 | 52.6±14.1 | 30(88.2) | 4(11.8) | 10(29.4) | 24(70.6) | 15(44.1) | 11(32.4) | 8(23.5) | ||
| 非MODS组 | 74 | 46.1±14.1 | 56(75.7) | 18(24.3) | 7(9.5) | 67(90.5) | 31(41.9) | 30(40.5) | 13(17.6) | ||
| t/z/χ2值 | -2.221 | 2.266 | 6.992 | 0.864 | |||||||
| P值 | 0.029 | 0.132 | 0.008 | 0.649 | |||||||
| 组别 | n | 损伤部位[例(%)] | ISS[M(Q1,Q3)]/分 | ||||||||
| 头颈部 | 面部 | 胸部 | 腹部或盆腔 | 四肢或骨盆 | |||||||
| MODS组 | 34 | 22(64.7) | 4(11.8) | 32(94.1) | 15(44.1) | 16(47.1) | 29 (25, 33) | ||||
| 非MODS组 | 74 | 45(60.8) | 15(20.3) | 66(89.2) | 27(36.5) | 33(44.6) | 26 (21, 30) | ||||
| t/z/χ2值 | 0.150 | 1.163 | 0.215 | 0.571 | 0.057 | -2.215 | |||||
| P值 | 0.698 | 0.281 | 0.643 | 0.450 | 0.811 | 0.027 | |||||
2.2 入院suPAR水平及其他可能影响因素的组间比较
对MODS组和非MODS组患者的入院血浆suPAR、入院白细胞计数(WBC)、合并休克、并发感染、接受手术、接受血液净化等情况进行比较,结果显示,MODS组患者入院suPAR、合并休克率、并发感染率和接受手术率均显著高于非MODS组(P < 0.05),入院WBC和接受血液净化率的组间差异无统计学意义(表 2)。
| 组别 | n | suPAR(x±s)/ng·mL-1 | WBC[M(Q1,Q3)]/109·L-1 | 休克[例(%)] | 感染[例(%)] | 手术[例(%)] | 血液净化[例(%)] |
| MODS组 | 34 | 6.7±2.7 | 13.2(9.7, 16.1) | 14(41.2) | 21(61.8) | 18(52.9) | 2(5.9) |
| 非MODS组 | 74 | 5.0±2.1 | 12.6(10.4, 17.2) | 13(17.6) | 18(24.3) | 24(32.4) | 2(2.7) |
| t/z/χ2值 | -3.639 | -0.470 | 6.925 | 14.155 | 4.123 | - | |
| P值 | 0.000 | 0.639 | 0.008 | 0.000 | 0.042 | 0.589 |
2.3 suPAR及各影响因素的多因素回归分析
采用逐步回归法,对上述两组间差异有统计学意义的7个变量(年龄、合并慢性疾病、ISS、suPAR、合并休克、并发感染、接受手术)进行多因素Logistic回归分析,结果显示合并慢性疾病、ISS、suPAR及并发感染是创伤后发生MODS的独立预测因素(P < 0.05,表 3)。
| 因素 | B值 | OR值 | 95% CI | P值 |
| 合并慢性疾病 | 1.514 | 4.544 | 1.112~18.573 | 0.035 |
| ISS | 0.081 | 1.084 | 1.008~1.166 | 0.031 |
| suPAR | 0.270 | 1.310 | 1.067~1.610 | 0.010 |
| 并发感染 | 1.645 | 5.180 | 1.880~14.277 | 0.001 |
2.4 suPAR对创伤后MODS的预测价值
利用ROC曲线分析入院suPAR和ISS对创伤后MODS的预测作用,结果提示入院suPAR水平具有中等预测价值,其曲线下面积(AUC)为0.704(95%CI=0.608~0.788, P < 0.001),取最大约登指数对应的截断值5.04 ng/mL时,敏感度为73.5%,特异度为62.2%。ISS预测创伤后MODS的AUC为0.632(95%CI=0.534~0.723, P=0.022, 图 1),取截断值26分时对应的敏感度为73.5%,特异度为58.1%。
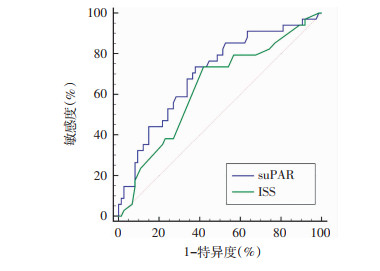
|
| 图 1 入院suPAR和ISS对创伤后MODS的预测价值 |
3 讨论
MODS是导致严重创伤患者“第三峰死亡”的主要原因之一,其发生过程和炎症反应十分密切。组织损伤后,坏死细胞和中性粒细胞等部分活化免疫细胞释放损伤相关分子模式(damage-associated molecular patterns, DAMPs),激活多种免疫细胞和补体系统,加之血小板的活化,会共同触发机体炎症介质的生成和释放,而组织低灌注、凝血和神经内分泌通路激活引发的内皮细胞受损,会进一步促进炎症介质的扩散,伤后30 min即可引发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)[7, 10]。随着抗炎反应的启动,全身炎症反应可能进展为持续炎症-免疫抑制-分解代谢综合征(persistent inflammation-immunosuppression catabolism syndrome, PICS),使机体对病原体的防御能力降低,入侵微生物释放脂多糖等病原体相关分子模式(pathogen-associated molecular patterns, PAMPs),进一步刺激免疫细胞释放炎症介质,形成恶性循环,极易引发MODS和脓毒症等并发症[11],增加创伤后期的死亡风险。动态监测炎症状态、早期识别并干预MODS进程,对降低死亡率尤为重要。
本研究的主要指标suPAR是一种新兴的炎症标志物,其在多种炎症相关性疾病中的良好预后价值已被大量证明。本研究中,MODS组的血浆suPAR水平显著高于非MODS组,表明严重创伤后发生MODS的患者在入院时体内即存在较高水平的炎症和免疫激活,这是符合MODS的病理生理基础的。不少研究指出SIRS患者的血浆suPAR水平显著升高[12-13],证实suPAR与全身炎症反应之间的密切关系,而SIRS作为MODS的基础,suPAR与MODS间的关系由此可见一斑。LONG等[14]报道关于suPAR与重症急性胰腺炎(severe acute pancreatitis, SAP)的研究也指出进展为MODS的SAP患者早期血浆suPAR水平显著高于未进展组,同样揭示了suPAR与MODS发生、发展间的关系。本研究中MODS组的合并休克率、并发感染率和接受手术率显著高于非MODS组,但入院WBC组间差异无统计学意义,与文献[15-16]报道一致。白细胞反应是急性炎症的重要过程,数量最多的中性粒细胞一般在24 h内穿过血管壁游出至周围组织,24~48 h后即发生凋亡和坏死。因此,即使在创伤后24~48 h内检测WBC,结果也会因采血具体时间的不同而有较大波动。这可能是导致WBC组间差异无统计学意义的原因之一。
ISS是国际公认的创伤严重程度评分系统,总分由3个最严重损伤区域(头颈部、面部、胸部、腹部、四肢及骨盆、体表)中的各最高简明损伤定级(abbreviated injury scale, AIS)分值的平方和相加而成。ISS越高,表明创伤程度越重。本研究结果显示,MODS组患者的ISS显著高于非MODS组,这与既往回顾性研究的结果相符[15-17],提示创伤后发生MODS的患者受到的解剖学损伤更为严重。在调整混杂因素后,ISS仍是创伤后MODS的独立预测因素,但预测价值稍弱,笔者认为可能与以下几个因素有关:一方面,按照ISS的计算规则,ISS≥16分的创伤大多数是多发伤,而ISS无法评估损伤部位的多少,同时,ISS只计算身体3个最严重损伤区域中的各自最高AIS,导致忽略了每个区域内最重伤以外的其他伤,即忽略了同一区域内多处损伤的综合效应,若患者在同一区域内有多处重伤,ISS将低估创伤程度,此时,由这些损伤引发的局部和全身的炎症反应和免疫激活水平便无法完全和ISS对应起来,TIMMERMANS等[18]的研究结果提示炎症指标suPAR与创伤患者的ISS之间无明显相关性。基于此,单独应用ISS预测创伤后MODS的价值可能有限。另一方面,对于同一例患者,AIS和ISS在创伤发生后就已确定,不会随着病情进展而发生变化,但机体创伤后的炎症和免疫水平一直处于动态变化之中,且极容易受到缺血再灌注损伤、手术、病原体感染等多种因素影响,这些因素往往会加速MODS进程,然而临床上,受到更多的这些“二次打击”的患者ISS并不一定较高,从这一角度也能对该结果作出一定解释。
根据多因素Logistic回归分析的结果,在调整年龄等混杂因素后,合并慢性疾病和并发感染仍是创伤后MODS的独立预测因素。临床上,合并慢性基础疾病的患者相应脏器的功能往往减退,生理贮备能力降低,对机体急性应激的应答与防御能力较弱,更容易发生器官功能障碍甚至衰竭。感染更是MODS的促进因素,机体感染后PAMPs释放在MODS的发生、发展中扮演的重要角色早已得到揭示,积极预防和控制感染,已成为预防MODS等创伤后炎症相关性并发症发生的重要举措。本研究结果显示,入院血浆suPAR水平也是创伤后MODS的独立预测因素,单独应用时具有中等价值,与PATRANI等[19]的研究suPAR对多发伤后多器官功能衰竭(multiple organ failure, MOF)的预测作用结果相符,当取截断值suPAR >5.04 ng/mL时,敏感度为73.5%,高于特异度62.2%。研究[20]表明,uPAR和suPAR在局部及外周循环中的浓度增高时,会抑制巨噬细胞对已凋亡的中性粒细胞和其他细胞群的吞噬作用,而严重创伤时巨噬细胞功能受损也在动物实验中被证实[21]。因此可以推测,严重创伤时,suPAR抑制巨噬细胞的吞噬作用,导致凋亡细胞不能被完全吞噬,最终破裂释放胞内物质,进一步加重炎症反应和组织损伤,这可能是suPAR在MODS进展中的一个作用机制。目前有关suPAR与创伤后MODS/MOF的临床研究国内外均开展较少,多数研究集中在和MODS具有共同生理基础的脓毒症上,PREGERNIG等[22]和HUANG等[5]的荟萃分析均报道suPAR对脓毒症具有中等程度的诊断和预后预测价值,且其拥有较ICU常用炎症标志物降钙素原(PCT)更好的特异度,提示suPAR在脓毒症、MODS等炎症性疾病中具有良好的临床应用前景。
综上,严重创伤患者入院血浆suPAR水平能够预测创伤后MODS的发生,早期监测suPAR对识别患者机体炎症及免疫激活水平、指导临床评估和治疗具有一定价值。但本研究也存在一定局限性:①研究为单中心设计,样本量仍然偏小,结果可能存在一定偏倚;②本研究仅检测了患者入院时的血浆suPAR水平,没有对其进行动态监测,而创伤后的炎症免疫反应十分复杂且持续变化,连续检测suPAR可能具有更大的临床意义;③本研究因聚焦于探讨suPAR的早期预测价值,没有建立预测模型,相关影响因素的纳入可能不够全面,研究结果显示单独应用suPAR时AUC在0.7左右,预测价值仍然有限,因此还需要更大样本量的研究进一步探讨suPAR联合其他指标及评分对创伤后MODS的预测能力。
| [1] |
GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2018, 392(10159): 1736-1788. DOI:10.1016/S0140-6736(18)32203-7 |
| [2] |
ZHOU M G, WANG H D, ZENG X Y, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [3] |
王正刚, 张连阳. 创伤死亡曲线研究现状[J]. 中华创伤杂志, 2011, 27(4): 382-384. WANG Z G, ZHANG L Y. Research advances in trauma death curve[J]. Chin J Trauma, 2011, 27(4): 382-384. DOI:10.3760/cma.j.issn.1001-8050.2011.04.030 |
| [4] |
THUNØ M, MACHO B, EUGEN-OLSEN J. suPAR: the molecular crystal ball[J]. Dis Markers, 2009, 27(3): 157-172. DOI:10.3233/DMA-2009-0657 |
| [5] |
HUANG Q R, XIONG H Y, YAN P J, et al. The diagnostic and prognostic value of suPAR in patients with sepsis[J]. Shock, 2020, 53(4): 416-425. DOI:10.1097/shk.0000000000001434 |
| [6] |
DESMEDT S, DESMEDT V, DELANGHE J R, et al. The intriguing role of soluble urokinase receptor in inflammatory diseases[J]. Crit Rev Clin Lab Sci, 2017, 54(2): 117-133. DOI:10.1080/10408363.2016.1269310 |
| [7] |
LORD J M, MIDWINTER M J, CHEN Y F, et al. The systemic immune response to trauma: an overview of pathophysiology and treatment[J]. Lancet, 2014, 384(9952): 1455-1465. DOI:10.1016/S0140-6736(14)60687-5 |
| [8] |
RⅡSBRO R, CHRISTENSEN I J, HØGDALL C, et al. Soluble urokinase plasminogen activator receptor measurements: influence of sample handling[J]. Int J Biol Markers, 2001, 16(4): 233-239. |
| [9] |
HUTCHINGS L, WATKINSON P, DUNCAN YOUNG J, et al. Defining multiple organ failure after major trauma: A comparison of the Denver, Sequential Organ Failure Assessment, and Marshall scoring systems[J]. J Trauma Acute Care Surg, 2017, 82(3): 534-541. DOI:10.1097/TA.0000000000001328 |
| [10] |
ZINDEL J, KUBES P. DAMPs, PAMPs, and LAMPs in immunity and sterile inflammation[J]. Annu Rev Pathol, 2020, 15: 493-518. DOI:10.1146/annurev-pathmechdis-012419-032847 |
| [11] |
HESSELINK L, HOEPELMAN R J, SPIJKERMAN R, et al. Persistent inflammation, immunosuppression and catabolism syndrome (PICS) after polytrauma: a rare syndrome with major consequences[J]. J Clin Med, 2020, 9(1): 191. DOI:10.3390/jcm9010191 |
| [12] |
ŞIRINOǦLU M, SOYSAL A, KARAASLAN A, et al. The diagnostic value of soluble urokinase plasminogen activator receptor (suPAR) compared to C-reactive protein (CRP) and procalcitonin (PCT) in children with systemic inflammatory response syndrome (SIRS)[J]. J Infect Chemother, 2017, 23(1): 17-22. DOI:10.1016/j.jiac.2016.08.015 |
| [13] |
BACKES Y, SLUIJS K F, MACKIE D P, et al. Usefulness of suPAR as a biological marker in patients with systemic inflammation or infection: a systematic review[J]. Intens Care Med, 2012, 38(9): 1418-1428. DOI:10.1007/s00134-012-2613-1 |
| [14] |
LONG D, WANG Y J, WANG H, et al. Correlation of serum and ascitic fluid soluble form urokinase plasminogen activator receptor levels with patient complications, disease severity, inflammatory markers, and prognosis in patients with severe acute pancreatitis[J]. Pancreas, 2019, 48(3): 335-342. DOI:10.1097/MPA.0000000000001247 |
| [15] |
KONG T, PARK Y S, LEE H S, et al. The delta neutrophil index predicts development of multiple organ dysfunction syndrome and 30-day mortality in trauma patients admitted to an intensive care unit: a retrospective analysis[J]. Sci Rep, 2018, 8(1): 17515. DOI:10.1038/s41598-018-35796-4 |
| [16] |
苗振军, 刘志祯, 周峰, 等. 多发伤患者并发多器官功能障碍综合征的危险因素分析[J]. 中华创伤杂志, 2018, 34(12): 1114-1119. MIAO Z J, LIU Z Z, ZHOU F, et al. Risk factor analysis of polytrauma patients combined with multiple organ dysfunction syndrome[J]. Chin J Trauma, 2018, 34(12): 1114-1119. DOI:10.3760/cma.j.issn.1001-8050.2018.12.010 |
| [17] |
马晓媛, 肖雅, 陈涛, 等. 解剖学评分联合生理学评分对严重创伤患者并发多器官功能障碍综合征的预测价值[J]. 中华烧伤杂志, 2016, 32(2): 105-108. MA X Y, XIAO Y, CHEN T, et al. Predictive value of combining of anatomy scoring system and physiological scoring system for the diagnosis of multiple organ dysfunction syndrome in patients with severe trauma[J]. Chin J Burns, 2016, 32(2): 105-108. DOI:10.3760/cma.j.issn.1009-2587.2016.02.009 |
| [18] |
TIMMERMANS K, VANEKER M, SCHEFFER G J, et al. Soluble urokinase-type plasminogen activator levels are related to plasma cytokine levels but have low predictive value for mortality in trauma patients[J]. J Crit Care, 2015, 30(3): 476-480. DOI:10.1016/j.jcrc.2015.01.006 |
| [19] |
PATRANI M, TSAGANOS T, KOTZAMPASSI K, et al. Soluble urokinase plasminogen activator receptor informs on the progression course after multiple injuries[J]. Biomarkers, 2016, 21(7): 660-664. DOI:10.3109/1354750X.2016.1171911 |
| [20] |
PARK Y J, LIU G, TSURUTA Y, et al. Participation of the urokinase receptor in neutrophil efferocytosis[J]. Blood, 2009, 114(4): 860-870. DOI:10.1182/blood-2008-12-193524 |
| [21] |
吕琦, 金大地, 金丽娟. 多发性创伤后巨噬细胞吞噬凋亡白细胞的功能变化[J]. 中华创伤杂志, 1999, 15(1): 29-31. LYU Q, JIN D D, JIN L J. Change of macrophages' ability to phagocytose apoptotic cells after multiple trauma[J]. Chin J Traumatol, 1999, 15(1): 29-31. |
| [22] |
PREGERNIG A, MVLLER M, HELD U, et al. Prediction of mortality in adult patients with Sepsis using six biomarkers: a systematic review and meta-analysis[J]. Ann Intens Care, 2019, 9(1): 125. DOI:10.1186/s13613-019-0600-1 |




