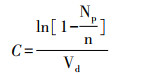2. 400044 重庆,重庆大学光电技术及系统教育部重点实验室,新型微纳器件与系统技术国防重点学科实验室
2. Key Laboratory of Optoelectronic Technology and Systems of Ministry of Education, Defense Key Disciplines Lab of Novel Micro-Nano Devices and System Technology, Chongqing University, Chongqing, 400044, China
肺癌是恶性肿瘤致死的主要病因[1],分子靶向治疗是肺癌治疗的一线手段。而肺癌基因突变的精准定量是提高靶向治疗效果和实现精准医疗的重要环节。目前,基因突变的检测方法主要有直接测序法[2]、扩增受阻基因突变系统(amplification refractory mutations system, ARMS)[3]、实时荧光定量PCR法[4]及高分辨率溶解曲线分析法[5]等多种方法。但这些方法都只能定性或相对定量,难以精准绝对定量。
数字PCR(digital PCR,dPCR)是可以高敏特异地对核酸样本进行数字化绝对定量分析的第3代PCR技术,在稀有突变检测和表达量微小差异鉴定方面具有无可比拟的优势[6]。然而市面上的许多数字PCR技术都需要依赖大型昂贵检测仪器,检测成本高。因此,本研究建立基于新型十万目六边形微腔芯片(novel 100 000 hexagonal microchamber chip,NHMC)的数字PCR平台用于肺癌基因突变绝对定量,以丰富微流控式数字PCR技术,并为肿瘤基因突变检测提供新的方法选择。
1 材料与方法 1.1 临床病例收集2020年1-10月陆军军医大学第二附属医院通过AmoyDx基因检测试剂盒(艾德生物,厦门,中国)确诊的6例EGFR G719X突变肺癌患者的组织切片,每例各10张。纳入标准:①影像学、病理学及体征确诊为原发性肺癌患者;②心电图、血常规、肝肾功能、骨髓功能基本正常;③患者及家属知情同意。排除标准:①意识障碍,精神病患者;②具有其他严重基础性疾病,如糖尿病、高血压、肺心病、甲亢等;③怀孕或哺乳期妇女。本研究经陆军军医大学第二附属医院伦理委员会审批(2021-研第020-01)。
1.2 肺癌组织切片DNA提取将6例肺癌组织样本随机编号为F1~F6,并使用核酸提取试剂盒(上海生物芯片,上海,中国)从肺癌组织中提取基因组DNA,具体步骤详见试剂盒说明书。
1.3 质粒制备用TE缓冲液(北京天根,北京,中国)将1 007 ng/μL G719S突变质粒按10倍梯度稀释至3.01×100、3.01×101、3.01×102、3.01×103、3.01×104、3.01×105、3.01×106、3.01×107 copies/μL,并依次编号为1~8号。用TE缓冲液分别将100 ng/μL L858R突变质粒、codon12突变质粒及H19-1突变质粒稀释至3.20×108、3.01×108、2.88×108 copies/μL。
1.4 PCR引物探针设计及体系构建选取EGFR包含G719S突变位点的19号外显子上的341个碱基,使用Primer premier 5软件(Premier,加拿大)选出得分最高的引物和探针,探针引物序列见表 1。序列均由上海生物工程有限公司合成。使用Premix Ex TaqTM (Probe qPCR;TaKaRa,东京,日本)试剂,按照12.5 μL PreMix、6.375 μL ddH2O、0.625 μL 20 mg/mL BSA、2.5 μL样本、前后引物及探针各1 μL配制总体积为25 μL的PCR反应体系。扩增条件如下:95 ℃预变性30 s;95 ℃变性40 s,56 ℃退火延伸40 s,共45个循环;4 ℃保温。
| 名称 | 序列(5′- 3′) | 修饰 |
| 正向引物 | TGAGGATCTTGAAGGAAACTGA | - |
| 反向引物 | CCTTATACACCGTGCCGAAC | - |
| 突变型探针 | AAGTGCT+GGGCTC | 5′-FAM,3′-MGB |
| 野生型探针 | AGTGCT+GAGCTCC | 5′-HEX,3′-MGB |
1.5 NHMC制作与结构设计
芯片制作过程如图 1所示:①将聚二甲基硅氧烷(polydimethylsiloxane, PDMS;Dow Corning,米德兰德,美国)A、B和Triton X-100(Sigma-Aldrich,圣路易斯,美国)以一定质量比配制,混匀后脱气20 min(图 1Aa);②将混合液倒在刻有微腔室的硅基母模及用于输送样本的微流体通道母模上,并在其上方依次加盖PET膜、玻璃片和重物,75 ℃加热固化(图 1Ab);③移除重物及玻璃片,从母模上剥离PET/PDMS薄层和PDMS管道,并用2 mm的打孔器在PDMS管道进样口处打孔(图 1Ac);④将等离子处理后的PDMS薄层的非结构面与干净玻片键合,同时将结构面与PDMS管道层结构面相贴备用(图 1Ad)。
|
| A:NHMC制备流程示意图 a: PDMS混合液制备;b: PDMS腔室层及管道层制备;c: PDMS腔室层及管道层成品; d: NHMC组装;B:NHMC分解侧面示意图;C:PDMS管道层俯视示意图;D:PDMS腔室层俯视示意图 图 1 NHMC的制备流程与结构设计示意图 |
芯片分3层(图 1B):上层由2 mm厚的PDMS管道作为可拆卸的泵源,包含了几十条平行微流体通道(图 1C);中层由500 μm厚的包含113 137个微腔阵列的PDMS薄层作为数字分割室(图 1D),每个微腔室为六棱柱体,深度为60 μm,上下底面的对边间距为40 μm;下层由载玻片作为支撑层。
1.6 NHMC-dPCR检测具体操作流程如下:①芯片抽真空:将NHMC(图 1Ad)脱气20 min;②样本进样:取出已脱气的NHMC,立即将PCR预混液加入进样孔中,静置5~30 s即可实现液样在113 137个微腔阵列中的数字化分割;③加油密封:剥离PDMS管道层的同时加入200 μL硅油,冲洗管道中残余的液样并完成油性切割密封;④玻片密封:将涂有PDMS的玻片覆盖在油封后的PDMS薄层上,完成最后封装;⑤PCR扩增:将封装好的芯片置于平板PCR仪(Eppendorf,汉堡,德国)上进行扩增;⑥芯片成像:用荧光显微镜(Nikon,东京,日本)对扩增后的芯片进行成像观察。
1.7 数据分析根据泊松分布公式,推导出适用于NHMC-dPCR的理论公式[7]:
其中Np为阳性孔数,n为微腔数,Vd为每个分区的体积。改进后的芯片由于腔室数量的变化,n更改为113 137,Vd更改为0.125 nL。将其代入公式(1),得到样品浓度(C)的计算公式:
通过Image J 1.53c版软件(National Institutes of Health,马里兰,美国)的计数功能,统计芯片扩增后阳性孔的数量。采用OriginPro 2019b版软件(OriginLab,北安普敦,美国)对计算结果进行分析。
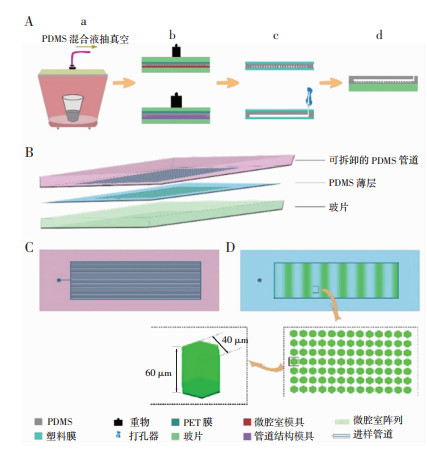
2 结果 2.1 芯片成像与实物展示图 2A为一个代表性样本X经NHMC-dPCR检测的荧光显微图,可见不含目标序列的腔室显示低荧光水平(即“阴性信号”),而含目标序列的腔室显示高荧光水平(即“阳性信号”)。使用Image J软件将图 2A转换为灰度(图 2B),以荧光占比10%~12%(灰度条上荧光背景峰群起点处)为阈值区分阳性孔和背景;最终以直径和亮度两项指标对样本X阳性突变孔进行统计(图 2C)。NHMC实物如图 2D所示。
|
| A:样本X的荧光显微图(×100);B:Image J处理后样本X的灰度图;C:样本X阳性突变统计结果;D:NHMC实物图 图 2 样本X的检测结果图与NHMC实物图 |
2.2 G719S突变扩增体系的引物和探针浓度优化
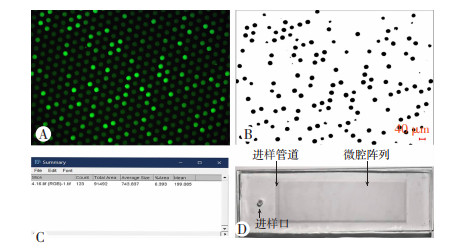
由于dPCR技术的检测限受终点荧光值的影响,因此优化体系中引物、探针的浓度十分必要。在56 ℃最佳退火温度下,加入0.4 μmol/L探针和2.5 μmol/L模板进行PCR扩增,以确定荧光值最高的最佳引物浓度。如图 3A所示,在0.1~0.9 μmol/L范围内,荧光值与引物浓度呈正比;当引物浓度为1 μmol/L时荧光值略有下降。因此,以0.9 μmol/L作为引物的最佳浓度。同样,为了确定荧光值最高的最佳探针浓度,在56 ℃最佳退火温度和0.9 μmol/L最佳引物浓度下,加入2.5 μmol/L模板进行PCR扩增。结果表明,在0.1~0.5 μmol/L浓度范围内,扩增曲线的相对荧光值与探针浓度呈反比(图 3B);原始曲线的绝对荧光值与探针浓度呈正比(图 3C)。扩增曲线的趋势与原始曲线相反,是因为探针添加越多,背景越高,相对增量越低。为保证最高的终点荧光值,确定0.5 μmol/L作为最佳探针浓度。
|
| A:引物浓度优化的扩增曲线;B:探针浓度优化的扩增曲线;C:探针浓度优化的原始曲线 图 3 引物和探针浓度优化曲线图 |
2.3 NHMC-dPCR的性能验证与灵敏度
由NHMC-dPCR检测1~8号G719S突变质粒结果(图 4A~H)可知,突变阳性孔数与PCR混合液中质粒模板的浓度梯度呈正比。图 4I显示了这8个浓度梯度质粒的测量浓度与其期望值之间关系。通过线性回归分析,获得在8个数量级动态范围内的线性方程Y=0.725X-0.581和相关系数R2=0.984。这表明测量浓度和预期浓度具有良好的相关性。

|
| A~H:1~8号稀释质粒的荧光显微图;I:8个浓度梯度质粒测量浓度与其期望值之间线性关系 图 4 8个10倍梯度突变质粒的荧光图及其测量值与期望值之间的线性关系 |
当只有一个正分区时,根据1.7中的公式(2)可计算出NHMC的理论检测限为0.070 copies/μL。然而,在实际核酸检测中,受吸附等多种因素的影响,芯片的检测限往往高于理论值。由图 4A可知,NHMC的灵敏度为3.01 copies/μL,远远高于DNA测序、qPCR和ARMS等。
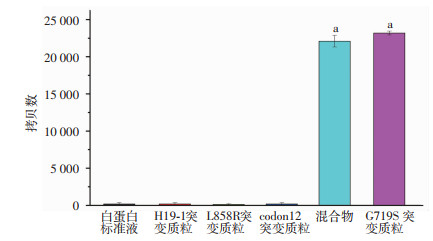
2.4 NHMC-dPCR的特异性及抗干扰能力验证为验证NHMC-dPCR系统的特异性及抗干扰能力,分别测定了20.5 g/L白蛋白标准溶液(血清中的主要物质),2.88×108 copies/μL H19-1突变质粒(长链非编码RNA突变),3.20×108 copies/μL L858R突变质粒(EGFR突变),3.01×108 copies/μL codon12突变质粒(KRAS突变),3.01×105 copies/μL G719S突变质粒以及用4种干扰物配制的浓度为3.01×105 copies/μL的G719S突变质粒混合液。其中NHMC-dPCR检测白蛋白标准溶液、H19-1突变质粒、L858R突变质粒和codon12突变质粒均未发现阳性拷贝。而G719S突变质粒及其与4种物质混合液的检测结果分别为23 194.4 copies和22 095.7 copies;两者与其他4种干扰物的拷贝数相比,差异具有统计学意义(P < 0.01,图 5)。结果表明该体系具有较好的特异性和较强的抗干扰能力。
|
| a: P < 0.01,与白蛋白标准液、H19-1突变质粒、L858R突变质粒及codon12突变质粒比较 图 5 NHMC-dPCR检测G719S及其他干扰物质拷贝数 |
2.5 在检测肺癌组织样本中的应用
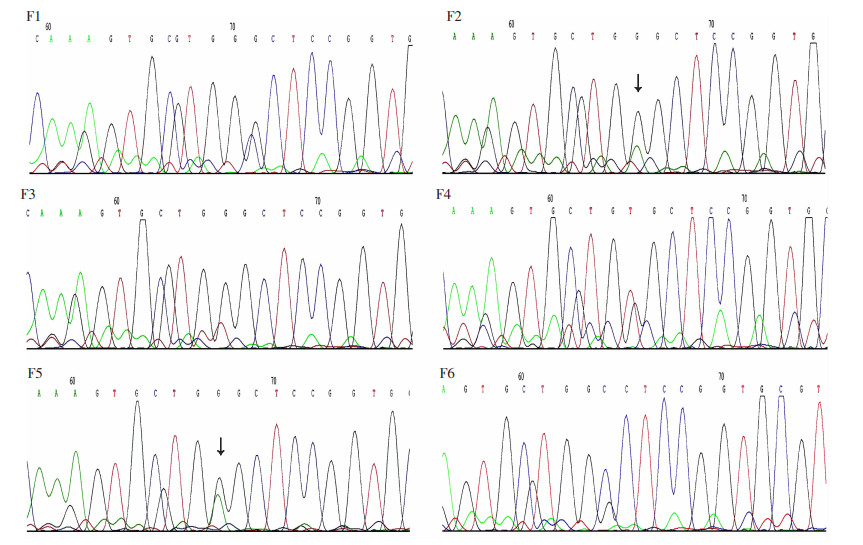
为了验证NHMC-dPCR在临床样本中的实际应用,分别用NHMC-dPCR、液滴式数字PCR(droplet digital PCR,ddPCR)和DNA测序3种方法对6例EGFR G719X突变的肺癌组织样本进行检测并比较方法间的一致性。3种方法均测得F2和F5有EGFR G719S阳性突变,F1、F3、F4及F6为阴性。其中NHMC-dPCR和ddPCR均可快速直观地观察到阳性突变并大致判断突变浓度(图 6、7),还可对目的序列进行绝对定量;而DNA测序需要仔细比对碱基从而得出目标突变位点(图 8),不如前两种方法直观,且无法对突变基因进行定量。NHMC-dPCR、ddPCR和DNA测序的检测结果显示,3种方法一致性较好,阳性符合率及阴性符合率均为100%,NHMC-dPCR与ddPCR定量结果一致(表 2),NHMC-dPCR绝对定量能力达到了传统ddPCR的水平。

|
| 图 6 F1~F6肺癌组织样品NHMC-dPCR检测的荧光显微观察(×100) |

|
| 横轴为VIC通道荧光增量,纵轴为FAM通道荧光增量;微滴在坐标系内聚类为4簇:左下黑色为无模板微滴,左上蓝色为仅有FAM信号的液滴,右下为仅有VIC信号的微滴,右上为同时发出FAM与VIC信号的双阳性微滴 图 7 F1~F6肺癌组织样品ddPCR检测结果 |
|
| 箭头示样本核酸序列中的EGFR G719S阳性突变位点(G→A) 图 8 F1~F6肺癌组织样品DNA测序检测结果 |
| 样本 | DNA测序 | ddPCR(copies) | NHMC-dPCR(copies) |
| F1 | 定性(-) | 0 | 0 |
| F2 | 定性(+) | 1 581.8 | 1 822.4 |
| F3 | 定性(-) | 0 | 0 |
| F4 | 定性(-) | 0 | 0 |
| F5 | 定性(+) | 218.3 | 451.7 |
| F6 | 定性(-) | 0 | 0 |
3 讨论
精确测定EGFR突变的种类及含量,有针对性地选择靶向药是提高肺癌疗效、降低癌症死亡率的重要途径之一[8]。对于突变丰度低的样本,检测方法的灵敏度和特异性对突变序列定量结果的准确性有很大影响。数字PCR技术最明显的优势在于单分子PCR扩增,目前已广泛应用于癌症治疗监测[9]、单细胞分析[10]、寄生虫诊断[11]及环境监测[12]等分子生物学领域。其基本原理是将样品分割成许多独立的子反应单元,每个子单元包含一个或没有目标分子,是dPCR的关键环节。基于样本的分散方式,dPCR通常分为磁珠模式、微滴模式和芯片模式,其中芯片模式是基于腔室的微流控分区技术实现样本的数字化分割。
PDMS材料具有良好的透光透气性、强生物兼容性、易倒模复制等特点,是制作多阵列微腔室的理想材料[13]。最近,本项目组基于PDMS软光刻技术结合微流控加工技术设计了一种“三明治型”dPCR芯片,并对其自进样分割方式及抗水分挥发方法等不断改进和优化;已在H1975肺癌细胞系EGFR gDNA初步检测中有稳定表现[7, 14]。本研究中的新型十万目六边形微腔芯片是在前期芯片基础上多次改良的版本,具有更多优点:①将连接微腔的进样管道去除,设计成可拆卸的PDMS管道,避免由于PDMS透气性不够导致的油冲洗不充分问题。②微腔室由原来的圆柱体空腔改为六棱柱空腔设计,使在相同尺寸的微阵列中空腔数量由20 000个增加至113 137个。5倍多空腔数量的增加不仅大大提高了样本的数字化分割效率,而且在PDMS透气性一致的情况下,可使进样时间由1~2 min减少至5~30 s。③在芯片制作与扩增体系中添加比例更合适的Triton X-100和BSA,较大程度减少样品的吸附,使检测结果更接近于真实值。
本研究开发的NHMC-dPCR技术最低检测浓度为3.01 copies/μL,检测值与期望值之间高度一致(Y=0.725X-0.581, R2=0.984),在微量丰度基因突变的应用中具有良好的性能和较高的价值。NHMC-dPCR检测白蛋白标准液、H19-1突变质粒、L858R突变质粒及codon12突变质粒未发现阳性孔,检测G719S突变质粒及其与以上4种干扰物混合的结果相差不大;证明在检测EGFR G719S突变的应用中特异性高、抗干扰能力较强。NHMC-dPCR与ddPCR、DNA测序方法比较显示,3种方法对6例临床肺癌组织样本定性结果吻合度高,而NHMC-dPCR在基因突变绝对定量上与传统的ddPCR结果一致;证明建立的NHMC-dPCR技术在临床样本检测中具有较高的准确性和可靠性。其中DNA测序技术仅能定性,且具有耗时长、操作过程复杂、结果观察不够直观等缺点。而ddPCR存在液滴数目限制和管路堵塞问题,在检测之前需要评估样本状态并测定核酸浓度。ddPCR检测的样品核酸浓度若超过液滴范围,则需要在检测前对样品进行不同程度的稀释,操作步骤的增加可能会影响定量结果;蛋白质残留、热循环等导致的液滴聚集和管路阻塞,还会导致目的序列定量失败。相比之下,NHMC-dPCR技术不受核酸浓度和液滴数的限制,无需提前对样本核酸浓度进行评估和稀释,除去制作芯片的时间,整个检测过程仅需1.5 h左右。且样本的自进样分割、PCR扩增及结果观察均在一个芯片中完成,摆脱了对液滴振荡仪、液滴流式计数仪等大型昂贵仪器的依赖,大大简化了操作步骤,减少了检测成本。此外,基于PDMS材料本身的多孔透气特性,本技术所需的NHMC还可提前大批量制备并抽真空备用,在多场合实现随时对核酸样本进行快速绝对定量检测。
综上,NHMC-dPCR无需依赖标准曲线、内参基因及大型贵重仪器即可实现对样品的实时绝对定量,具有成本低、操作简单、速度快、抗干扰能力强等优点。NHMC-dPCR的建立不仅丰富了微流控式芯片数字PCR技术,也为其他样本检测的临床应用和科学研究提供了另一种选择。
| [1] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. DOI:10.3322/caac.21654 |
| [2] |
IMYANITOV E N, IYEVLEVA A G, LEVCHENKO E V. Molecular testing and targeted therapy for non-small cell lung cancer: Current status and perspectives[J]. Crit Rev Oncol Hemat, 2021, 157: 103194. DOI:10.1016/j.critrevonc.2020.103194 |
| [3] |
SIGGILLINO A, ULIVI P, PASINI L, et al. Detection of EGFR mutations in plasma cell-free tumor DNA of TKI-treated advanced-NSCLC patients by three methodologies: scorpion-ARMS, PNAClamp, and digital PCR[J]. Diagnostics, 2020, 10(12): 1062. DOI:10.3390/diagnostics10121062 |
| [4] |
SHIN S, KIM J, KIM Y, et al. Assessment of real-time PCR method for detection of EGFR mutation using both supernatant and cell pellet of malignant pleural effusion samples from non-small-cell lung cancer patients[J]. Clin Chem Lab Med, 2017, 55(12): 1962-1969. DOI:10.1515/cclm-2016-0851 |
| [5] |
JOY R A, THELAKKATTUSSERRY S K, VIKKATH N, et al. Somatic mutation detection efficiency in EGFR: a comparison between high resolution melting analysis and Sanger sequencing[J]. BMC cancer, 2020, 20(1): 902. DOI:10.1186/s12885-020-07411-1 |
| [6] |
SUGIMORI M, SUGIMORI K, TSUCHIYA H, et al. Quantitative monitoring of circulating tumor DNA in patients with advanced pancreatic cancer undergoing chemotherapy[J]. Cancer Sci, 2020, 111(1): 266-278. DOI:10.1111/cas.14245 |
| [7] |
CUI X, WU L, WU Y, et al. Fast and robust sample self-digitization for digital PCR[J]. Anal Chim Acta, 2020, 1107: 127-134. DOI:10.1016/j.aca.2020.02.010 |
| [8] |
OSOEGAWA A, HASHIMOTO T, TAKUMI Y, et al. Acquired resistance to an epidermal growth factor receptor-tyrosine kinase inhibitor (EGFR-TKI) in an uncommon G719S EGFR mutation[J]. Invest New Drug, 2018, 36(6): 999-1005. DOI:10.1007/s10637-018-0592-y |
| [9] |
WOOD-BOUWENS C M, HASLEM D, MOULTON B, et al. Therapeutic monitoring of circulating DNA mutations in metastatic cancer with personalized digital PCR[J]. J Mol Diagn, 2020, 22(2): 247-261. DOI:10.1016/j.jmoldx.2019.10.008 |
| [10] |
LIU X M, NOLL L, SHI X R, et al. Single-cell-based digital PCR detection and association of shiga toxin-producing Escherichia coli serogroups and major virulence genes[J]. J Clin Microbiol, 2020, 58(3): e01684-19. DOI:10.1128/jcm.01684-19 |
| [11] |
POMARI E, PIUBELLI C, PERANDIN F, et al. Digital PCR: a new technology for diagnosis of parasitic infections[J]. Clin Microbiol Infec, 2019, 25(12): 1510-1516. DOI:10.1016/j.cmi.2019.06.009 |
| [12] |
STALEY Z R, BOYD R J, SHUM P, et al. Microbial source tracking using quantitative and digital PCR to identify sources of fecal contamination in stormwater, river water, and beach water in a great lakes area of concern[J]. Appl Environ Microb, 2018, 84(20): e01634-18. DOI:10.1128/aem.01634-18 |
| [13] |
AHRBERG C D, CHOI J W, LEE J M, et al. Plasmonic heating-based portable digital PCR system[J]. Lab Chip, 2020, 20(19): 3560-3568. DOI:10.1039/d0lc00788a |
| [14] |
NING Y, CUI X, YANG C, et al. A self-digitization chip integrated with hydration layer for low-cost and robust digital PCR[J]. Anal Chim Acta, 2019, 1055: 65-73. DOI:10.1016/j.aca.2018.12.029 |