急性心肌梗死(acute myocardial infarction,AMI)是一种常见的严重心血管疾病,死亡率很高。大约30%接受介入治疗的AMI患者会经历心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury, MIRI),其并发症会引发一系列不良后果,例如恶性心律不齐、心力衰竭,甚至猝死[1]。I/R损伤可引起氧化应激、炎症反应、免疫功能障碍并诱发先天免疫。心脏肥大细胞(cardiac mast cell, CMC)位于微脉管周围,在I/R发病早期阶段通过脱颗粒和释放介体(包括类胰蛋白酶、肾素、组胺和肝素等)起直接作用,并进行快速内吞以回收颗粒,以在反复损伤刺激期间维持脱粒反应[2]。长期的心肌缺血介导肥大细胞的脱粒和肾素的过度释放,从而激活局部心脏的肾素-血管紧张素系统,导致去甲肾上腺素释放和心律不齐,而缺血预处理(ischemic preconditioning, IPC)可以通过肥大细胞上的G蛋白偶联受体触发蛋白激酶C-ε/醛脱氢酶2型(PKC-/ALDH2)途径减轻损伤[3-4]。ALDH2基因中的错义单核苷酸多态性(SNP)rs671导致ALDH2蛋白的显性负型表达,携带rs671突变的人表现出过量的乙醛积聚,导致饮酒后出现潮红综合征[5],此外,据报道,Rs671还与多种疾病有关[6],例如肌肉萎缩、骨质疏松症、髋部骨折、阿尔茨海默病和食道癌。
中药用于治疗和预防疾病已有数千年的历史,被证明对治疗心血管疾病有效且安全。《中国药典》记载的中药“冠心丹参”(Guanxin Salvia Miltiorrhiza, GXDS)配方是中国缺血性心脏病临床治疗的主要处方之一,配方由丹参、三七和黄檀组成[7]。研究表明GXDS制剂可通过PI3K/Akt信号转导上调雌激素受体β来防止心肌缺血再灌注损伤引起的心肌重塑[8]。此外,研究显示GXDS的心脏保护作用与其抗炎、抗氧化、抑制压力、负性变力和变时作用以及通过中枢和外周靶点引起的副交感神经调节有关[9],但是其对于CMC的作用和机制尚少见研究。因此, 本研究旨在探讨GXDS对于CMC的作用及其潜在机制。
1 材料与方法 1.1 大鼠冠状动脉结扎MIRI模型72只健康成年雄性Sprague-Dawley大鼠,体质量(300±20)g,10~12周龄,购自湖南省SJA实验动物有限公司(编号SYXK-2020-004,伦理审批号JN.No20191030),并饲养在温度25~28 ℃、湿度40%~50%的SPF级环境中。
通过结扎冠状动脉左前降支(LAD)缺血处理30 min,然后释放结扎再灌注120 min,建立大鼠MIRI模型:将大鼠用1%的戊巴比妥钠(50 mg/kg,腹膜内注射;Sigma-Aldrich,美国)麻醉,在气管切开术后通过导管通气,进行开胸手术,使用6-0丝线(科辉医疗技术有限公司,中国)结扎LAD冠状动脉,通过RM6240BD多通道生理信号系统(成都仪器厂)记录视紫绀、壁运动异常和ST段抬高以验证心肌缺血损伤,30 min后松开结扎,然后缝合胸腔并再灌注120 min。MIRI模型标准:视紫绀、壁运动减少且ST段恢复50%以上。
1.2 大鼠处理与分组将72大鼠分为6组,每组12只:①对照组,进行假手术;②I/R组(按照1.1说明建立MIRI模型);③GXDS组,MIRI手术前30 min,使用5 mg/kg GXDS[10]腹腔注射预处理;④肥大细胞脱粒剂组(MCD组),假手术前30 min,使用肥大细胞脱粒剂C48/80(0.5 mg/kg,静脉内注射,Sigma-Aldrich,83856-13-7,美国)预处理;⑤MCD-I/R组,MIRI造模前30 min,使用C48/80预处理;⑥GXDS-MCD组,MIRI造模前30 min,使用GXDS和C48/80处理。
1.3 HE染色石蜡包埋后,将大鼠心脏的左心室标本切成4 μm的切片,用苏木精、碳酸锂和曙红染色,以梯度酒精系列脱水,用二甲苯透明,并用中性胶密封。用光子显微镜(BH-Z,奥林巴斯公司,日本)对切片进行观察和拍照。心肌组织学评分的严重程度如下:正常(0),轻度(1),中度(2),重度(3)和极重度损伤(4)。
1.4 透射电子显微镜观察从大鼠心脏中分离出LAD冠状动脉(2 mm)和左心室心肌(1 mm×1 mm×1 mm),分别在室温下于2.5%戊二醛中保存1 h,在4 ℃中保存12 h。将心脏标本包埋在树脂中,制作50~80 nm切片,然后用醋酸铀和柠檬酸铅双重染色。在透射电子显微镜(TEM,MORADA G2,德国)下评价冠状动脉和心肌的形态特征。
1.5 甲苯胺蓝染色制作心肌和冠状动脉切片后,使用甲苯胺蓝染色观察切片中完整(IMC)和脱粒(DMC)肥大细胞的数目,并在BH-Z显微镜(Olympus Corporation,日本)下计数,然后计算肥大细胞脱粒率:MCD=DMCs/(IMCs)+DMCs×100%。
1.6 RNA分离和qRT-PCR检测通过TRIzol试剂盒(GenStar,北京)从心脏组织中提取总RNA,并通过反转录合成cDNA。使用一步SYBR Green定量实时聚合酶链反应(qRT-PCR)试剂盒(GenStar,中国)进行定量分析,每个反应进行3次。引物序列由Sangon BiGXDSech(中国)合成,通过比较阈值循环(Ct)方法以2-ΔΔCt计算倍数变化,靶基因的相对水平通过管家基因GAPDH进行标准化。GAPDH正向:5′-TGAGAGGGAAATCGTGCGTGAC-3′,反向5′-AAGAAGGAAGGCTGGAAAAGAG-3′;miR-330-3p正向:5′-ACCTGCTGGTGGAAAACATCATT-3′,反向5′-AGGAGCAAGTAGGCACCTCACAC-3′;ALDH2正向:5′-CAAGCAAACCTTCGATTGATCTCT-3′,反向5′-ATAG-GCTCAATCCCGTCCTTAAAA-3′。
1.7 Western blot检测通过商业试剂盒(默克蛋白快速提取试剂盒,中国)从心脏组织中提取蛋白质,并使用BCA试剂盒(GenStar,中国)测定蛋白质含量,将提取的蛋白质通过10%SDS-PAGE凝胶电泳分离,并转移至PVDF膜(苏州康润)。抗ALDH2抗体(稀释度1∶2 000,Abcam,美国)和抗GAPDH抗体(稀释度1∶5 000,Abcam,美国)在4 ℃下孵育膜过夜,然后将山羊抗小鼠多克隆抗体(稀释度1∶5 000,Affinity,美国)室温孵育1 h,通过ECL化学发光法(GenStar,中国)可视化,并通过凝胶分析系统(Bio-Rad,Hercules,美国)成像。ALDH2的相对表达通过Image J 2X(NIH,美国)进行分析,通过目的蛋白条带与内参GAPDH条带光密度值比值量化。
1.8 细胞培养心肌细胞H9C2(2-1)和肥大细胞RBL-2H3购自国家细胞资源中心(中国科学院,上海),用添加10%胎牛血清(FBS,Gibco,美国)和含乙醇的DMEM(BioInd,以色列)中培养。培养条件为5%CO2和95%湿度的恒温箱中。
将1×106/mL的H9C2与相等数量的RBL-2H3在96孔板中共培养(Millipore,美国)12 h。用GXDS(2 μmol/L)或C48/80(1 μmol/L)处理细胞,并分为:①对照组,未经处理的培养基培养;②MCD组,1 μmol/L C48/80处理30 min;③GXDS组,以2 μmol/L GXDS预处理60 min后,以1 μmol/L C48/80预处理30 min;④ALDH2 vector组,使用ALDH2 vector转染24 h后,以1 μmol/L C48/80预处理30 min。
1.9 双重荧光素酶报告基因实验克隆miR-330-3p与ALDH2基因3’UTR的结合序列,同时由睿凯细胞生物科技有限公司(中国)合成结合位点的突变序列,并将两种序列各自剪接至pYr-MirTarget载体中海肾荧光素酶基因下游的XhoⅠ和NGXDSI限制位点。
将RBL-2H3细胞以每孔2×105个细胞接种到12孔板中。使用Lipofectamine 2000(Invitrogen,美国),将细胞与2 μg pYr-MirTarget-ALDH2-3′UTR(野生型或突变体)和50 nmol/L miR-330-3p mimics(模拟物)/mimics NC共转染,48 h后收获细胞,使用双重荧光素酶报告基因检测试剂盒(BeyGXDSime,中国)进行检测,用化学发光免疫分析仪(Kpsontech,中国)检测相对光单位(RLU),通过萤火虫荧光素酶与海肾荧光素酶(Rluv/Fluc)活性荧光单位比值量化。
1.10 流式细胞仪分析在室温下,将各组心肌细胞或肥大细胞悬液(100 μL中4×105个细胞)与10 μL的Annexin V和5 μL的PI孵育15 min,然后通过Flowjo 10(BD Biosciences,美国)检测和分析细胞凋亡率。
1.11 MTT测定将每组心肌细胞或肥大细胞分别接种于96孔板(1×103/孔),将10 μL噻唑基蓝(Sigma-Aldrich,美国) 添加到每个孔中,并在37 ℃下孵育4 h,然后用150 μL二甲基亚砜(DMSO,Sigma-Aldrich,美国)置换溶液,用多光谱微板分光光度计(Thermo Scientific,美国)在490 nm处测量光密度值D(490)。
1.12 酶联免疫吸附测定(ELISA)收集每组细胞上清液和大鼠血清,通过ELISA试剂盒检测cTnI和类胰蛋白酶的浓度。
1.13 统计学分析采用SPSS 25.0统计软件,所有数据表示为x±s。通过单向方差分析和χ2检验比较平均值和百分比值。Bonferroni检验和Wilcoxon秩和检验用于组间比较,P < 0.05表示差异具有统计学意义。
2 结果 2.1 GXDS通过miR-330-3p/ALDH2抑制肥大细胞脱粒和心肌细胞凋亡双荧光素酶报告基因和Western blot分析显示:miR-330-3p可通过靶向ALDH2的3’UTR而抑制其表达,PCR和Western blot分析显示:与对照组相比,MCD组miR-330-3p转录水平明显降低(P < 0.05),ALDH2的mRNA和蛋白水平显著升高;GXDS预处理则能明显上调miR-330-3p水平(P < 0.05),促进ALDH2的表达(P < 0.05),且呈现剂量依赖性(图 1)。

|
|
1:对照组;2:MCD组;3:miR-330-3p mimics组;4:GXDS组;a:P < 0.05,与对照组比较;b:P < 0.05,与MCD组比较 A:双荧光素酶报告基因验证miR-330-3p与ALDH2结合;B:不同处理后各组细胞ALDH2表达水平;C:不同处理后各组细胞ALDH2和miR-330-3p转录水平;D:不同浓度GXDS处理后各组细胞ALDH2表达水平 图 1 GXDS通过miR-330-3p抑制ALDH2的表达 |
流式细胞仪分析显示:与对照组相比,MCD组H9C2(2-1)和RBL-2H3细胞的凋亡率明显升高(P < 0.05),细胞活力被显著抑制(P < 0.05),而GXDS预处理或ALDH2 Vector转染可抑制C48/80诱导的细胞凋亡,促进细胞活力(P < 0.05,图 2A~C);ELISA分析显示: 与对照组相比,MCD组cTnI和类胰蛋白酶水平明显升高(P < 0.05),而GXDS和ALDH2 Vector组cTnI和类胰蛋白酶水平与MCD组相比显著降低(P < 0.05,图 2D、E)。
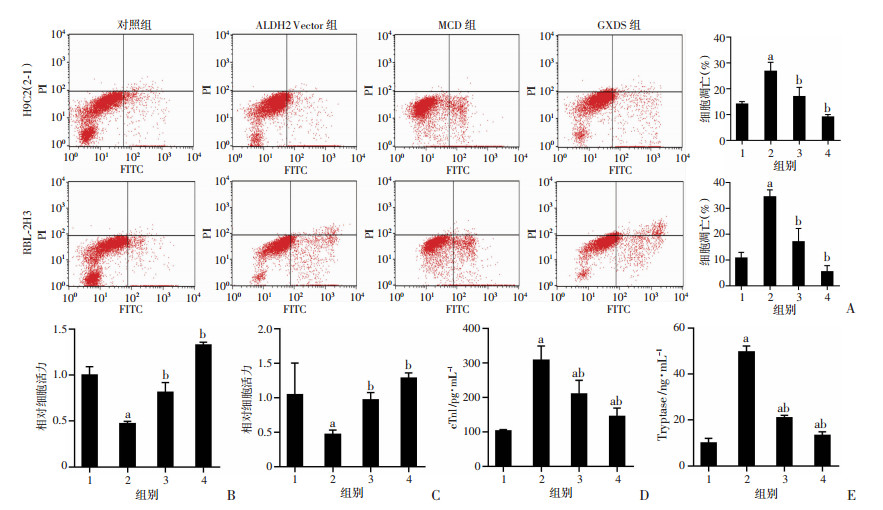
|
|
1:对照组;2:MCD组;3:GXDS组;4:ALDH2 Vector组;a:P < 0.05,与对照组比较;b:P < 0.05,与MCD组比较 A:流式细胞仪分析H9C2(2-1)和RBL-2H3细胞凋亡率;B、C:MTT检测H9C2(2-1)和RBL-2H3细胞活力;D、E:ELISA检测cTnI和类胰蛋白酶(Tryptase)的释放 图 2 GXDS改善C48/80诱导的细胞损伤 |
2.2 GXDS通过抑制肥大细胞脱粒缓解心脏损伤
与对照组相比,MCD和I/R组大鼠的收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、心率(HR)、心率收缩压乘积(RPP)、左室射血分数(LVEF)和左室缩短分数(LVFS)降低(P < 0.05),与I/R组相比,MCD-I/R组中SBP、DBP、MAP、HR、RPP、LVEF和LVFS明显更低(P < 0.05);与I/R组或MCD-I/R组相比,GXDS组与GXDS-MCD组大鼠SBP、DBP、MAP、HR、RPP、每搏输出量指数(SI)、LVEF和LVFS值均显著升高(P < 0.05),而HR水平差异无统计学意义(图 3、图 4A~C)。
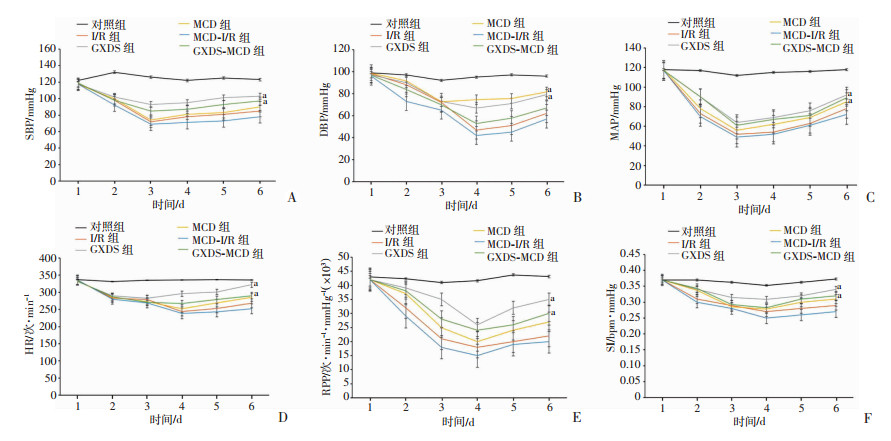
|
|
a:P < 0.05,与MCD-I/R或I/R组比较 A~F:各组大鼠SBP、DBP、MAP、HR、RPP和SI 图 3 各组大鼠心肌损伤相关指标的比较 |
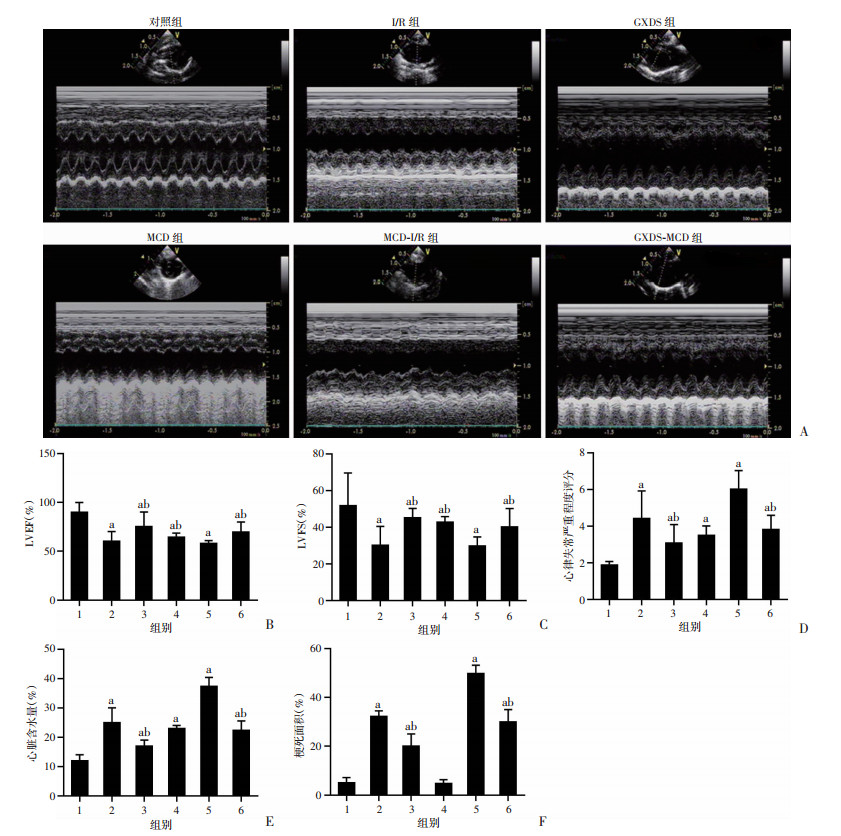
|
|
1:对照组;2:I/R组;3:GXDS组;4:MCD组;5:MCD-I/R组;6:GXDS-MCD组;a:P < 0.05,与对照组比较;b:P < 0.05,与MCD-I/R或I/R组比较 A:各组大鼠经胸超声心动图表现;B~F:各组大鼠LVEF、LVFS、心律失常严重程度评分、心脏含水量和梗死面积 图 4 GXDS通过抑制大鼠心脏肥大细胞脱粒而改善I/R诱导的损伤 |
与对照组相比,I/R组的心律失常严重程度评分、心脏含水量和梗死面积显著增加(P < 0.05),MCD组的心律失常严重程度评分和心脏含水量明显增加(P < 0.05),但两组之间的梗死面积无明显变化;与I/R组相比,MCD-I/R组心律失常严重程度评分、心脏含水量和梗死面积明显加重(P < 0.05),与I/R组或MCD-I/R组相比,GXDS组与GXDS-MCD组大鼠心律失常严重程度评分、心脏含水量和梗死面积明显降低(P < 0.05,图 4D~F)。
2.3 GXDS通过抑制肥大细胞脱粒缓解心血管损伤I/R损伤或C48/80预处理可以导致大鼠心肌水肿、心肌间质中胶原蛋白含量增加、肌纤维破坏和少量炎性细胞浸润,GXDS预处理可缓解C48/80或I/R损伤引起心肌水肿、肌纤维损伤和炎性细胞浸润(图 5);此外,TEM观察显示I/R组大鼠冠状动脉和左心室心肌的肌原纤维和内皮明显破坏,细胞膜和内皮完整性丧失,C48/80预处理则引起线粒体超微结构变化和大量胞质液泡的出现,而GXDS治疗后可观察到少量肌原纤维和内皮细胞破坏,并且心肌和动脉损伤得到明缓解(图 5)。
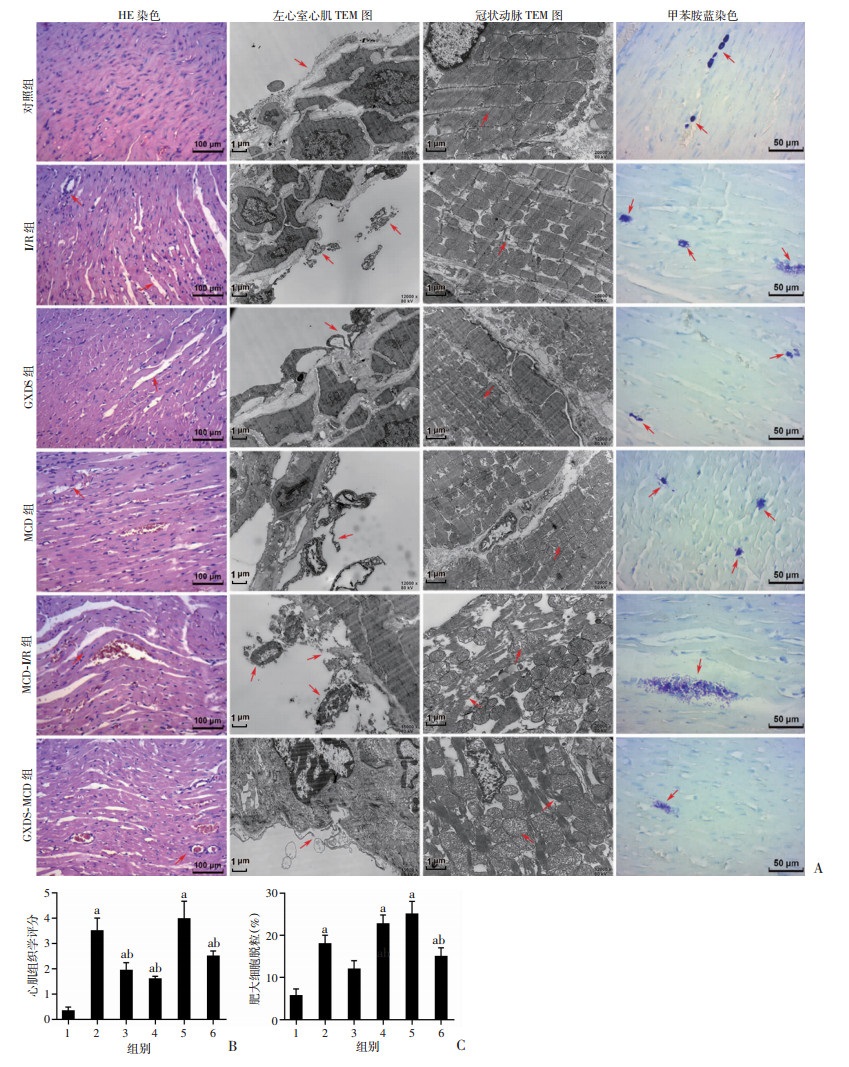
|
|
1: 对照组; 2: I/R组; 3: GXDS组; 4: MCD组; 5: MCD-I/R组; 6: GXDS-MCD组; a: P<0.05,与对照组比较; b: P<0.05, 与MCD-I/R或I/R组比较; 箭头示肥大细胞脱粒 A: HE染色检测心肌的组织病理学变化, TEM检测左心室心肌和冠状动脉的超微结构, 甲苯胺蓝染色检测的肥大细胞脱粒; B: 心肌组织学评分; C: 肥大细胞脱粒(%) 图 5 GXDS、C48/80处理后大鼠心肌和冠状动脉形态及损伤标志物的变化 |
与对照组中正常的肥大细胞完整颗粒相比,I/R组中肥大细胞脱粒并分散在心肌中,部分聚集在血管周围;在MCD组中C48/80的预处理导致肥大细胞的脱颗粒,并且在MCD-I/R组中肥大细胞脱颗粒显著增强而形成弥漫性星云状颗粒;在GXDS和GXDS-MCD组中,GXDS预处理可以显著抑制肥大细胞的脱粒和星云状颗粒的形成(图 5)。定量分析结果显示:与对照组相比,I/R组的心肌组织病理学评分和肥大细胞脱颗粒率显著增加(P < 0.05),而GXDS的预处理可显著降低心肌组织病理学评分和肥大细胞脱颗粒程度(P < 0.05,图 5)。
2.4 GXDS通过miR-330-3p/ALDH2抑制体内肥大细胞脱粒与对照组相比,I/R和MCD组miR-330-3p的转录水平明显上调而ALDH2表达显著降低(P < 0.05),MCD-IR组miR-330-3p的转录水平相较于I/R组明显更高(P < 0.05),而ALDH2水平则明显更低(P < 0.05),GXDS预处理则可下调miR-330-3p的转录水平,促进ALDH2的表达(P < 0.05,图 6A、B)。此外,ELISA分析显示:与对照组相比,I/R组的cTnI(P < 0.05)、类胰蛋白酶水平(P < 0.05)显著增加,GXDS预处理可有效抑制cTnI、类胰蛋白酶释放(P < 0.05,图 6C、D)。
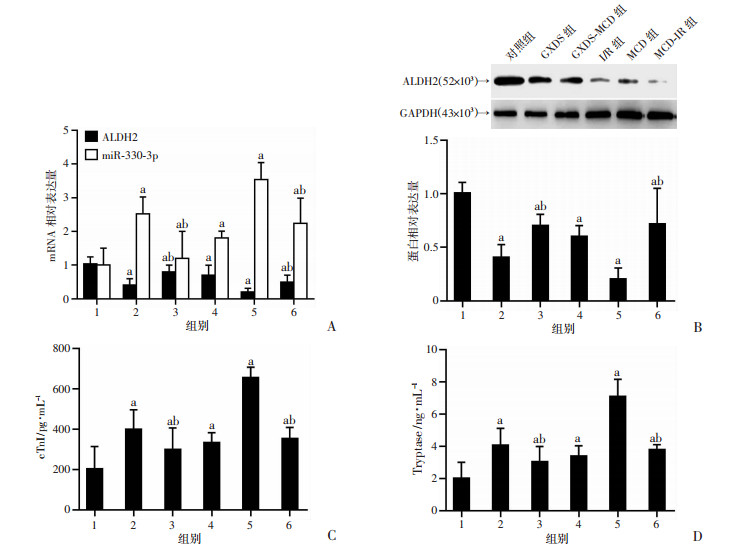
|
|
1:对照组;2:I/R组;3:GXDS组;4:MCD组;5:MCD-IR组;6:GXDS-MCD组;a:P < 0.05,与对照组比较;b:P < 0.05,与MCD-I/R或I/R组比较 A:qRT-PCR检测不同组小鼠组织中ALDH2和miR-330-3p水平;B:Western blot检测不同组小鼠组织中ALDH2水平;C:ELISA检测cTnI的释放;D:ELISA检测类胰蛋白酶的释放 图 6 GXDS通过miR-330-3p/ALDH2抑制肥大细胞脱粒 |
3 讨论
在心肌梗死之前进行GXDS预处理或在MI之后及时给予GXDS可以改善猪模型中I/R损伤的长期预后,减少心室功能障碍和不良后果,并且不会下调ALDH2受体蛋白的表达[11]。GXDS治疗12周后,糖尿病小鼠的心脏ALDH2受体和5′-单磷酸腺苷(AMP) 激活的信号通路正常化,心脏炎症和氧化应激以及心肌细胞的凋亡、肥大和纤维化被明显抑制。近期文献则表明:运动和GXDS均对去卵巢雌性大鼠I/R诱发的心肌损伤具有有效的保护作用,这与改善心室收缩和舒张功能、抑制炎症因子的释放有关,并且减少心肌纤维的紊乱,从而降低大鼠血压[12-13]。但是GXDS对于心脏的保护作用是否与肥大细胞脱粒有关及其分子机制尚未可知。
本研究结果显示: GXDS以及ALDH2过表达质粒预处理均可显著减少心律不齐、心脏含水量和梗死面积组,部分恢复I/R损伤引起的SBP、DBP、MAP、RPP、LVEF和LVFS的下降,使得这些伤害效应得到明显改善。大鼠中CMC的分布和密度接近人类,可以作为研究CMC的理想模型。大鼠中CMC主要分布在心内膜(5%)、心外膜(50%)和心肌(45%,其中31%位于脉管系统周围)[14]。肥大细胞可以被C48/80激活并促进介质的释放,而C48/80可以加速I/R损伤诱导的肥大细胞的募集和脱粒[15]。在本研究中,C48/80处理可以促进肥大细胞脱粒和类胰蛋白酶释放,并加剧血流动力学异常、心律不齐和心脏水肿。TEM结果表明:C48/80加剧LAD冠状动脉中细胞膜的丧失和内皮完整性,并严重破坏左心室心肌的肌原纤维和线粒体。另外,在C48/80处理组中,心肌水肿、肌纤维不良和炎性细胞浸润明显增加。但是,GXDS预处理可减轻C48/80干预和I/R损伤下肥大细胞脱颗粒和类胰蛋白酶的释放,从而改善心脏功能障碍和有害反应,并保留内皮完整性和线粒体功能。类胰蛋白酶是实验室诊断的潜在标志物,也是临床治疗的潜在靶标[16]。肥大细胞对各种炎性环境的影响与类胰蛋白酶的酶学特性密切相关,后者直接介导过敏、免疫失调和组织器官的重塑[17]。最近的研究表明:心肌I/R损伤通过调节ALDH2通路而促进肥大细胞标志物(类胰蛋白酶和糜酶)的分泌以及促炎因子的产生[18-19]。本研究结果显示:I/R损伤可促进肥大细胞脱粒,并表现为类胰蛋白酶和糜酶的释放增加,C48/80处理可加剧肥大细胞脱粒程度,而GXDS预处理则能逆转I/R损伤或C48/80处理诱导的肥大细胞脱粒。miR-330-3p可促进心肌细胞的凋亡,并加速心肌纤维化和肥大。近期研究则指出:miR-330-3p通过激活TLR4/MyD88/NF-κB信号通路来介导心肌细胞凋亡,并促进炎症细胞因子的级联释放[20]。本研究结果表明:I/R损伤后,心肌中miR-330-3p的水平显著增加而ALDH2表达下降,C48/80可促进miR-330-3p表达而下调ALDH2表达,但GXDS预处理可逆转miR-330-3p/ALDH2的表达改变。组织蛋白酶G(中性粒细胞来源的蛋白酶)和糜蛋白酶(肥大细胞来源的蛋白酶)的双重抑制剂可阻断小鼠梗死心脏的免疫反应,减少心肌胶原蛋白的沉积,并改善心室功能通过局部粘着信号传导调节,抑制心肌细胞凋亡、肌原纤维变性和心脏成纤维细胞分化为成纤维细胞[21-22]。体外实验证实:miR-330-3p通过与ALDH2的3′UTR结合而抑制其表达,最终促进心肌细胞凋亡和肥大细胞脱粒,而GXDS处理可以有效抑制miR-330-3p表达,通过上调ALDH2水平而促进心肌细胞存活并抑制肥大细胞脱粒。
总之,I/R损伤会导致大鼠心脏功能障碍、严重的心律失常、明显的水肿、梗死和组织病理学损害,而GXDS预处理可显著减轻这些变化,从而证实GXDS的心脏保护作用。肥大细胞促分泌素C48/80加剧I/R损伤诱导的肥大细胞脱粒和类胰蛋白酶释放,而GXDS的早期干预则显著降低C48/80的负性作用,机制分析显示:GXDS预处理可通过miR-330-3p/ALDH2抑制I/R损伤诱导的心肌肥大细胞脱颗粒,从而下调糜蛋白酶和类胰蛋白酶的表达,抑制心肌细胞的凋亡。
| [1] |
刘晓瑜, 顾民华, 徐煜凌, 等. 定心方Ⅰ号方通过调控GSK3β/Nrf2/HO-1通路防治大鼠心肌缺血再灌注损伤的机制研究[J]. 中药新药与临床药理, 2020, 31(11): 1265-1270. LIU X Y, GU M H, XU Y L, et al. Dingxin recipe Ⅰ prevents myocardial ischemia reperfusion injury through GSK3β/Nrf2/HO-1 pathway[J]. Tradit Chin Drug Res Clin Pharmacol, 2020, 31(11): 1265-1270. |
| [2] |
蒋佳玲, 李俊, 许鸣, 等. 广枣叶总黄酮对心肌缺血再灌注损伤模型大鼠的保护作用及其作用机制[J]. 沈阳药科大学学报, 2020, 37(11): 1009-1014. JIANG J L, LI J, XU M, et al. Myocardial protective function and mechanism of total flavonoids from Jujube leaves after myocardial ischemia-reperfusion injury in rats[J]. J Shenyang Pharm Univ, 2020, 37(11): 1009-1014. |
| [3] |
SONG S H, LIU F, ZHAO Y Y, et al. Bruton's tyrosine kinase inhibitor attenuates warm hepatic ischemia/reperfusion injury via modulation of the NLR family pyrin domain containing 3 inflammasome[J]. Transplant Proc, 2020, 52(10): 2947-2954. |
| [4] |
王励, 谌小龙, 刘慧玲, 等. β-arrestin-2通过上调PI3K/Akt信号抑制自噬以减轻小鼠肝脏缺血-再灌注损伤[J]. 器官移植, 2020, 11(6): 692-697. WANG L, CHEN X L, LIU H L, et al. Β-arrestin-2 inhibits autophagy by up-regulating PI3K/Akt signal to alleviate liver ischemia-reperfusion injury in mice[J]. Organ Transplant, 2020, 11(6): 692-697. |
| [5] |
夏万松, 夏英, 韦四喜, 等. ALDH2基因rs671单核苷酸多态性位点发生(A→G)RNA编辑[J]. 国际检验医学杂志, 2020, 41(22): 2693-2696, 2700. XIA W S, XIA Y, WEI S X, et al. ALDH2 gene rs671 single nucleotide polymorphism site occurs RNA editing (A to G)[J]. Int J Lab Med, 2020, 41(22): 2693-2696, 2700. |
| [6] |
ZHOU L, ISHIZAKI H, SPITZER M, et al. ALDH2 mediates 5-nitrofuran activity in multiple species[J]. Chem Biol, 2012, 19(7): 883-892. |
| [7] |
宋海英, 王培利, 刘剑刚, 等. 冠心丹参滴丸对缺血心肌AMPK-解偶联蛋白2的调控作用[J]. 中西医结合心脑血管病杂志, 2019, 17(15): 2272-2276. SONG H Y, WANG P L, LIU J G, et al. The modulation of AMPK-uncoupling protein 2 in ischemia myocardium by Guanxindanshen dropping pills[J]. Chin J Integr Med Cardio-Cerebrovasc Dis, 2019, 17(15): 2272-2276. |
| [8] |
汤世民, 邢小燕, 邓雪红, 等. 冠心丹参方及其有效成分治疗冠心病的研究进展[J]. 中国中药杂志, 2016, 41(20): 3721-3726. TANG S M, XING X Y, DENG X H, et al. Research progress of Guanxin Danshen formula and its effective components in treating coronary artery heart disease[J]. China J Chin Mater Med, 2016, 41(20): 3721-3726. |
| [9] |
CHENG Y, ZHU H, GAO W. MicroRNA-330-3p represses the proliferation and invasion of laryngeal squamous cell carcinoma through downregulation of Tra2β-mediated Akt signaling[J]. Mol Cell Probes, 2020, 52: 101574. |
| [10] |
苟小江, 王培利, 王承龙. 冠心丹参滴丸治疗冠心病的系统评价与Meta分析[J]. 中药新药与临床药理, 2019, 30(10): 1262-1268. GOU X J, WANG P L, WANG C L. Systematic review and meta analysis of Guanxin Danshen dropping pills in the treatment of coronary heart disease[J]. New Drugs Clin Pharmacol Traditional Chin Med, 2019, 30(10): 1262-1268. |
| [11] |
SONG K, LI L, QUAN Q, et al. Inhibited histone deacetylase 3 ameliorates myocardial ischemia-reperfusion injury in a rat model by elevating microRNA-19a-3p and reducing cyclin-dependent kinase 2[J]. IUBMB Life, 2020, 72(12): 2696-2709. |
| [12] |
MIYAKE H, KOIKE Y, SEO S, et al. The effect of pre-and post-remote ischemic conditioning reduces the injury associated with intestinal ischemia/reperfusion[J]. Pediatr Surg Int, 2020, 36(12): 1437-1442. |
| [13] |
何贵新, 肖婷, 秦伟彬, 等. 基于PI3K/AKT信号通路探讨芪参益气滴丸改善心肌缺血再灌注损伤的实验研究[J]. 北京中医药大学学报, 2020, 43(9): 762-768. HE G X, XIAO T, QIN W B, et al. Experimental study on the effect of Qishen Yiqi Dripping Pill on myocardial ischemia-reperfusion injury via PI3K/AKT signaling pathway[J]. J Beijing Univ Tradit Chin Med, 2020, 43(9): 762-768. |
| [14] |
WANG H L, LIU F L, LI R Q, et al. Electroacupuncture improves learning and memory functions in a rat cerebral ischemia/reperfusion injury model through PI3K/Akt signaling pathway activation[J]. Neural Regen Res, 2021, 16(6): 1011-1016. |
| [15] |
郭银雪, 葛平玉, 詹继红. 肾茶黄酮预防急性肾缺血模型大鼠再灌注损伤作用及其机制[J]. 中国老年学杂志, 2020, 40(20): 4399-4402. GUO Y X, GE P Y, ZHAN J H. Preventive effect of renal tea flavonoids on reperfusion injury in rats with acute renal ischemia and its mechanism[J]. Chin J Gerontol, 2020, 40(20): 4399-4402. |
| [16] |
彭兴, 林玲, 周祥群, 等. miR-133b靶向YES1抑制心肌缺血再灌注引起的心肌细胞凋亡和活性氧簇的积累[J]. 南方医科大学学报, 2020, 40(10): 1390-1398. PENG X, LIN L, ZHOU X Q, et al. miR-133b inhibits myocardial ischemia-reperfusion-induced cardiomyocyte apoptosis and accumulation of reactive oxygen species in rats by targeting YES1[J]. J South Med Univ, 2020, 40(10): 1390-1398. |
| [17] |
WEI C H, WU G, CAI Q, et al. Retraction Note to: MicroRNA-330-3p promotes cell invasion and metastasis in non-small cell lung cancer through GRIA3 by activating MAPK/ERK signaling pathway[J]. J Hematol Oncol, 2020, 13(1): 142. |
| [18] |
SHAO Z Q, DOU S S, ZHU J G, et al. Apelin-13 inhibits apoptosis and excessive autophagy in cerebral ischemia/reperfusion injury[J]. Neural Regen Res, 2021, 16(6): 1044-1051. |
| [19] |
王晓丽, 张薇, 张雪侠, 等. 生姜挥发油对脑缺血再灌注大鼠溶酶体-线粒体途径凋亡的影响[J]. 中药新药与临床药理, 2020, 31(10): 1153-1157. WANG X L, ZHANG W, ZHANG X X, et al. Effect of ginger volatile oil on lysosomal-mitochondrial apoptosis in rats with cerebral ischemia-reperfusion[J]. Tradit Chin Drug Res Clin Pharmacol, 2020, 31(10): 1153-1157. |
| [20] |
何望安, 王茹, 沈波, 等. CCR5抗体对大鼠心肌缺血再灌注损伤保护作用的机制研究[J]. 华中科技大学学报(医学版), 2020, 49(4): 419-423, 454. HE W A, WANG R, SHEN B, et al. Protective effects of CCR5 antibody on myocardial ischemia-reperfusion injury in rats[J]. Acta Med Univ Sci et Technol Huazhong, 2020, 49(4): 419-423, 454. |
| [21] |
龚慧琴, 周支香, 刘录山, 等. 淫羊藿次苷Ⅱ通过沉默信息调控子1-叉头蛋白O1通路减轻心肌缺血再灌注损伤[J]. 中华高血压杂志, 2020, 28(8): 744-749. GONG H Q, ZHOU Z X, LIU L S, et al. Icariside Ⅱ reduces myocardial ischemia-reperfusion injury through activating silent information regulator 1/acetylated-forkhead box O1 pathway[J]. Chin J Hypertens, 2020, 28(8): 744-749. |
| [22] |
WEI C H, ZHANG R G, CAI Q, et al. MicroRNA-330-3p promotes brain metastasis and epithelial-mesenchymal transition via GRIA3 in non-small cell lung cancer[J]. Aging, 2019, 11(17): 6734-6761. |




