人脂肪间充质干细胞(human adipose-derived stem cells,hASCs)在组织再生和修复过程中发挥着重要作用[1-2]。由于它们具有自我更新和多谱系分化的能力,被认为是组织工程和再生医学应用的理想细胞来源,特别是分化为骨、软骨和肌肉。然而hASCs的临床应用需要大量的细胞,并且在体外培养hASCs的过程中发现,随着扩增倍数的增加hASCs会逐渐丧失增殖能力和干细胞特性。虽然使用药物刺激等生物化学方法会促进其增殖,但会改变其干细胞特性。因此,在体外培养脂肪间充质干细胞的过程中,如何提高hASCs增殖能力并保持其干细胞特性,是目前亟待解决的问题。
现已知电场刺激是一种用于诱导细胞凋亡、增殖等各种细胞过程改变的物理方法[3]。且越来越多的研究表明电场可以影响多种细胞的增殖和凋亡,比如成纤维细胞[4]、软骨细胞[5]等。并且不同类型的细胞,直流电场影响其增殖的参数不同。目前关于直流电场对脂肪间充质干细胞增殖影响[3, 6]的研究尚少。而ERK1/2是近年来研究细胞增殖较为广泛的靶点之一[3],抑制该蛋白可显著抑制电刺激诱导的细胞增殖[7]。因此,本研究以第三代hASCs为研究对象,设置不同的直流电场参数,观察直流电场对hASCs增殖及其干细胞特性的影响,同时探讨直流电场诱导的hASCs增殖是否与ERK1/2的磷酸化激活有关。
1 材料与方法 1.1 主要试剂与仪器胎牛血清购自美国Gibco公司,DMEM高糖培养基、胰酶、胰蛋白酶-EDTA、青霉素-链霉素溶液购自美国HyClone公司,Ⅰ型胶原酶、二甲基亚砜购自美国Sigma公司,抗体CD73-PE、CD90-PE-CY7、CD105-APC、CD14-FITC、CD31-FITC、CD34-FITC、CD45-FITC购自美国BD公司,CCK-8购自美国Abmole公司,p-ERK1/2购自美国Cell Signaling Technology公司,GAPDH购自华安生物公司,成骨诱导分化培养基、成软骨分化培养基、成脂诱导培养基购自美国赛业生物公司,细胞培养瓶、培养皿、96孔板、6孔板购自美国Corning公司。流式细胞仪购自美国BD公司,酶标仪购自德国Berthold公司,二氧化碳孵箱、超低温离心机购自美国Thermo公司,荧光倒置显微镜购自日本Olympus公司,恒温摇床购自上海一恒公司。
1.2 组织来源脂肪组织取自2020年1-10月西南医科大学附属医院整形烧伤外科行腹部及大腿部吸脂术的5例健康成人,年龄18~40岁,体质量指数(BMI)为19~30 kg/m2,并有适当的脂肪沉积,女性要求尿液妊娠实验阴性,并取得知情同意。研究经西南医科大学附属医院伦理委员会审核(KY2021065)。
1.3 直流电场施加设备该设备由固定在细胞/组织培养室顶盖上的镀金电极组成[8],其中培养室适合标准的6孔细胞/组织培养板(128 mm×85 mm×22 mm;内直径33.78 mm;生长面积8.96 cm2),便于操作和灭菌,并将培养基蒸发降至最低。每组电极板由13根直径为1 mm镀金电极并联组成(根据6孔培养盒培养孔的尺寸和直流电场的均匀性确定)。并且每组电极板均使用聚甲基丙烯酸甲酯密封,以防止电刺激过程中释放的毒性介质干扰实验结果。从盖子上伸出的电极尖端在并联电路中焊接到镀银铜线上,并通过香蕉连接器连接到标准电源。电量及其应用模式可以通过调节电源来调节。该设备通过用75%乙醇浸泡2 h,用生理盐水冲洗,紫外灯照射下过夜灭菌。
1.4 hASCs细胞的分离、培养将术中获取的脂肪组织置于无菌的50 mL含有PBS的离心管中,快速送入实验室。将获取的脂肪抽吸物剔除血管杂质,PBS反复冲洗,并剪碎。加入0.1%Ⅰ型胶原酶37 ℃恒温摇床消化,200 r/min离心40 min, 等量体积的完全培养基(高糖DMEM+10%胎牛血清+1%双抗)终止消化,1 200 r/min离心5 min,去上清,沉淀用完全培养基重悬后使用100目的尼龙网过滤,接种在培养瓶中, 置于37 ℃、5%CO2的孵箱中培养,24 h后换液,3~4 d换液。培养7~10 d,根据细胞的融合度决定是否传代。
1.5 hASCs的传代及分组去掉培养基,PBS洗涤1次,以去除培养基中的血清,加入1 mL 0.25%的胰酶消化2 min, 倒置显微镜下观察到细胞间隙变大、细胞变圆,立即用培养基终止消化,吹打混匀,300×g离心3 min,2 mL培养基重悬细胞,轻轻吹打成单细胞悬液,按1传2的比例传代,当细胞生长融合至70%~80%即可传代。
细胞分为刺激组和未刺激组,刺激组分别给予50、100、150、200 mV/mm直流电场刺激,刺激频率为1 h/d,连续刺激3 d。未刺激组(0 mV/mm)插入电极但未通电。
1.6 细胞增殖检测 1.6.1 细胞计数法直流电场刺激后用胰酶将细胞消化成单细胞悬液后计数, 增殖率=(当前细胞总数-0 h细胞总数/0 h细胞总数)×100%。
1.6.2 CCK-8法检测细胞增殖不同电压连续电刺激3 d,将细胞消化成单细胞悬液,按5 000个/孔接种在96孔板中,每组设置5个复孔,放入孵箱中培养24 h,分别加入10 μL CCK-8试剂,混匀后放入孵箱中培养4 h, 用酶标仪测量波长450 nm处光密度值[D(450)]。
1.7 hASCs细胞鉴定 1.7.1 免疫表型鉴定选取P3代细胞及电刺激后的细胞用胰蛋白酶消化,制成细胞悬液,并调整为1×106个/mL。取1.5 mL离心管8个并标记1~8号,其中1~4号为实验组,5~8号为同行对照组,分别在离心管中加入100 μL细胞悬液。1~4号管均加入阳性抗体CD73-PE、CD90-PE-CY7、CD105-APC 1 μL,再分别加入阴性抗体CD14-FITC、CD31-FITC、CD34-FITC、CD45-FITC 1 μL。5~8号管分别设置为1~4号管对应的同型对照组。加入抗体后于室温避光条件下孵育30 min,随后加入400 μL PBS,混匀后上机进行检测。
1.7.2 成脂诱导用胰蛋白酶消化hASCs,制成细胞悬液,按2×104/cm2接种在6孔板中,每孔加入2 mL完全培养基。将细胞置于孵箱中培养。每隔3 d换液,当细胞融合度达到100%,将培养基换为2 mL成脂诱导分化培养基A液。诱导3 d后,将培养基换为2 mL成脂诱导分化培养基B液。24 h后,吸走B液,换回A液进行诱导。A液和B液交替作用3~5次后(12~20 d),继续用B液维持培养4~7 d直到脂滴变得足够大、圆。定向分化诱导第14天后用油红O染色定性观察体外诱导分化的结果。
1.7.3 成骨诱导用胰蛋白酶消化hASCs,制成细胞悬液,按2×104/cm2接种在0.1%明胶包被的6孔板中,每孔加入2 mL完全培养基。将细胞置于37 ℃、5%CO2的培养箱中进行培养。当细胞融合度达到60%~70%时,将培养基换为干细胞成骨诱导分化完全培养基。诱导2~4周后,视细胞的形态变化及生长情况,用茜素红进行染色。
1.8 蛋白免疫印迹检测将刺激组和未刺激组(0 mV/mm)的细胞使用预冷的细胞刮收集,并加入含蛋白酶抑制剂和磷酸酶抑制剂的裂解液裂解细胞,细胞超声促进细胞裂解,4 ℃,12 000×g离心40 min,收集上清。BCA法测定各组样本蛋白浓度,100 ℃水浴锅蛋白变性,电泳、转膜、封闭,孵育一抗GAPDH、p-ERK抗体(1 ∶1 000),4 ℃冰箱中孵育过夜,再室温孵育特异性二抗(1 ∶5 000)2 h,TBST漂洗3次,每次5 min,加入化学发光底物使用凝胶成像系统显影。
1.9 统计学分析采用GraphPad Prism统计学软件进行分析,数据以x±s表示,两两比较采用t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 hASCs形态学观察及鉴定 2.1.1 hASCs形态hASCs接种24 h后大部分细胞贴壁,倒置显微镜观察显示,细胞形态大多呈梭形,少数呈三角形或多边形。7 d后可见细胞数量明显增多,排列紧密。见图 1。
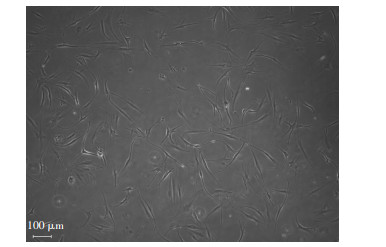
|
| 图 1 倒置显微镜观察原代脂肪间充质干细胞的形态 |
2.1.2 流式细胞仪检测hASCs表面抗原
hASCs细胞表面抗原CD105、CD73、CD90阳性表达率分别为97.32%、96.71%、99.95%,抗原CD14、CD34、CD31、CD45的阴性表达率分别为1.35%、0.57%、1.16%、1.37%。见图 2。
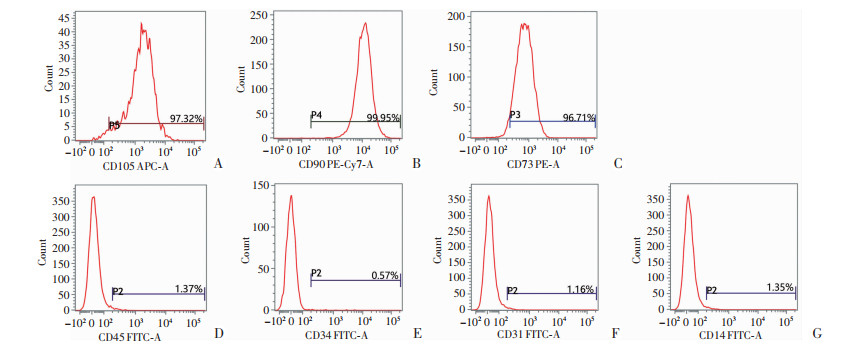
|
| A~C:干细胞表面阳性标志物CD105(A)、CD90(B)和CD73(C)的表达;D~G:干细胞表面阴性标志物CD45(D)、CD34(E)、CD31(F)及CD14(G)的表达 图 2 流式细胞术检测原代脂肪间充质干细胞表面标志物的表达 |
2.1.3 成脂、成骨诱导
成脂诱导2周后,细胞内出现形态大小不一的脂滴,油红O染色呈阳性。成骨诱导4周的过程中,hASCs的形态逐渐由梭形变为多边形,倒置显微镜下可观察到细胞间有钙结节形成,茜素红染色呈阳性。见图 3。
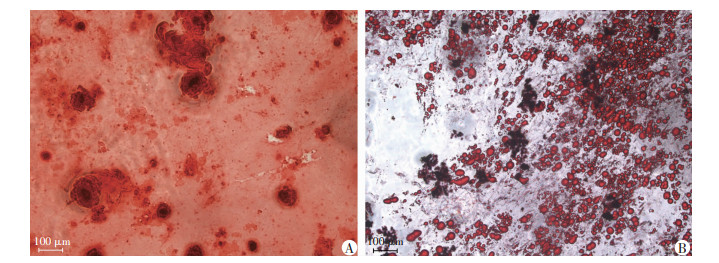
|
| A:成骨诱导4周茜素红染色;B:成脂诱导2周油红O染色 图 3 倒置显微镜观察原代脂肪间充质干细胞成脂、成骨分化 |
2.2 直流电场可促进hASCs增殖
结果显示,直流电场刺激3 d后,50、100、150 mV/mm组细胞增殖率和光密度值均明显高于未刺激组(P < 0.01)。而200 mV/mm组细胞增殖率和光密度值均低于50、100和150 mV/mm组;与0 mV/mm组相比,200 mV/mm组细胞增殖率明显降低(P < 0.01),而光密度值明显升高(P < 0.05)。见图 4。表明在一定范围内(0~150 mV/mm)直流电场的刺激可以促进脂肪间充质干细胞的增殖。
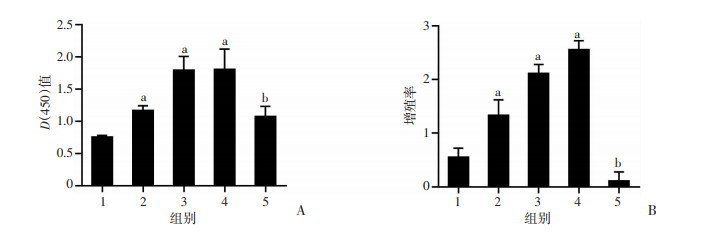
|
|
1:未刺激组;2~5:分别为50、100、150、200 mV/mm刺激组;a:P < 0.01,b:P < 0.05,与未刺激组比较 A:各组细胞的光密度值;B:各组细胞的增殖率 图 4 不同强度直流电场刺激下细胞的光密度值和增殖率 |
2.3 直流电场对hASCs的细胞形态和干细胞表面标志物表达的影响
直流电场(50、100、150 mV/mm)作用3 d后,hASCs的细胞形态与未刺激组无明显差异,均呈梭形或长梭形,偶有三角形或多边形(图 5)。流式细胞仪分析直流电场刺激3 d后hASCs表面抗原CD105、CD90、CD73的阳性表达率分别为95.88%、99.62%、96.50%,抗原CD14、CD34、CD31、CD45的阴性表达率分别为0.28%、0.48%、0.25%、0.08%。见图 6。证实直流电场作用后hASCs仍具有干细胞的形态和表型特征。
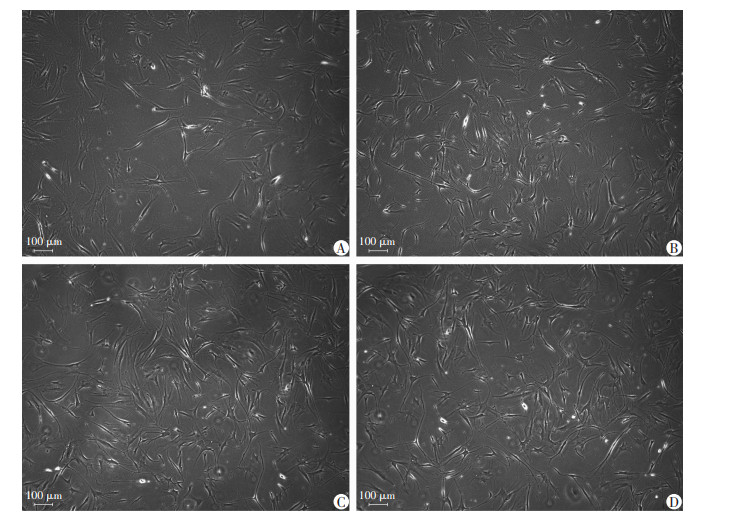
|
| A:未刺激组脂肪间充质干细胞形态;B、C、D:分别为50、100、150 mV/mm刺激组脂肪间充质干细胞形态 图 5 倒置显微镜观察不同强度直流电场刺激下hASCs形态 |
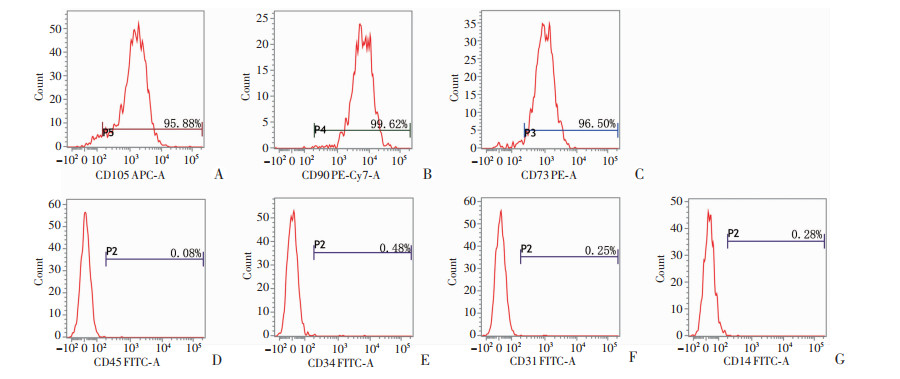
|
| A~C:干细胞表面阳性标志物CD105(A)、CD90(B)和CD73(C)的表达;D~G:干细胞表面阴性标志物CD45(D)、CD34(E)、CD31(F)及CD14(G)的表达 图 6 直流电场作用后干细胞表面标志物的表达 |
2.4 直流电场作用对hASCs分化能力的影响
将直流电场处理3 d后的脂肪间充质干细胞使用胰酶消化后细胞计数铺板,分别进行成脂、成骨分化诱导。如图 7所示,刺激组和未刺激组细胞均能诱导成脂肪细胞和骨细胞。在诱导成脂的过程中刺激组细胞分化的速度较未刺激组快,第3天逐渐开始出现脂滴,而未刺激组第8天开始出现脂滴,继续培养至第14天,两组细胞脂滴增大增多。这表明刺激组和未刺激组均能诱导成脂。在成骨诱导的过程中可见类似的现象,刺激组的细胞较未刺激组更早出现钙结节(刺激组第5天,未刺激组第10天)。继续培养至28 d后,两组细胞进行茜素红染色均能观察到红色的矿化物。这提示电刺激前后细胞均能诱导成骨细胞。结果表明直流电场的作用并不会改变脂肪间充质干细胞的分化能力,但可以明显提高脂肪间充质干细胞分化的速度。

|
| 图 7 倒置显微镜观察刺激组和未刺激组hASCs成骨、成脂诱导分化 |
2.5 直流电场可能通过调控ERK1/2蛋白的磷酸化促进hASCs的增殖
不同强度(0、50、100、150 mV/mm)的直流电场作用于脂肪间充质干细胞后,提取各组细胞蛋白。蛋白免疫印迹实验证明刺激组细胞p-ERK1/2蛋白的相对表达明显高于未刺激组(P < 0.01,图 8)。提示直流电场可能通过调控ERK1/2信号通路来影响hASCs的增殖。
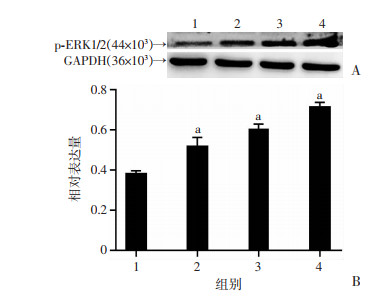
|
| 1:未刺激组;2~4:分别为50、100、150 mV/mm刺激组A:免疫印迹检验结果;B:蛋白半定量分析结果 a:P < 0.01,与未刺激组(0 mV/mm)比较 图 8 直流电场对hASCs p-ERK1/2蛋白表达的影响 |
3 讨论
脂肪间充质干细胞能够自我更新、多向分化,被广泛运用于再生医学和组织工程。但现有技术培养脂肪间充质干细胞使其在体外扩增所耗时间较长,在培养过程中脂肪间充质干细胞容易分化和衰老,并且脂肪间充质干细胞的临床转化应用需要大量的保持干性的细胞。这严重阻碍了脂肪间充质干细胞的临床利用和转化。近年来研究表明外源性的直流电场可以显著调控细胞的增殖和凋亡,然而不同类型的细胞,直流电场影响其细胞增殖的具体参数不同[3]。因此,探究直流电场对脂肪间充质干细胞增殖及其干细胞特性的影响,对于人脂肪间充质干细胞的临床转化应用具有重要意义。本研究成功的分离并鉴定了脂肪间充质干细胞,取第3代脂肪间充质干细胞探索直流电场对脂肪间充质干细胞增殖、形态特征、细胞表面标志物、分化能力、增殖相关蛋白p-ERK1/2等的影响。
研究证实在胚胎发育和创面愈合(皮肤创面的电场为100~150 mV/mm)的过程中存在着生理性的直流电场;临床研究也发现,电场可以明显促进皮肤、骨、肌肉和神经组织的愈合和再生[9-10]。细胞组织的再生离不开细胞的增殖、迁移等细胞生物学行为的参与。这提示电场可能通过改变细胞的增殖、迁移等生物学行为加速创面的愈合。并且越来越多的研究也证明一定强度的电场刺激可以影响细胞的增殖、凋亡等生物学行为[11-14]。本研究显示,在一定范围内(0~150 mV/mm),随着直流电场强度的增加,可以促进脂肪间充质干细胞的增殖,而当电场强度增加到200 mV/mm时,细胞增殖则受到抑制,与文献[15]报道相符。越来越多研究也证明电场刺激(其刺激强度大多在10~100 mV/mm)在促进细胞增殖方面具有显著的作用,比如角质形成细胞[16]、雪旺细胞[17]、大鼠嗅鞘细胞[18]等。而200 mV/mm的电场强度大于生理条件的电场(100~150 mV/mm),可能通过某种潜在的机制抑制细胞的增殖,这还有待于我们进一步探索。
众所周知,干细胞是一类原始的、未分化的、具有自我更新、增殖和分化能力的细胞。其增殖方式包括对称分裂和不对称分裂。目前国际细胞治疗学会脂肪间充质干细胞的鉴定标准[19]为:①具有典型脂肪干细胞的形态特征:细胞大多成梭形或者长梭形;②高表达特异性的表面标记物CD73、CD90、CD105,不表达或者低表达CD14、CD34、CD31、CD45;③具有分化为骨细胞、脂肪细胞等多项分化潜能。GRIFFIN等[11]发现使用简并波、电容耦合、脉冲电磁场等处理后的骨髓间充质干细胞依然具有干细胞的生物学特性。本研究检测了直流电场处理前后整个培养皿中脂肪间充质干细胞的干细胞生物学特性,结果发现刺激组和未刺激组的脂肪间充质干细胞的细胞形态并无明显差异,均能高表达CD105、CD73、CD90,低表达CD14、CD45、CD31、CD34。并且未刺激组和刺激组的细胞均能诱导分化为骨细胞和脂肪细胞。提示直流电场处理后的细胞仍然具有特征性的脂肪间充质干细胞的形态特征、表达干细胞特异性的表面抗原并且具有多项分化的能力。这表明直流电场的刺激并不会改变脂肪间充质干细胞的干细胞生物学特性。
电刺激本身作为一种外来的物理刺激,其诱导的细胞增殖与多种信号通路的激活有关。大量研究表明,电刺激可以磷酸化激活ERK,抑制ERK可显著降低电刺激诱导的细胞增殖[7]。这提示ERK信号通路在电刺激促进细胞增殖方面可能扮演着重要的角色。因此,本研究检测了直流电场刺激组和未刺激组磷酸化激活的ERK的表达,结果显示在一定范围内(0~150 mV/mm)随着直流电场强度的增加,磷酸化激活的ERK表达也增加,且差异均具有统计学意义。这与WAN等[20]研究电刺激诱导卫星细胞增殖的实验结果基本一致。目前的研究结果提示,电刺激对细胞增殖的影响及其分子机制似乎具有一定的共性而不是特异性。这为电刺激用于各种疾病的治疗以及生物再生医学其他领域提供了潜在的可能。
综上所述,本研究结果表明一定强度的直流电场可能通过调控ERK的磷酸化诱导脂肪间充质干细胞的增殖,并且不改变其干细胞生物学特性,对于干细胞的临床应用和转化具有重要意义。但直流电场促进脂肪间充质干细胞的增殖的具体分子机制还有待进一步的研究。
| [1] |
SHINGYOCHI Y, ORBAY H, MIZUNO H. Adipose-derived stem cells for wound repair and regeneration[J]. Expert Opin Biol Ther, 2015, 15(9): 1285-1292. |
| [2] |
HASSAN W U, GREISER U, WANG W. Role of adipose-derived stem cells in wound healing[J]. Wound Repair Regen, 2014, 22(3): 313-325. |
| [3] |
LOVE M R, PALEE S, CHATTIPAKORN S C, et al. Effects of electrical stimulation on cell proliferation and apoptosis[J]. J Cell Physiol, 2018, 233(3): 1860-1876. |
| [4] |
WANG Y, ROUABHIA M, LAVERTU D, et al. Pulsed electrical stimulation modulates fibroblasts' behaviour through the Smad signalling pathway[J]. J Tissue Eng Regen Med, 2017, 11(4): 1110-1121. |
| [5] |
CHAO P H, ROY R, MAUCK R L, et al. Chondrocyte translocation response to direct current electric fields[J]. J Biomech Eng, 2000, 122(3): 261-267. |
| [6] |
THRIVIKRAMAN G, MADRAS G, BASU B. Intermittent electrical stimuli for guidance of human mesenchymal stem cell lineage commitment towards neural-like cells on electroconductive substrates[J]. Biomaterials, 2014, 35(24): 6219-6235. |
| [7] |
LI L, ZHANG Y M, QIAO W L, et al. Role of mitogen-activated protein kinases in the regulation of paraventricular nucleus to gastric ischemia-reperfusion injuries[J]. Chin Med J (Engl), 2007, 120(12): 1082-1087. |
| [8] |
MOBINI S, LEPPIK L, BARKER J H. Direct current electrical stimulation chamber for treating cells in vitro[J]. Biotechniques, 2016, 60(2): 95-98. |
| [9] |
KHOURI C, KOTZKI S, ROUSTIT M, et al. Hierarchical evaluation of electrical stimulation protocols for chronic wound healing: An effect size meta-analysis[J]. Wound Repair Regen, 2017, 25(5): 883-891. |
| [10] |
GARDNER S E, FRANTZ R A, SCHMIDT F L. Effect of electrical stimulation on chronic wound healing: a meta-analysis[J]. Wound Repair Regen, 1999, 7(6): 495-503. |
| [11] |
GRIFFIN M, IQBAL S A, SEBASTIAN A, et al. Degenerate wave and capacitive coupling increase human MSC invasion and proliferation while reducing cytotoxicity in an in vitro wound healing model[J]. PLoS ONE, 2011, 6(8): e23404. |
| [12] |
WANG M, LI P, LIU M, et al. Potential protective effect of biphasic electrical stimulation against growth factor-deprived apoptosis on olfactory bulb neural progenitor cells through the brain-derived neurotrophic factor-phosphatidylinositol 3'-kinase/Akt pathway[J]. Exp Biol Med (Maywood), 2013, 238(8): 951-959. |
| [13] |
MATSUKI N, ISHIKAWA T, IMAI Y, et al. Low voltage pulses can induce apoptosis[J]. Cancer Lett, 2008, 269(1): 93-100. |
| [14] |
PEDROTTY D M, KOH J, DAVIS B H, et al. Engineering skeletal myoblasts: roles of three-dimensional culture and electrical stimulation[J]. Am J Physiol Heart Circ Physiol, 2005, 288(4): H1620-H1626. |
| [15] |
NUCCITELLI R, NUCCITELLI P, RAMLATCHAN S, et al. Imaging the electric field associated with mouse and human skin wounds[J]. Wound Repair Regen, 2008, 16(3): 432-441. |
| [16] |
SEBASTIAN A, IQBAL S A, COLTHURST J, et al. Electrical stimulation enhances epidermal proliferation in human cutaneous wounds by modulating p53-SIVA1 interaction[J]. J Invest Dermatol, 2015, 135(4): 1166-1174. |
| [17] |
HUANG J, HU X, LU L, et al. Electrical regulation of Schwann cells using conductive polypyrrole/chitosan polymers[J]. J Biomed Mater Res A, 2010, 93(1): 164-174. |
| [18] |
QI F, WANG Y, MA T, et al. Electrical regulation of olfactory ensheathing cells using conductive polypyrrole/chitosan polymers[J]. Biomaterials, 2013, 34(7): 1799-1809. |
| [19] |
DOMINICI M, LE BLANC K, MUELLER I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy Position Statement[J]. Cytotherapy, 2006, 8(4): 315-317. |
| [20] |
WAN Q, YEUNG S S, CHEUNG K K, et al. Optimizing electrical stimulation for promoting satellite cell proliferation in muscle disuse atrophy[J]. Am J Phys Med Rehabil, 2016, 95(1): 28-38. |




