瘢痕疙瘩是病因未明的良性纤维增生性疾病,呈浸润性生长,缺乏自发消退,切除后极易复发[1]。由于其发病机制目前仍未完全阐明,导致临床缺乏令人满意的治疗方案。临床观察表明,对于浅表浸润型瘢痕疙瘩, 其不同部位表现出不同的生长特点,中央区域萎缩,质软色浅,被称为老化部,边缘区域充血明显,明显隆起并逐渐侵入周围正常皮肤,显示瘢痕疙瘩的特征性生长,被称为增生或侵袭部[2-3],对比分析瘢痕疙瘩中心与边缘的组织学差异或可有助于解释瘢痕疙瘩类肿瘤样生长的原因。由于细胞外基质在真皮层的过度沉积以及真皮乳头层的舌状推进前缘是瘢痕疙瘩瘢痕的标志[4],相关研究更多集中在瘢痕疙瘩中心与边缘成纤维细胞、炎症细胞浸润以及胶原纤维等方面的差异[2, 5-6],但瘢痕疙瘩类肿瘤样生长的潜在机制仍不清楚。
近来研究发现,瘢痕疙瘩表皮层参与瘢痕疙瘩的形成,并通过上皮间质转化(epithelium-to-mesenchymal transition,EMT)在瘢痕疙瘩的侵袭性生长中发挥重要作用[7-8]。EMT是上皮细胞失去细胞极性和细胞间连接,获得侵袭性和迁移性,最终形成间充质细胞的过程。在该过程中,细胞间连接被破坏,细胞骨架重排,上皮细胞标志物如E-cadherin表达降低,间充质标志物如Vimentin表达升高,细胞形态由立方状变为长梭形,从而有利于细胞迁移与侵袭[9]。EMT已被证明与伤口愈合、器官纤维化和恶性肿瘤侵袭和转移相关[10-11]。
缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)是诱导EMT发生的主要细胞因子[12],已被证明在肺癌等多种恶性肿瘤中通过EMT促进肿瘤的侵袭与转移[13]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种高度特异性的促血管生成因子,通过促进毛细血管出芽生长,为肿瘤的增殖和转移提供相对有利的微环境[14],也参与EMT调控[15]。由于瘢痕疙瘩组织中心与边缘的差异,我们推测瘢痕疙瘩表皮层以及EMT程度也存在差异,并与瘢痕疙瘩边缘侵袭性生长相关,HIF-1α以及VEGF可能是其中的重要影响因子,但目前相关研究尚少。因此,本研究对比分析瘢痕疙瘩边缘与中心E-cadherin、Vimentin、VEGF和HIF-1α蛋白表达以及表皮层组织学上的差异,纳入正常皮肤作为对照,探讨瘢痕疙瘩边缘侵袭性生长的原因,为临床抑制瘢痕生长并促进其消退提供新的治疗思路。
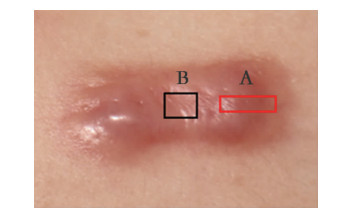
1 资料与方法 1.1 临床资料纳入2019年10月至2020年8月于西南医科大学整形烧伤外科行瘢痕疙瘩切除手术治疗的患者16例,并纳入术中需要进行正常皮肤切除的手术患者9例,患者均知情同意。纳入标准:明确诊断为瘢痕疙瘩(瘢痕生长超出原创面范围)、病程大于1年且呈持续性浸润生长以及未接受过治疗的病例。排除标准:①局部皮肤存在感染、溃疡、出血、恶变等;②存在肿瘤或其他严重疾病(垂体肾上腺疾病、传染病、皮肤病及自身免疫性疾病等)者;③耳垂瘢痕疙瘩。本研究已通过西南医科大学附属医院伦理委员会的批准(KY2019090)。将每个瘢痕疙瘩标本分为中心及边缘两部分,中心定义为处于瘢痕中央的凹陷扁平或有消退趋势的部位,边缘定义为瘢痕疙瘩生长外缘与周围健康皮肤相接的增生活跃部位,见图 1。
|
| A:边缘;B:中心 可见边缘凸起,充血明显,中心相对凹陷,呈消退状 图 1 胸部浅表浸润型瘢痕疙瘩图像 |
1.2 组织学分析
所有组织标本采集后在15 min内固定于4%多聚甲醛溶液中24~48 h,石蜡包埋。
1.2.1 HE染色对组织蜡块进行切片,切片厚度为4 μm,HE(Solarbio,中国)染色后在显微镜下(Olympus, BX53, 东京,日本)观察组织学特征。每例标本均于高倍镜(×200)下从表皮到皮下依次取3个不重叠视野,计数各视野微血管数量,并计算血管密度(/mm2),再取每例标本所对应的血管密度均值进行分析。
1.2.2 免疫组织化学染色采用S-P染色法进行免疫组化染色。将石蜡组织连续切片,切片厚度4 μm,常规脱蜡水化,微波炉热修复抗原。以抗E-cadherin(1 ∶100;Zenbio,中国)、Vimentin(1 ∶100;Zenbio,中国)、HIF-1α(1 ∶200;Abcam,美国)、VEGF(1 ∶200;Abcam,美国)的单克隆抗体为一抗,辣根过氧化物酶标记的兔抗鼠IgG为二抗(中杉金桥,中国),使用DAB染色试剂盒(中杉金桥,中国)进行显色,苏木精复染(Solarbio, 中国),脱水透明封片后在显微镜(Olympus, BX53, 东京,日本)下检测棕色抗体,以反映与抗原结合的抗体的存在。棕色染色表示阳性表达区域,棕色阴影表示目标蛋白的表达水平。高倍镜(×400)下对每个标本表皮层随机选择5个不重叠视野,并再对经HIF-1α及VEGF抗体染色标本从真皮浅层到深层依次取5个不重叠视野,采用Image J软件分析系统测量图像IOD值,再取每例标本所对应的5个不重叠视野的IOD值的均值进行分析。
1.3 Western blot检测采用液氮研磨法将收集的样本组织在液氮低温状态下研磨成粉末,加入含有蛋白酶抑制剂的裂解液冰上放置15 min,裂解细胞提取蛋白质,细胞超声进一步促进细胞裂解,4 ℃,12 000×g离心40 min,收集上清。BCA法测定各组样本蛋白浓度,100 ℃水浴锅蛋白变性,电泳、转膜、封闭,孵育一抗GAPDH、VEGF、HIF-1α、Vimentin、Ecadhrin抗体(1 ∶1 000),4 ℃孵育过夜;再室温孵育特异性二抗(1 ∶5 000)2 h,TBST漂洗3次,每次5 min,加入化学发光底物使用凝胶成像系统显影,Image J软件对条带灰度进行分析。通过计算各组目的蛋白条带的灰度值与内参蛋白GAPDH灰度值的比值,对目的蛋白进行半定量,并比较各组间表达水平的差异。
1.4 统计学分析数据以x±s表示,采用SPSS 19.0统计软件进行单因素方差分析。以P < 0.05表示差异具有统计学意义。
2 结果 2.1 患者基本情况共纳入瘢痕疙瘩标本16例,其中男性5例,女性11例,年龄22~38(31.2±4.8)岁,病史1.5~20(5.4±4.8)年。其中9例取自前胸部,3例取自腹部,2例取自肩背部, 2例取自颌面部。正常皮肤标本9例,其中男性4例,女性5例,年龄15~40(26.8±8.0)岁。其中7例为术中正常皮肤的猫耳去除部分(3例取自背部,3例取自胸部,1例取自面部),2例为全厚皮片移植手术修剪掉的正常皮肤(均取自腹部)。
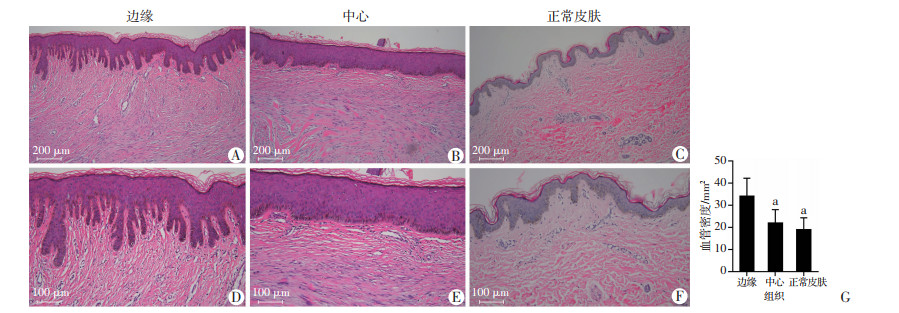
2.2 组织学观察瘢痕疙瘩表皮明显厚于正常皮肤,边缘上皮层呈明显树枝状分支并深入真皮,形成较深的犬牙交错表现,中心表皮层趋于扁平,从中心到边缘,表皮层分支逐渐变长变细,向真皮层深入程度逐渐加深,基底层及部分棘层角质形成细胞形态变为长梭形,细胞间间隙增大,以深入真皮层部分为甚。边缘微血管丰富,平均血管密度明显高于瘢痕疙瘩中心及正常皮肤(P < 0.05,图 2),瘢痕疙瘩中心与正常皮肤平均血管密度未见明显差异。
|
| A、D:瘢痕疙瘩边缘;B、E:瘢痕疙瘩中心;C、F:正常皮肤;可见从瘢痕疙瘩中心到边缘,表皮层分支逐渐变长变细,向真皮层深入程度逐渐加深,基底层及部分棘层角质形成细胞形态变为长梭形,细胞间间隙增大,以深入真皮层部分为甚;G:不同皮肤平均血管密度统计 a:P < 0.05,与边缘比较 图 2 瘢痕疙瘩边缘、中心、正常皮肤的组织学表现 |
2.3 免疫组织化学评价
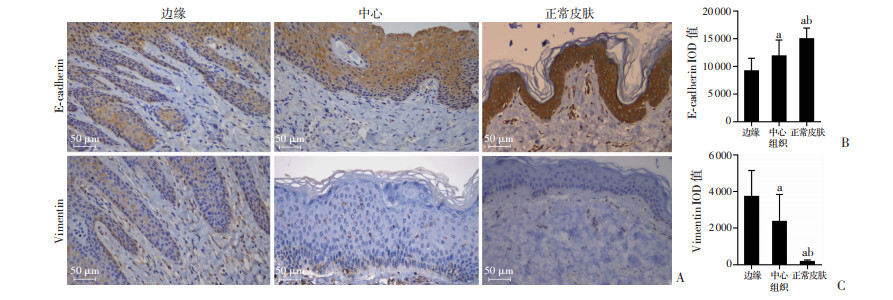
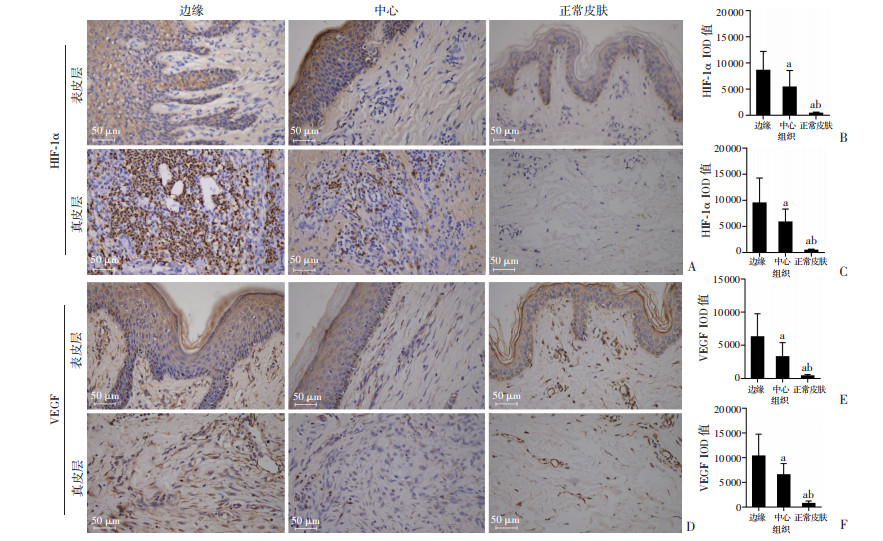
采用免疫组织化学方法对瘢痕疙瘩边缘、中心以及正常皮肤E-cadherin、Vimentin、HIF-1α以及VEGF表达进行分析。可见瘢痕疙瘩与真皮接触部分(基底层)的角质形成细胞形态由椭圆或立方形变为长梭形,E-cadherin表达降低或缺失并显示Vimentin的表达,以边缘深入真皮层的角质形成细胞为甚。结果表明,瘢痕疙瘩边缘及中心表皮层E-cadherin表达显著低于正常皮肤(P < 0.05),且边缘显著低于中心(P < 0.05);瘢痕疙瘩边缘及中心表皮层Vimentin表达显著高于正常皮肤(P < 0.05),且边缘显著高于中心(P < 0.05),见图 3。瘢痕疙瘩边缘和中心表皮层与真皮层HIF-1α以及VEGF表达均显著高于正常皮肤(P < 0.05),且边缘显著高于中心(P < 0.05),见图 4。
|
| A:免疫组织化学染色结果;B、C:分别为不同组织表皮层E-cadherin和Vimentin的IOD值 a:P < 0.05,与边缘比较;b:P < 0.05,与中心比较 图 3 瘢痕疙瘩边缘、中心和正常皮肤的E-cadherin和Vimentin的表达 |
|
| A、D:分别为免疫组织化学染色观测HIF-1α和VEGF的表达;B、C、E、F:分别为不同组织表皮层和真皮层HIF-1α和VEGF的IOD值 a:P < 0.05,与边缘比较;b:P < 0.05,与中心比较 图 4 瘢痕疙瘩边缘、中心和正常皮肤表皮层和真皮层的HIF-1α和VEGF的表达 |
2.4 Western blot检测
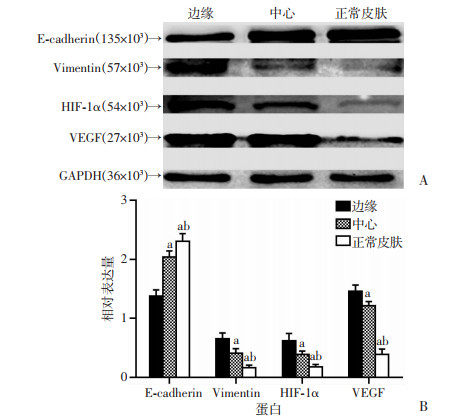
采用Western blot检测瘢痕疙瘩边缘、中心以及正常皮肤E-cadherin、Vimentin、HIF-1α以及VEGF蛋白的表达。结果表明,瘢痕疙瘩边缘E-cadherin表达显著低于瘢痕疙瘩中心(P < 0.05),均显著低于正常皮肤(P < 0.05),瘢痕疙瘩边缘Vimentin、HIF-1α以及VEGF蛋白表达均显著高于瘢痕疙瘩中心(P < 0.05),均显著高于正常皮肤(P < 0.05),见图 5。
|
| A:Western blot检测结果;B:半定量分析结果(n=4) a:P < 0.05,与边缘比较;b:P < 0.05,与中心比较 图 5 不同皮肤组织E-cadherin、Vimentin、HIF-1α以及VEGF蛋白的表达 |
3 讨论
瘢痕疙瘩是指生长超出原有伤口范围,向周围皮肤侵袭性生长的病理性瘢痕。研究表明,与正常皮肤相比,瘢痕疙瘩表皮层增厚,角质形成细胞处于亚稳态[16],其通过下调上皮细胞标志物如E-cadherin等的表达、上调间充质细胞标志物如Vimentin等的表达,使细胞极性丧失、粘附性降低、运动性增强,转化为成纤维样细胞,从而支持瘢痕疙瘩的侵袭性生长[7-9, 17],即角质形成细胞在瘢痕疙瘩侵袭性生长中具有重要作用。但既往研究多为对瘢痕疙瘩总体或局部的表皮层或EMT的描述,缺乏对瘢痕疙瘩中心与边缘的对比研究。众所周知,瘢痕疙瘩内部存在明显异质性,中心逐渐消退而边缘表现出侵袭性生长的特征,因此中心与边缘在表皮层以及EMT程度上可能也存在差异,对比分析这一差异性以及造成差异的原因或可进一步阐明其边缘侵袭性生长的机制。
本研究发现,瘢痕疙瘩表皮明显厚于正常皮肤,边缘表皮层呈树枝状分支并深入真皮,中心表皮层趋于扁平,从中心到边缘,表皮层分支逐渐变长变细,深入真皮层程度逐渐加深,基底层及部分棘层、颗粒层角质形成细胞形态变为长梭形,细胞间间隙增大,以深入真皮层部分为甚(图 2)。同时,瘢痕疙瘩表皮层E-cadherin表达明显弱于正常皮肤,边缘显著弱于中心,Vimentin表达显著强于正常皮肤,边缘强于中心,也主要发生在表皮基底层,以深入真皮层部分为甚(图 3)。E-cadherin参与同型细胞间的黏附连接且维持细胞极性,在维持上皮细胞形态及组织结构完整中发挥极其重要的作用,Vimentin则与细胞运动性的获得相关[10]。以上结果表明,瘢痕疙瘩表皮层存在明显异常及异质性,且边缘EMT程度显著强于中心,活跃的EMT可能通过增加角质形成细胞的侵袭性从而支持瘢痕疙瘩边缘向邻近皮肤的浸润性生长。同时,也可能与边缘表皮层向真皮层延伸有关。但既往多数研究表明瘢痕疙瘩表皮层为增厚扁平状[18-19],我们认为可能与瘢痕疙瘩内部异质性、纳入瘢痕类型以及瘢痕状态相关。本研究对象是持续增长的浅表浸润型瘢痕疙瘩,其具有更明显的增殖侵袭边缘以及消退的中心,而既往研究多未考虑瘢痕疙瘩内部异质性[19],且并未明确区分纳入瘢痕类型(浅表浸润型、隆起型)[18]以及瘢痕状态(活跃期、稳定期、消退期),从而导致结论上的差异,更深层次的原因有待进一步的探究。
HIF-1α是缺氧应激反应的关键介质之一,在缺氧微环境中表达增加[20]。缺氧是肿瘤组织的重要特征,HIF-1α在多种肿瘤中高表达, 并通过诱导EMT促进肿瘤细胞的侵袭、转移[13]。瘢痕疙瘩表现出与肿瘤相似的缺氧微环境以及侵袭行为[10],HIF-1α高表达并诱导EMT产生可能也是瘢痕疙瘩侵袭性生长的重要机制[8]。HIF-1α还可上调组织中VEGF的表达从而促进微血管增生[21],血管生成是肿瘤生长及浸润必不可少的条件,瘢痕疙瘩邻近病变皮肤率先出现的充血表现也表明血管生成与瘢痕疙瘩局部浸润相关。
本研究显示,瘢痕疙瘩表皮层与真皮层相较于正常皮肤均显著表达HIF-1α和VEGF,且边缘显著高于中心,与瘢痕疙瘩内EMT程度及微血管数量相一致(图 2、4)。同样的,MA等[8]的体外实验研究也表明低氧/HIF-1α丰富的微环境有利于瘢痕疙瘩来源的角质形成细胞通过EMT现象转化为成纤维细胞,从而支持瘢痕疙瘩的侵入性生长。且抑制HIF-1α[8, 22]或改善缺氧[23]则可逆转EMT现象。李红雨等[15]在对卵巢癌组织的研究中也发现VEGF的表达与EMT呈正相关,以上表明HIF-1α和VEGF高表达的局部微环境是边缘EMT更为活跃的重要原因。而HIF-1α和VEGF在边缘高表达可能与边缘组织相对于中心表现出更多的炎症细胞浸润以及更活跃的成纤维细胞分裂及胶原合成相关,高炎症及高代谢状态使得边缘显示出更高的耗氧量[24-25],故而其虽相较于中心表现为更多的微血管,但仍处于相对更缺氧状态,因此表达更高的HIF-1α,HIF-1α的高表达促进VEGF的表达以及大量微血管增生,这与临床观察到的边缘充血而中心相对苍白表现相一致。SONG等[26]的研究发现经高压氧治疗后,瘢痕疙瘩缺氧改善但血流灌注下降,也可侧面印证本研究的结果。但这似乎与既往瘢痕疙瘩中心严重缺氧以及边缘常氧或轻度缺氧的结论相悖[27-28]。我们认为可能与对缺氧的证明方式(因瘢痕疙瘩中心血管数量少于边缘,且管腔较边缘扁平而认为中心更为缺氧,但氧张力还与组织代谢相关)[28]以及取材部位上的差异[27]有关,同时也有研究认为严重缺氧时HIF-1α表达不一定增加[29]。JAIDEE等[30]研究表明,HIF-1α常氧下也可持续表达,表明HIF-1α的表达程度并不完全与缺氧程度相关。此外,样本数量、瘢痕状态也可能是本研究与既往研究结果不一致的原因,有待扩大样本量进行更深入的分析。
综上,本研究发现,瘢痕疙瘩表皮层存在明显的异常及异质性,边缘表皮层呈细分枝状并明显深入真皮,EMT活跃,局部微环境中HIF-1α、VEGF高表达且微血管丰富。这可能是瘢痕疙瘩边缘侵袭性生长的重要原因,HIF-1α可能是其中的关键因子。靶向抑制HIT-1α或可成为瘢痕疙瘩治疗的潜在目标,同时未来新疗法的开发中也不应忽视角质形成细胞群体,且在治疗时应将边缘作为重点治疗区域,这或可有助于提高治疗效果。
| [1] |
NANGOLE F W, AGAK G W. Keloid pathophysiology: fibroblast or inflammatory disorders?[J]. JPRAS Open, 2019, 22: 44-54. |
| [2] |
LU F, GAO J, OGAWA R, et al. Biological differences between fibroblasts derived from peripheral and central areas of keloid tissues[J]. Plast Reconstr Surg, 2007, 120(3): 625-630. |
| [3] |
LIMANDJAJA G C, NIESSEN F B, SCHEPER R J, et al. The keloid disorder: heterogeneity, histopathology, mechanisms and models[J]. Front Cell Dev Biol, 2020, 8: 360. |
| [4] |
LEMPERLE G, SCHIERLE J, KITOGA K E, et al. Keloids: which types can be excised without risk of recurrence? a new clinical classification[J]. Plast Reconstr Surg Glob Open, 2020, 8(3): e2582. |
| [5] |
SYED F, AHMADI E, IQBAL S A, et al. Fibroblasts from the growing margin of keloid scars produce higher levels of collagen Ⅰ and Ⅲ compared with intralesional and extralesional sites: clinical implications for lesional site-directed therapy[J]. Br J Dermatol, 2011, 164(1): 83-96. |
| [6] |
JIAO H, ZHANG T R, FAN J C, et al. The superficial dermis may initiate keloid formation: histological analysis of the keloid dermis at different depths[J]. Front Physiol, 2017, 8: 885. |
| [7] |
HAHN J M, MCFARLAND K L, COMBS K A, et al. Partial epithelial-mesenchymal transition in keloid scars: regulation of keloid keratinocyte gene expression by transforming growth factor-β1[J]. Burn Trauma, 2016, 4(1): 30. |
| [8] |
MA X, CHEN J, XU B, et al. Keloid-derived keratinocytes acquire a fibroblast-like appearance and an enhanced invasive capacity in a hypoxic microenvironment in vitro[J]. Int J Mol Med, 2015, 35(5): 1246-1256. |
| [9] |
KUWAHARA H, TOSA M, EGAWA S, et al. Examination of epithelial mesenchymal transition in keloid tissues and possibility of keloid therapy target[J]. Plast Reconstr Surg Glob Open, 2016, 4(11): e1138. |
| [10] |
TAN S, KHUMALO N, BAYAT A. Understanding keloid pathobiology from a quasi-neoplastic perspective: less of a scar and more of a chronic inflammatory disease with cancer-like tendencies[J]. Front Immunol, 2019, 10: 1810. |
| [11] |
XU G, ZHAO H, XU J, et al. Hard antler extract inhibits invasion and epithelial-mesenchymal transition of triple-negative and Her-2+ breast cancer cells by attenuating nuclear factor-κB signaling[J]. J Ethnopharmacol, 2021, 269: 113705. |
| [12] |
TAM S Y, WU V W C, LAW H K W. Hypoxia-induced epithelial-mesenchymal transition in cancers: HIF-1α and beyond[J]. Front Oncol, 2020, 10: 486. |
| [13] |
PARK J H, MOON M, KIM J S, et al. TOPK mediates hypoxia-induced epithelial-mesenchymal transition and the invasion of nonsmall-cell lung cancer cells via the HIF-1α/snail axis[J]. Biochem Biophys Res Commun, 2021, 534: 941-949. |
| [14] |
BEKES I, FRIEDL T W, KÖHLER T, et al. Does VEGF facilitate local tumor growth and spread into the abdominal cavity by suppressing endothelial cell adhesion, thus increasing vascular peritoneal permeability followed by ascites production in ovarian cancer?[J]. Mol Cancer, 2016, 15: 13. |
| [15] |
李红雨, 余亚南, 胡晓静, 等. 上皮性卵巢癌组织中TGF-β1, FOXQ1, VEGF, E-cad, N-cad的表达及意义[J]. 山东医药, 2017, 57(2): 91-94. LI H Y, YU Y N, HU X J, et al. The expression and significance of TGF-β1, FOXQ1, VEGF, E-cad, N-cad in epithelial ovarian cancer[J]. Shandong Med J, 2017, 57(2): 91-94. |
| [16] |
LIMANDJAJA G C, BELIEN J M, SCHEPER R J, et al. Hypertrophic and keloid scars fail to progress from the CD34- /α-smooth muscle actin (α-SMA)+ immature scar phenotype and show gradient differences in α-SMA and p16 expression[J]. Br J Dermatol, 2020, 182(4): 974-986. |
| [17] |
YANG C E, MOON S J, KIM S J, et al. Epithelial-mesenchymal transition in keloid tissue[J]. Arch Plast Surg, 2018, 45(6): 600-601. |
| [18] |
LIMANDJAJA G C, VAN DEN BROEK L J, WAAIJMAN T, et al. Increased epidermal thickness and abnormal epidermal differentiation in keloid scars[J]. Br J Dermatol, 2017, 176(1): 116-126. |
| [19] |
JUMPER N, PAUS R, BAYAT A. Functional histopathology of keloid disease[J]. Histol Histopathol, 2015, 30(9): 1033-1057. |
| [20] |
ZHANG M, LIU S, GUAN E, et al. Hyperbaric oxygen therapy can ameliorate the EMT phenomenon in keloid tissue[J]. Medicine (Baltimore), 2018, 97(29): e11529. |
| [21] |
吴晓燕, 刘林盛, 罗志广, 等. 病理性瘢痕患者HIF-1α、VEGF、MMP-2的表达及临床意义[J]. 中国医师杂志, 2018, 20(7): 1025-1028, 1031. WU X Y, LIN L S, LUO Z G, et al. Expression and clinical significance of HIF-1α, VEGF, MMP-2 in patients with pathological scar[J]. J Chin Physician, 2018, 20(7): 1025-1028, 1031. |
| [22] |
LEI R, ZHANG S, WANG Y, et al. Metformin inhibits epithelial-to-mesenchymal transition of keloid fibroblasts via the HIF-1α/PKM2 signaling pathway[J]. Int J Med Sci, 2019, 16(7): 960-966. |
| [23] |
ZHANG M, LIU S, Guan E, et al. Hyperbaric oxygen therapy can ameliorate the EMT phenomenon in keloid tissue[J]. Medicine (Baltimore), 2018, 97(29): e115. |
| [24] |
CHIN M S, FRENIERE B B, BONNEY C F, et al. Skin perfusion and oxygenation changes in radiation fibrosis[J]. Plast Reconstr Surg, 2013, 131(4): 707-716. |
| [25] |
ICHIOKA S, ANDO T, SHIBATA M, et al. Oxygen consumption of keloids and hypertrophic scars[J]. Ann Plast Surg, 2008, 60(2): 194-197. |
| [26] |
SONG K X, LIU S, ZHANG M Z, et al. Hyperbaric oxygen therapy improves the effect of keloid surgery and radiotherapy by reducing the recurrence rate[J]. J Zhejiang Univ Sci B, 2018, 19(11): 853-862. |
| [27] |
TOUCHI R, UEDA K, KUROKAWA N, et al. Central regions of keloids are severely ischaemic[J]. J Plast Reconstr Aesthet Surg, 2016, 69(2): e35-e41. |
| [28] |
KUROKAWA N, UEDA K, TSUJI M. Study of microvascular structure in keloid and hypertrophic scars: density of microvessels and the efficacy of three-dimensional vascular imaging[J]. J Plast Surg Hand Surg, 2010, 44(6): 272-277. |
| [29] |
ZHENG J, SONG F, LU S L, et al. Dynamic hypoxia in scar tissue during human hypertrophic scar progression[J]. Dermatol Surg, 2014, 40(5): 511-518. |
| [30] |
JAIDEE R, KONGPETCH S, SENGGUNPRAI L, et al. Phenformin inhibits proliferation, invasion, and angiogenesis of cholangiocarcinoma cells via AMPK-mTOR and HIF-1A pathways[J]. Naunyn-Schmiedeberg's Arch Pharmacol, 2020, 393(9): 1681-1690. |




