增生性瘢痕(hypertrophic scar,HS)作为外伤及手术后最常见的继发疾病,在创伤、手术后的发生率可达40%以上,烧伤后高达70%[1]。HS是一种发生在真皮的纤维化疾病,主要特征为成纤维细胞(fibroblasts,Fb)大量增殖及细胞外基质(extracellular matrix,ECM) 过度生成和异常沉积。瘢痕的过度增生或挛缩,往往导致丑陋外观并可严重损害肢体关节活动以及口鼻眼等体表器官的生理功能,对患者造成巨大的身心伤害。转化生长因子-β1(transforming growth factor-β1,TGF-β1) 是引起纤维化疾病的重要细胞因子之一,其介导的经典的TGF-β1/Smad信号通路以及非经典的ERK/MAPK信号通路在纤维化疾病形成中起重要作用,TGF-β不仅可以刺激胶原的产生,还可通过增加基质金属蛋白酶抑制剂(tissue inhibitors of metalloproteinases,TIMPs) 的表达及抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)合成,从而减少创口处胶原的降解。TGF-β1参与创面修复过程中炎症、细胞因子趋化、创口收缩、血管化及细胞外基质沉积等过程。M2型巨噬细胞是TGF-β1的来源之一,提示M2型巨噬细胞对调节创伤愈合中细胞外基质形成与重塑起到关键作用。
神经调节素受体降解蛋白1(neuregulin receptor degradation protein 1,Nrdp1)是一种泛素连接酶,可特异性作用于一些底物分子,参与多种病理或生理过程。有研究显示,在Nrdp1转基因(Nrdp1-TG)小鼠的腹腔巨噬细胞中表达较高水平的精氨酸酶1(arginase1,Arg1)[2]。Arg1是M2型巨噬细胞的一类标志分子,同时Nrdp1-TG促进小鼠M2型巨噬细胞活化相关基因Fizz1、Ym1和MR的表达。进一步研究发现,Nrdp1通过泛素化调控,介导巨噬细胞M2型极化。本研究体外构建小鼠成纤维细胞与巨噬细胞共培养体系,通过siRNA-Nrdp1靶向干预,观察巨噬细胞极化对成纤维细胞促纤维化因子分泌能力的作用,探讨干预巨噬细胞极化对成纤维细胞增殖、胶原分泌等生物学行为的影响。
1 材料与方法 1.1 实验动物健康无特殊病原体级4 d至1周昆明小鼠(雌雄不限),体质量25~35 g,购自广东省医学实验动物中心,许可证号:SCXK(粤)2018-0002。本研究经暨南大学附属广州市红十字会医院伦理委员会审批通过(〔2017〕-405-01)。
1.2 主要试剂与仪器澳洲胎牛血清、高糖RPMI1640培养基购自美国Gibco公司,兔抗小鼠CD11c单克隆抗体购自天津三箭生物技术股份有限公司,兔抗小鼠CD206、CD68单克隆抗体购自美国Biolegend公司,凝胶配制试剂盒购自上海碧云天生物技术有限公司,兔抗小鼠Nrdp1单克隆抗体购自美国Santa Cruz公司,兔抗小鼠精氨酸酶1、诱导型一氧化氮合酶(iNOS)单克隆抗体购自美国Abcam公司,羊抗兔IgG抗体购于上海帛龙生物科技有限公司,Nrdp1-siRNA购自广州锐博生物科技公司,IL-13购自美国Peprotech公司,LPS购自美国Sigma-Aldrich公司,γ干扰素购自美国R & D systems公司。CCK-8试剂盒来源,倒置相差显微镜购自日本Nikon公司,Transwell共培养小室购于美国Corning公司,二氧化碳(CO2)恒温培养箱购自美国Thermo公司,Mini Protean 3 cell型凝胶电泳仪购自美国Bio-Rad公司。
1.3 成纤维细胞培养无菌条件下取3只断颈处死小鼠尾部尖端组织。用含1%青霉素-链霉素的PBS溶液清洗3次。眼科剪尽可能去掉表皮及脂肪组织,剩余真皮组织再次用PBS溶液漂洗3次。眼科剪剪碎组织至0.3 mm3左右,将碎组织块均匀平铺到底面积25 cm2培养瓶底部,置于37 ℃、5%CO2恒温培养箱中孵育6 h。观察组织块可较好贴附在瓶底后,移液枪加入2 mL高糖RPMI1640培养基(含1%青霉素-链霉素和体积分数20%澳洲胎牛血清),再次放入恒温培养箱孵育24 h。次日移除不贴壁的组织块并更换6 mL新鲜高糖RPMI1640培养基(含1%青霉素-链霉素和体积分数10%澳洲胎牛血清),继续培养,48~72 h换液1次,待细胞融合度>80%时传代。培养72 h,于200倍倒置相差显微镜下观察原代细胞形态。实验选择第4~6代Fb。
1.4 巨噬细胞的培养另取5只小鼠,脱颈处死,体积分数75%乙醇浸泡3 min,腹腔注射5 mL RPMI1640培养基,适度按摩小鼠腹部2~3 min,镊子夹起小鼠下腹皮肤,剪开约1 cm切口,暴露腹膜,20 mL注射器抽取腹腔培养基灌洗液。细胞悬液1 200 r/min离心5 min。用含体积分数10%胎牛血清的RPMI1640培养液重悬,置于直径6 cm培养皿中,于37 ℃、5%CO2培养箱培养24 h,待贴壁1 h后,更换预温RPMI1640培养基,剩下的贴壁细胞为小鼠腹腔巨噬细胞。于200倍倒置相差显微镜下观察原代细胞形态,取原代细胞进行后续实验。
1.5 巨噬细胞的诱导极化 1.5.1 细胞分组及处理取2个批次巨噬细胞,均按随机数字表法分为3组,每组3皿。阴性对照组细胞用高糖RPMI1640培养基培养;LPS组:M1型巨噬细胞(简称M1)用加入终浓度100 ng/mL LPS和20 ng/mL γ干扰素的高糖RPMI1640培养基培养;IL-13组:M2型巨噬细胞(简称M2)用加入终浓度10 ng/mL IL-13的高糖RPMI1640培养基培养。各组细胞均置于37 ℃、5%CO2培养箱中培养24 h后进行后续检测。
1.5.2 流式细胞仪检测细胞表面标记蛋白取1个批次各组细胞,流式细胞仪检测M1、M2表面蛋白。
1.5.3 蛋白质印迹法检测iNOS与精氨酸酶1蛋白表达取1个批次各组细胞,低温条件下提取总蛋白,二辛丁酸法测定各组蛋白浓度。按照凝胶试剂制备盒说明书配制分离胶及浓缩胶,将各组蛋白样品调整至等浓度后上样。取20 μg总蛋白行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,湿法转膜后,加入兔抗鼠精氨酸酶1单克隆一抗(稀释比1 ∶1 000)、兔抗鼠iNOS单克隆一抗(稀释比1 ∶1 000),摇床上4 ℃孵育过夜。加入羊抗兔IgG二抗(稀释比1 ∶2 000),摇床上室温孵育1 h。超敏化学发光试剂盒显影,凝胶成像分析系统进行分析,以β-微管蛋白为内参照,结果以目的蛋白与β-微管蛋白的灰度值比值表示。实验重复3次。
1.6 巨噬细胞的诱导极化及siRNA-Nrdp1转染 1.6.1 细胞分组及处理取巨噬细胞按随机数字表法分为6组,每组2皿。LPS组、IL-13组细胞同1.5.1分别进行诱导;M1-空白对照组(LPS-NC)、M2-空白对照组(IL-13-NC)细胞用空质粒转染48 h后,同1.5.1的M1组、M2组分别进行M1、M2诱导;LPS-siRNA-Nrdp1组、IL-13-siRNA-Nrdp1组细胞用搭载siRNA-Nrdp1的质粒转染48 h后同1.5.1的M1组、M2组分别进行M1、M2诱导。各组细胞均置于37 ℃、5%CO2培养箱中培养24 h后进行后续检测。
1.6.2 蛋白质印迹法检测Nrdp1蛋白表达除一抗为兔抗鼠Nrdp1单克隆抗体(稀释比1 ∶100)外,其余处理同1.5.3。
1.7 诱导及转染后的巨噬细胞与Fb共培养 1.7.1 细胞分组及处理取第4~6代Fb,制备单细胞悬液,以3×105/mL接种于Transwell共培养体系底板内,按随机数字表法分为7组,均放入培养箱(37 ℃、5%CO2)培养。另取巨噬细胞,制备单细胞悬液,同1.5.1分组处理。待Fb贴壁后,将各组巨噬细胞分别加入任意一组Fb所在Transwell共培养体系中上层小室,放入培养箱(37 ℃、5%CO2)培养。培养体系为含有高糖RPMI1640培养基和10%澳洲胎牛血清,培养8、12、24 h进行后续检测。
1.7.2 ELISA法检测细胞培养上清液中TGF-β1、Ⅰ型胶原前体表达收取各组细胞培养上清液,检测TGF-β1、Ⅰ型胶原前体表达,按照TGF-β1、Ⅰ型胶原前体ELISA试剂盒说明书步骤操作,计算各时间点TGF-β1、Ⅰ型胶原前体表达。其中TGF-β1检测时另取Fb,与1.6.1 Fb共培养前处理相同,设为Fb对照组,检测该指标。
1.7.3 CCK-8法检测Fb增殖活力完成1.6.2检测后,将各组共培养体系中上层小室去掉。更换培养基,消化、离心、重悬培养体系底层Fb,取2×104个/mL细胞接种至96孔板,每孔100 μL置于37 ℃、5%CO2细胞培养箱6 h,待细胞贴壁后根据CCK-8试剂盒说明加入试剂。继续培养2 h后酶标仪检测波长450 nm处光密度值[D(450)],以此代表细胞活力。
1.8 统计学分析采用SPSS 13.0统计软件进行分析,数据以x±s表示。采用析因设计的方差分析,组间两两比较采用Bonferroni t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 成纤维细胞及腹腔巨噬细胞形态从小鼠尾部真皮组织原代Fb培养72 h,细胞大小、形态较均一,呈长梭形,见图 1。小鼠原代腹腔巨噬细胞贴壁后为圆形、椭圆或多角形,胞核圆形或椭圆形,见图 2。
|
| 图 1 小鼠原代Fb培养72 h细胞形态(倒置相差显微镜×200) |
|
| 图 2 原代小鼠腹腔巨噬细胞形态(倒置相差显微镜×200) |
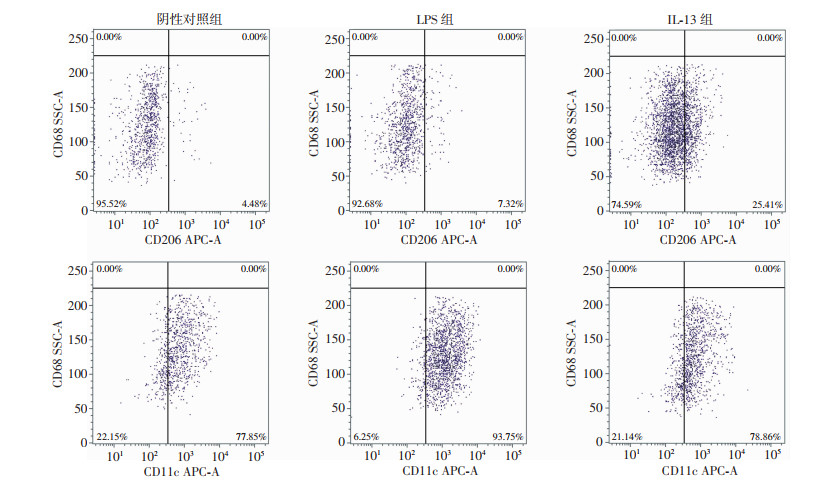
2.2 流式细胞仪检测巨噬细胞表面标记蛋白
结果显示,IL-13组CD206阳性细胞比例(36.66%± 15.56%)较阴性对照组(7.23%±2.57%)显著升高(P < 0.01);同时,IL-13组CD11c阳性细胞比例(89.30%±2.52%)也高于阴性对照组(70.46%±5.60%),差异有统计学意义(P < 0.01)。见图 3。
|
| 图 3 流式细胞仪检测各组CD206(上排)、CD11c(下排)阳性情况 |
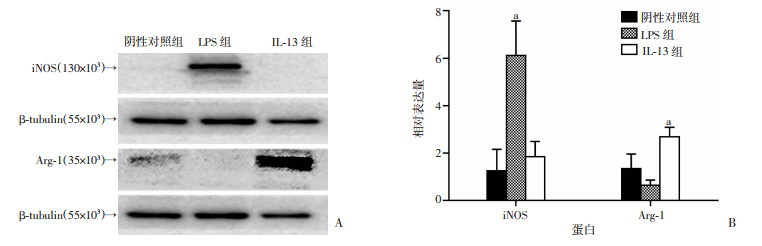
2.3 Western blot检测巨噬细胞亚型M1、M2特异性产物
IL-13组M2特异性产物Arg-1明显高于阴性对照组和LPS组(P < 0.01),同时,LPS组M1型巨噬细胞特异性产物iNOS明显高于阴性对照组和IL-13组(P < 0.01)。见图 4。
|
| A:Western blot检测结果;B:半定量分析结果 a:P < 0.01,与阴性对照组比较 图 4 Western blot检测不同组别iNOS、Arg-1的表达 |
2.4 siRNA-Nrdp1抑制M1、M2相关基因Nrdp1的表达
结果显示,LPS-siRNA-Nrdp1组和IL-13-siRNA-Nrdp1组的Nrdp1表达明显低于对应对照组及NC组(P < 0.01,图 5)。
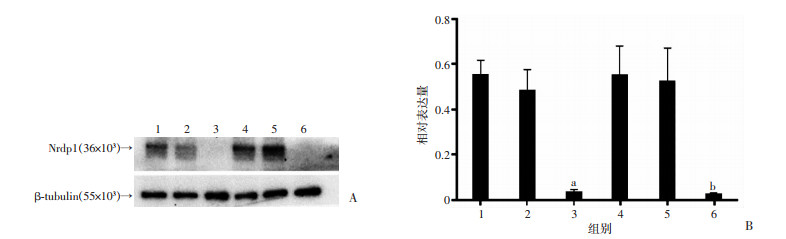
|
| 1:LPS组;2:LPS-NC组;3:LPS-siRNA-Nrdp1组;4:IL-13组;5:IL-13-NC组;6:IL-13-siRNA-Nrdp1组;a:P < 0.01,与LPS组和LPS-NC组比较;b:P < 0.01,与IL-13组和IL-13-NC组比较 图 5 Western blot检测不同组别Nrdp1的表达 |
2.5 ELISA检测各组不同时段共培养体系上清液TGF-β1的表达
结果显示,共培养8 h时,各实验组TGF-β1分泌量差异无统计学意义(P>0.05);共培养12 h时,各实验组TGF-β1分泌量无统计学差异(P>0.05);共培养24 h时,IL-13-siRNA-Nrdp1组TGF-β1分泌量明显低于IL-13组及IL-13-NC组(P < 0.01)。见图 6。
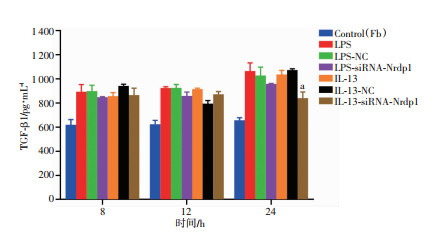
|
| a:P < 0.01,与IL-13组和IL-13-NC组比较 图 6 不同时间点各组TGF-β1含量变化 |
2.6 ELISA检测共培养体系上清液Ⅰ型前胶原的表达
ELISA检测结果显示:共培养8 h时,IL-13-siRNA-组Ⅰ型前胶原分泌量低于IL-13-siRNA-Nrdp1组(P < 0.05);共培养12、24 h时,IL-13组Ⅰ型前胶原分泌量明显低于IL-13-siRNA-Nrdp1组(P < 0.01)。见图 7。
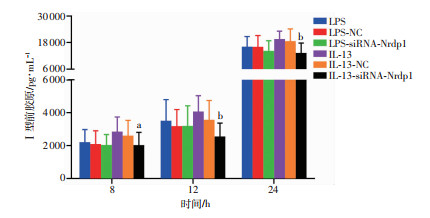
|
| a:P < 0.05,b:P < 0.01,与IL-13组和IL-13-NC组比较 图 7 不同时间点Ⅰ型前胶原含量变化 |
2.7 CCK-8检测成纤维细胞活力
CCK-8检测结果显示:共培养达8 h时,IL-13-siRNA-Nrdp1组与IL-13组Fb增殖活力差异无统计学意义(P>0.05);共培养达12、24 h时,IL-13-siRNA- Nrdp1组Fb增殖活力低于IL-13组(P < 0.05)。见图 8。
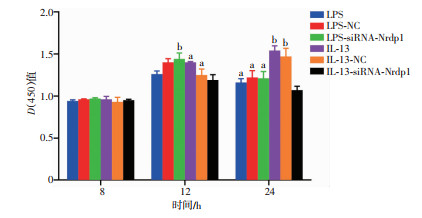
|
| a:P < 0.05,b:P < 0.01,与IL-13-siRNA-Nrdp1组比较 图 8 不同时间点成纤维细胞增殖活力变化 |
3 讨论
在大面积烧伤患者的创面修复期,常见增生性瘢痕组织。对该类患者行血清检测可见TGF-β1分泌高于常人;同时增生性瘢痕组织中TGF-β mRNA表达也明显高于正常皮肤组织及成熟瘢痕,表明TGF-β1的异常高表达是增生性瘢痕形成的重要原因之一[3-4]。TGF-β1是目前公认最重要的促纤维化细胞因子,参与调节细胞外基质的沉积、炎症、细胞分化、生长以及增殖,是一类具有多种功能的细胞因子[5-6]。巨噬细胞在不同外部因素刺激下可分化为不同亚型,目前已知其主要有2种转化激活路径[7],即经典激活途径(M1)及替代激活途径(M2)。有研究发现M2是TGF-β1的重要来源[8]。M2型巨噬细胞是巨噬细胞的一种激活亚型。因此,调控巨噬细胞向M2型转化,对于控制TGF-β1生成,从而影响瘢痕形成有一定意义。本实验中M2诱导组中TGF-β1含量明显高于对照组。
泛素系统由泛素及各类酶组成,主要有E1激活酶、E2共轭酶及E3连接酶。E3连接酶决定了底物的特异性。Nrdp1是一类E3连接酶,已被证实参与泛素化活动[9-10],YE等[2]研究证实Nrdp1具有双向调控巨噬细胞极化的功能。共培养体系可以较好模拟机体内组织间的相互作用,将多种细胞置于同一环境,以研究细胞间复杂的相互反应。本研究采用Transwell共培养,相较单一培养细胞能更准确反映细胞间相互作用情况。本研究结果显示:在巨噬细胞、成纤维细胞的共培养体系中,ELISA检测各组上清液TGF-β1在不同时段分泌量的改变,发现共培养达24 h时,IL-13-siRNA-Nrdp1组TGF-β1分泌量明显低于IL-13组(P < 0.01)。提示通过siRNA干扰Nrdp1的合成从而减少M2型巨噬细胞生成,可减少共培养体系中成纤维细胞TGF-β1分泌量。
增生性瘢痕的形成同成纤维细胞的过度增殖紧密相关,成纤维细胞在TGF-β等作用下分化为富含α-肌动蛋白(α-SMA)的肌成纤维细胞,收缩创面及产生ECM。因此,对增生性瘢痕而言,控制成纤维细胞增殖是抑制瘢痕增生的重要手段。本研究结果显示:共培养达24 h时,IL-13-siRNA-Nrdp1组Fb增殖活力低于LPS组、LPS-NC组及LPS-siRNA-Nrdp1组(P < 0.05),且明显低于IL-13组和IL-13-NC组(P < 0.05)。提示通过siRNA干扰Nrdp1合成调控巨噬细胞向M2型极化,可抑制共培养体系中成纤维细胞增殖。
目前对于增生性瘢痕生物学形成机制学说,大家普遍支持胶原代谢紊乱学说,胶原蛋白的大量合成及Ⅰ、Ⅲ型胶原纤维比例改变是增生性瘢痕形成的重要机制。研究显示创伤愈合早期以Ⅲ型胶原为数量优势,随着修复进行逐渐以Ⅰ型胶原为主,最后Ⅰ型胶原可占创面总胶原的80%~90%。Ⅰ、Ⅲ型胶原比例的改变以及Ⅰ型胶原增多是形成增生性瘢痕的重要原因[11-12]。本研究结果显示,通过siRNA干扰Nrdp1的合成从而影响M2型巨噬细胞极化,可减少共培养体系中成纤维细胞Ⅰ型前胶原的产生。
综上所述,本研究通过siRNA干扰Nrdp1合成,影响巨噬细胞向M2型极化,可抑制共培养体系中成纤维细胞的增殖,减少共培养体系中成纤维细胞TGF-β1及Ⅰ型前胶原的分泌。本研究为小鼠动物实验,需进一步行人体细胞实验,以更确切地探讨增生性瘢痕的临床治疗意义。
| [1] |
FINNERTY C C, JESCHKE M G, BRANSKI L K, et al. Hypertrophic scarring: the greatest unmet challenge after burn injury[J]. Lancet, 2016, 388(10052): 1427-1436. |
| [2] |
YE S, XU H M, JIN J, et al. The E3 ubiquitin ligase neuregulin receptor degradation protein 1 (Nrdp1) promotes M2 macrophage polarization by ubiquitinating and activating transcription factor CCAAT/enhancer-binding Protein β (C/EBPβ)[J]. J Biol Chem, 2012, 287(32): 26740-26748. |
| [3] |
WANG J F, JIAO H, STEWART T L, et al. Fibrocytes from burn patients regulate the activities of fibroblasts[J]. Wound Repair Regen, 2007, 15(1): 113-121. |
| [4] |
KWAN P O, TREDGET E E. Biological principles of scar and contracture[J]. Hand Clin, 2017, 33(2): 277-292. |
| [5] |
LICHTMAN M K, OTERO-VINAS M, FALANGA V. Transforming growth factor beta (TGF-beta) isoforms in wound healing and fibrosis[J]. Wound Repair Regen, 2016, 24(2): 215-222. |
| [6] |
MCKEOWN-LONGO P J, HIGGINS P J. Hyaluronan, transforming growth factor β, and extra domain A-fibronectin: A fibrotic triad[J]. Adv Wound Care, 2021, 10(3): 137-152. |
| [7] |
YUNNA C, MENGRU H, LEI W, et al. Macrophage M1/M2 polarization[J]. Eur J Pharmacol, 2020, 877: 173090. |
| [8] |
MARTIN P, LEIBOVICH S J. Inflammatory cells during wound repair: the good, the bad and the ugly[J]. Trends Cell Biol, 2005, 15(11): 599-607. |
| [9] |
PRINTSEV I, YEN L, SWEENEY C, et al. Oligomerization of the Nrdp1 E3 ubiquitin ligase is necessary for efficient autoubiquitination but not ErbB3 ubiquitination[J]. J Biol Chem, 2014, 289(12): 8570-8578. |
| [10] |
ZHOU C L, LIU Q J, ZHAO W, et al. Nrdp1 increases neuron apoptosis via downregulation of Bruce following intracerebral haemorrhage[J]. J Inflamm Lond Engl, 2019, 16: 24. |
| [11] |
TEJIRAM S, ZHANG J, TRAVIS T E, et al. Compression therapy affects collagen type balance in hypertrophic scar[J]. J Surg Res, 2016, 201(2): 299-305. |
| [12] |
CARNEY B C, LIU Z, ALKHALIL A, et al. Elastin is differentially regulated by pressure therapy in a porcine model of hypertrophic scar[J]. J Burn Care Res, 2017, 38(1): 28-35. |




