脓毒症(sepsis)是一种机体对感染的反应失调引起的威胁生命的器官功能障碍,是严重创伤、烧伤、休克的常见并发症,是目前重症医学科常见的危重症之一[1]。脓毒症发生率高,病死率也居高不下。肺脏是脓毒症后易受损的靶器官之一,在病程早期便可出现急性肺损伤(acute lung injury,ALI),甚至引起呼吸系统功能障碍,导致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),是脓毒症患者死亡的重要病因[2]。肺血管通透性的增加是导致脓毒症后肺损伤的重要原因,寻找治疗脓毒症后肺损伤和肺血管渗漏的方法,对于降低脓毒症的发生率和死亡率具有重要意义。
周细胞(pericyte,PC)是分布于多种微循环系统中的一种具有免疫、分泌和多种分化潜能的细胞[3],是血管的重要组成部分,能通过直接作用或旁分泌信号与内皮细胞产生重要的相互作用[4]。微囊泡(microvesicle,MV)是细胞凋亡或受到刺激后释放的一种微小膜性结构,可携带母细胞来源的生物活性物质。其分子层包膜可以有效避免所运载的生物活性物质被降解,并通过与靶细胞膜受体结合或与靶细胞直接融合的方式传递信息物质[5],在细胞间信息传递中发挥重要作用。有研究表明:外源性周细胞微囊泡(PC derived MV,PC-MV)输注可增加脑梗死小鼠的脑皮层血流灌注,从而促进脑梗死小鼠神经功能的恢复[6]。本科室前期研究发现:周细胞可以通过旁分泌作用分泌微囊泡,对于脓毒症血管反应性和血管通透性具有协同调控和保护作用[7]。那么,PC-MV对脓毒症大鼠的肺功能是否也有保护作用?对此,本研究采用盲肠结扎穿孔术(cecal ligation puncture,CLP)建立脓毒症模型,观察PC-MV对脓毒症大鼠肺血管通透性、肺病理、动脉血气及炎性因子的影响,研究其对脓毒症大鼠肺损伤的保护作用,为脓毒症治疗提供新的方法。
1 材料与方法 1.1 实验动物与试剂成年SPF级SD大鼠,雌雄不拘,12~14周龄,体质量(220±20)g,由陆军特色医学中心实验动物中心提供[动物使用许可证号:SYXK(军)2017-0058],动物饲养与动物实验过程均遵循动物伦理委员会的规定。周细胞专用培养基(pericyte medium)购自美国Science Cell公司,伊文思蓝(Evans blue, EB)购自美国Sigma公司,肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)的酶联免疫吸附试验(ELISA)试剂盒购自南京建成生物工程研究所。
1.2 脓毒症模型的制备与分组大鼠术前禁食12 h,自由饮水。模型制备时腹腔注射戊巴比妥钠(30 mg/kg)麻醉大鼠,使用碘伏腹部消毒,于腹部正中切口暴露盲肠,使盲肠末端粪便充盈,用无菌线结扎盲肠末端0.6 cm处,用三角锥贯穿结扎部位,将盲肠原路放回腹腔,缝合切口并放回笼中,自由饮水。CLP建模12 h后,插管检测大鼠平均动脉血压,血压下降30%或以上,认为模型成功。将40只大鼠按随机数字表法分为4组(n=10):正常(Sham)组、PC-MV对照(Sham+MV)组、脓毒症(sepsis, Sep)组和PC-MV治疗(Sep+MV)组。正常组仅开腹并缝合,不做盲肠穿孔,PC-MV对照组开腹并缝合后立即尾静脉注射PC-MV(1×107/只),脓毒症组在模型建立后不做其他处理,PC-MV治疗组在模型建立后立即尾静脉注射PC-MV(1×107/只)。
1.3 大鼠原代周细胞的提取与培养取初断乳大鼠视网膜,剪碎至细小片状,转入2 g/L的Ⅰ型胶原酶中,放于37 ℃水浴锅消化30 min后,立即加入含有10%FBS的周细胞培养基终止消化。将液体用100目尼龙滤网过滤,收集滤过液体,再用350目尼龙滤网过滤,收集下层细胞,250×g离心10 min,弃去上清液,加入适量周细胞培养基,将沉淀轻轻吹打重悬,转入25 cm3的细胞培养瓶中。待细胞长至80%~90%时消化传代。
1.4 PC-MV的提取与鉴定采用无血清培养基刺激PC,刺激24 h后收集培养基上清,200×g离心15 min(4 ℃),去除残余细胞,取上清2 000×g离心15 min(4 ℃),去除残余细胞碎片,随后取上清16 000×g离心45 min(4 ℃),取沉淀,用PBS洗涤3次后,加入PBS重悬,置于-80 ℃保存备用。取得的PC-MV样品通过透射电镜观察形态,并用流式细胞仪进行鉴定。
1.5 标本采集与观察指标 1.5.1 动脉血气指标CLP 12 h后,取各组大鼠股动脉血1 mL, 以全自动血气分析仪检测动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)、氢离子浓度指数(PH)。
1.5.2 肺组织湿干质量比CLP 12 h后,将大鼠麻醉固定并处死,打开胸腔,取左肺上叶,用滤纸吸干肺组织表面血液,天平称量记录为湿质量;将肺组织放入50 ℃烤箱烘干72 h至肺组织质量不再变化,取出称量记录为干质量,计算肺组织的湿干质量比。
1.5.3 肺组织病理结构观察CLP 12 h后,将大鼠麻醉固定,在大鼠吸气末夹闭气管,打开胸腔,经肺循环灌注PBS直至双肺组织变白,用冷PBS漂洗表面血液,放于4%多聚甲醛溶液中固定。经常规脱水、石蜡包埋、切片、HE染色,光学显微镜下观察肺组织病理结构变化并拍照。
1.5.4 血清炎性因子水平CLP 12 h后,取大鼠股静脉血2 mL,室温下静置20 min,1 000×g离心10 min,取上层血清,采用ELISA试剂盒检测大鼠血清中TNF-α、IL-6的含量。
1.5.5 伊文思蓝测定大鼠肺血管通透性大鼠麻醉固定,经股静脉插管并注射伊文思蓝(20 mg/mL,60 mg/kg),注射30 min后打开胸腔,经肺循环灌注生理盐水直至双肺组织变白,取完整肺组织,观察变化并拍照。
1.6 统计学分析采用SPSS 18.0统计软件,实验数据均以x±s表示,多组间比较采用双因素方差分析,组间两两比较采用LSD-t检验。检验水准:α=0.05。
2 结果 2.1 PC-MV的鉴定使用细胞免疫荧光技术进行周细胞的鉴定,结果显示:周细胞标志性蛋白血小板衍生生长因子β(platelet-derived growth factor receptor beta,PDGFR-β)和神经胶质抗原2(neuron-glia antigen 2,NG2)呈阳性表达(图 1A)。为检测PC-MV对脓毒症大鼠的保护作用,使用超速离心法从PC培养基上清中收集PC-MV,并使用透射电镜及流式细胞仪进行鉴定。透射电镜结果显示(图 1B):PC-MV呈大小不一的球形,直径为100~1 000 nm,具有典型双分子膜性结构,与微囊泡结构一致。流式细胞仪检测结果显示(图 1C):PC-MV表达周细胞阳性标记物NG2和α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA),此外,使用流式标准微珠在侧向散射光(side scatter, SSC)通道设门,可见PC-MV直径为100~1 000 nm,与电镜结果一致。上述结果提示所收集PC-MV纯度较高,可用于后续实验。
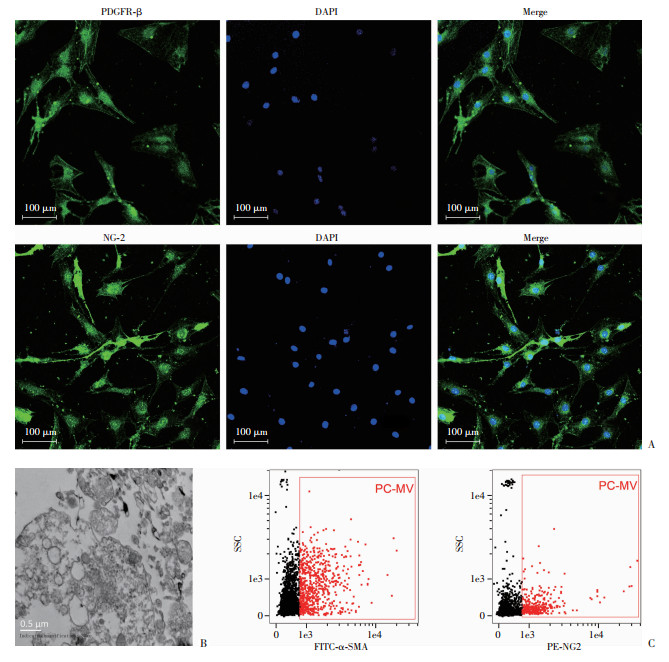
|
| A:荧光显微镜检测周细胞表达PDGFR-β(上)和NG2(下);B:透射电镜观察PC-MV形态;C:流式细胞仪检测PC-MV表达α-SMA(左)、NG2(右) 图 1 定性检测大鼠PC-MV |
2.2 PC-MV对脓毒症肺血管通透性的保护作用
肺湿干质量比结果显示(图 2A):与正常组(Sham)大鼠相比,PC-MV对照组差异无统计学意义,脓毒症大鼠肺湿干质量比显著增加,提示脓毒症后肺水含量显著上升,出现严重的肺水肿。PC-MV处理后大鼠肺湿干质量比显著降低(P < 0.01),表明PC-MV可显著降低脓毒症大鼠肺含水量,改善肺水肿。此外,伊文思蓝透过率结果显示(图 2B):正常组大鼠肺表面光滑、折光度好,仅有少量蓝色斑点,提示正常大鼠肺屏障功能良好,伊文思蓝渗漏极少。脓毒症大鼠肺表面颜色暗淡,有大量伊文思蓝渗出,左下肺呈明显深蓝色,提示脓毒症后大鼠肺血管通透性显著增加。PC-MV处理后,大鼠肺表面色泽明显改善,EB渗漏点大幅减少,提示PC-MV治疗可显著改善脓毒症大鼠肺血管通透性。上述结果表明:PC-MV对脓毒症后肺血管通透性具有保护作用。
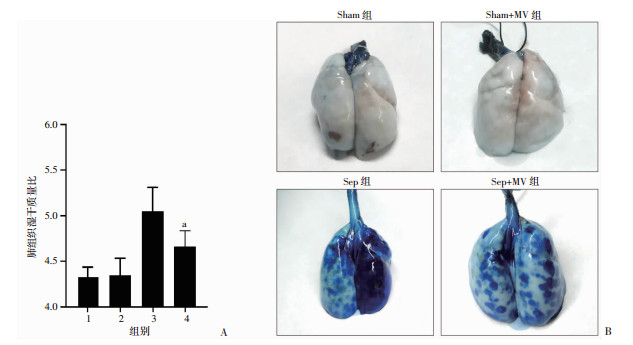
|
| A:肺组织湿干质量比(n=10) 1:Sham组;2:Sham+MV组;3:Sep组;4:Sep+MV组;a:P < 0.01,与Sep组比较;B:伊文思蓝染色检测肺组织血管通透性 图 2 PC-MV对脓毒症大鼠肺血管通透性的保护作用 |
2.3 PC-MV对脓毒症大鼠肺功能的保护作用
各组大鼠肺组织HE染色结果显示(图 3A):正常组(Sham)与PC-MV对照组大鼠肺泡轮廓清晰可见,结构完整,肺泡壁厚度正常,未见红细胞及炎性细胞浸润。脓毒症组肺泡出现大范围破裂,肺泡壁增厚并伴有水肿,有明显的红细胞及炎性细胞浸润现象。PC-MV治疗后,肺泡破裂情况明显减少,肺泡结构显著恢复,肺泡壁厚度降低,红细胞及炎性细胞浸润明显好转,提示PC-MV改善了脓毒症大鼠肺病理损伤。大鼠动脉血气指标结果显示(图 3B~D):与正常组大鼠相比,PC-MV对照组的差异均没有统计学意义;脓毒症后大鼠PaO2和PH均显著降低,PaCO2显著升高;PC-MV处理后,与脓毒症组相比,大鼠PaO2与PH均显著升高,PaCO2显著降低,差异均有统计学意义(P < 0.01)。其余的血气指标数值未做详细计算,不做进一步说明。上述结果表明:脓毒症后大鼠肺功能明显受损,表现为呼吸性酸中毒和低氧血症,PC-MV可显著改善脓毒症大鼠肺病理损伤及动脉血气指标,对肺功能起到良好的保护作用。
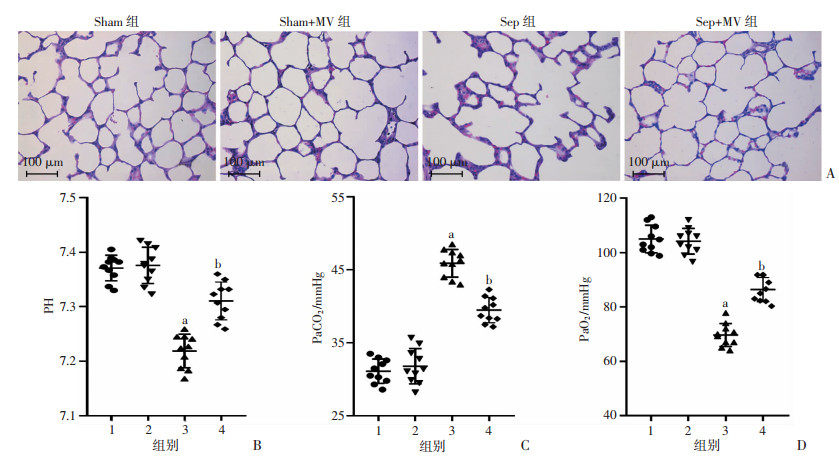
|
| A:大鼠肺病理结构变化(HE);B~D:大鼠动脉血气指标PH、PaCO2、PaO2变化(n=10) 1:Sham组;2:Sham+MV组;3:Sep组;4:Sep+MV组;a:P < 0.01,与Sham组比较;b:P < 0.01,与Sep组比较 图 3 PC-MV对脓毒症肺功能的保护作用 |
2.4 PC-MV对脓毒症炎症反应的作用
大鼠炎性因子变化检测结果显示(图 4):与正常组(Sham)相比,脓毒症组大鼠血清炎性因子TNF-α水平显著增加,增加比例为42.6%,IL-6水平显著增加,增加比例为61.1%(P < 0.01);PC-MV治疗后,TNF-α水平增加比例降为27.4%,IL-6水平增加比例降为22.6%(P < 0.01)。PC-MV对照组与正常组的差异无统计学意义。上述结果表明:脓毒症会引发强烈的全身炎性反应,PC-MV可以明显抑制脓毒症后炎性因子水平的增加,提示PC-MV可以抑制炎性因子的释放,减轻脓毒症后炎症反应。
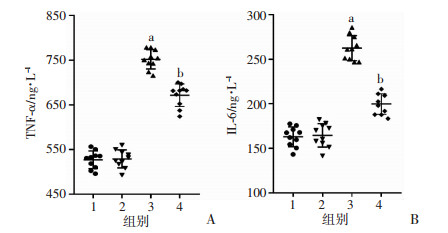
|
| 1:Sham组;2:Sham+MV组;3:Sep组;4:Sep+MV组;a: P < 0.01,与Sham组比较;b:P < 0.01,与Sep组比较 图 4 PC-MV对脓毒症大鼠血清炎性因子TNF-α(A)、IL-6(B)水平的影响(n=10) |
3 讨论
脓毒症是各种创伤、烧伤、缺氧、再灌注损伤及外科大手术常见的并发症之一,早期即可引起急性肺损伤和呼吸系统障碍,严重时可造成多器官功能障碍和脓毒症休克,甚至导致死亡[8]。血管渗漏是脓毒症主要的病理生理过程,肺血管通透性增加,会导致免疫细胞、抗体和补体分子及其他物质从血液进入肺泡,引起肺器官功能损伤[9]。因此,恢复脓毒症后血管功能对于保护肺器官、提高脓毒症的治疗效果具有重要的意义。
周细胞分布于多种微血管系统的内皮细胞与基底膜之间,是血管单位的重要组成部分,在血管发育和血管重构方面发挥重要作用[10]。周细胞参与冠状动脉微循环功能调控,其收缩会导致微循环阻塞,引起心肌缺血再灌注后无复流现象[11]。同时周细胞作为血脑屏障的组成部分,对血脑屏障有双向调节作用[12]。周细胞可以通过旁分泌信号与内皮细胞产生重要的相互作用,与微血管屏障相关疾病密切相关:周细胞可以分泌血管紧张素Ⅰ与内皮细胞的Tie2受体结合,从而促进新生血管成熟和稳定[13];周细胞还可以释放含有BDNF、FGFb、NGF、VEGF和PLGF的MV,其不同的分泌功能可能在调节神经炎症,促进神经修复,刺激神经再生方面起重要作用[14]。本研究结果表明:周细胞释放的MV可以降低脓毒症后肺水含量,对脓毒症肺血管通透性有保护作用。脓毒症后大鼠动脉血气PH和PaO2显著降低,PaCO2显著升高,说明脓毒症后常见呼吸性酸中毒及低氧血症,与急性呼吸窘迫综合征的表征一致。本研究结果表明:PC-MV对上述动脉血气指标均有明显的改善作用,同时可以减轻脓毒症后肺病理损伤程度,说明PC-MV对脓毒症后肺损伤有明显的保护作用。
MV是由脂质双分子层包绕形成的球形膜性囊泡,直径为100~1 000 nm,可在生理刺激或细胞损伤时从母细胞细胞膜以脱落或出芽形式释放。MV具有磷脂双分子层,可以保护内容物在运输过程不被水解[15];同时作为纳米级分子,具有较强的生物屏障穿透能力[16]。与细胞治疗相比,MV具有天然的靶向性,不易蓄积和产生免疫排斥反应[5]。因此,MV的治疗功能已经成为目前研究的热点。此前已有研究发现:间充质干细胞释放的MV可以降低急性肺损伤的肺血管内皮细胞通透性,稳定内皮屏障功能,减少肺部炎症和肺水肿[17-18]。间充质干细胞释放的MV还可以诱导周细胞脱离,刺激内皮细胞增殖,从而促进血管生成[19]。但是,对于周细胞来源的MV作用,相关研究较少。近期有研究发现:PC-MV能通过促进VEGF、Ang-1和N-Cadherin的表达促进脑梗死后血管生成,改善脑梗死小鼠的脑血流灌注[6]。本科室前期的研究发现:PC-MV可通过携带Ang-1、miR-145和miR-132发挥对脓毒症后血管平滑肌细胞收缩功能和血管内皮细胞屏障功能的协同保护作用[7]。
本研究结果表明:PC-MV可以降低脓毒症后肺血管通透性,减轻肺水肿程度,改善肺组织功能,并抑制炎性因子释放,对脓毒症肺损伤有明显的保护作用。但PC-MV是如何发挥对肺血管通透性的保护作用的?其具体机制还需进一步的研究。
| [1] |
CECCONI M, EVANS L, LEVY M, et al. Sepsis and septic shock[J]. Lancet, 2018, 392(10141): 75-87. |
| [2] |
FUJISHIMA S, GANDO S, DAIZOH S, et al. Infection site is predictive of outcome in acute lung injury associated with severe sepsis and septic shock[J]. Respirology, 2016, 21(5): 898-904. |
| [3] |
ATTWELL D, MISHRA A, HALL C N, et al. What is a pericyte?[J]. J Cereb Blood Flow Metab, 2016, 36(2): 451-455. |
| [4] |
CAPORALI A, MARTELLO A, MISCIANINOV V, et al. Contribution of pericyte paracrine regulation of the endothelium to angiogenesis[J]. Pharmacol Ther, 2017, 171: 56-64. |
| [5] |
ABREU S C, WEISS D J, ROCCO P R. Extracellular vesicles derived from mesenchymal stromal cells: a therapeutic option in respiratory diseases?[J]. Stem Cell Res Ther, 2016, 7(1): 53. |
| [6] |
WANG Q, WEI J, SHI Y. Platelet microvesicles promote the recovery of neurological function in mouse model of cerebral infarction by inducing angiogenesis[J]. Biochem Biophys Res Commun, 2019, 513(4): 997-1004. |
| [7] |
张紫森. 周细胞对脓毒症大鼠血管舒缩和屏障功能的协同保护作用及机制[D]. 重庆: 陆军军医大学, 2019. DOI: 10.27001/d.cnki.gtjyu.2019.000165. ZHANG Z S. The synergistic protection of pericyte on vascular reactivity and vascular permeability after sepsis and its mechanism[D]. Chongqing: Army Medical University, 2019. DOI: 10.27001/d.cnki.gtjyu.2019.000165. |
| [8] |
SHARAWY N, LEHMANN C. New directions for sepsis and septic shock research[J]. J Surg Res, 2015, 194(2): 520-527. |
| [9] |
ARMSTRONG S M, MUBAREKA S, LEE W L. The lung microvascular endothelium as a therapeutic target in severe influenza[J]. Antiviral Res, 2013, 99(2): 113-118. |
| [10] |
RÓZYCKA J, BRZÓSKA E, SKIRECKI T. Aspects of pericytes and their potential therapeutic use[J]. Postepy Hig Med Dosw (Online), 2017, 71(0): 186-197. |
| [11] |
O'FARRELL F M, MASTITSKAYA S, HAMMOND-HALEY M, et al. Capillary pericytes mediate coronary no-reflow after myocardial ischaemia[J]. Elife, 2017, 6: e29280. |
| [12] |
殷孟兰, 袁庆, 徐耀, 等. 周细胞对脑卒中后损伤及修复作用的研究现状[J]. 中国临床药理学杂志, 2019, 35(23): 3125-3128, 3133. YIN M L, YUAN Q, XU Y, et al. Research status of pericytes on stroke injury and repair[J]. Chin J Clin Pharmacol, 2019, 35(23): 3125-3128, 3133. |
| [13] |
CHAKROBORTY D, SARKAR C, YU H, et al. Dopamine stabilizes tumor blood vessels by up-regulating angiopoietin 1 expression in pericytes and Kruppel-like factor-2 expression in tumor endothelial cells[J]. Proc Natl Acacl Sci USA, 2011, 108(51): 20730-20735. |
| [14] |
GACEB A, ÖZEN I, PADEL T, et al. Pericytes secrete pro-regenerative molecules in response to platelet-derived growth factor-BB[J]. J Cereb Blood Flow Metab, 2018, 38(1): 45-57. |
| [15] |
EL-ANDALOUSSI S, LAKHAL S, MäGER I, et al. Exosomes for targeted siRNA delivery across biological barriers[J]. Adv Drug Deliv Rev, 2013, 65(3): 391-397. |
| [16] |
JIANG X C, GAO J Q. Exosomes as novel bio-carriers for gene and drug delivery[J]. Int J Pharm, 2017, 521(1/2): 167-175. |
| [17] |
HU S, PARK J, LIU A, et al. Mesenchymal stem cell microvesicles restore protein permeability across primary cultures of injured human lung microvascular endothelial cells[J]. Stem Cells Transl Med, 2018, 7(8): 615-624. |
| [18] |
WANG H, ZHENG R, CHEN Q, et al. Mesenchymal stem cells microvesicles stabilize endothelial barrier function partly mediated by hepatocyte growth factor (HGF)[J]. Stem Cell Res Ther, 2017, 8(1): 211. |
| [19] |
BELTRAMO E, LOPATINA T, BERRONE E, et al. Extracellular vesicles derived from mesenchymal stem cells induce features of diabetic retinopathy in vitro[J]. Acta Diabetol, 2014, 51(6): 1055-1064. |




