代谢综合征(metabolism syndrome,MS)是一组以中心性肥胖、糖代谢异常、高血压、血脂异常等多种危险因素在个体聚集为特点的代谢紊乱症候群[1]。研究表明MS与心血管疾病(cardiovascular diseases,CVD)和糖尿病发病密切相关,可显著增加CVD死亡风险和总死因死亡风险[2]。既往研究提示MS与动脉硬化风险增加密切相关[3-4],认为动脉硬化可能是MS导致CVD的中间环节[5]。MS包括中心性肥胖、高血压、高血糖、甘油三酯(triglycerides,TG)升高和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)降低5个组分[6-7]。关于MS各个组分对动脉硬化的影响结论不一,国内一项研究对5181名40岁以上研究对象的体检资料分析发现,除中心性肥胖外,其余MS组分对动脉硬化均有显著影响[8]。而日本一项队列研究结果则提示TG升高和HDL-C降低对动脉硬化也无显著影响[9]。此外,MS及其组分与动脉硬化的相关性在不同性别中可能存在差异[10-11]。肱踝脉搏波传导速度(brachia-ankle pulse wave velocity,baPWV)是评价动脉硬化的早期敏感指标[12],其效度和信度在既往研究中已得到证实[13]。baPWV值越大,说明动脉硬化程度越高[12]。本研究将以baPWV作为动脉硬化的评价指标,在我国人群中进一步探讨MS及其组分与动脉硬化的相关性,并分析其性别差异。
1 资料与方法 1.1 研究对象本研究采用横断面研究设计,基于一项慢性病综合控制和病因研究项目[14],以北京市房山区周口店等9个乡镇为调查现场,选取该项目2013-2017年间的基线调查数据。研究对象纳入标准:(1)汉族;(2)年龄≥18岁;(3)签署知情同意书。排除标准:(1)有重大疾病或严重慢性病者,如恶性肿瘤、严重肝肾疾病等;(2)行动不便不能配合调查者;(3)baPWV、MS相关指标等关键变量缺失者。本研究已通过北京大学生物医学伦理委员会审查批准(IRB00001052-07056)。
1.2 研究内容与方法 1.2.1 调查内容与资料收集本研究调查内容包括问卷调查、体格检查和血生化检测。采用标准调查问卷收集研究对象的一般人口学资料、行为生活习惯和疾病史等信息。体格检查由经统一培训的专业人员进行,包括身高、体质量、腰围(waist circumference,WC)、臀围、收缩压(SBP)和舒张压(DBP)等。所有体格检查指标均以3次重复测量平均值为最终测量值。
使用日本欧姆龙公司的BP-203RPE Ⅲ全自动动脉硬化检测仪测量baPWV。测量时需研究对象安静平躺3min,将与体积描记和压力感知传感器相连的袖带捆绑于双侧踝关节和上臂肘关节处,测量肱动脉、胫后动脉脉搏波。baPWV的计算方法为:踝、肘关节测量点间距离除以2次脉搏波之间的时间差。本研究以研究对象左、右侧身体baPWV平均值作为最终测量值。
血生化检测指标包括:空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、TG、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和HDL-C。具体检测方法详见基于本研究人群的其他研究[15]。
1.2.2 相关指标定义吸烟定义为现在或曾经每日至少吸烟1支,且至少持续1年;饮酒定义为现在或曾经每周至少饮酒1次,且至少持续1年;规律活动定义为体力劳动或锻炼每周至少3次,且每次持续时间至少0.5 h。MS采用中华医学会糖尿病学分会2017年修订版标准[7],即具备以下3项及以上:①中心性肥胖:男性WC≥90 cm,女性WC≥85 cm;②高血糖:FPG≥6.1 mmol/L,或餐后2 h血糖≥7.8 mmol/L,或已确诊为糖尿病并接受治疗者;③高血压:SBP≥130 mmHg或DBP≥85 mmHg,或已确诊为高血压并接受治疗者;④TG升高:TG≥1.7 mmol/L;⑤HDL-C降低:HDL-C < 1.04 mmol/L。MS组分数为研究对象具有上述5种代谢异常组分的数量。基于既往研究关于动脉硬化的定义[15-16],本研究将baPWV≥1 700 cm/s[17]定义为动脉硬化。
1.3 统计学分析数据录入使用Epi Data 3.1软件平行双录入,数据清理和统计分析采用Stata 14.0软件。定性资料以例数和百分比[n(%)]表示,组间比较采用Pearson χ2检验。定量资料中正态分布数据以x±s表示,组间比较采用t检验或方差分析;非正态分布数据以中位数和四分位数[M(P25, P75)]表示,组间比较采用Wilcoxon秩和检验或Kruskal-Wallis秩和检验。不同MS组分数组间的动脉硬化患者占比的趋势分析采用趋势卡方检验,baPWV的趋势分析采用简单线性回归。采用多因素Logistic回归模型分析MS及其组分与动脉硬化的相关性,并计算OR值及其95%置信区间(CI)。采用似然比(likelihood-ratio,LR)检验分析MS及其组分与动脉硬化相关性的性别差异。所有检验均为双侧检验,检验水准α=0.05。
2 结果 2.1 基本特征根据纳入和排除标准,共纳入6 737名研究对象,年龄(57.5±10.3)岁,其中男性3 196(47.4%)人。MS患者年龄显著高于非患者[(58.3±9.6)岁vs (56.1±11.5)岁,P < 0.001],男性占比显著低于非患者(45.3% vs 51.3%,P < 0.001)。此外,除家庭人均月收入、婚姻状况外,MS患者与非患者间其他人口学特征差异均有统计学意义(P < 0.05)。除TC和LDL-C外,MS患者与非患者间其他体格检查和血生化指标差异均有统计学意义(P < 0.05)。见表 1。
| 特征 | 总体(n=6 737) | MS(n=4 340) | 非MS(n=2 397) | t/z/χ2 | P值 |
| 年龄/岁 | 57.5±10.3 | 58.3±9.6 | 56.1±11.5 | 8.2 | < 0.001 |
| 男性 | 3196(47.4) | 1 967(45.3) | 1 229(51.3) | 21.9 | < 0.001 |
| 教育程度初中及以上 | 3 957(58.7) | 2 456(56.6) | 1 501(62.6) | 23.2 | < 0.001 |
| 家庭人均月收入≥800元a | 1 784(28.1) | 1 159(28.3) | 625(27.8) | 0.2 | 0.629 |
| 在婚 | 5 904(87.6) | 3 818(88.0) | 2 086(87.0) | 1.3 | 0.258 |
| 吸烟 | 2 976(44.2) | 1 869(43.1) | 1 107(46.2) | 6.1 | 0.014 |
| 饮酒 | 2 371(35.2) | 1 432(33.0) | 939(39.2) | 25.8 | < 0.001 |
| 规律活动a | 3 411(51.8) | 2 308(54.1) | 1 103(47.4) | 27.7 | < 0.001 |
| 睡眠时长≥7 h/da | 4 908(75.3) | 3 209(76.4) | 1 699(73.2) | 8.3 | 0.004 |
| WC/cm | 91.7±9.5 | 95.2±8.1 | 85.3±8.5 | 47.2 | < 0.001 |
| BMI/kg·m-2 | 26.1±3.6 | 27.2±3.3 | 24.2±3.2 | 35.5 | < 0.001 |
| TC/mmol·L-1 | 3.1±0.9 | 3.1±1.0 | 3.1±0.9 | 0.8 | 0.428 |
| TG/mmol·L-1 | 1.3(0.8, 1.9) | 1.6(1.0, 2.3) | 0.9(0.7, 1.3) | 31.6 | < 0.001 |
| HDL-C/mmol·L-1 | 0.9±0.3 | 0.8±0.3 | 1.1±0.3 | 32.3 | < 0.001 |
| LDL-C/mmol·L-1 | 2.2±0.8 | 2.2±0.9 | 2.2±0.8 | 0.6 | 0.572 |
| SBP/mmHg | 137.5±19.7 | 140.5±19.0 | 131.9±19.9 | 17.7 | < 0.001 |
| DBP/mmHg | 81.1±11.4 | 82.5±11.4 | 78.6±11.1 | 13.3 | < 0.001 |
| FPG/mmol/L | 5.2(4.4, 6.6) | 5.6(4.6, 7.4) | 4.8(4.2, 5.4) | 22.3 | < 0.001 |
| baPWV/cm·s-1 | 1 634(1 432, 1879) | 1 680(1 493, 1 930) | 1 521(1 344, 1 770) | 18.5 | < 0.001 |
| a: 数据有缺失 | |||||
2.2 动脉硬化和MS及其组分患病情况
所有研究对象中位baPWV为1 634(1 432, 1 879)cm/s,动脉硬化患者占41.7%,女性中动脉硬化患病率显著高于男性(42.8% vs 40.3%,P=0.037)。MS患者占64.4%,女性中MS患病率显著高于男性(67.0% vs 61.6%,P < 0.001)。MS各个组分,即中心性肥胖、高血压、高血糖、TG升高和HDL-C降低患病率分别为69.1%、76.6%、43.3%、31.6%和68.2%,女性中心性肥胖、高血糖和TG升高患病率均显著高于男性(P < 0.001),而高血压和HDL-C降低患病率则显著低于男性(P < 0.05)。见表 2。
| 项目 | 总体(n=6 737) | 男性(n=3 196) | 女性(n=3 541) | χ2 | P值 |
| 动脉硬化 | 2 806(41.7) | 1 289(40.3) | 1 517(42.8) | 4.4 | 0.037 |
| MS | 4 340(64.4) | 1 967(61.6) | 2 373(67.0) | 21.9 | < 0.001 |
| MS组分 | |||||
| 中心性肥胖 | 4 658(69.1) | 2 000(62.6) | 2 658(75.1) | 122.7 | < 0.001 |
| 高血压 | 5 162(76.6) | 2 486(77.8) | 2 676(75.6) | 4.6 | 0.032 |
| 高血糖 | 2 920(43.3) | 1 256(39.3) | 1 664(47.0) | 40.5 | < 0.001 |
| TG升高 | 2 128(31.6) | 916(28.7) | 1 212(34.2) | 24.1 | < 0.001 |
| HDL-C降低 | 4 594(68.2) | 2 290(71.7) | 2 304(65.1) | 33.6 | < 0.001 |
2.3 不同MS及其组分患病特征研究对象动脉硬化患病情况比较
MS患者和非患者中动脉硬化患病率分别为47.7%和30.7%,差异有统计学意义(P < 0.001)。男性和女性中,MS患者动脉硬化患病率均显著高于非患者(P < 0.001)。见表 3。
| 项目 | 总体 | 男性 | 女性 | ||||||||
| n(%) | χ2 | P值 | n(%) | χ2 | P值 | n(%) | χ2 | P值 | |||
| MS | |||||||||||
| 是 | 2 071(47.7) | 184.8 | < 0.001 | 862(43.8) | 25.9 | < 0.001 | 1 209(51.0) | 193.1 | < 0.001 | ||
| 否 | 735(30.7) | 427(34.7) | 308(26.4) | ||||||||
| MS组分 | |||||||||||
| 中心性肥胖 | |||||||||||
| 是 | 2 007(43.1) | 12.8 | < 0.001 | 796(39.8) | 0.6 | 0.428 | 1 211(45.6) | 32.2 | < 0.001 | ||
| 否 | 799(38.4) | 493(41.2) | 306(34.7) | ||||||||
| 高血压 | |||||||||||
| 是 | 2 608(50.5) | 715.2 | < 0.001 | 1 201(48.3) | 296.0 | < 0.001 | 1 407(52.6) | 424.2 | < 0.001 | ||
| 否 | 198(12.6) | 88(12.4) | 110(12.7) | ||||||||
| 高血糖 | |||||||||||
| 是 | 1 485(50.9) | 179.7 | < 0.001 | 583(46.4) | 31.8 | < 0.001 | 902(54.2) | 165.6 | < 0.001 | ||
| 否 | 1 321(34.6) | 706(36.4) | 615(32.8) | ||||||||
| TG升高 | |||||||||||
| 是 | 979(46.0) | 24.3 | < 0.001 | 372(40.6) | 0.0a | 0.838 | 607(50.1) | 39.5 | < 0.001 | ||
| 否 | 1 827(39.6) | 917(40.2) | 910(39.1) | ||||||||
| HDL-C降低 | |||||||||||
| 是 | 1 921(41.8) | 0.2 | 0.688 | 921(40.2) | 0.0b | 0.836 | 1 000(43.4) | 0.9 | 0.357 | ||
| 否 | 885(41.3) | 368(40.6) | 517(41.8) | ||||||||
| a: 确切数值为0.042;b: 确切数值为0.043 | |||||||||||
所有研究对象中,除HDL-C降低外,其余MS组分患者动脉硬化患病率均显著高于非患者(P < 0.001)。在男性中,仅高血压和高血糖患者动脉硬化患病率显著高于非患者(P < 0.001);在女性中,除HDL-C降低外,其余MS组分患者动脉硬化患病率均显著高于非患者(P < 0.001)。见表 3。
所有研究对象中,MS组分数从0至5者中动脉硬化患病率逐渐升高(P < 0.001),分别为4.9%、30.3%、34.5%、40.7%、52.2%和60.5%。男性和女性中均呈现类似趋势(P < 0.001)。见图 1。
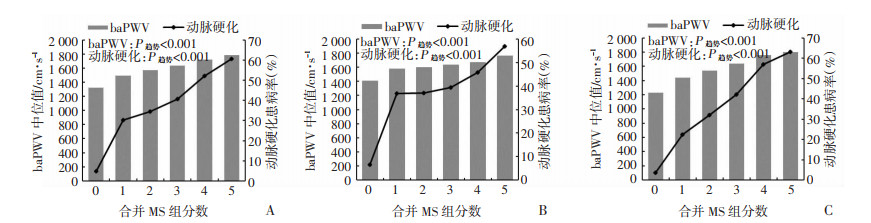
|
| A:总体人群;B:男性人群;C:女性人群 图 1 不同代谢综合征组分数研究对象的baPWV和动脉硬化情况 |
2.4 MS及其组分与动脉硬化的多因素Logistic回归分析
在调整年龄、性别、受教育程度、婚姻、收入、吸烟、饮酒、体力活动、睡眠和BMI后,MS患者动脉硬化风险是非患者的2.36倍(95% CI: 2.06~2.71, P < 0.001)。MS与动脉硬化的相关性在女性中强于男性,OR值分别为2.71 (95% CI: 2.22~3.30, P < 0.001)和2.03 (95% CI: 1.67~2.48, P < 0.001),差异具有统计学意义(P=0.023)。见表 4。
| 项目 | 总体 | 男性 | 女性 | |||||
| OR(95%CI) | P值 | OR(95%CI) | P值 | OR(95%CI) | P值 | |||
| MS | 2.36(2.06, 2.71) | < 0.001 | 2.03(1.67, 2.48) | < 0.001 | 2.71(2.22, 3.30) | < 0.001 | ||
| MS组分 | ||||||||
| 中心性肥胖 | 1.22(1.03, 1.44) | 0.018 | 1.12(0.89, 1.41) | 0.346 | 1.32(1.04, 1.69) | 0.025 | ||
| 高血压 | 5.84(4.86, 7.01) | < 0.001 | 5.60(4.28, 7.34) | < 0.001 | 6.10(4.75, 7.85) | < 0.001 | ||
| 高血糖 | 1.91(1.69, 2.16) | < 0.001 | 1.67(1.40, 2.00) | < 0.001 | 2.09(1.76, 2.48) | < 0.001 | ||
| TG升高 | 1.42(1.24, 1.62) | < 0.001 | 1.38(1.13, 1.69) | 0.002 | 1.46(1.22, 1.75) | < 0.001 | ||
| HDL-C降低 | 0.97(0.85, 1.10) | 0.616 | 1.08(0.88, 1.31) | 0.466 | 0.90(0.75, 1.07) | 0.236 | ||
| MS组分数 | 1.62(1.53, 1.72) | < 0.001 | 1.55(1.43, 1.69) | < 0.001 | 1.69(1.56, 1.83) | < 0.001 | ||
| Logistic回归分析仅纳入所有变量信息完整者6009人;调整年龄、性别(男、女)、受教育程度(小学及以下、初中及以上)、婚姻状况(在婚、非在婚)、人均月收入水平(< 800元、≥800元)、吸烟(是、否)、饮酒(是、否)、体力活动情况(规律、不规律)、睡眠时长(< 7 h/d、≥7 h/d)和BMI | ||||||||
所有研究对象中,除HDL-C降低外,其余组分均与动脉硬化显著相关,相关性由大到小依次为高血压(OR=5.84, 95% CI: 4.86~7.01, P < 0.001)、高血糖(OR=1.91, 95%CI: 1.69~2.16, P < 0.001)、TG升高(OR=1.42, 95%CI: 1.24~1.62, P < 0.001)和中心性肥胖(OR=1.22, 95%CI: 1.03~1.44, P=0.018)。在男性中,中心性肥胖和HDL-C降低与动脉硬化之间无显著相关性;在女性中,仅HDL-C降低与动脉硬化之间无显著相关性。见表 4。
所有研究对象中,动脉硬化风险随MS组分数增加而升高,MS组分数每增加1项,动脉硬化风险是原来的1.62倍(95%CI:1.53~1.71,P < 0.001)。MS组分数增加对动脉硬化的影响在男性和女性中的OR值分别为1.55(95%CI:1.43~1.69,P < 0.001)和1.68(95%CI:1.55~1.82,P < 0.001),差异无统计学意义。见表 4。
3 讨论本研究基于6 797名北方农村居民资料,探讨MS及其组分与动脉硬化的相关性,并分析其性别差异。结果显示MS与动脉硬化风险增加显著相关,但各个组分对动脉硬化的影响不同。此外,MS及其各组分与动脉硬化的相关性在男女中存在差异。
本研究发现MS患者动脉硬化风险是非患者的2.41倍,与既往研究基本一致[3, 8]。朱文华等[3]对浙江省9 201名研究对象体检资料分析发现,MS患者动脉硬化风险是非患者的2.6倍。台湾一项队列研究对1 518名社区居民随访3年后发现,MS患者动脉硬化风险是非患者的1.52倍[18]。国外研究同样发现MS与动脉硬化风险增加密切相关[19-20]。目前认为胰岛素抵抗(高胰岛素血症)可能是MS导致动脉硬化的核心环节。高胰岛素血症可促进胶原蛋白合成,并刺激血管平滑肌细胞增生和肥大[21],或通过干扰血管舒缩物质的产生而导致动脉扩张性下降,增加动脉硬度[22]。此外,高胰岛素血症可引起机体一系列炎症反应,产生氧化应激、破坏凝血和纤溶平衡,引起糖、脂等多种代谢紊乱,促进动脉粥样硬化形成[23]。
本研究结果显示除HDL-C降低外,其余组分均与动脉硬化显著相关,其中高血压的相关性最强,这与WENG等[24]、陆骆等[25]研究结果一致。高血压可增加血流机械应力,直接作用于血管壁,导致动脉内膜受损、血管顺应性下降,引起炎症反应、纤维细胞和平滑肌细胞增生等病理生理反应,进而诱发动脉硬化[26]。HDL-C被认为是动脉硬化的保护因子,具有抗氧化应激、促进损伤内皮修复以及减少细胞因子表达等作用[27-28],可抑制动脉粥样斑块形成,HDL-C降低可使动脉硬化风险升高[28]。然而本研究并未发现HDL-C降低与动脉硬化间的相关性。LI等[18]和GOMEZ-SANCHEZ等[19]研究中同样未发现此相关性,而王安心等[8]研究则显示HDL-C降低可使动脉硬化风险升高0.48倍。既往研究提示HDL-C对CVD的影响不能仅通过其水平来评估[29],还应考虑其大小等因素[30]。本研究并未对不同HDL-C亚类进行分析,这可能是未发现HDL-C与动脉硬化相关的原因。既往一些研究还发现中心性肥胖和/或TG升高对动脉硬化无影响[8, 18-19]。但本研究结果显示中心性肥胖和TG升高与动脉硬化间均显著相关,翁春燕等[24]和陆骆等[25]研究也有此发现。研究表明中心性肥胖可通过脂肪酸沉积于胰岛β细胞等多种途径造成高胰岛素血症,进而导致动脉硬化[31]。血液中TG升高时,脂质交换活跃,造成LDL-C增多、HDL-C减少,导致血管内皮损伤、功能失调,形成动脉粥样斑块[27]。总之,现有研究关于MS各个组分与动脉硬化的相关性结论不一,研究人群特征、MS及其组分定义以及动脉硬化衡量方式的不同可能是导致上述争议的原因,尚需进一步的研究探明MS各组分与动脉硬化间的关系。
本研究发现相较于男性,MS与动脉硬化的相关性在女性中更强。既往研究也发现了这一性别差异。陈丽英等[11]对8599名研究对象体检资料分析发现,女性中MS患者baPWV升高风险是非患者的3倍,而男性中为2.6倍。日本一项研究结果显示,在调整多项混杂因素后,女性中MS患者动脉硬化风险是非患者的8.02倍,而男性中仅3.65倍[20]。目前尚无明确机制解释这种性别差异,可能与男女激素水平有关。研究表明雌激素可促进糖脂代谢[32],睾酮可降低体内脂肪组织沉积[33],均对动脉血管有一定保护作用,而随年龄增长,男女性激素水平下降,但女性雌激素水平下降速度更快[34-35],而男性睾酮水平下降则相对平缓[33],对动脉血管的保护作用减弱较慢。此外,研究表明男女性动脉血管的力学特性存在差异,女性血管的基础状态优于男性[36]。其次,男性通常具备更多的心血管危险因素,例如吸烟、饮酒和不规律饮食等[37]。这两方面的原因导致在MS发生之前,男性动脉硬化程度可能已经高于女性,因此MS对其动脉硬化的相对影响更小。
本研究还发现MS各个组分对动脉硬化的影响存在性别差异,女性中仅HDL-C降低对动脉硬化无显著影响,而男性中HDL-C降低和中心性肥胖均无显著影响。既往研究中同样提示中心性肥胖与动脉硬化的相关性在男女间存在差异[24],可能与女性内脏脂肪脂解产生的游离脂肪酸向肝脏的输送量更大有关[38]。既往研究关于MS各个组分与动脉硬化的相关性在不同性别间的差异结论不一。湖南一项研究[39]显示女性中MS所有组分均与动脉硬化显著相关,而男性中HDL-C降低、TG升高和中心性肥胖则无显著相关。而河北一项研究则发现女性中TG升高和中心性肥胖与动脉硬化无显著相关,而男性中仅HDL-C降低无显著相关[8]。既往研究提示MS各组分对动脉硬化影响的性别差异与年龄有关,在20~39岁人群中与动脉硬化显著相关的MS组分在男性中更多,在40~59岁人群中在女性中更多,而在60~79岁人群中则相差不大[24]。研究对象年龄特征不同可能是导致上述研究结论不一的原因,尚需进一步大样本研究探明。
本研究以北京市房山区农村居民为研究对象,探究MS及其组分与动脉硬化的相关性,增加了北方农村人群中的流行病学证据。其次,研究各环节进行严格质量控制,分析过程控制多种混杂因素,结果可靠性较高,具有一定的科学价值和公共卫生意义,提示应加强对人群MS的监测和管理,这将有助于及早发现和预防动脉硬化,进而延缓CVD的发生,对防治CVD具有重要意义。但本研究也存在一定的局限性。首先,MS和动脉硬化的诊断均基于一次调查数据,且动脉硬化诊断仅采用baPWV一种指标,可能存在错分偏倚。其次,房山区为CVD高发地区[14],动脉硬化和MS患病率较高,研究结果外推至CVD风险较低人群时受一定限制。最后,本研究为横断面设计,因果推断能力不足,结果尚需长期队列研究进一步证实。
| [1] |
Expert Panel on Detection E. Executive summary of the third report of the national cholesterol education program (NCEP) expert panel on detection, evaluation, and treatment of high blood cholesterol in adults (adult treatment panel Ⅲ)[J]. JAMA, 2001, 285(19): 2486-2497. |
| [2] |
ECKEL R H, ALBERTI K G, GRUNDY S M, et al. The metabolic syndrome[J]. Lancet, 2010, 375(9710): 181-183. |
| [3] |
朱文华, 陈丽英, 卢崇蓉, 等. 代谢综合征组分异常积聚与肱踝动脉脉搏波传导速度的关系[J]. 中华心血管病杂志, 2018, 46(10): 810-817. ZHU W H, CHEN L Y, LU C R, et al. Association between the accumulation of metabolic syndrome abnormal components and arterial pulse wave velocity among adult individuals undergoing routine health examination[J]. Chin J Cardiol, 2018, 46(10): 810-817. |
| [4] |
CUSPIDI C, SALA C, TADIC M, et al. Association of metabolic syndrome with carotid thickening and plaque in the general population: a meta-analysis[J]. J Clin Hypertens (Greenwich), 2018, 20(1): 4-10. |
| [5] |
STEHOUWER C D, HENRY R M, FERREIRA I. Arterial stiffness in diabetes and the metabolic syndrome: a pathway to cardiovascular disease[J]. Diabetologia, 2008, 51(4): 527-539. |
| [6] |
ALBERTI K G, ZIMMET P, SHAW J, et al. The metabolic syndrome: a new worldwide definition[J]. Lancet, 2005, 366(9491): 1059-1062. |
| [7] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J]. 中华糖尿病杂志, 2018, 10(1): 4-67. Chinese Diabetes Society of Chinese Medical Association. Guidelines for the prevention and control of type 2 diabetes in China (2017 Edition)[J]. Chin J Diabetes Mellit, 2018, 10(1): 4-67. |
| [8] |
WANG A X, SU Z P, LIU X X, et al. Brachial-ankle pulse wave velocity and metabolic syndrome in general population: the APAC study[J]. BMC Cardiovasc Disord, 2016, 16(1): 1-10. |
| [9] |
TOMIYAMA H, HIRAYAMA Y, HASHIMOTO H, et al. The effects of changes in the metabolic syndrome detection status on arterial stiffening: a prospective study[J]. Hypertens Res, 2006, 29(9): 673-678. |
| [10] |
CHEN L, ZHU W, MAI L, et al. The association of metabolic syndrome and its components with brachial-ankle pulse wave velocity in South China[J]. Atherosclerosis, 2015, 240(2): 345-350. |
| [11] |
KIM H L, LEE J M, SEO J B, et al. The effects of metabolic syndrome and its components on arterial stiffness in relation to gender[J]. J Cardiol, 2015, 65(3): 243-249. |
| [12] |
ZHANG L, YIN J K, DUAN Y Y, et al. Evaluation of carotid artery elasticity changes in patients with type 2 diabetes[J]. Cardiovasc Diabetol, 2014, 13: 39. |
| [13] |
YAMASHINA A, TOMIYAMA H, TAKEDA K, et al. Validity, reproducibility, and clinical significance of noninvasive brachial-ankle pulse wave velocity measurement[J]. Hypertens Res, 2002, 25(3): 359-364. |
| [14] |
王梦莹, 唐迅, 秦雪英, 等. 北方农村地区居民常见慢性非传染性疾病的家系队列研究进展[J]. 中华流行病学杂志, 2018, 39(1): 94-97. WANG M Y, TANG X, QIN X Y, et al. Progress in research of family-based cohort study on common chronic non-communicable diseases in rural population in Northern China[J]. Chin J Epidemiol, 2018, 39(1): 94-97. |
| [15] |
孙可欣, 刘志科, 曹亚英, 等. 北京某社区2型糖尿病患者血糖控制情况与肱踝脉搏波传导速度的相关性研究[J]. 北京大学学报(医学版), 2015, 47(3): 431-436. SUN K X, LIU Z K, CAO Y Y, et al. Relationship between brachial-ankle pulse wave velocity and glycemic control of type 2 diabetes mellitus patients in Beijing community population[J]. J Peking Univ Heal Sci, 2015, 47(3): 431-436. |
| [16] |
黄哲, 许蓓蓓, 王小文, 等. 2型糖尿病患者肥胖状态与肱踝脉搏波传导速度的相关性[J]. 中华疾病控制杂志, 2019, 23(9): 1086-1091. HUANG Z, XU B B, WANG X W, et al. Association of obesity and brachial-ankle pulse wave velocity among type 2 diabetes patients[J]. Chin J Dis Control Prev, 2019, 23(9): 1086-1091. |
| [17] |
TOMIYAMA H, KOJI Y, YAMBE M, et al. Brachial: ankle pulse wave velocity is a simple and independent predictor of prognosis in patients with acute coronary syndrome[J]. Circ J, 2005, 69(7): 815-822. |
| [18] |
LI C I, KARDIA S L, LIU C S, et al. Metabolic syndrome is associated with change in subclinical arterial stiffness: a community-based Taichung community health study[J]. BMC Public Health, 2011, 11: 808. |
| [19] |
GOMEZ-SANCHEZ L, GARCIA-ORTIZ L, PATINO-ALONSO M C, et al. Association of metabolic syndrome and its components with arterial stiffness in Caucasian subjects of the MARK study: a cross-sectional trial[J]. Cardiovasc Diabetol, 2016, 15(1): 148. |
| [20] |
SATOH H, KISHI R, TSUTSUI H. Metabolic syndrome is a significant and independent risk factor for increased arterial stiffness in Japanese subjects[J]. Hypertens Res, 2009, 32(12): 1067-1071. |
| [21] |
FEENER E P, KING G L. Vascular dysfunction in diabetes mellitus[J]. Lancet, 1997, 350(Suppl 1): SI9-S13. |
| [22] |
KASHYAP S R, DEFRONZO R A. The insulin resistance syndrome: physiological considerations[J]. Diabetes Vasc Dis Res, 2007, 4(1): 13-19. |
| [23] |
REAVEN G M. Banting lecture 1988. Role of insulin resistance in human disease[J]. Diabetes, 1988, 37(12): 1595-1607. |
| [24] |
WENG C, YUAN H, TANG X, et al. Age- and gender- dependent association between components of metabolic syndrome and subclinical arterial stiffness in a Chinese population[J]. Int J Med Sci, 2012, 9(8): 730-737. |
| [25] |
陆骆, 张婕, 李勉, 等. 代谢综合征增加动脉硬化患病风险[J]. 内科理论与实践, 2012, 7(6): 443-447. LU L, ZHANG J, LI M, et al. Metabolic syndrome associated with increased risk of arteriosclerosis[J]. J Intern Med Concepts Pract, 2012, 7(6): 443-447. |
| [26] |
KASS D A. Ventricular arterial stiffening: integrating the pathophysiology[J]. Hypertension, 2005, 46(1): 185-193. |
| [27] |
林旻洁, 赵水平. 甘油三酯与冠心病发病关系及机制的研究进展[J]. 中国动脉硬化杂志, 2011, 19(12): 1043-1046. LIN M J, ZHAO S P. Advances in the relationship between triglycerides and coronary heart disease[J]. Chin J Arterioscler, 2011, 19(12): 1043-1046. |
| [28] |
ROSENSON R S, BREWER H B, CHAPMAN M J, et al. HDL measures, particle heterogeneity, proposed nomenclature, and relation to atherosclerotic cardiovascular events[J]. Clin Chem, 2011, 57(3): 392-410. |
| [29] |
KHERA A V, CUCHEL M, DE LA LLERA-MOYA M, et al. Cholesterol efflux capacity, high-density lipoprotein function, and atherosclerosis[J]. N Engl J Med, 2011, 364(2): 127-135. |
| [30] |
CHEI C L, YAMAGISHI K, KITAMURA A, et al. High-density lipoprotein subclasses and risk of stroke and its subtypes in Japanese population: the circulatory risk in communities study[J]. Stroke, 2013, 44(2): 327-333. |
| [31] |
李亮亮. 代谢综合征颈动脉内中膜厚度变化的探讨[J]. 医学信息, 2015(23): 380. LI L L. Study on the change of carotid intimal thickness in metabolic syndrome[J]. Med Inf, 2015(23): 380. |
| [32] |
PRADHAN A D. Sex differences in the metabolic syndrome: implications for cardiovascular health in women[J]. Clin Chem, 2014, 60(1): 44-52. |
| [33] |
LI C, FORD E S, LI B, et al. Association of testosterone and sex hormone-binding globulin with metabolic syndrome and insulin resistance in men[J]. Diabetes Care, 2010, 33(7): 1618-1624. |
| [34] |
CORDERO A, ALEGRIA E. Sex differences and cardiovascular risk[J]. Heart, 2006, 92(2): 145-146. |
| [35] |
REGITZ-ZAGROSEK V, LEHMKUHL E, MAHMOODZADEH S. Gender aspects of the role of the metabolic syndrome as a risk factor for cardiovascular disease[J]. Gend Med, 2007, 4(Suppl B): S162-S177. |
| [36] |
LIEBER A, MILLASSEAU S, BOURHIS L, et al. Aortic wave reflection in women and men[J]. Am J Physiol Heart Circ Physiol, 2010, 299(1): H236-H242. |
| [37] |
张林峰, 王增武, 陈祚, 等. 我国人群主要心血管病危险因素1982-2010年的变化[J]. 医学研究杂志, 2019, 48(3): 39-44. ZHANG L F, WANG Z W, CHEN Z, et al. Secular trends of major cardiovascular risk factors in middle-aged Chinese during the period of 1982 to 2010[J]. J Med Res, 2019, 48(3): 39-44. |
| [38] |
NIELSEN S, GUO Z, JOHNSON C M, et al. Splanchnic lipolysis in human obesity[J]. J Clin Invest, 2004, 113(11): 1582-1588. |
| [39] |
WENG C Y, YUAN H, YANG K, et al. Gender-specific association between the metabolic syndrome and arterial stiffness in 8, 300 subjects[J]. Am J Med Sci, 2013, 346(4): 289-294. |




