2. 400037,重庆,陆军军医大学(第三军医大学)附属第二医院病理科
2. Department of Pathology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China
骨肉瘤是在青少年以及儿童中最常见的原发骨恶性肿瘤,其恶性程度高,易转移,针对晚期骨肉瘤,目前尚缺乏有效的治疗方式[1]。肿瘤血管生成是指肿瘤细胞周围的内皮细胞在肿瘤细胞诱导下发生活化、迁移、增殖、成管等生物行为从而形成大量新生的结构、功能异常的分支血管的过程[2]。骨肉瘤是极富血管肿瘤,理论上其发生、发展皆离不开血管生成。近年来,已有许多研究表明,骨肉瘤的血管生成参与其恶性增殖、发生、侵袭及远处转移等恶性生物学行为,因此,针对骨肉瘤血管生成的靶向治疗,成为潜在的治疗发展方向[3]。分化抑制因子1(inhibitor of DNA binding 1, ID1)是螺旋-环-螺旋蛋白家族成员之一,在肿瘤细胞增殖、凋亡、自我更新等过程中发挥重要作用[4]。近年来,已有研究表明ID1能调控骨肉瘤细胞增殖、分化及失巢凋亡抵抗等生物学行为[5-7],但目前ID1对骨肉瘤血管生成的影响尚不清楚。血管内皮生长因子A(vascular endothelial growth factor A, VEGF-A)被认为是肿瘤血管生成调控的关键因素[3]。文献[8]报道,ID1能促进胶质瘤中VEGF-A表达,但ID1是否在骨肉瘤中调控VEGF-A表达尚不清楚。所以,本研究旨在通过生物信息学分析、组织分析及细胞体外实验,探讨ID1对骨肉瘤血管生成的影响及骨肉瘤中ID1对VEGF-A表达的调控作用,以期为靶向骨肉瘤血管生成的治疗方式提供新的思路。
1 材料与方法 1.1 实验材料实验细胞:人骨肉瘤细胞株143B购买自广州赛库生物技术有限公司(http://www.cellcook.com/)。人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVCEs)由陆军军医大学第二附属医院病理科实验室提供。组织标本:由陆军军医大学第二附属医院病理科提供,为该院2011-2017年33例经病理确诊的骨肉瘤石蜡组织标本,获取标本的术前同意书均取得患者书面知情同意,告知可能参与不涉及隐私泄露的科学研究,根据《赫尔辛基宣言》的道德准则进行研究,并通过陆军军医大学第二附属医院伦理委员会伦理审批(2018-069-01)。实验试剂及材料:高糖DMEM培养基购自HyClone公司(美国),小牛血清购自BI公司(以色列),即用型内皮细胞培养基(ECM)购自Sciencell公司(美国),胰酶及青霉素、链霉素双抗均购自HyClone公司,DMSO购自Sigma公司(美国),PBS来自北京中衫金桥公司。6、24、96孔细胞培养板购自Corning公司(美国),无菌玻璃底培养瓶由新桥中心实验室提供,RNAiso plus、逆转录试剂盒及PCR SYBR反应试剂盒均购买自TaKaRa公司(大连),VEGF-A的ELISA试剂盒购自深圳欣博盛公司,Matrigel(基质胶)购自Corning公司,蛋白裂解液(M-PERTM)购自Thermo公司(美国),PVDF膜购自上海Roche公司,ECL及Western blot配胶试剂盒均购自上海碧云天公司。鼠抗VEGF-A抗体购自Santa Cruz公司(美国),即用型免疫组化CD31抗体选用福州迈新公司。兔抗ID1抗体、HRP标记的山羊抗兔二抗、HRP标记的山羊抗鼠二抗均购自北京博奥森公司,兔抗GADPH购自杭州贤至公司。Transwell小室购自Millipore公司(德国)。ID1的小干扰RNA(siRNA)及对照和助转染试剂(ribobio-FECTTM CP)来自广州锐博公司;ID1(参考转录本为NM_002165.3)的过表达慢病毒(嘌呤霉素抗性)购自上海汉恒生物公司。
1.2 实验方法 1.2.1 细胞培养将143B细胞复苏后置于6孔板和培养瓶中培养,培养液为高糖DMEM培养基,并添加10%小牛血清、1%的链、青霉素双抗;HUVECs细胞复苏后置于6孔板培养,培养液为即用型ECM培养基,两种细胞均置于37 ℃、5% CO2饱和湿度的细胞培养箱中孵育。
1.2.2 143B细胞ID1过表达慢病毒转染取对数生长期的143B细胞以105/孔接种于6孔板,完全DMEM培养基培养,当细胞融合率达到30%~40%时,换用无血清DMEM培养基2 mL/孔,按预实验所得最佳MOI值30,计算每孔滴入的慢病毒量,分别加入对照慢病毒和过表达ID1慢病毒。培养24 h后,更换完全DMEM培养基,至细胞融合50%~60%时,用含2 μg/mL嘌呤霉素的DMEM培养基筛选1周,期间常规换液、传代,PCR、Western blot验证转染效果。
1.2.3 143B细胞ID1表达的RNAi敲低消化143B细胞后,以105/孔接种于6孔板,待细胞融合率达到30%~40%时,换用无血清DMEM培养基2 mL/孔,按20 nmol/L浓度分别添加无效干扰组,ID1 siRNA1组和ID1 siRNA2组的siRNA,并按说明书添加ribobio-FECTTM CP帮助转染。48 h后消化细胞,提取蛋白、cDNA,Western blot、PCR验证敲低效果。靶点序列如下:siRNA1“GAACTCGGAATCCGAAGTT”,siRNA2 “TCAGGGACCTTCAGTTGGA”,对照无效干扰序列公司保密,未能提供。
1.2.4 143B细胞条件培养基(CM)的制备取对数期生长的上述细胞,胰酶消化后离心,种于6孔板,控制各组(对照组,ID1过表达组,无效干扰组,ID1 siRNA1组,ID1 siRNA2组)接种细胞数量一致,约3×105/孔,加入完全DMEM培养基,于孵箱中培养24 h,充分漂洗之后,加入2 mL/孔的无血清DMEM培养基,培养48 h后,收集各组细胞培养液,1 500 r/min离心5 min,去沉淀,取上清收集为各组CM,继续下一步试验,或置于-20 ℃冰箱内短期保存。
1.2.5 HUVECs的Transwell迁移试验取对数生长期的HUVECs细胞,消化离心后,无血清DMEM培养基重悬,调整细胞数,接种于Transwell上室3×104/150 μL,24孔板的下室添加按上述分组的CM与完全DMEM培养基1 ∶1混合的培养液600 μL,于37 ℃、5%CO2饱和湿度的细胞培养箱中孵育24 h。取出小室,依次PBS漂洗,4%多聚甲醛固定,0.1%结晶紫染色,流水冲洗干净后,于倒置显微镜下100倍随机选取4个视野拍照,记录各组迁移细胞数。
1.2.6 HUVECs小管形成试验4 ℃预冷试验器材,在96孔板中加入Matrigel基质胶与无血清DMEM培养基1∶1混合后的悬液50 μL/孔,均匀铺开胶体,避免气泡产生,干扰实验观察,将培养板放入37 ℃孵箱中孵育30 min,至基质胶成半固体状,表面无液体残留。胶体凝固过程中,取HUVECs细胞,消化,利用上述各组CM与内皮培养基1 ∶1混合后的培养液重悬,调整细胞至约104个/100 μL(过表达研究组)或1.5×104个/100 μL(敲低研究组),各孔加入100 μL细胞悬液,每组设4个副孔,于孵箱中培养,8 h后取出96孔板,倒置显微镜下观察各组成管情况,拍照记录,采用Image J软件分析结果。
1.2.7 RT-qPCR检测ID1与VEGF-A的mRNA表达收集上述转染分组处理后的143B细胞,漂洗后,滴加RNAiso Plus 1 mL/孔,同TRIzol法提取总RNA,酶标仪确认纯度D(260)/D(280)在1.8~2.0之间,根据逆转录试剂盒说明书反转录,获得对应cDNA。按根据SYBR试剂盒说明书,10 μL体系,进行PCR扩增反应。反应条件为:95 ℃×30 s→(95 ℃×5 s → 60 ℃×60 s)40个循环。引物序列:GAPDH上游5′-GGAGCGAGATCCCTCCAAAAT-3′,下游5′-GGCTG-TTGTCATACTTCTCATGG-3′;ID1上游5′-ACGGCT-GTTACTCACGCCTC-3′,下游5′-GCTGGAGAATCTC-CACCTTGC-3′;VEGF-A上游5′-CTTCGCTTACT-CTCACCTGCTTCTG-3′,下游5′-GCTGCTTCTTCCAA-CAATGTGTCTC-3′。以GAPDH为参考,转化为2-ΔΔCt进行标准化后,分析比较各目的基因相对含量高低。
1.2.8 Western blot检测ID1与VEGF-A蛋白表达收集转染后各组细胞,加入裂解液和蛋白酶抑制剂,冰上裂解30 min。4 ℃下12 000 r/min离心20 min,吸取上清。在酶标仪上采用Protein A280法测定蛋白浓度,利用裂解液配平。按比例加入上样缓冲液,100 ℃水中煮沸10 min。按配胶试剂盒说明书配置10%分离胶和6%的浓缩胶,以60 μg/孔上样标本蛋白,行凝胶电泳,冰水浴中PVDF转膜,转膜条件为恒流150 mA,时间为90 min,5%的脱脂奶粉封闭1.5 h,孵一抗GAPDH(1 ∶2 000),ID1(1 ∶500),VEGF-A(1 ∶600),4 ℃过夜;次日PBST漂洗后,室温孵育对应HRP标记山羊抗兔或山羊抗鼠二抗1 h,漂洗后,利用ECL系统进行曝光显像,Image J软件分析相对灰度值。
1.2.9 ELISA检测肿瘤上清液中VEGF-A的蛋白浓度收集上述转染后各组细胞的CM,按1 ∶2稀释后,利用VEGF-A的ELISA试剂盒进行蛋白浓度检测,具体步骤参考试剂盒说明书,每组设置4个复孔。
1.2.10 R2数据库生信分析利用R2数据库(http://hgserver1.amc.nl) 进行生信分析,选择“mixed osteosarcoma-Kuijjer-127-vst-ilmnhwg6v2”数据集,进行ID1基因的GO富集分析;并选择相关性分析,分析ID1与VEGF-A之间的表达相关性。
1.2.11 免疫组化检测将获取人骨肉瘤石蜡标本交由专业病理技师连续切片,并完成脱蜡、抗原修复,双氧水清除内源性的过氧化物酶。漂洗切片,湿盒内37 ℃下山羊血清封闭30 min,滴加免疫组化一抗(ID1,1 ∶100;VEGF-A,1 ∶50;CD31即用型),4 ℃孵育过夜。次日取片,洗片后二抗孵育,37 ℃,30 min,DAB显色,苏木精复染,酒精分化,脱水,中性树胶封片。显微镜下观察采图,依照WEIDNER法[9]计数MVD,具体方法为:先低倍镜(×10)下将标本选3个微血管富集区域,在每个区域中随机计数1个高倍镜(×40)下的微血管数,取其平均值为对应标本的MVD值,其中被抗体染色有清楚界限的内皮细胞或细胞团均为计数的微血管。ID1和VEGF-A的IHC染色计分为细胞染色强度和染色面积两部分的得分乘积。低倍镜下选取染色明显区域,在该区域随机400倍镜下选取至少5个富含肿瘤细胞视野,取其得分中位数(强度评分:未显色0分、淡黄色1分、黄色2分、棕褐色3分;面积评分:无染色0分、染色面积1%~25% 1分、>25%~50% 2分、>50%~75% 3分、>75% 4分;ID1免疫组化评分≥4分认为是阳性结果,< 4分认为是阴性结果)。
1.3 统计学分析采用SPSS 20.0或GraphPad统计软件进行数据分析,计量资料采用x±s表示,两组比较采用t检验,多组间比较采用单因素方差分析,两两比较行LSD-t检验,相关性分析采用Spearman分析,检验水准α=0.05。体外细胞实验至少重复3次。
2 结果 2.1 ID1与骨肉瘤血管生成部分相关通路的GO富集分析利用R2数据库的mixed osteosarcoma- Kuijjer-127-vst-ilmnhwg6v2数据集分析,通过GO富集分析发现ID1可能参与调控骨肉瘤的细胞代谢调节、血管生成、血管形态发生、血管发育、脉管系统发育等通路,结果见图 1。
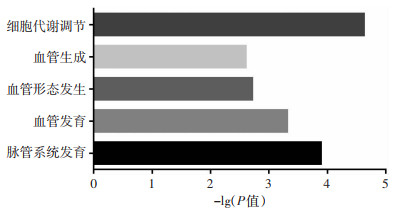
|
| 图 1 ID1与骨肉瘤血管生成部分相关通路的GO富集分析 |
2.2 ID1表达与骨肉瘤MVD的相关性
33例骨肉瘤中的ID1染色阴性组有8例,对应MVD值为(12.29±6.33);ID1染色阳性组有25例,对应MVD值为(21.59±8.735);ID1表达阳性组中的骨肉瘤MVD值高于ID1表达阴性组,差异具有统计学意义(P < 0.05,图 2)。

|
| 图 2 免疫组化观察人骨肉瘤组织ID1表达与CD31染色微血管密度的变化 |
2.3 过表达ID1对HUVECs小管生成和迁移能力的影响
通过慢病毒转染,成功建立ID1过表达143B细胞株,结果见图 3A~C。过表达ID1组的CM较对照组,能显著诱导HUVECs形成更多的小管分支样结构[(35.50±8.54) vs (15.25±5.12),P < 0.05,图 3D];同时,过表达ID1组的CM较对照组,也能明显增加HUVECs的迁移数量[(177.80±23.12) vs (82.25±15.36),P < 0.05,图 3E]。
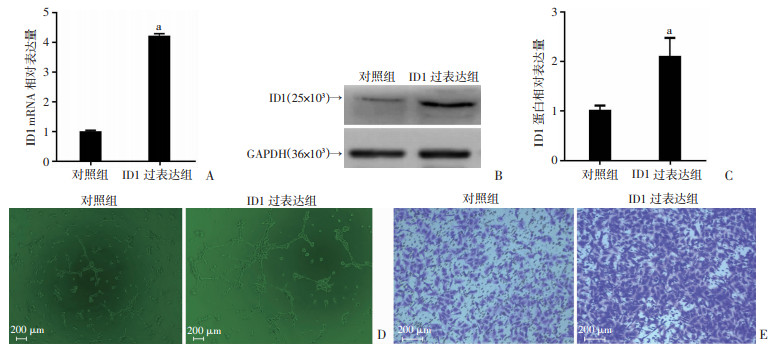
|
| A: RT-qPCR检测过表达ID1组与对照组中ID1的mRNA表达;B、C: Western blot检测ID1过表达组与对照组中ID1的蛋白表达量;D:过表达ID1组与对照组的CM对HUVECs的小管生成能力影响;E:过表达ID1组与对照组的CM对HUVECs的细胞迁移能力影响a: P < 0.05,与对照组比较 图 3 过表达ID1对HUVECs小管生成和迁移能力的影响 |
2.4 敲低ID1对HUVECs小管生成和迁移能力的影响
通过小干扰RNA转染,成功建立ID1低表达143B细胞株,结果见图 4。ID1 siRNA1和ID1 siRNA2两组的CM较无效干扰组,诱导HUVECs形成小管样结构的能力显著降低[(10.00±3.65),(11.50±5.32) 分别vs (25.75±6.85),P < 0.05];同时,ID1 siRNA1和ID1 siRNA2两组的CM较无效干扰组,诱导HUVECs的迁移数量明显减少[(75.90±7.00),(78.25±15.20)分别vs (130.25±11.38),P < 0.05,图 5]。
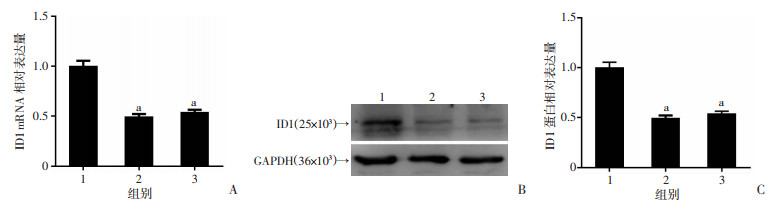
|
|
1:无效干扰组;2:ID1 siRNA1组;3:ID1 siRNA2组 A: RT-qPCR检测各组ID1的mRNA表达;B、C: Western blot检测各组ID1的蛋白表达量a: P < 0.05,与无效干扰组比较 图 4 通过RNAi技术建立ID1低表达143B细胞株 |
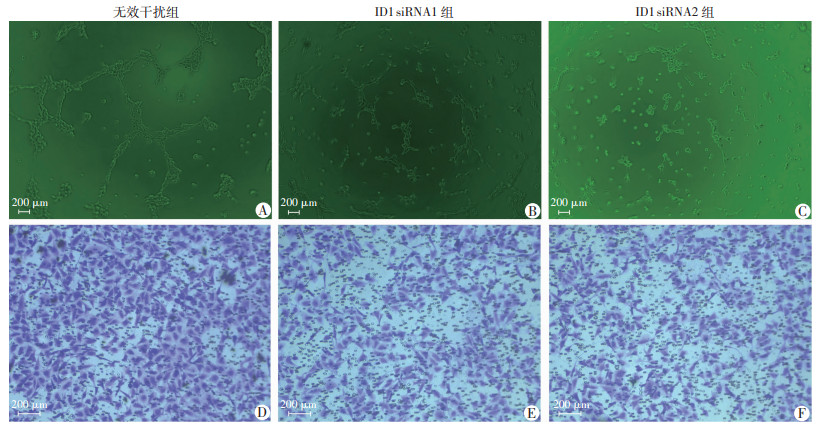
|
| A:比较过表达无效干扰组,ID1 siRNA1组和ID1 siRNA2组的CM对HUVECs的小管生成能力影响;D~F:比较无效干扰组,ID1 siRNA1组和ID1 siRNA2组的CM对HUVECs的细胞迁移能力影响 图 5 敲低ID1对HUVECs小管生成和迁移能力的影响 |
2.5 ID1对143B细胞VEGF-A蛋白表达和分泌的影响
利用R2数据库的mixed osteosarcoma- Kuijjer-127-vst-ilmnhwg6v2数据集分析,骨肉瘤组织中VEGF-A与ID1的mRNA表达呈正相关(r=0.244 1,P=0.005 7,图 6A)。与对照组相比,ID1过表达组的VEGF-A蛋白水平明显升高(P < 0.05);而相对无效干扰组,ID1敲低组的VEGF-A蛋白水平明显降低(P < 0.05,图 6B~D)。ELISA测得ID1过表达组CM中VEGF-A蛋白浓度(pg/mL)明显高于对照组[(893.95± 47.97)vs(698.17±47.30),P < 0.05];而ID1 siRNA1组(524.48±23.22)和ID1 siRNA2组(472.20±39.97)CM中的VEGF-A蛋白浓度(pg/mL)明显低于无效干扰组[(828.85±35.53),P < 0.05,图 6E]。
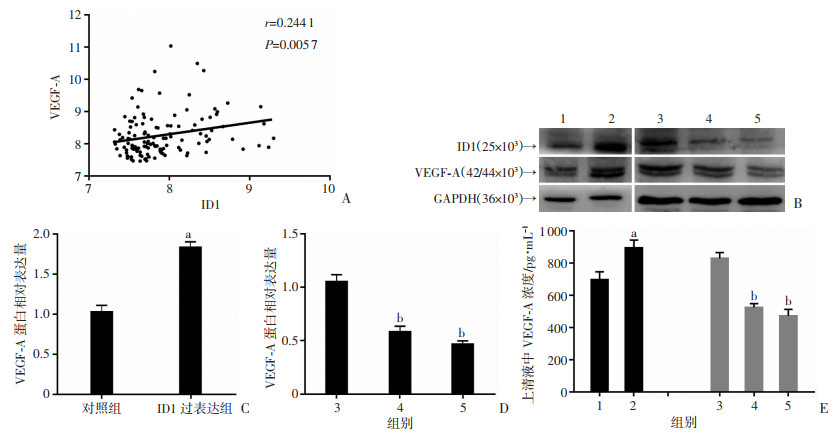
|
|
1:对照组;2:ID1过表达组;3:无效干扰组;4:ID1 siRNA1组;5:ID1 siRNA2组 A:R2数据库中,VEGF-A与ID1的相关性分析;B-D:Western blot检测各组VEGF-A蛋白的表达;E:ELISA检测各组CM经比例稀释后所含VEGF-A蛋白浓度a: P < 0.05,与对照组比较;b: P < 0.05,与无效干扰组比较 图 6 ID1对143B细胞VEGF-A表达和分泌影响 |
2.6 在33例人体骨肉瘤组织中ID1与VEGF-A的蛋白表达相关性
在33例人体骨肉瘤组织中,ID1染色和其所对应VEGF-A染色的典型图像见图 7A,其中病例1为ID1阴性表达样本与其对应的VEGF-A表达(低表达),病例2为ID1阳性表达样本和与其对应的VEGF-A表达(高表达)。相关性分析结果显示33例人骨肉瘤组织中,ID1和VEGF-A蛋白表达的IHC评分(反应IHC测得蛋白表达强度)呈正相关(r=0.464 3,P=0.006 5,图 7B)。
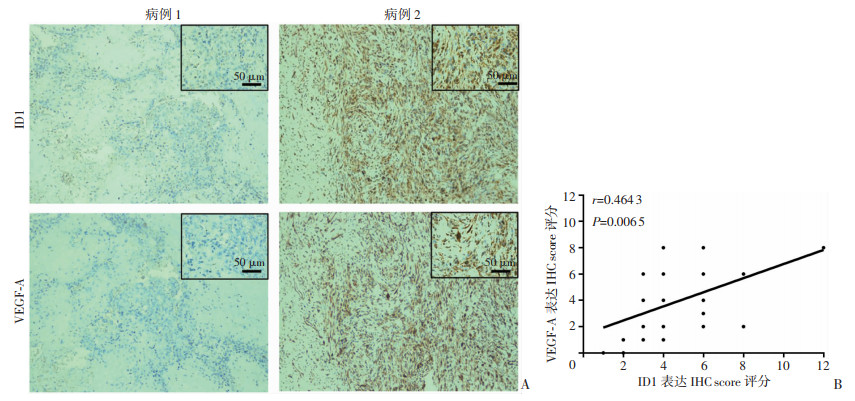
|
| A:人骨肉瘤组织中ID1和VEGF-A的IHC染色的典型图像;B:VEGF-A与ID1在人骨肉瘤组织中的相关性分析 图 7 人骨肉瘤组织中ID1与VEGF-A蛋白表达相关性 |
3 讨论
虽然近年来随着手术技术、化疗方案的改进,目前骨肉瘤患者总体的5年生存率可以达到65%~70%,但对于已发生转移的骨肉瘤患者,其5年生存率仍维持在20%左右[1]。由此可见,转移仍是目前骨肉瘤治疗失败的主要原因。而骨肉瘤的转移与其血管生成密切相关。新生的肿瘤血管缺乏正常的血管排列、周细胞连接松散、基底膜缺损,导致原位的肿瘤细胞能够轻易地透过血管进入血液系统,提供远处转移的前提[10]。而血液中存活的失巢凋亡抵抗的骨肉瘤细胞,又被证实具有更强的血管生成能力[11],使其能够在种植处的靶器官诱导新生血管生成,为种植肿瘤的形成提供营养。因此,理论上,针对晚期骨肉瘤(发生转移)的患者,在手术、化疗的基础上,联合靶向血管生成的治疗,可能在控制肿瘤进一步转移上起到一定效果。但因为晚期骨肉瘤的基因多变性、异质性及分子机制不明,目前血管靶向治疗的临床试验(主要为含抗血管活性的酪氨酸酶抑制剂)仍未获得满意疗效[12]。因此,进一步探究骨肉瘤血管生成的分子机制,寻找抗骨肉瘤血管生成的有效靶点具有重要意义。
ID1作为ID家族的蛋白之一,已被证实在包括骨肉瘤在内的多种恶性肿瘤中扮演促癌基因的角色,影响肿瘤细胞的分化、增殖和转移[13]。我们前期研究也发现ID1可以通过激活PI3K/AKT通路促进骨肉瘤细胞失巢凋亡抵抗,从而促进其远处转移[5]。但目前,尚缺乏ID1对骨肉瘤血管生成的功能及机制研究。我们通过文献复习发现,近年来有许多研究表明ID1参与多种实体瘤如卵巢癌、乳腺癌、胶质瘤等的肿瘤血管生成过程[8, 14-15]。随后,我们进一步结合生信分析提示ID1可能参与骨肉瘤的血管生成、血管形态发生、血管发育等通路,由此我们推测ID1可能也参与了骨肉瘤的血管生成调控。随后本研究通过体外细胞实验也证实骨肉瘤143B细胞的ID1表达与其诱导内皮细胞迁移、成管的能力呈正相关。ID1促进肿瘤的血管生成能力与其能够通过调控多种促血管形成因子密切相关。ID1在结直肠癌和卵巢癌中分别可以通过上调金属基质蛋白酶9(matrix metalloproteinase 9, MMP9)和2(MMP2)表达来促进肿瘤血管生成[14, 16]。YOUNG等[17]发现ID1能被转化生长因子-β(transforming growth factor-β, TGF-β)激活,继而促进肿瘤中VEGF-A表达。张涛等[8]的研究也发现,胶质瘤中ID1与VEGF-A的表达呈正相关。同时,过表达ID1也可以促进食管鳞癌细胞分泌胰岛素样生长因子2(insulin-likegrowthfactor 2, IGF2),促进肿瘤微环境中肿瘤相关成纤维细胞分泌VEGF-A促使肿瘤周围和转移前微环境的血管生成[18]。
VEGF-A是目前被发现的最强的促血管形成因子,能够通过结合肿瘤细胞和血管内皮细胞中其主要受体VEGFR2,激活下游Src、PI3K/AKT、MAPK、Rho等信号通路,促进肿瘤细胞的迁移、增殖及血管生成[19]。有研究表明VEGF-A在骨肉瘤组织中高表达,且高表达的VEGF-A预示着骨肉瘤患者更高的Enneking分期和远处转移,且高表达VEGF-A的患者,其生存期较低表达患者明显缩短[20]。ZHENG等[21]的研究发现,VEGFR2在骨肉瘤中呈阳性表达,且肺转移处的骨肉瘤较对应原位的骨肉瘤VEGFR2表达更高,VEGFR2能促进骨肉瘤转移。以上研究显示VEGF-A/VEGFR2信号在骨肉瘤中不但与血管生成相关,也与骨肉瘤转移密切相关,具有重要研究意义。本研究通过生信分析和组织IHC染色发现骨肉瘤中ID1与VEGF-A表达也呈正相关,同时,通过差异表达ID1,发现可以调控143B细胞中VEGF-A表达和分泌,提示骨肉瘤中ID1可能通过调控VEGF-A表达来影响骨肉瘤的血管生成。
综上,本研究通过人体组织、生信及体外细胞实验发现,ID1可能通过上调VEGF-A表达来促进骨肉瘤血管生成,有望成为针对骨肉瘤血管生成的治疗新靶点。但本研究缺乏进一步的机制研究,骨肉瘤中ID1如何调控VEGF-A的表达,其具体机制有待后续更深入的研究阐明。
| [1] |
ZHAO G S, GAO Z R, ZHANG Q, et al. TSSC3 promotes autophagy via inactivating the Src-mediated PI3K/Akt/mTOR pathway to suppress tumorigenesis and metastasis in osteosarcoma, and predicts a favorable prognosis[J]. J Exp Clin Cancer Res, 2018, 37(1): 188. DOI:10.1186/s13046-018-0856-6 |
| [2] |
FOLKMAN J. Angiogenesis: an organizing principle for drug discovery?[J]. Nat Rev Drug Discov, 2007, 6(4): 273-286. DOI:10.1038/nrd2115 |
| [3] |
TSAI H C, TZENG H E, HUANG C Y, et al. WISP-1 positively regulates angiogenesis by controlling VEGF-A expression in human osteosarcoma[J]. Cell Death Dis, 2017, 8(4): e2750. DOI:10.1038/cddis.2016.421 |
| [4] |
ZHAO Z X, BO Z Y, GONG W Y, et al. Inhibitor of differentiation 1(Id1) in cancer and cancer therapy[J]. Int J Med Sci, 2020, 17(8): 995-1005. DOI:10.7150/ijms.42805 |
| [5] |
ZHAO G S, ZHANG Q, CAO Y, et al. High expression of ID1 facilitates metastasis in human osteosarcoma by regulating the sensitivity of anoikis via PI3K/AKT depended suppression of the intrinsic apoptotic signaling pathway[J]. Am J Transl Res, 2019, 11(4): 2117-2139. |
| [6] |
HAO L, LIAO Q, TANG Q, et al. Id-1 promotes osteosarcoma cell growth and inhibits cell apoptosis via PI3K/AKT signaling pathway[J]. Biochem Biophys Res Commun, 2016, 470(3): 643-649. DOI:10.1016/j.bbrc.2016.01.090 |
| [7] |
仇超, 康权, 迭小红, 等. Id1基因对人骨肉瘤细胞恶性逆转向成骨分化的影响[J]. 第三军医大学学报, 2016, 38(4): 344-349. QIU C, KANG Q, DIE X H, et al. Effect of Id1 gene on reversing malignant biological behaviors and inducing osteogenic differentiation of human osteosarcoma cells[J]. J Third Mil Med Univ, 2016, 38(4): 344-349. DOI:10.16016/j.1000-5404.201507046 |
| [8] |
张涛, 王辉, 杨晓文. 脑胶质瘤中Id1与VEGF的表达及其与肿瘤血管生成的关系[J]. 解剖学研究, 2018, 40(5): 390-393, 402. ZHANG T, WANG H, YANG X W. The relationships and angiogenesis among the expressions of inhibitor of differetiation/DNA banding factor (Id1) and vascular endothelial growth factor (VEGF) in gliomas[J]. Anat Res, 2018, 40(5): 390-393, 402. |
| [9] |
WEIDNER N, FOLKMAN J, POZZA F, et al. Tumor angiogenesis: a new significant and independent prognostic indicator in early-stage breast carcinoma[J]. J Natl Cancer Inst, 1992, 84(24): 1875-1887. DOI:10.1093/jnci/84.24.1875 |
| [10] |
高自然, 赵郭盛, 彭动斌, 等. 印记基因TSSC3对骨肉瘤血管生成的影响[J]. 第三军医大学学报, 2018, 40(10): 855-861. GAO Z R, ZHAO G S, PENG D B, et al. Effect of overexpression of imprinted gene TSSC3 on angiogenesis in human osteosarcoma[J]. J Third Mil Med Univ, 2018, 40(10): 855-861. DOI:10.16016/j.1000-5404.201801125 |
| [11] |
GAO Z R, ZHAO G S, LV Y, et al. Anoikis-resistant human osteosarcoma cells display significant angiogenesis by activating the Src kinase-mediated MAPK pathway[J]. Oncol Rep, 2019, 41(1): 235-245. DOI:10.3892/or.2018.6827 |
| [12] |
XIE L, JI T, GUO W. Anti-angiogenesis target therapy for advanced osteosarcoma (Review)[J]. Oncol Rep, 2017, 38(2): 625-636. DOI:10.3892/or.2017.5735 |
| [13] |
ZHAO Z X, BO Z Y, GONG W Y, et al. Inhibitor of differentiation 1(Id1) in cancer and cancer therapy[J]. Int J Med Sci, 2020, 17(8): 995-1005. DOI:10.7150/ijms.42805 |
| [14] |
SU Y J, GAO L J, TENG L C, et al. Id1 enhances human ovarian cancer endothelial progenitor cell angiogenesis via PI3K/Akt and NF-κB/MMP-2 signaling pathways[J]. J Transl Med, 2013, 11(1): 1-8. DOI:10.1186/1479-5876-11-132 |
| [15] |
LIN X, QIU W X, XIAO Y Y, et al. MiR-199b-5p suppresses tumor angiogenesis mediated by vascular endothelial cells in breast cancer by targeting ALK1[J]. Front Genet, 2019, 10: 1397. DOI:10.3389/fgene.2019.01397 |
| [16] |
武雪亮, 薛军, 王立坤, 等. DNA结合分化抑制蛋白1和基质金属蛋白酶9在结直肠癌中的表达及与微血管密度的相关性[J]. 中国医学科学院学报, 2016, 38(6): 696-701. WU X L, XUE J, WANG L K, et al. Expressions of inhibitors of DNA binding-1 and matrix metalloproteinase-9 in colorectal adenocarcinoma tissues and their correlations with microvessel density[J]. Acta Acad Med Sin, 2016, 38(6): 696-701. DOI:10.3881/j.issn.1000-503X.2016.06.011 |
| [17] |
YOUNG V J, AHMAD S F, BROWN J K, et al. Peritoneal VEGF-A expression is regulated by TGF-β1 through an ID1 pathway in women with endometriosis[J]. Sci Rep, 2015, 5: 16859. DOI:10.1038/srep16859 |
| [18] |
XU W W, LI B, GUAN X Y, et al. Cancer cell-secreted IGF2 instigates fibroblasts and bone marrow-derived vascular progenitor cells to promote cancer progression[J]. Nat Commun, 2017, 8: 14399. DOI:10.1038/ncomms14399 |
| [19] |
CLAESSON-WELSH L, WELSH M. VEGFA and tumour angiogenesis[J]. J Intern Med, 2013, 273(2): 114-127. DOI:10.1111/joim.12019 |
| [20] |
WU H Z, ZHANG J M, DAI R H, et al. Transferrin receptor-1 and VEGF are prognostic factors for osteosarcoma[J]. J Orthop Surg Res, 2019, 14(1): 296. DOI:10.1186/s13018-019-1301-z |
| [21] |
ZHENG B X, ZHOU C L, QU G J, et al. VEGFR2 promotes metastasis and PD-L2 expression of human osteosarcoma cells by activating the STAT3 and RhoA-ROCK-LIMK2 pathways[J]. Front Oncol, 2020, 10: 543562. DOI:10.3389/fonc.2020.543562 |




