系统性红斑狼疮(systemic lupus erythematosus,SLE)是典型的慢性多系统、多脏器损害的自身免疫性疾病,以大量自身抗体及补体形成为特征,临床表现和严重程度各不相同,严重危害人类健康。狼疮性肾炎是SLE主要表现之一,也是导致发病率和病死率增高的主要因素[1]。SLE的发病机制涉及遗传、激素、环境、表观遗传等因素,但其病因至今尚不完全清楚[2]。
长链非编码RNA(long non-conding RNA, lncRNA) 是长度大于200个核苷酸的非编码RNA[3-4]。研究表明lncRNA在表观遗传调控、基因表达剂量补偿效应、细胞周期和细胞分化调控等众多生物学事件中发挥着重要作用[5]。有研究报道,许多lncRNA与自身免疫介导的炎症性疾病的发病相关,例如SLE、RA等[6]。研究证实: 一些lncRNA通过表观遗传调控,包括DNA甲基化、组蛋白修饰、微小RNA等参与SLE的发生和发展,并影响SLE治疗药物的作用[7-8]。然而lnc RNA在SLE中的具体作用机制仍未知。
本研究利用RNA-seq筛选在SLE患者外周血单核细胞(peripheral blood mononuclear cell, PBMCs)中高水平表达的lncRNA,筛选出表达上调最显著的lncRNA,然后采用qRT-PCR技术验证。结果显示RP11-288L9.1水平与对照组相比显著上调。因此,针对RP11-288L9.1做进一步研究,探讨RP11-288L9.1与SLE炎症发生是否相关,以及其具体的潜在作用。进一步的研究发现RP11-288L9.1定位在巨噬细胞中,构建RP11-288L9.1敲低和过表达慢病毒,并检测转染后巨噬细胞炎症相关因子的表达,探讨RP11-288L9.1在SLE炎症中可能的作用,为治疗SLE提供新的思路。
1 资料与方法 1.1 研究对象研究样本来自2018年1月至2020年1月本科确诊为SLE患者的外周血,分离血浆置于-80 ℃冰箱保存备用,8例均为女性,年龄24~51(38.9±10.2)岁,临床诊断符合1997年美国风湿协会修订的诊断标准,除外感染、肿瘤及其他结缔组织病。对照组来自门诊体检的8例女性健康志愿者,无免疫系统疾病和使用免疫抑制剂的病史, 年龄18~60周岁。排除标准:男性,年龄>60或<18周岁;有高血压、糖尿病等全身综合性疾病;有其他免疫系统疾病或使用免疫抑制剂的病史;其他不适合本研究的患者。纳入的研究对象均知情同意,本研究通过本院伦理委员会审批(KY2020167)。
1.2 主要试剂小鼠单核巨噬细胞RAW264.7购自美国ATCC细胞资源库(ATCCⓇ SC-6003),血浆RNA提取试剂TRIzol购自美国Life公司,糖原(glycogen G)购自碧云天公司,Annexin V-FITC细胞凋亡检测试剂盒购自碧云天公司,CCK-8试剂盒购自东仁公司,去基因组DNA反转录试剂盒、qPCR试剂盒购自Bestar公司。
1.3 PBMCs及总RNA提取提取患者PBMCs总RNA用于检测差异表达lncRNA的表达,提取慢病毒处理的巨噬细胞总RNA用于检测RP11-288L9.1上调、下调后炎症细胞因子的表达变化。将冻存的患者外周血置于冰上融化,12 000×g,4 ℃离心10 min以沉淀血浆中的血细胞。取500 μL血浆加入1 mL TRIzol裂解液,旋涡震荡数秒后静置5 min;慢病毒处理的巨噬细胞,在6孔板中加入1 mL TRIzol裂解液,轻轻混匀,裂解5 min,并将裂解液收集到1.5 mL离心管中。然后按TaKaRa公司用户手册提取总RNA。
1.4 qRT-PCR检测lncRNA RP11-288L9.1的表达PBMCs和细胞的总RNA按照PrimerScriptTM说明书进行逆转录,-20 ℃保存cDNA。设计RP11-288L9.1及相关炎症因子的引物并比对其特异性,交北京擎科生物公司合成(序列如表 1所示)。以cDNA为模版,配PCR反应体系,体系为20 μL,每个检测指标设置3个复孔,以β-actin为内参消除实验误差。PCR程序如下所示:95 ℃预变性3 min,95 ℃ 5 s,58 ℃ 34 s,72 ℃ 60 s,共40个循环,用2-ΔΔCt法分析相关分子的相对表达量。
| 基因 | 序列 | 长度/bp |
| RP11 | 正向5′-GGCGTGTCACCAGTTTAT-3′ 反向5′-ATTGCTTACAGTCGGGAT-3′ |
223 |
| AC096579 | 正向5′-ACGGACCGAATCACTG-3′ 反向5′-AACGCTCATTTCCATACAC-3′ |
159 |
| NRIR-1 | 正向5′-AGCCTGACGGACCGAATC-3′ 反向5′-AACGCTCATTTCCATACACCA-3′ |
229 |
| NRIR-2 | 正向5′-GGACCGAATCACTGCC-3′ 反向5′-TTCCCTTTCATCCACTTT-3′ |
209 |
| XLOC-031958 | 正向5′-AGAGCCTGACGGACCGAATC-3′ 反向5′-GGGCCTGTGAAAGGTCTGGTA-3′ |
177 |
| AL92874212-1 | 正向5′-TACCCATAATCAGTAACCT-3′ 反向5′-AAAGCACCGATCAACA-3′ |
251 |
| AL92874212-2 | 正向5′-CCTGACGGACCGAATC-3′ 反向5′-TGTAGTTGCCCTGCTT-3′ |
169 |
| IL-1β | 正向5′-TGATGTTCGTCCCTGTCC-3′ 反向5′-CACGCAATAGTAATGTCCTG-3′ |
185 |
| IL-4 | 正向5′-TGGAGCAGGTGAAGAATG-3′ 反向5′-AGCAGGAAGAACAGAGGG-3′ |
211 |
| IL-6 | 正向5′-AGTAGTGAGGAACAAGCCAGAG-3′ 反向5′-TACATTTGCCGAAGAGCC-3′ |
262 |
| IL-10 | 正向5′-ACCAAGACCCAGACATCA-3′ 反向5′-TTCACAGGGAAGAAATCG-3′ |
193 |
| TGF-β1 | 正向5′-ATCAACGCCCGCCACAAG-3′ 反向5′-GGCCCACGGCAGGTAATT-3′ |
186 |
| β-action | 正向5′-GGGGTGAAATGTGAGGCG-3′ 反向5′-CTCGGTCTTCGTAGATTGCTTA-3′ |
169 |
1.5 小鼠单核巨噬细胞培养
小鼠单核巨噬细胞RAW264.7细胞在含10%胎牛血清及100 U/mL青霉素、链霉素的DMEM高糖培养液中培养,培养条件为5%CO2、37 ℃,隔天换液并观察细胞的生长状况。待RAW264.7细胞生长至70%~80%融合度时,弃去旧的细胞培养液,并用PBS洗涤细胞2次,加入0.25%的胰蛋白酶,于倒置显微镜下观察细胞形态的变化,当细胞出现胞质回缩,胞体变圆,细胞间隙变大时,弃去消化液,立即加入含10%血清的细胞培养液终止消化,用吸管吸取培养液,反复轻柔吹打贴壁的细胞使之脱落并悬浮,调整细胞至合适密度后接种于新的培养皿中,置于5%CO2、37 ℃培养箱中培养。
1.6 慢病毒包装及感染细胞 1.6.1 病毒包装用于包装过表达、敲低RP11-288L9.1重组慢病毒的穿梭质粒和包装质粒(pGag/Pol、pRev、pVSV-G)由北京擎科生物科技有限公司构建,未插入目的片段的空白穿梭质粒作为对照组。293T细胞(ATCC细胞库)在10 cm培养皿中培养至80%~90%融合度时,接种15 cm培养皿;加入18 mL含10% FBS的DMEM培养液,混匀后37 ℃、5%CO2培养过夜;在1支无菌的5 mL离心管中加入1.5 mL无血清DMEM,按1 ∶1的比例加入含目的序列的穿梭质粒和包装质粒(pGag/Pol、pRev、pVSV-G),混匀,取另1支无菌的5 mL离心管,加入1.5 mL无血清DMEM,再加入300 μL RNAi-Mate,混匀,室温放置5 min后,将两管混合,室温放置20~25 min;除去15 cm培养皿中的培养液,加入8 mL无血清的DMEM培养液;将转染混合物逐滴加入15 cm培养皿中,轻轻地前后摇晃培养皿以混匀复合物,在37 ℃、5%CO2培养箱中温育4~6 h;吸弃转染液,加入18 mL含10% FBS的DMEM培养液,37 ℃、5%CO2继续培养72 h。利用超速离心(4 ℃,20 000 r/min,2 h)收集病毒;分装的病毒液贴上标签,-80 ℃冰箱保存。
1.6.2 感染巨噬细胞将生长状态良好的巨噬细胞RAW264.7(ATCC细胞库)于37 ℃、5%CO2培养箱培养。24 h后更换1次培养液继续培养,待细胞汇合度达80%左右传代培养,保持细胞良好的生长状态。处于对数生长期的细胞胰酶消化,完全培养基制成(3~5)×104/mL细胞悬液,接种相应的细胞数到培养板中,继续培养保证感染时铺板量达到15%~30%。按照预实验结果,更换感染培养基,加入最适病毒量进行感染。感染后24 h,更换为常规培养基继续培养。感染后72 h左右,荧光显微镜观察报告基因(如GFP)的表达情况。
1.7 荧光原位杂交(FISH)检测RP11-288L9.1的细胞定位实验分为3组:过表达RP11-288L9.1组命名为RP11-288L9.1 OE,敲低RP11-288L9.1组命名为RP11-288L9.1 KD,对照组。细胞利用4 %多聚甲醛固定,然后将载玻片用盐酸乙醇溶液浸洗10 min,自来水充分清洗,待玻片晾干后,滴1滴poly-l-lysine溶液于玻片上,覆盖样品孔,室温放置10~30 min;吸去多余的溶液,用无菌水冲洗表面数次。接种前至少室温干燥1 h或过夜晾干。透明与脱水:取适量固定后样品与载玻片上,放入46 ℃孵箱中烘干10 min;将样品浸入蛋白酶K缓冲液中,37 ℃ 20 min,然后浸入灭菌水中清洗3次,每次1 min;再依次浸入50%、80%、100%乙醇中脱水,每次3 min,最后在室温晾干。杂交:加9 μL杂交缓冲液到载玻片的样品上,尽量让样品全被覆盖在杂交缓冲液上加1 μL探针(终浓度5 ng/μL);将载玻片水平放在有2×SSC的湿盒中,盖好盖子,然后一起放入46 ℃孵育箱中,杂交1.5 h;将冲洗缓冲液预热到48 ℃备用。冲洗:杂交后,迅速小心用预热的冲洗液冲洗载坡片1~2次;然后快速将载玻片放入48 ℃冲洗液中,放置20 min后,用灭菌水润洗载玻片3次,最后在空气中晾干。镜检与拍照:晾干后,滴1滴抗荧光衰弱剂,小心盖上盖玻片,使样品被抗荧光衰弱剂覆盖,排除气泡,吸去多余液体,然后用指甲油封边;及时进行镜检,在同视野下观察;Zeiss LSM 700共聚焦激光扫描显微镜拍摄结果。
1.8 流式细胞仪检测细胞凋亡把细胞培养液吸出至一合适离心管内,PBS洗涤贴壁细胞1次,加入适量胰酶细胞消化液(可含有EDTA)消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。需避免胰酶的过度消化。把细胞轻轻吹打下来,转移到离心管内,1 000×g离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取50 000~100 000重悬的细胞,1 000×g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。加入5 μL Annexin V-FITC,轻轻混匀。加入10 μL碘化丙啶染色液,轻轻混匀。室温(20~ 25 ℃)避光孵育10~20 min,随后置于冰浴中。可以使用铝箔进行避光。利用流式细胞仪立即上机检测。
1.9 CCK-8检测细胞增殖在96孔板中配制100 μL的细胞悬液,将培养板放在37 ℃、5%CO2培养箱中预培养24 h;向培养板中加入10 μL不同浓度的待测物质;将培养板放在培养箱孵育;每孔轻轻加入10 μL CCK-8溶液。孵育1~4 h后,用酶标仪测定在450 nm处的光度值D(450)。
1.10 统计学分析采用SPSS 16.0统计软件。细胞实验均重复3次。组间比较根据数据类型使用配对t检验。P < 0.05为具有统计学意义。
2 结果 2.1 SLE患者PBMCs中lncRNA RP11-288L9.1高表达通过RNA-seq筛选获得NRIR-1、NRIR-2、XLOC_031958、RP11-288L9.1、AL92874212-1、AL92874212-2 6个差异表达的lncRNA,进一步通过qRT-PCR验证在SLE患者和健康对照PBMCs中这6个lncRNA的表达。结果显示:SLE患者PBMCs中RP11-288L9.1的表达较对照组显著上调(P < 0.01,图 1)。
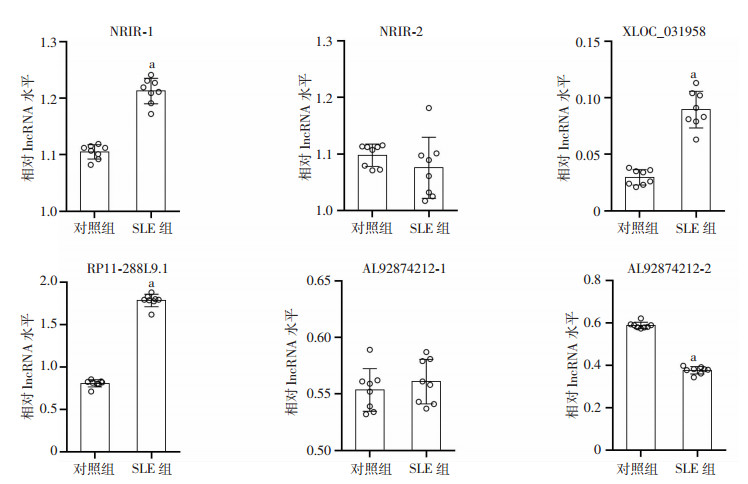
|
| a: P < 0.01,与对照组比较 图 1 qRT-PCR验证SLE患者及健康对照PBMCs中差异表达的lncRNA |
2.2 RP11-288L9.1过表达可抑制巨噬细胞的增殖
过表达和敲低RP11-288L9.1的慢病毒转染巨噬细胞后,采用FISH技术定位发现RP11-288L9.1位于巨噬细胞胞浆中, 过表达组表达水平高于对照组,敲低组低于对照组(图 2A);qRT-PCR检测转染后过表达组和敲低组RP11-288L9.1的表达,结果显示:与对照组比较,过表达组RP11-288L9.1的表达上升,敲低组RP11-288L9.1的表达降低(P < 0.01,图 2B);流式细胞仪检测细胞凋亡,结果显示:RP11- 288L9.1敲低组的巨噬细胞凋亡率低于对照组,过表达组的巨噬细胞凋亡率高于对照组(图 2C、D,P < 0.05)。采用CCK-8检测细胞增殖,结果显示:敲低组巨噬细胞增殖水平高于对照组,过表达组巨噬细胞增殖水平低于对照组(图 2E,P < 0.05)。上述实验结果表明RP11-288L9.1可以抑制巨噬细胞的增殖,促进巨噬细胞的凋亡。
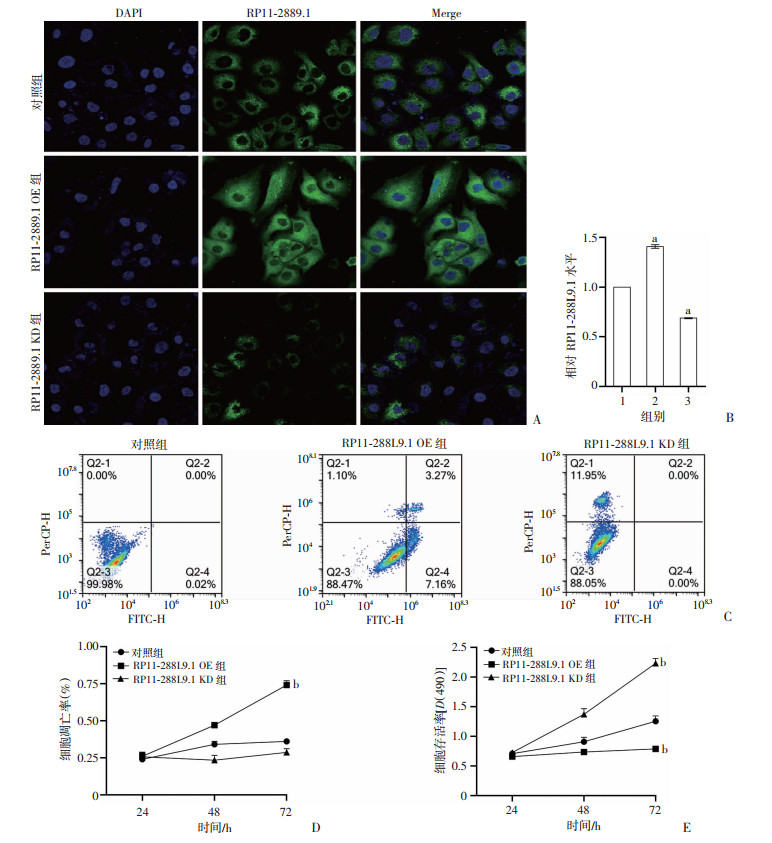
|
| A: 利用FISH检测转染72 h后各组RP11-288L9.1的表达;B:利用qPCR检测转染后过表达组和敲低组RP11-288L9.1的表达1:对照组;2:RP11-288L9.1 OE组;3:RP11-288L9.1 KD组;a:P < 0.01,与对照组比较;C、D: 转染后巨噬细胞凋亡率b: P < 0.05,与对照组比较;E:转染后巨噬细胞细胞活性b: P < 0.05,与对照组比较 图 2 过表达和敲低RP11-288L9.1对巨噬细胞凋亡率和细胞活性的影响 |
2.3 过表达和敲低RP11-288L9.1对巨噬细胞相关炎症细胞因子表达的影响
qRT-PCR检测结果显示:在巨噬细胞中转染过表达和敲低RP11-288L9.1的慢病毒后,过表达目的lncRNA后的巨噬细胞中IL-1β、IL-6表达显著上升,IL-4、IL-10、TGF-β1表达显著下降;敲低巨噬细胞中目的lncRNA后,IL-1β、IL-6表达显著下降,IL-4、IL-10、TGF-β1表达显著上升。表明RP11-288L9.1在巨噬细胞中可能影响了炎症细胞因子的合成来调控免疫反应(图 3)。

|
| 1:对照组;2:RP11-288L9.1 OE组;3:RP11-288L9.1 KD组; a:P < 0.05,b: P < 0.01, 与对照组比较 图 3 过表达和敲低RP11-288L9.1对炎症细胞因子表达的影响 |
3 讨论
系统性红斑狼疮受到多种因素影响,其发病机制复杂多样。越来越多的证据表明lncRNA与SLE发病密切相关,在SLE临床诊断和治疗方面具有巨大的潜力。LI等[9]分析SLE患者及健康对照组外周血T细胞中lncRNA的表达水平,检测到1 935种差异表达的lncRNA,提示这些差异的lncRNA在SLE疾病发生及发展过程中发挥调节作用。大量研究表明lncRNA可以通过调节炎症细胞因子的产生进而影响机体免疫状态。CARPENTER等[10]报道lncRNACOX2被定性为TLR配体诱导的动态调控基因,进而发挥促进和抑制炎症细胞因子表达的作用;一些lncRNA包括THRIL[11]、Lnc13[12]被报道可调节髓系细胞的炎症细胞因子表达。
为了验证lncRNA与SLE发病的相关性,本研究首先通过RNA-seq筛选获得SLE患者PBMCs高水平表达的lncRNA,筛选出6个差异表达较明显的lncRNA,作为备选lncRNA。然后采用qRT-PCR技术验证8例SLE患者和8例健康对照组PBMCs中差异表达lncRNA的表达,比较其差异表达,结果显示RP11-288L9.1水平上调显著,因此将RP11-288L9.1作为本研究的目的lncRNA。
运用RNA FISH技术进行目的lncRNA的定位,发现其主要信号定位于巨噬细胞的胞浆。巨噬细胞在机体固有免疫和适应性免疫应答中发挥着关键的作用,是机体中免疫反应中重要的免疫细胞[13]。近年来,大量研究表明巨噬细胞在SLE发病机制中发挥重要的作用。SLE常累及肾脏,Ⅵ型狼疮肾炎患者肾脏组织中巨噬细胞的高水平表达直接预示患者预后不良[14]。将狼疮模型鼠体内的巨噬细胞清除可显著缓解其肾炎及疾病活动度[15]。巨噬细胞在不同微环境信号刺激下,可改变其自身的形态和生理特征,极化成两类细胞,即经典活化型细胞(M1型) 和替代活化型细胞(M2型)[16]。巨噬细胞极化的调控机制尚不完全清楚,越来越多的证据表明lncRNA在巨噬细胞极化转换中发挥重要作用。已有研究显示:心脏和凋亡相关lncRNA(cardiac and apoptosis-related lncRNA,Carlr)[17]、lncRNA A_30_P01020139[18]等lncRNA可以通过调控转录因子,进而改变巨噬细胞极化状态。以上研究结果均提示lncRNA可能通过调控巨噬细胞极化状态,同时抑制了巨噬细胞的增殖,并促进了巨噬细胞的凋亡,从而在SLE发病过程中具有重要作用。
为了进一步验证RP11-288L9.1对巨噬细胞的调控机制,本研究构建了lncRNA敲低和过表达慢病毒,并利用慢病毒转染的方法在巨噬细胞系中过表达和敲低RP11-288L9.1,通过荧光显微镜观察发现转染荧光阳性,为接下来的研究打下了良好的基础。
本研究通过检测转染后各巨噬细胞相关炎症细胞因子表达水平,结果显示:过表达RP11-288L9.1后的巨噬细胞中炎症细胞因子IL-1β、IL-6表达显著上升,IL-4、IL-10、TGF-β1表达显著下降;敲低RP11-288L9.1的巨噬细胞,IL-1β、IL-6表达显著下降,IL-4、IL-10、TGF-β1表达显著上升。巨噬细胞极化的状态不同,在免疫应答中发挥着不同的作用。极化的M1型巨噬细胞以分泌促炎因子为主,如IL-1β、IL-6等,具有强大的抗原提呈及吞噬能力,促进Th1免疫应答,发挥抗胞内病原菌和抗肿瘤的作用,同时在机体的免疫应答中发挥促炎作用[19]。M2型巨噬细胞分泌抗炎细胞因子如IL-4、IL-10、TGF-β1等,具有抗炎的免疫调控作用,并能促进组织修复和伤口愈合[13]。巨噬细胞的炎症反应主要通过NF-κB、STAT3等转录因子相关信号通路介导,其中NF-κB、ER/K12、ERK5、STAT3等多种转录因子在lncRNA调控作用下磷酸化后入核,继而影响细胞核内巨噬细胞相关炎症因子的转录[20]。有研究表明lncRNA-GAS5内质网应激途径的激活可调控巨噬细胞的增殖和凋亡[21],所以推测RP11-288L9.1也可能是通过NF-κB、STAT3等转录因子相关信号通路调节炎症因子的合成,并进一步调控内质网应激途径的激活来对巨噬细胞的增殖和凋亡产生影响,但是其具体机制仍需进一步的深入研究。
本研究结果提示RP11-288L9.1可能通过调控巨噬细胞的极化状态进而影响细胞因子的表达,可能通过促进Th1免疫应答,增强巨噬细胞抗原提呈及吞噬能力,促进机体炎症的进一步发展,这种作用方式可能是RP11-288L9.1在SLE发生和发展中的重要作用机制,为以后继续深入研究lncRNA在SLE发病中的作用提供了重要的方向。
机体免疫异常是SLE一个重要特征,巨噬细胞作为机体免疫的重要参与者,在炎症反应和宿主防御中均扮演重要角色,本研究结果表明:RP11-288L9.1可以通过调控巨噬细胞的极化状态进而影响了炎症细胞因子的表达,并通过增强巨噬细胞抗原提呈及吞噬能力,促进Th1免疫应答,导致机体炎症的进一步发展。这可能是SLE发生的机制之一。但RP11-288L9.1在SLE中发挥分子作用的具体机制、影响因素及临床诊断、治疗、预后等还有待进一步探索。
| [1] |
KIRIAKIDOU M, CHING C L. Systemic lupus erythematosus[J]. Ann Intern Med, 2020, 172(11): ITC81-ITC96. |
| [2] |
DURCAN L, O'DWYER T, PETRI M. Management strategies and future directions for systemic lupuserythematosus in adults[J]. Lancet, 2019, 393(10188): 2332-2343. |
| [3] |
YAO R W, WANG Y, CHEN L L. Cellular functions of long noncoding RNAs[J]. Nat Cell Biol, 2019, 21(5): 542-551. |
| [4] |
SUN Q, HAO Q, PRASANTH K V. Nuclear long noncoding RNAs: key regulators of gene expression[J]. Trends Genet, 2018, 34(2): 142-157. |
| [5] |
VERGADI E, VAPORIDI K, TSATSANIS C. Regulation of endotoxin tolerance and compensatory anti-inflammatory response syndrome by non-coding RNAs[J]. Front Immunol, 2018, 9: 2705. |
| [6] |
WU Y, ZHANG F, MA J, et al. Association of large intergenic noncoding RNA expression with disease activity and organ damage in systemic lupus erythematosus[J]. Arthr Res Ther, 2015, 17(1): 131. |
| [7] |
WU G C, PAN H F, LENG R X, et al. Emerging role of long noncoding RNAs in autoimmune diseases[J]. Autoimmun Rev, 2015, 14(9): 798-805. |
| [8] |
LONG H, YIN H, WANG L, et al. The critical role of epigenetics in systemic lupus erythematosus and autoimmunity[J]. J Autoimmun, 2016, 74: 118-138. |
| [9] |
LI L J, ZHAO W, TAO S S, et al. Comprehensive long non-coding RNA expression profiling reveals their potential roles in systemic lupus erythematosus[J]. Cell Immunol, 2017, 319: 17-27. |
| [10] |
CARPENTER S, AIELLO D, ATIANAND M K, et al. A long noncoding RNA mediates both activation and repression of immune response genes[J]. Science, 2013, 341(6147): 789-792. |
| [11] |
CASTELLANOS-RUBIO A, FERNANDEZ-JIMENEZ N, KRATCHMAROV R, et al. A long noncoding RNA associated with susceptibility to celiac disease[J]. Science, 2016, 352(6281): 91-95. |
| [12] |
CHAN J, ATIANAND M, JIANG Z, et al. Cutting edge: a natural antisense transcript, AS-IL1α, controls inducible transcription of the proinflammatory cytokine IL-1α[J]. J Immunol, 2015, 195(4): 1359-1363. |
| [13] |
HUME D A. The many alternative faces of macrophage activation[J]. Front Immunol, 2015, 6: 370. |
| [14] |
CHEUNSUCHON B, INCHAROEN P, CHAWANASUN-TORAPOJ R, et al. Glomerular macrophage is an indicator of early treatment response in diffuse proliferative lupus nephritis[J]. J Med Assoc Thai, 2013, 96(Suppl 2): S246-S251. |
| [15] |
CHALMERS S A, CHITU V, HERLITZ L C, et al. Macrophage depletion ameliorates nephritis induced by pathogenic antibodies[J]. J Autoimmun, 2015, 57: 42-52. |
| [16] |
YOON J, UM H N, JANG J, et al. Eosinophil activation by Toll-like receptor 4 ligands regulates macrophage polarization[J]. Front Cell Dev Biol, 2019, 7: 329. |
| [17] |
CASTELLANOS-RUBIO A, KRATCHMAROV R, SEBASTIAN M, et al. Cytoplasmic form of carlr lncRNA facilitates inflammatory gene expression upon NF-κB activation[J]. J Immunol, 2017, 199(2): 581-588. |
| [18] |
CHEN X, DU J, ZHU Y, et al. Comprehensive analysis of lncRNA and mRNA expression profiles in macrophages activated by Actinidia eriantha polysaccharide[J]. Int J Biol Macromol, 2019, 136: 980-993. |
| [19] |
LI H, JIANG T, LI M Q, et al. Transcriptional regulation of macrophages polarization by microRNAs[J]. Front Immunol, 2018, 9: 1175. |
| [20] |
YIN L, DAI Q, JIANG P, et al. Manganese exposure facilitates microglial JAK2-STAT3 signaling and consequent secretion of TNF-α and IL-1β to promote neuronal death[J]. Neurotoxicology, 2018, 64: 195-203. |
| [21] |
徐雅楠, 于嘉霖, 马臣杰, 等. Lnc RNA-GAS5对BCG感染小鼠巨噬细胞后细胞坏死的调控作用[J]. 微生物学通报, 2019, 46(4): 858-868. XU Y N, YU J L, MA C J, et al. Regulation of LncRNA-GAS5 on necrosis of macrophage induced by Bacillus Calmette-Guérin[J]. Microbio China, 2019, 46(4): 858-868. |




