2. 710061 西安,西安交通大学第一附属医院: 肝胆外科;
3. 710061 西安,西安交通大学第一附属医院: 老年外科
2. Department of Hepatobiliary Surgery, the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an, Shaanxi Province, 710061, China;
3. Department of Geriatric Surgery, the First Affiliated Hospital of Xi'an Jiaotong University, Xi'an, Shaanxi Province, 710061, China
原发性肝癌(primary liver cancer,PLC)是全球常见的恶性肿瘤之一,严重威胁着人们的身体健康[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌最常见的病理类型,通常起病隐匿、早期缺乏典型临床症状且缺乏有效的早期诊断靶标,故早期确诊难度较大;再加上HCC进展较为迅速且恶性程度高,导致HCC患者预后往往较差。因此,基于HCC的诊治现状,对其发病机制进行深入探索,进而寻求有效的早期诊断指标和预后监测指标就显得尤为重要且迫切。microRNA(miRNAs)是一类长度为21~25 nt的非编码单链RNA,其在进化上具有高度保守性,能够通过与靶基因mRNA特异性的碱基互补配对导致靶基因mRNA降解或抑制其翻译,从而实现在转录后水平对基因的表达进行调控。miRNAs广泛参与了肝细胞癌的发生和发展,其可通过调控肿瘤细胞的增殖[2]、侵袭及转移[3]等多种恶性生物学过程,进而发挥其促癌或者抑癌的生物学作用。研究表明miR-3934-5p在非小细胞肺癌[4]和神经母细胞瘤[5]均发挥促癌功能,而miR-3934-5p在HCC中的表达及功能目前均不清楚。
β-内酰胺酶(beta-lactamases,LACTB)是一种位于线粒体膜间隙的哺乳动物活性位点丝氨酸蛋白,其从细菌青霉素结合蛋白进化而来的,在哺乳动物的肝脏、心脏和骨骼肌的组织中普遍存在。研究发现LACTB可通过减少线粒体磷脂酰乙醇胺合成过程中线粒体磷脂酰丝氨酸脱羧酶的水平,调控线粒体脂质代谢,而进一步影响细胞的分化,继而影响肿瘤进展[6]。研究显示LACTB在乳腺癌[7]、结直肠癌[8]及肝癌组织[9]中表达均明显下调,表明其在肿瘤细胞的增殖、侵袭和远处转移等恶性生物学行为中起到重要的调节作用。而LACTB与miR-3934-5p的关系也不清楚。因此,本研究旨在探讨miR-3934-5p在肝癌组织及细胞中的表达情况、临床意义及生物学功能,并进一步研究其分子机制,从而为HCC的临床诊治提供潜在的分子靶标。
1 材料与方法 1.1 组织与细胞收集53例2013年9月至2014年8月在本院肝胆外科手术治疗后经病理证实为肝细胞癌患者的癌旁肝脏组织及肿瘤组织。患者术前均未行非手术相关治疗,均有详细的随访信息。本课题经本院伦理委员会审核(2020伦审科字第107号),且获得患者知情同意。HEK293T、正常永生化人肝细胞L02及肝癌细胞株(Hep3B、Huh7、MHCC97-L、SK-Hep-1、MHCC97-H、HCCLM3)均购自中科院上海细胞库。
1.2 试剂培养细胞所使用的DMEM培养基和胎牛血清购自美国Gibco公司;双抗(氨苄青霉素和链霉素)由美国HyClone公司提供;提取RNA所使用的TRIzol试剂及转染所需的LipofectamineTM 2000由美国Invitrogen公司提供;miR-3934-5p(miRA1001165-1-100)和U6(miRAN0002-1-100)的引物序列、miR-3934-5p inhibitors (anti-miR-3934-5p, miR20018349-1-5)及阴性对照序列(anti-miR-NC, miR2N0000001-1-5)、靶向LACTB的小干扰siRNA(siG000114294A-1-5)由广州锐博生物技术有限公司提供(miR-3934-5p inhibitors被用来敲减HCC细胞中miR-3934-5p的表达;小干扰siLACTB被用来敲减HCC细胞中LACTB的表达);ECL发光液购自美国Milipore公司;LACTB抗体(货号ab131171)购自Abcam公司;BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;RIPA裂解液购自西安赫特生物科技有限公司。
1.3 方法 1.3.1 细胞培养含10%胎牛血清、100 IU/mL青霉素及100 μg/mL链霉素的DMEM培养基被用来培养L02、Hep3B、Huh7、MHCC97-L、SK-Hep-1、MHCC97-H、HCCLM3细胞,培养条件为5%CO2、37 ℃的恒温培养箱。
1.3.2 转染HCCLM3细胞常规培养接种于6孔板中,待细胞汇合度达50%左右时,将miR-3934-5p inhibitors和/或LACTB siRNA及相应的阴性对照序列按照Lipofectamine TM 2000说明书步骤加入6孔板中,用无双抗含10%胎牛血清的DMEM培养基培养6 h后,更换成完全培养基继续培养,48 h后收取细胞,进行转染效率检测和功能学实验。
1.3.3 实时定量PCR (RT-qPCR)TRIzol法提取HCC组织及细胞中RNA,逆转录及定量操作按照说明书步骤进行,分别以U6和β-actin为内参,通过2-△△Ct法分别计算miR-3934-5p及LACTB相对表达量,每个样本独立重复实验3次。miR-3934-5p正向引物:5′-GCCAGCTCCTACATCTCAGC-3′;LACTB引物: 正向5′-ACAGAGCAGGAGAATGAA-3′, 反向5′-TGACTA-CCAGGTTTGAAGA3′。
1.3.4 CCK-8检测调整经转染的HCCLM3细胞为5×104/mL,并接种100 μL细胞悬液至96孔培养板,每组设5个复孔,在细胞培养箱中进行常规培养。分别在0、24、48、72 h各取出1个培养板进行检测。在避光情况下,每孔加入10 μL CCK-8溶液,继续在细胞培养箱中孵育0.5 h,通过酶标仪测定450 nm波长处的光密度值D(450),整理数据结果并绘制细胞生长曲线。
1.3.5 克隆形成实验调整经转染的HCCLM3细胞密度,使得每个小皿中的细胞数为1 000个,然后将小皿置于细胞培养箱中培养,定期观察细胞生长状态。当小皿中的单个细胞形成肉眼可见的细胞团块时将其取出,依次进行PBS清洗、甲醇固定、结晶紫染色、拍照。对细胞克隆进行计数和统计学分析。
1.3.6 EdU细胞增殖检测调整经转染的HCCLM3细胞为5×104/mL,并接种100 μL细胞悬液至96孔培养板,置于培养箱中培养;按照试剂盒说明书配制EdU培养基,并用其孵育细胞,对细胞进行EdU标记。按照说明书依次进行细胞固定、Apollo染色、DNA染色、拍照。计算EdU阳性细胞比并对结果进行统计学分析。
1.3.7 Western blot检测利用RIPA裂解液抽提经转染的HCCLM3细胞的总蛋白并用BCA法进行蛋白定量。将待检测蛋白样品按40 μg/孔上样后行SDS-PAGE电泳,然后通过湿转法将蛋白转移至PVDF膜上,将膜用5%脱脂牛奶封闭2 h后进行一抗(LACTB, 1 ∶1 000;β-actin,1 ∶1 000)4 ℃孵育过夜;第2天,用TBST溶液洗膜3次,每次10 min;二抗室温孵育1 h;TBST洗膜3次,每次10 min;最后,在暗室进行ECL化学发光显影。
1.3.8 荧光素酶报告基因实验利用TargetScan数据库(http://www.targetscan.org/)预测miR-3934-5p的靶基因,获得预测价值较高的靶基因LACTB。分别构建含野生型和突变型LACTB 3′UTR的荧光素酶表达载体(WT-3′UTR和MUT-3′UTR)。实验分2组:WT-3′UTR组和MUT-3′UTR组。取对数生长期细胞接种于24孔板,待293T细胞汇合度达50%左右时,分别共转染含WT-3′UTR和MUT-3′UTR荧光素酶表达质粒及miR-3691-5p inhibitors和阴性对照序列。使用荧光素酶报告基因实验检测仪进行实验结果测定。将荧光素酶活性和海肾荧光活性的比值进行整理后进行统计学分析。
1.4 统计学分析采用SPSS 22.0统计软件。计量资料以x±s表示,采用t检验;miR-3934-5p的表达与HCC患者各临床病理特征之间的相关性采用χ2检验;Kaplan-Meier生存曲线分析miR-3934-5p表达与HCC患者生存预后的关系;通过Spearman相关性检验分析HCC中miR-3934-5p与LACTB表达的相关性。P < 0.05为差异有统计学意义。实验均重复3次。
2 结果 2.1 miR-3934-5p在HCC中的表达及其临床意义采用RT-qPCR检测53对肝癌及癌旁组织中miR-3934-5p的表达,结果显示:miR-3934-5p在肝癌组织中的表达显著高于癌旁组织(P < 0.001,图 1A)。在TCGA在线数据库ENCORI中检索miR-3934-5p在50例正常肝组织及370例肝癌组织中的表达,结果也发现miR-3934-5p在HCC组织中高表达(P=0.038, 图 1B)。另外,RT-qPCR检测miR-3934-5p在正常肝细胞L02及肝癌细胞株(Hep3B、Huh7、MHCC97-L、SK-Hep-1、MHCC97-H、HCCLM3)中的表达,结果显示:相较于正常肝细胞L02,miR-3934-5p在各肝癌细胞系中的表达均显著上调(P < 0.05,图 1C)。以miR-3934-5p在53例HCC组织的中位表达值,将这53例HCC患者分为miR-3934-5p高表达组(n=27)和miR-3934-5p低表达组(n=26),分析miR-3934-5p的表达与HCC患者的临床病理特征及生存预后之间的关系。结果如表 1所示:miR-3934-5p的高表达与肿瘤大小(P=0.040)、肿瘤数量(P=0.013)、血管侵犯(P=0.006)及TNM分期(P=0.017)相关。另外,生存分析结果显示:与miR-3934-5p低表达组比较,miR-3934-5p高表达组患者的总体生存时间更短,预后更差(P=0.004,图 1D)。
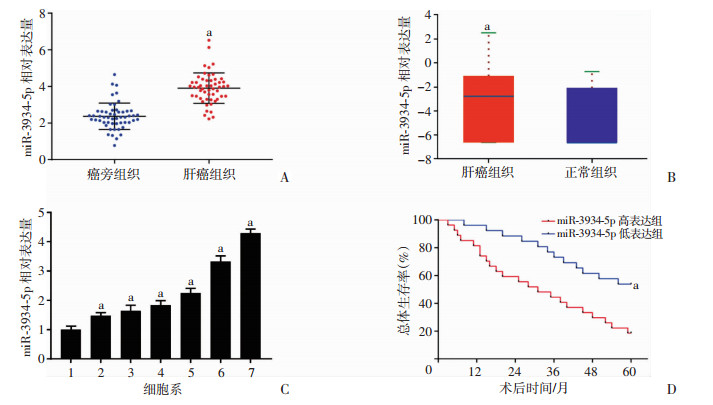
|
| A:miR-3934-5p在53对HCC及癌旁组织中的表达水平a: P < 0.001,与癌旁组织比较;B:TCGA数据库检索显示miR-3934-5p在HCC组织中高表达a: P=0.038,与正常组织比较;C:miR-3934-5p在各肝癌细胞系中的表达1:L02;2:Hep3B;3:Huh7;4:MHCC97-L; 5:SK-Hep-1;6:MHCC97-H; 7:HCCLM3;a: P < 0.05,与L02比较;D:miR-3934-5p高、低表达组患者的总体生存时间比较a: P=0.004,与miR-3934-5p高表达组比较 图 1 miR-3934-5p在HCC中的表达及其与总体生存率的关系 |
| 临床病理特征 | n | miR-3934-5p表达水平 | P值 | |
| 高表达组(n=27) | 低表达组(n=26) | |||
| 年龄/岁 | 0.922 | |||
| ≥60 | 35 | 18 | 17 | |
| < 60 | 18 | 9 | 9 | |
| 性别 | 0.317 | |||
| 男 | 38 | 21 | 17 | |
| 女 | 15 | 6 | 9 | |
| HBV感染 | 0.668 | |||
| 阴性 | 9 | 4 | 5 | |
| 阳性 | 44 | 23 | 21 | |
| 肝硬化 | 0.606 | |||
| 无 | 5 | 2 | 3 | |
| 有 | 48 | 25 | 23 | |
| 血清AFP/ng·mL-1 | 0.465 | |||
| ≤400 | 12 | 5 | 7 | |
| >400 | 41 | 22 | 19 | |
| 肿瘤长径 | 0.040 | |||
| ≤5 cm | 25 | 9 | 16 | |
| >5 cm | 28 | 18 | 10 | |
| 肿瘤数量 | 0.013 | |||
| 1 | 34 | 13 | 21 | |
| ≥2 | 19 | 14 | 5 | |
| 血管侵犯 | 0.006 | |||
| 无 | 33 | 12 | 21 | |
| 有 | 20 | 15 | 5 | |
| TNM分期 | 0.017 | |||
| Ⅰ+Ⅱ | 43 | 18 | 25 | |
| Ⅲ+Ⅳ | 10 | 9 | 1 | |
2.2 敲减miR-3934-5p抑制肝癌细胞的增殖能力
在各肝癌细胞系中,HCCLM3细胞系中的miR-3934-5p表达最高(图 1C)。因此,HCCLM3细胞系被用作进行miR-3934-5p敲减的细胞模型进行后续的功能学研究。在HCCLM3细胞系中,利用Lipofectamina 2000瞬时转染miR-3934-5p inhibitor,对细胞中的miR-3934-5p进行敲减,转染效率差异具有统计学意义(P < 0.001,图 2)。CCK-8实验、平板克隆实验及EdU实验分别被用来评价HCCLM3细胞的活性及增殖能力,结果表明:与对照组比较,敲减miR-3934-5p后HCCLM3细胞的活性明显下降(P < 0.05,图 3A),其增殖能力被显著抑制(P < 0.05,图 3B、C)。
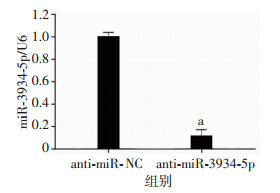
|
| a: P < 0.001, 与anti-miR-NC组比较 图 2 敲减HCCLM3细胞中miR-3934-5p表达的转染效率检测 |
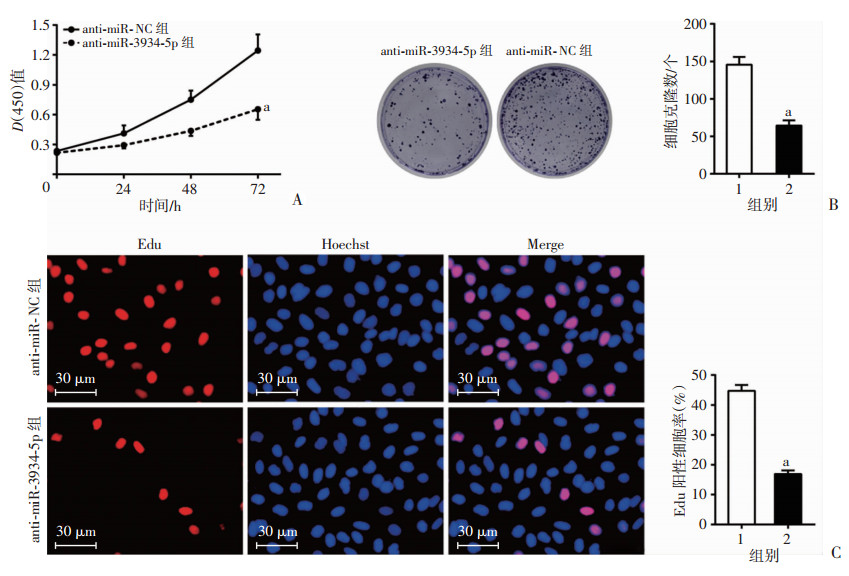
|
|
1:anti-miR-NC组;2:anti-miR-3934-5p组;a: P < 0.001,与anti-miR-NC组比较 A:敲减miR-3934-5p显著抑制HCCLM3细胞的活性;B:敲减miR-3934-5p显著抑制HCCLM3细胞的克隆形成能力;C:敲减miR-3934-5p显著抑制HCCLM3细胞的增殖能力 图 3 敲减miR-3934-5p对HCCLM3细胞增殖能力的影响 |
2.3 LACTB是miR-3934-5p的直接作用靶点
采用TaregetScan数据库预测miR-3934-5p的作用靶点,结果显示:LACTB mRNA的3′非翻译区存在与miR-3934-5p直接结合的作用位点(图 4A)。RT-qPCR结果显示:相较于癌旁正常组织,LACTB在肝癌组织中低表达(P < 0.001,图 4B)。Spearman相关性分析发现:在HCC组织中,LACTB mRNA与miR-3934-5p的表达呈负相关(r=-0.730 3,P < 0.000 1,图 4C)。在转染miR-3934-5p inhibitor的HCCLM3细胞中检测LACTB的表达,结果显示:在敲减miR-3934-5p后,LACTB在mRNA和蛋白水平均显著被上调(P < 0.05,图 4D、E),证实miR-3934-5p可负向调控LACTB的表达。双荧光素酶报告基因实验结果显示,敲减miR-3934-5p可显著增强含野生型LACTB mRNA 3′UTR的质粒载体的荧光素酶活性,而对含突变型LACTB mRNA 3′UTR的质粒载体荧光素酶活性的影响差异无统计学意义(P < 0.05,图 4F)。表明LACTB是miR-3934-5p的直接作用靶点。
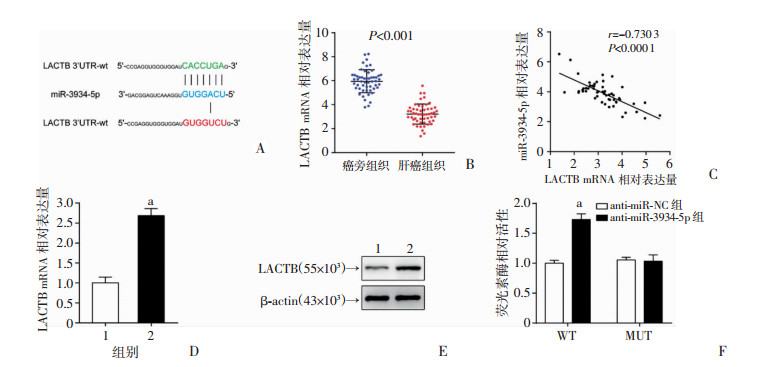
|
|
1:anti-miR-NC组;2:anti-miR-3934-5p组;a: P < 0.05, 与anti-miR-NC组比较 A:TaregetScan数据库预测分析;B:正常肝组织和肝癌组织中LACTB mRNA的表达;C:HCC组织中LACTB mRNA与miR-3934-5p表达的相关分析;D:敲减miR-3934-5p后HCCLM3细胞中LACTB mRNA表达;E:敲减miR-3934-5p后HCCLM3细胞中LACTB蛋白表达;F:双荧光素酶报告基因实验检测敲减miR-3934-5p后LACTB mRNA 3′UTR的质粒载体的荧光素酶活性 图 4 LACTB是miR-3934-5p的直接靶点 |
2.4 LACTB介导miR-3934-5p对肝癌细胞增殖能力的促进作用
在HCCLM3中,对miR-3934-5p和LACTB进行敲减,转染效率通过Western blot实验进行验证(图 5A)。CCK-8实验结果证实:敲减miR-3934-5p可显著抑制HCCLM3细胞的活性,而敲减LACTB可逆转这一效应(P < 0.05,图 5B);平板克隆实验和EdU实验也证实:敲减LACTB可逆转敲减miR-3934-5p对HCCLM3细胞增殖能力的抑制作用(P < 0.05,图 5C、D)。
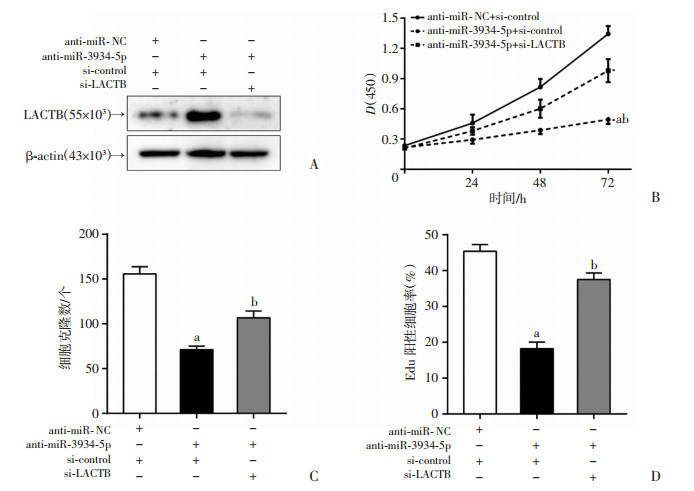
|
|
a: P < 0.05,与anti-miR-NC + si-control组比较;b: P < 0.05,与anti-miR-3934-5p + si-control组比较 A:转染效率检测;B:敲减miR-3934-5p对HCCLM3细胞活性抑制效应的影响;C:敲减miR-3934-5p对HCCLM3细胞克隆形成能力抑制效应的影响;D:敲减miR-3934-5p对HCCLM3细胞增殖能力抑制效应的影响 图 5 LACTB介导了miR-3934-5p对HCCLM3细胞增殖能力的促进作用 |
3 讨论
研究表明miRNAs可在转录后水平对原癌基因或抑癌基因的表达进行调控,进而影响肿瘤细胞的多种生物学行为,如增殖、凋亡、血管生成、侵袭及转移等,从而在肿瘤进展过程中发挥抑癌或者促癌作用[10-12]。ZHAO等[13]研究发现:miR-424-5p在HCC中表达下调,功能学实验证实过表达miR-424-5p可通过影响细胞周期从而抑制HCC细胞的增殖能力,进一步研究发现癌基因E2F7介导了miR-424-5p对HCC细胞增殖能力的抑制作用。另有研究发现miR-3174在HCC组织和细胞中表达上调,并且其高表达与肿瘤大小相关;功能学研究发现过表达miR-3174可促进细胞增殖且抑制细胞凋亡,进一步机制探索发现miR-3174可靶向抑制FOXO1,进而调控Bim、P21、cyclin D1及c-myc等基因的表达,从而发挥其生物学功能[14]。本课题组之前的研究也发现:在HCC中高基质硬度环境下miR-3682-3p的表达上调,后者可通过促进细胞凋亡从而抑制HCC细胞的增殖[15]。还发现miR-769-5p[16]和miR-130-3p[17]在HCC中高表达,而且其可以促进HCC细胞增殖和迁移能力,在HCC进展中发挥促癌作用。YU等[18]研究表明:处于缺氧微环境中的HCC细胞可分泌大量包含miR-1273f的外泌体,在外泌体的介导下,miR-1273f可与处在常氧环境下的肿瘤细胞发生交互作用,促进其增殖能力。另外,有研究发现miR-3934-5p在非小细胞肺癌和神经母细胞瘤中均发挥促癌功能,可影响肿瘤细胞的增殖从而促进肿瘤进展[4-5]。本研究结果显示:miR-3934-5p在肝癌组织及细胞中表达上调,且其高表达与较恶的临床病理特征和较差的生存预后相关,提示miR-3934-5p在HCC进展中可能发挥促癌功能;CCK-8实验、平板克隆实验及EdU实验证实敲减miR-3934-5p显著抑制HCC细胞的活性及增殖能力。而缺氧微环境或者高基质硬度微环境是否可以作为上游驱动因素影响miR-3934-5p在HCC中的表达,我们将在后续的研究中进行探索。
LACTB是一种存在于哺乳动物肝脏、心脏和骨骼肌等组织细胞线粒体膜间隙的可溶性聚合体蛋白[19]。研究表明LACTB作为一种与脂质代谢有关的蛋白[7],可以参与人体的多种生理生化反应,并在其中发挥重要作用[6, 20]。KECKESOVA等[7]早在2017年就发现LACTB在乳腺癌组织和细胞系中表达下调,进一步研究证实LACTB通过影响线粒体脂质代谢和肿瘤细胞的状态进而发挥抑癌作用。从此,LACTB在其他肿瘤发生、发展过程中的作用逐渐被探索。在结直肠癌中研究发现:LACTB通过与MDM2竞争型结合p53,减少p53的降解从而稳定其表达,最终LACTB通过抑癌蛋白p53发挥其抑癌功能[21-23]。另外,XUE等[9]发现LACTB在肝癌组织中异常低表达,并且其低表达与肝癌患者的预后相关,进一步实验发现LACTB参与肝癌细胞的增殖、迁移和侵袭等生物学过程,证实LACTB在HCC中的抑癌作用。本研究通过TargetScan数据库预测到LACTB是miR-3934-5p的潜在下游靶点。经过统计学分析,发现在HCC组织中LACTB mRNA和miR-3934-5p的表达呈负相关;在HCCLM3细胞中敲减miR-3934-5p可上调LACTB的表达,即miR-3934-5p可负向调控LACTB的表达;接着通过双荧光素酶报告基因实验证实miR-3934-5p与LACTB mRNA 3′UTR之间存在直接结合;最后,通过回复实验证实LACTB介导了miR-3934-5p的生物学功能。
综上所述,本研究发现miR-3934-5p在HCC组织及细胞中异常高表达,且其高表达与不良临床病理特征和较差的生存预后显著相关。在HCC细胞中,敲减miR-3934-5p可通过靶向上调抑癌基因LACTB的表达从而抑制HCC细胞的增殖能力。表明miR-3934-5p可作为潜在的HCC分子标志物和治疗靶点。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
LI Y, WANG X Y, LI Z G, et al. MicroRNA-4651 represses hepatocellular carcinoma cell growth and facilitates apoptosis via targeting FOXP4[J]. Biosci Rep, 2020, 40(6): BSR20194011. |
| [3] |
MAJID A, WANG J X, NAWAZ M, et al. miR-124-3p suppresses the invasiveness and metastasis of hepatocarcinoma cells via targeting CRKL[J]. Front Mol Biosci, 2020, 7: 223. |
| [4] |
REN A J, WEN Z Z, ZHENG L J. Downregulation of miR-3934-5p enhances A549 cell sensitivity to cisplatin by targeting TP53INP1[J]. Exp Ther Med, 2019, 18(3): 1653-1660. |
| [5] |
YE W, LIANG F, YING C, et al. Downregulation of microRNA-3934-5p induces apoptosis and inhibits the proliferation of neuroblastoma cells by targeting TP53INP1[J]. Exp Ther Med, 2019, 18(5): 3729-3736. |
| [6] |
CUCCHI D, MAURO C. LACTB-mediated tumour suppression by increased mitochondrial lipid metabolism[J]. Cell Death Differ, 2017, 24(7): 1137-1139. |
| [7] |
KECKESOVA Z, DONAHER J L, DE COCK J, et al. LACTB is a tumour suppressor that modulates lipid metabolism and cell state[J]. Nature, 2017, 543(7647): 681-686. |
| [8] |
ZENG K, CHEN X, HU X, et al. LACTB, a novel epigenetic silenced tumor suppressor, inhibits colorectal cancer progression by attenuating MDM2-mediated p53 ubiquitination and degradation[J]. Oncogene, 2018, 37(41): 5534-5551. |
| [9] |
XUE C, HE Y, ZHU W, et al. Low expression of LACTB promotes tumor progression and predicts poor prognosis in hepatocellular carcinoma[J]. Am J Transl Res, 2018, 10(12): 4152-4162. |
| [10] |
LI Y, ZHOU Y, MA L, et al. MiR-3677-3p promotes hepatocellular carcinoma progression via inhibiting GSK3β[J]. Acta Biochim Biophys Sin (Shanghai), 2020, 52(12): 1404-1412. |
| [11] |
SI T, NING X J, ZHAO H W, et al. MicroRNA-9-5p regulates the mitochondrial function of hepatocellular carcinoma cells through suppressing PDK4[J]. Cancer Gene Ther, 2020, 1-13. |
| [12] |
DUAN X H, LI W, HU P, et al. MicroRNA-183-5p contributes to malignant progression through targeting PDCD4 in human hepatocellular carcinoma[J]. Biosci Rep, 2020, 40(10): BSR20201761. |
| [13] |
ZHAO Y C, ZHU C Q, CHANG Q, et al. MiR-424-5p regulates cell cycle and inhibits proliferation of hepatocellular carcinoma cells by targeting E2F7[J]. PLoS One, 2020, 15(11): e0242179. |
| [14] |
WANG Q, YANG X, ZHOU X, et al. MiR-3174 promotes proliferation and inhibits apoptosis by targeting FOXO1 in hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2020, 526(4): 889-897. |
| [15] |
YAO B W, NIU Y S, LI Y Z, et al. High-matrix-stiffness induces promotion of hepatocellular carcinoma proliferation and suppression of apoptosis via miR-3682-3p-PHLDA1-FAS pathway[J]. J Cancer, 2020, 11(21): 6188-6203. |
| [16] |
XIAN Y, WANG L, YAO B, et al. MicroRNA-769-5p contributes to the proliferation, migration and invasion of hepatocellular carcinoma cells by attenuating RYBP[J]. Biomed Pharmacother, 2019, 118: 109343. |
| [17] |
张雷, 王宇锋, 王亮, 等. miR-130b-3p通过靶向作用于INTS6促进肝细胞癌生长和转移[J]. 山西医科大学学报, 2019, 50(5): 543-550. ZHANG L, WANG Y F, WANG L, et al. The miR-130b-3p promotes metastasis and proliferation of hepatocellular carcinoma by targeting INTS6[J]. J Shanxi Med Univ, 2019, 50(5): 543-550. |
| [18] |
YU Y, MIN Z, ZHOU Z, et al. Hypoxia-induced exosomes promote hepatocellular carcinoma proliferation and metastasis via miR-1273f transfer[J]. Exp Cell Res, 2019, 385(1): 111649. |
| [19] |
POLIANSKYTE Z, PEITSARO N, DAPKUNAS A, et al. LACTB is a filament-forming protein localized in mitochondria[J]. Proc Natl Acad Sci USA, 2009, 106(45): 18960-18965. |
| [20] |
LI H T, DONG D Y, LIU Q, et al. Overexpression of LACTB, a mitochondrial protein that inhibits proliferation and invasion in glioma cells[J]. Oncol Res, 2019, 27(4): 423-429. |
| [21] |
LANG V, PALLARA C, ZABALA A, et al. Tetramerization-defects of p53 result in aberrant ubiquitylation and transcriptional activity[J]. Mol Oncol, 2014, 8(5): 1026-1042. |
| [22] |
RUSSO A, ESPOSITO D, CATILLO M, et al. Human rpL3 induces G1/S arrest or apoptosis by modulating p21 (Waf1/cip1) levels in a p53-independent manner[J]. Cell Cycle, 2013, 12(1): 76-87. |
| [23] |
WALERYCH D, LISEK K, SOMMAGGIO R, et al. Proteasome machinery is instrumental in a common gain-of-function program of the p53 missense mutants in cancer[J]. Nat Cell Biol, 2016, 18(8): 897-909. |




