心血管疾病是老年人群的主要疾患之一,也是主要死亡因素之一[1]。D-半乳糖(D-galactose,D-gal)是公认的氧化致衰剂,已经广泛用于动物衰老模型与体外细胞衰老模型的构建。D-gal构建动物衰老模型可致机体多种器官出现氧化应激损伤[2-3]。我们既往研究显示,人参皂苷Rg1是中医临床“补气要药”人参的重要抗衰老成分,它能拮抗D-gal所致的脑、肝脏、肾脏和生殖腺等多个器官的氧化应激损伤[4-5]。有研究证明[6-7],人参皂苷Rg1对心脑血管疾病和心肌细胞损伤有良好的预防作用,但其机制尚不清楚。本研究采用D-gal构建小鼠心脏损伤模型,探讨人参皂苷Rg1拮抗D-gal所致小鼠心脏损伤的保护作用及其激活Nrf2抗氧化信号通路的初步机制。
1 材料与方法 1.1 实验动物8周龄C57BL/6J小鼠,体质量15~20 g,雌雄各半,由重庆医科大学实验动物中心提供[合格证号: SCXK(渝)2007-0001]。
1.2 材料与试剂人参皂苷Rg1(成都曼思特生物科技有限公司,纯度>99%);D-半乳糖(上海麦克林生化科技有限公司, 纯度>99%);BCA蛋白浓度测定试剂盒与超氧化物歧化酶试剂盒(上海碧云天生物技术研究所);总超氧化物歧化酶(total superoxide dismutase, T-SOD)、丙二醛(malondialdehyde, MDA)、过氧化氢酶(catalase, CAT)、谷草转氨酶(aspartate aminotransferase, AST/GOT)与乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒(南京建成科技有限公司);兔单克隆抗体Nrf2、兔单克隆抗体Keap1、兔单克隆抗体HO-1、β-actin鼠单克隆抗体、山羊抗鼠二抗、山羊抗兔二抗(Signaling公司)。
1.3 D-gal损伤小鼠模型构建与分组给药小鼠按抽签法随机分为4组,每组10只。D-gal损伤模型组[8]:腹腔注射D-gal(200 mg·kg-1·d-1×42 d);Rg1干预模型组:按D-gal损伤模型组小鼠处理,从建模第16天起腹腔注射Rg1(40 mg·kg-1·d-1×26 d);对照组:腹腔注射等量生理盐水42 d;Rg1对照组:按对照组处理小鼠16 d,再腹腔注射Rg1(剂量同Rg1干预模型组)。建模与给药完成后第2天检测相关指标。
1.4 小鼠生物学表现观察损伤造模过程中每天观察记录各组小鼠生物学表现(包括小鼠精神状态、活动能力、毛色、饮食与饮水量、大便情况等,并测定体质量)。
1.5 心脏指数测定建模与给药完成后第2天称体质量(g),颈椎脱臼处死小鼠,快速取出心脏称湿质量(g),心脏指数=心脏湿质量(mg)/体质量(g)。
1.6 心脏组织学病理学观察5%多聚甲醛溶液固定心脏,常规方法制备石蜡切片,HE染色,光学显微镜下观察心肌组织结构变化,Masson染色观察胶原纤维沉积。每组随机选取5个视野,Image-Pro Plus图像分析软件进行细胞直径测量与心肌纤维间胶原纤维量计算。
1.7 心肌超微结构观察取各组小鼠左心室心尖部组织,2.5%戊二醛固定液前固定24 h,1%四氧化锇后固定2 h。乙醇与丙酮梯度脱水、Epon812树脂包埋,制成50~70 nm的超薄切片,醋酸双氧铀和硝酸铅电子染色,透射电镜下观察心肌纤维超微结构变化。
1.8 心肌酶测定与心肌氧化和抗氧化指标测定取各组小鼠适量心脏组织制备10%组织匀浆,3 500 r/min离心10 min,收集上清液。BCA蛋白浓度测定试剂盒检测各组上清液的蛋白浓度,按AST、LDH(n=5),MDA、T-SOD、CAT(n=6)检测试剂盒说明书进行相关检测并分析数据。
1.9 心脏组织中Nrf2、Keap1、HO-1蛋白表达量检测取冷冻心脏组织制备蛋白样品,BCA蛋白浓度试剂盒检测各组蛋白浓度。蛋白定量后调整其浓度,按30 μg/泳道加样。SDS-PAGE凝胶分离,PVDF膜进行转膜,5%脱脂奶粉封闭2 h。兔抗Nrf2(1 ∶1 000)、兔抗Keap1(1 ∶1 000)、兔抗HO-1(1 ∶1 000)、鼠抗β-actin(1 ∶1 000),4 ℃孵育过夜,山羊抗鼠二抗(1 ∶10 000)、山羊抗兔二抗(1 ∶10 000)室温摇床孵育2 h,洗膜,ECL发光液显色,Image J软件计算目的蛋白与内参蛋白β-actin比值。
1.10 统计学分析用GraphPad Prism统计软件进行分析和作图,实验数据以x±s表示,各组间比较采用t检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠生物学动态情况随着注射D-gal时间和累计剂量增加,D-gal损伤模型组小鼠毛发逐渐粗糙,毛色晦暗,精神萎靡,活动能力下降,进食较少,大便稀溏,体质量增加缓慢,其余3组无明显不良体征。
2.2 Rg1对D-gal损伤小鼠心脏质量及心脏指数影响D-gal损伤模型组小鼠心脏指数明显升高,Rg1干预模型组心脏指数明显降低(P < 0.01,表 1)。
| 组别 | 心脏湿质量/g | 体质量/g | 心脏指数 |
| 对照组 | 0.095 7±0.000 9 | 20.390±0.217 | 4.695±0.031 |
| D-gal损伤模型组 | 0.100 7±0.001 2 | 20.290±0.172 | 4.965±0.066a |
| Rg1对照组 | 0.096 5±0.001 2 | 20.950±0.196 | 4.606±0.032b |
| Rg1干预模型组 | 0.096 1±0.001 4 | 20.310±0.207 | 4.731±0.031b |
| a:P < 0.01,与对照组比较; b:P < 0.01,与D-gal损伤模型组比较 | |||
2.3 Rg1对D-gal损伤小鼠心肌组织病理学影响
对照组心肌纤维排列整齐,形态正常,胞质染色均匀;D-gal损伤模型组小鼠心肌纤维排列紊乱,心肌纤维直径增大(P < 0.01),胞质染色不均,心肌纤维肿胀,部分心肌纤维断裂和坏死;注射Rg1干预后,心肌纤维直径增大不明显,心肌纤维排列和形态基本正常(图 1、2)。
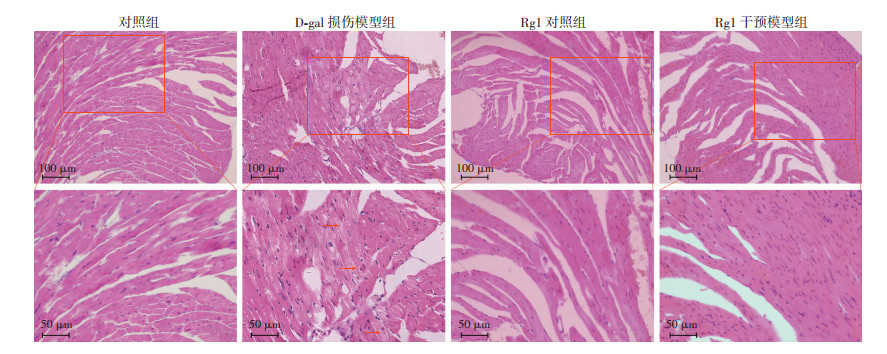
|
| 箭头示受损的心肌纤维 图 1 HE染色观察Rg1对D-gal损伤小鼠心肌组织的影响 |
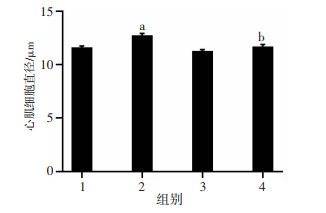
|
| 1:对照组;2:D-gal损伤模型组;3:Rg1对照组;4:Rg1干预模型组;a:P < 0.01,与对照组比较;b:P < 0.05,与D-gal损伤模型组比较 图 2 Rg1对D-gal损伤小鼠心肌细胞直径的影响 |
2.4 Rg1对D-gal损伤小鼠心脏纤维超微结构的影响
对照组超微结构形态正常,表现为肌丝束排列整齐,肌节明带、暗带、Z线、M线等结构完整,线粒体排列整齐。D-gal损伤模型组心肌肌丝束排列紊乱,肌节及明暗带结构不清楚,心肌纤维部分线粒体嵴断裂,基质肿胀,排列不齐;Rg1干预后,心肌纤维损伤明显减轻,胶原纤维沉积减少(图 3)。

|
| 图 3 Rg1对D-gal损伤小鼠心肌纤维超微结构的影响 |
2.5 Rg1对D-gal损伤小鼠心脏胶原纤维沉积的影响
对照组无明显胶原纤维沉积;D-gal损伤模型组胶原纤维沉积增多;Rg1干预后,胶原纤维沉积明显减少(图 4)。
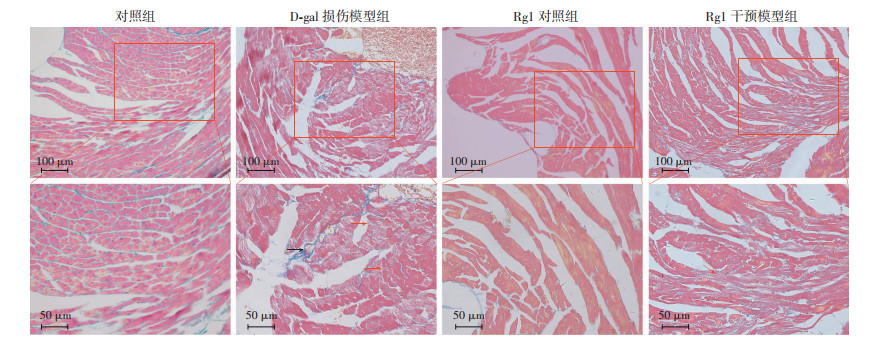
|
| 红色箭头示受损的心肌纤维,黑色箭头示胶原纤维沉积 图 4 Masson染色观察Rg1对D-gal损伤小鼠心脏胶原纤维沉积的影响 |
2.6 Rg1对D-gal损伤小鼠心脏组织心肌酶谱的影响
D-gal损伤模型组AST活力显著增加(P < 0.05),LDH活力显著增加(P < 0.01);Rg1干预模型组AST、LDH活力显著降低(P < 0.05,表 2)。
| 组别 | AST/U·g-1 | LDH/U·g-1 |
| 对照组 | 14.84±2.42 | 3 278.3±176.4 |
| D-gal损伤模型组 | 18.56±1.55a | 3 878.9±252.2b |
| Rg1对照组 | 15.43±1.18d | 3 219.3±232.6d |
| Rg1干预模型组 | 15.54±1.49c | 3 440.5±117.9c |
| a:P < 0.05, b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与D-gal损伤模型组比较 | ||
2.7 Rg1对D-gal损伤小鼠心脏组织氧化与抗氧化损伤的影响
D-gal损伤模型组T-SOD活性显著降低(P < 0.05),MDA含量显著增加,CAT活性显著降低(P < 0.01);Rg1干预模型组T-SOD、CAT活性较损伤模型组显著增加,MDA含量显著降低(P < 0.05,表 3)。
| 组别 | T-SOD/U·mg-1 | CAT/U·mg-1 | MDA/μmol·mg-1 |
| 对照组 | 95.29±3.54 | 50.84±4.13 | 1.28±0.05 |
| D-gal损伤模型组 | 84.07±2.60a | 23.31±5.89b | 1.51±0.03b |
| Rg1对照组 | 102.60±3.97d | 60.47±6.86d | 1.26±0.09c |
| Rg1干预模型组 | 97.55±4.31c | 49.88±8.89c | 1.32±0.06c |
| a:P < 0.05, b:P < 0.01,与对照组比较;c:P < 0.05,d:P < 0.01,与D-gal损伤模型组比较 | |||
2.8 Rg1对D-gal损伤小鼠心脏组织Nrf2、Keap1、HO-1蛋白表达的影响
Western blot结果显示,与对照组相比,D-gal损伤模型组Nrf2表达量明显降低(P < 0.05),HO-1的表达量明显降低(P < 0.01),Keap1表达量无明显变化;Rg1干预后,Nrf2、HO-1表达量明显升高,Keap1表达量明显降低(P < 0.01,图 5)。
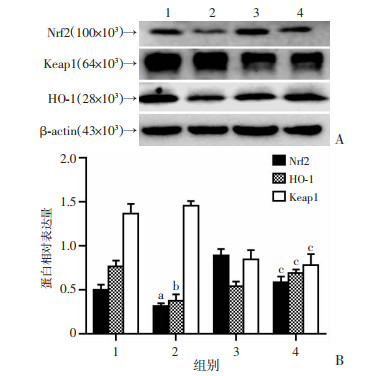
|
|
1:对照组;2:D-gal损伤模型组;3:Rg1对照组;4:Rg1干预模型组 A:Western blot检测结果;B:半定量分析结果a: P < 0.05, b: P < 0.01, 与对照组比较;c:P < 0.01,与D-gal损伤模型组比较 图 5 Rg1对D-gal损伤小鼠心脏组织Nrf2、Keap1、HO-1蛋白表达的影响 |
3 讨论
随着年龄的增长,心脏逐渐出现器官水平和细胞水平的退行性改变,从而诱发冠心病、心力衰竭等与心脏衰老相关疾病。人参是中医临床补气要药,人参皂苷Rg1是人参重要的抗衰老单体成分,具有抗氧化应激损伤和延缓细胞衰老作用[4-5]。本研究采用D-半乳糖(D-gal)构建小鼠损伤模型,探讨人参皂苷Rg1拮抗D-gal对心脏的氧化损伤作用与激活Nrf2抗氧化信号通路的初步机制。
D-gal是一种公认的氧化致衰剂,用其构建的衰老动物模型与自然衰老相似,已被广泛用于抗衰老药物的研究[9]。研究证明[10],D-gal对组织细胞有明确的致衰作用,对心脏具有氧化应激损伤作用。脏器指数测定和组织病理学观察可反映器官结构的变化,本实验结果表明,随着注射D-gal时间和累计剂量增加,损伤模型组小鼠脏器指数明显增加;组织病理学和超微结构观察显示,D-gal可致心肌排列紊乱,心肌纤维出现退行性损伤,心肌纤维的线粒体肿胀,形态异常;胶原纤维沉积量增多,提示D-gal能造成心脏结构损伤。在建立损伤模型中注射Rg1干预进程,结果证明,心脏指数显著降低,心肌组织结构和超微结构损伤明显减轻;胶原纤维沉积量也明显减少,说明Rg1能拮抗D-gal对心脏结构的损伤。
心肌特异性酶检测是评价心肌损伤的重要指标,当心肌纤维损伤坏死时,细胞膜通透性增强时,大量心肌酶将释放入血液, 通过测定心肌酶水平有助于诊断心肌损伤程度[11]。本研究结果表明,D-gal损伤模型组小鼠心肌组织匀浆中谷草转氨酶(AST)和乳酸脱氢酶(LDH)活力显著上升,Rg1干预后AST和LDH活力均显著降低,这进一步证明Rg1有明确保护心脏作用。氧化应激学说是细胞损伤的主要学说;细胞内含有大量的抗氧化物质,如SOD能将细胞内的超氧化物自由基转化为过氧化氢和分子氧,而CAT能将过氧化氢转化为水,通过这种方式以可防止或修复由超氧化物自由基和过氧化氢引起的细胞损伤[12-13]。丙二醛(MDA)是脂质过氧化作用的稳定最终产物,是间接测量脂质过氧化作用的指标之一[14]。本研究结果表明,D-gal损伤模型小鼠的心肌组织匀浆中T-SOD、CAT活性显著降低,MDA表达量显著升高,采用Rg1干预后,T-SOD、CAT活性显著升高,MDA表达量显著降低。以上结果提示Rg1拮抗D-gal对小鼠心脏损伤的机制与降低氧化应激有关。
研究证明[15]Keap1/Nrf2/ARE信号通路是重要的抗氧化应激通路。正常情况时,Nrf2处于非活化状态,与Keap1结合于细胞质内;氧化应激时,Keap1中的-SH基团的修饰和Nrf2的磷酸化促进了Nrf2与Keap1解离并易位到核中,Nrf2结合Maf蛋白后,激活抗氧化剂反应元件(ARE)并增加Nrf2调控基因HO-1的转录,发挥抗氧化的作用[16]。本研究结果表明,D-gal损伤模型小鼠心脏组织匀浆中Nrf2、HO-1蛋白表达量显著减少,Rg1干预后,Nrf2、HO-1表达量明显增加,Keap-1表达量明显减少,提示Rg1拮抗D-gal对小鼠心脏氧化损伤可能与激活Keap1-Nrf2-ARE通路相关。
综上所述,Rg1的干预能有效拮抗D-gal对心肌的损伤,其机制可能是Rg1抑制D-gal对心脏的氧化应激损伤,以及上调了Keap1/Nrf2/ARE信号通路。
| [1] |
FAJEMIROYE J O, DA CUNHA L C, SAAVEDRA-RODRÍGUEZ R, et al. Aging-induced biologi-cal changes and cardiovascular diseases[J]. Biomed Res Int, 2018, 2018: 7156435. |
| [2] |
侯吉颖, 陈雄斌, 陈粼波, 等. D-半乳糖诱导大鼠骨髓基质细胞衰老及其机制[J]. 基础医学与临床, 2017, 37(3): 307-312. HOU J Y, CHEN X B, CHEN L B, et al. Senescence induced by D-galactose and its biological mechanism in rat bone marrow stromal cells[J]. Basic Clin Med, 2017, 37(3): 307-312. |
| [3] |
LI J, CAI D, YAO X, et al. Protective effect of Ginsenoside Rg1 on hematopoietic stem/progenitor cells through attenu-ating oxidative stress and the Wnt/β-catenin signaling path-way in a mouse model of d-Galactose-induced aging[J]. Int J Mol Sci, 2016, 17(6): 849. |
| [4] |
向玥, 陈粼波, 姚辉, 等. 人参皂苷Rg1对D-半乳糖所致衰老小鼠海马的保护机制[J]. 中草药, 2017, 48(18): 3789-3795. XIANG Y, CHEN L B, YAO H, et al. Protective mechanism of ginsenoside Rg1 on Hippocampus of aging mice induced by D-galactose[J]. Chin Tradit Herb Drugs, 2017, 48(18): 3789-3795. |
| [5] |
ZHU J, MU X, ZENG J, et al. Ginsenoside Rg1 prevents cognitive impairment and Hippocampus senescence in a rat model of D-galactose-induced aging[J]. PLoS ONE, 2014, 9(6): e101291. |
| [6] |
TANG F, LU M, YU L, et al. Inhibition of TNF-α-mediated NF-κB activation by ginsenoside Rg1 contributes the attenuation of cardiac hypertrophy induced by abdominal aorta coarctation[J]. J Cardiovasc Pharmacol, 2016, 68: 257-264. |
| [7] |
DONG G, CHEN T, REN X, et al. Rg1 prevents myocardial hypoxia/reoxygenation injury by regulating mitochondrial dynamics imbalance via modulation of glutamate dehydro-genase and mitofusin 2[J]. Mitochondrion, 2016, 26: 7-18. |
| [8] |
EL-BAZ F K, SALEH D O, ABDEL JALEEL G A. Heamatococcus Pluvialis ameliorates bone loss in experi-mentally-induced osteoporosis in rats via the regulation of OPG/RANKL pathway[J]. Biomedecine Pharmacother, 2019, 116: 109017. |
| [9] |
HO S C, LIU J H, WU R Y, et al. Establishment of the mimetic aging effect in mice caused by D-galactose[J]. Biogerontology, 2003, 4(1): 15-18. |
| [10] |
BO-HTAY C, PALEE S, APAIJAI N, et al. Effects of d-galactose-induced ageing on the heart and its potential interventions[J]. J Cell Mol Med, 2018, 22(3): 1392-1410. |
| [11] |
WANG R, WANG M, ZHOU J, et al. Shuxuening injection protects against myocardial ischemia-reperfusion injury through reducing oxidative stress, inflammation and thrombosis[J]. Ann Transl Med, 2019, 7(20): 562. |
| [12] |
WEYDERT C J, CULLEN J J. Measurement of superoxide dismutase, catalase and glutathione peroxidase in cultured cells and tissue[J]. Nat Protoc, 2010, 5(1): 51-66. |
| [13] |
LIU B H, MA R D, ZHANG J, et al. Preventive effect of small-leaved Kuding tea (Ligustrum robustum (roxb.) bl.) polyphenols on D-galactose-induced oxidative stress and aging in mice[J]. Evid Based Complement Alternat Med, 2019, 2019: 3152324. |
| [14] |
MAO C, YUAN J Q, LV Y B, et al. Associations between superoxide dismutase, malondialdehyde and all-cause mortality in older adults: a community-based cohort study[J]. BMC Geriatr, 2019, 19(1): 104. |
| [15] |
段懿涵, 盛瑜, 徐健, 等. 姬松茸多糖对D-半乳糖诱导的衰老模型小鼠的抗衰老作用及其Keap1/Nrf2/ARE信号转导途径机制[J]. 吉林大学学报(医学版), 2020, 46(2): 346-351, 435. DUAN Y H, SHENG Y, XU J, et al. Anti-aging effects of Agaricus blazei polysaccharide in D-galactose-induced aging model mice and Keap1/Nrf2/ARE signal transduction pathway mechanism[J]. J Jilin Univ Med Ed, 2020, 46(2): 346-351, 435. |
| [16] |
BELLEZZA I, GIAMBANCO I, MINELLI A, et al. Nrf2-Keap1 signaling in oxidative and reductive stress[J]. Biochim Biophys Acta Mol Cell Res, 2018, 1865(5): 721-733. |




