2. 510220 广州,中国人民解放军陆军第七十四集团军医院重症医学科
2. Department of Critical Care Medicine, the PLA 74th Group Army Hospital, Guangzhou, Guangdong Province, 510220, China
疟疾是一种严重的蚊媒传染病。据世界卫生组织(WHO)报告,2018年全球疟疾感染病例数约2.28亿,其中大部分来自非洲、东南亚及地中海等地区,死亡人数高达40.5万人次[1]。然而,目前仍无有效的疟疾治疗疫苗[2],且抗疟药物的滥用也引发了广泛的抗药性[3-4]。因此,控制媒介生物按蚊的种群数量是阻断疟疾传播最有效的方法之一。大劣按蚊(Anopheles dirus)是我国重要的传疟媒介之一,在我国海南省和西南部地区较为常见[5]。按蚊属于卵生动物,其体内卵黄蛋白(yolk protein, YP)能够为胚胎发育提供需要的营养物质。卵黄蛋白原(vitellogenin, Vg)是几乎所有卵生动物YP的前体,对卵生动物卵巢的成熟及蚊卵的发育起着至关重要的作用[6-7]。因此,围绕Vg分子研究大劣按蚊的生殖生理机制,通过改变蚊虫繁殖能力控制蚊虫种群密度的研究工作相继开展[8-10]。
然而,目前关于大劣按蚊生殖生理的分子机制尚少见报道。因此在前期获得大劣按蚊Vg基因cDNA片段的基础上[10],本研究拟通过cDNA末端快速扩增(rapid amplification of cDNA ends, RACE)技术对大劣按蚊卵黄蛋白原(Anopheles dirus vitellogenin,AdVg)基因的5′末端及3′末端进行RACE扩增,然后利用Vector NTI软件进行校正、拼接得到全长序列。最后,通过结构域预测分析,构建重组质粒,表达和纯化得到重组蛋白,为进一步探究分析其在大劣按蚊体内的功能和作用提供了依据和条件。
1 材料与方法 1.1 蚊种及实验动物大劣按蚊海南株由陆军军医大学军事预防医学系热带医学教研室常规饲养保种。饲养条件为28 ℃、相对湿度80%,幼虫喂饲自制酵母猪肝干粉,成蚊喂饲10%蔗糖水。健康昆明小鼠2只,体质量16~20 g,雌雄不限,供3 d龄大劣按蚊成蚊饲血,由陆军军医大学实验动物中心提供。
1.2 主要试剂Trizol裂解液购自杭州博日科技有限公司;三氯甲烷和异丙醇购自成都科隆化学品有限公司;MEGAscriptTM RNAi Kit购自Invitrogen公司;OMEGA Plasmid Mini Kit I试剂盒、PrimeScriptTM逆转录试剂盒、DNA胶回收试剂盒购自日本TaKaRa公司;引物序列合成来自上海生工生物工程有限公司。
1.3 大劣按蚊卵黄蛋白原基因的RACE扩增及全长序列拼接 1.3.1 引物设计根据课题组前期研究获得大劣按蚊Vg基因的cDNA片段进行RACE引物Gene-Specific Primers(GSPs)设计,遵循原则如下:23~28 nt;50~70% GC含量;Tm≥65 ℃,或touchdown PCR,Tm >70 ℃;与通用引物的3′末端不互补。本研究设计3′-RACE和5′-RACE引物序列GPS1和GPS2,见表 1。
| 名称 | 引物序列(5′→3′) | 引物长度/bp |
| GPS1 | CAAGGTTGTCGTCAGCCCGTCTC | 23 |
| GPS2 | ACGGTGTTGGTCACGCTGGTATG | 23 |
1.3.2 RACE扩增
参照SMARTTMRACE cDNA Amplification kit说明书进行,合成3′-RACE-Ready cDNA和5′-RACE-Ready cDNA后,分别进行3′-RACE和5′-RACE PCR扩增。3′-RACE PCR的反应体系为:15.5 μL PCR-Grade H2O,25.0 μL 2×SeqAmpTMBuffer,1.0 μL SeqAmp DNA Polymerase,混匀后加入2.5 μL 3′-RACE-Ready cDNA,5 μL 10×UPM,1 μL GSP1,反应体系为50 μL。5′-RACE PCR的反应体系为:15.5 μL PCR-Grade H2O,25.0 μL 2×SeqAmpTMBuffer,1.0 μL SeqAmp DNA Polymerase,混匀后分别加入2.5 μL 5′-RACE-Ready cDNA,5 μL 10×UPM,1 μL GSP2,反应体系为50 μL。然后分别进行touchdown PCR,5′-RACR PCR的反应条件(3′-RACE PCR的反应条件不同点见括号内)为:94 ℃ 30 s,72 ℃ 2min(3′-RACE产物>3 kb,故3′-RACE设置为8 min)5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min(3′-RACE设置为8 min)5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min(3′-RACE设置为4 min),25个循环。
1.3.3 x目的片段测序及序列分析将RACE PCR产物进行1%琼脂糖凝胶电泳,切胶后进行纯化回收,并将纯化产物连接于pMD-18T质粒上送至Invitrogen公司进行测序。测序结果用Vector NTI 11.5软件进行校正、拼接以得到AdVg基因完整的cDNA序列。随后对序列进行比对分析,并通过BankIt上传至NCBI数据库。
1.4 AdVg蛋白结构域及三级结构的预测与分析利用NCBI对AdVg蛋白的结构域进行预测与分析[11]。并通过Swiss Model预测蛋白三级结构,对富含丝氨酸的区域进行分析。
1.5 功能域蛋白的表达与纯化依照选定功能域的氨基酸序列,利用OVERLAP方法形成模板DNA,再利用PCR扩增的方法得到双链DNA。然后将PCR产物连接到pet28a(+)质粒中,转化至大肠杆菌,利用大肠杆菌表达系统进行蛋白的表达[12]并进一步做亲和纯化。
1.5.1 质粒转化及阳性克隆的小量表达与鉴定在冰上将5 μg目的质粒加入到100 μL Rosetta(DE3)感受态细胞中,混匀后静置30 min;水浴锅42 ℃热击90 s,冰上放置2 min;加入800 μL预热的LB液体培养基,37 ℃ 158 r/min培养50~60 min;6 000 r/min离心4 min,保留150 μL菌液重悬混匀后涂至LB(卡那抗性)平板上;倒置平板,37 ℃培养12~16 h。随后,挑选含重组质粒的单菌落至10 mL LB液体培养基(卡那抗性)中,其中5 mL在37 ℃培养过夜后于-20 ℃保种;余下5 mL在37 ℃震荡培养至D(600)约为0.6,然后取部分菌液作为对照组,余下菌液加入IPTG(终浓度1 mmol/L)进行诱导表达,37 ℃震荡培养4 h;取0.15 mL菌液,12 000×g离心2 min,沉淀以40 μL 1×loading buffer重悬裂解并取10 μL用于SDS-PAGE检测。
1.5.2 蛋白表达分布检测取4 μL保存菌种接种于4 mL LB液体培养基(卡那抗性)中震荡培养16 h;然后将全部菌液接种于400 mL LB液体培养基中,37 ℃扩大培养至D(600)约为0.6,然后加入IPTG进行诱导,30 ℃继续震荡培养8 h;8 000 r/min离心3 min,弃上清,收集菌体重悬于50 mL预冷的NTA-0缓冲液中,加溶菌酶(终浓度0.1 mg/mL),冰浴30 min;超声(功率200 W、工作3 s、暂停4 s、时间15 min)破碎菌体;16 000 r/min 4 ℃离心50 min,分别取10 μL上清及沉淀进行SDS-PAGE检测。
1.5.3 蛋白大量表达及破菌检测取100 μL上述保存的菌种进行表达和破菌检测,方法同1.5.2。
1.5.4 包涵体蛋白纯化以50 mL STET缓冲液将1.5.3中收集到的沉淀重悬并加入DTT(1 mmol/L);超声(200 W、工作3 s、暂停3 s)10 min以促进杂蛋白溶解;10 000 r/min 4 ℃离心10 min,去上清;重复上诉步骤至上清透明;沉淀以PBS重悬,超声(功率200 W、工作3 s、暂停3 s)10 min;16 000 r/min 4 ℃离心10 min,去上清;以3 mL 6 mol/L盐酸胍重悬包涵体并加入DTT(5 mmol/L);220 r/min 37 ℃震荡4 h至包涵体全部溶解;10 000 r/min 4 ℃离心10 min,取上清。取蛋白溶液10 μL进行SDS-PAGE检测。
1.5.5 包涵体蛋白复性在4 ℃环境下,用注射器将2倍体积的3 mol/L盐酸胍稀释蛋白溶液逐滴加入到200 mL复性液(pH=8.0)中,最大转速搅拌24 h;降低转速再搅拌24 h;以PEG20000将蛋白溶液浓缩体积至50~100 mL并在4 ℃以TE缓冲液透析48 h;再以PEG20000将蛋白溶液浓缩体积至10~20 mL在4 ℃以TE缓冲液透析48 h。
1.5.6 复性蛋白纯化用0.22 μm过滤器过滤1.5.5中获得的上清蛋白溶液备用;准备Ni-NTA柱,以1 mL/min的流速上样;以NTA-0缓冲液(pH=8.0)洗柱至流出液不含蛋白;以咪唑(20、60、200和500 mmol/L) 梯度洗脱至G250检测液不变色;以3倍柱体积去离子水洗涤柱料,以20%乙醇封柱;取10 μL透析浓缩洗脱液进行SDS-PAGE电泳检测。
2 结果 2.1 AdVg基因RACE PCR扩增结果AdVg基因的5′-RACE PCR产物经1%琼脂糖凝胶电泳检测可见一条1 500 bp左右的条带,3′-RACE PCR产物经1%琼脂糖凝胶电泳检测可见一条5 000 bp左右的条带。电泳结果如图 1。
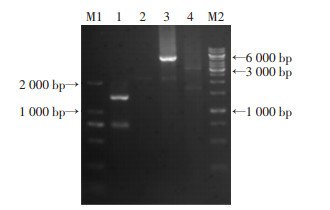
|
| M1:DL2000 DNA Marker;1:AdVg 5′ RACE扩增产物;2:试剂盒5′ RACE扩增阳性对照;3:AdVg 3′ RACE扩增产物;4:试剂盒3′ RACE扩增阳性对照;M2:1kb DNA Marker 图 1 RACE PCR产物电泳结果 |
2.2 AdVg基因全长序列分析
利用Vector NTI 11.5软件对5′-RACE和3′-RACE扩增获得的序列进行校正和拼接,成功获得AdVg cDNA全长序列共6 477 bp,包含5′非翻译区(UTR)序列117 bp,开放阅读框(OFR)序列6 168 bp,3′UTR序列192 bp。AdVg全长cDNA序列结构组成示意图如图 2。AdVg开放阅读框序列翻译后的氨基酸序列共包含2 055个氨基酸,分子量约为226×103。对AdVg氨基酸序列进行比对分析,结果显示其与斯氏按蚊、库态按蚊、微小按蚊、浅色按蚊、美彩按蚊和冈比亚按蚊卵黄蛋白原氨基酸序列的同源性高达93.73%~94.51%。表明成功扩增出大劣按蚊卵黄蛋白原基因cDNA的全长序列。本研究获得的AdVg cDNA全长序列及开放阅读框翻译后的氨基酸序列均已提交至NCBI数据库,序列登录号为MW349850。
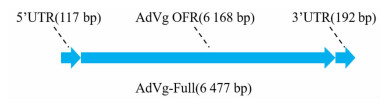
|
| 图 2 AdVg全长cDNA结构组成示意图 |
2.3 AdVg蛋白结构域及三级结构的预测和分析
利用NCBI预测AdVg蛋白的结构域(图 3A),包括卵黄蛋白N端结构域(vitellogenin N domain,Vit N)(41~851 aa),未知功能结构域(unknown function domain,DUF1943)(884~1 217 aa)和vWD结构域(von- Willebrand domain,vWD)(1 660~1 850 aa)。通过对AdVg氨基酸序列进行分析,其含有3个富含丝氨酸的区域,氨基酸位点分别为365~389 aa、448~489 aa及1 921~1 947 aa,结果见图 3B。利用Swiss Model对AdVg蛋白的三级结构进行预测,获得40~1 230 aa及1 383~1 628 aa序列的三级结构图,红框中蓝色部分为AdVg蛋白中富含丝氨酸的区域。
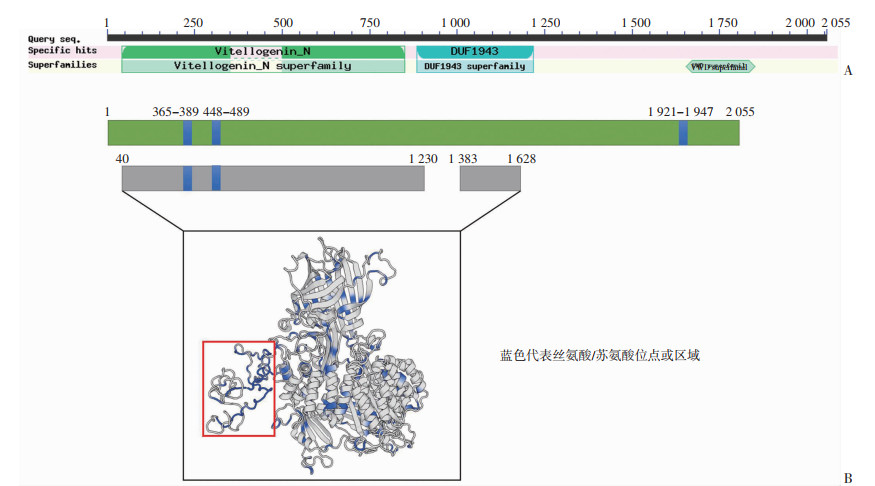
|
| A:AdVg蛋白结构域的预测;B:AdVg蛋白三级结构的预测 图 3 AdVg蛋白结构域及三级结构的预测 |
2.4 AdVg Vit N功能域蛋白重组质粒的构建
选取Vitellogenin N(41~851 aa)结构域进行后续的表达与纯化。将Vitellogenin N结构域对应的碱基序列构建入pet28a(+)质粒中,重组质粒图谱如图 4,红色即为插入序列部分。
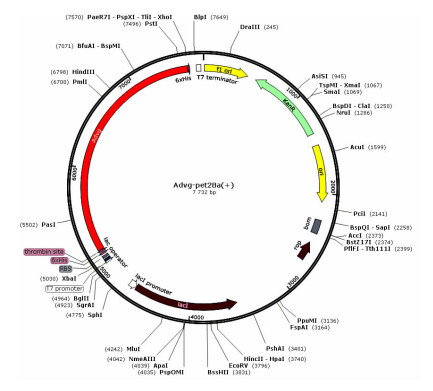
|
| 图 4 AdVg- pet28a(+)重组质粒图谱 |
2.5 AdVg功能域蛋白的表达与纯化
将重组质粒转化入Rosetta(DE3)感受态细胞中,采用卡那抗性筛选阳性克隆,并对重组质粒进行测序验证,目的蛋白基因序列与AdVg Vit N结构域基因序列完全一致。阳性克隆经小量表达及破菌分布SDS-PAGE检测,可见明显差异条带(图 5A红色箭头示),表明重组蛋白基因经IPTG诱导后可在大肠杆菌表达系统中进行表达。同时,重组蛋白分子量在94×103左右,包含His tag标签(~4×103),大小符合目的蛋白分子量的预期。另外,在沉淀中蛋白条带较上清明显,提示重组蛋白大部分表达在包涵体中(图 5A)。随后,对筛选到的重组阳性克隆放大培养、超声破菌,包涵体蛋白经过纯化后进行SDS-PAGE检测,结果显示融合蛋白的大小正常、纯度较高(图 5B),可进行后续的复性纯化。大量表达获得的重组蛋白包涵体经复性及Ni-NTA纯化技术对蛋白进行纯化浓缩,纯化结果见图 5C。本研究得到纯度为80%左右的重组蛋白,可用于后续研究。
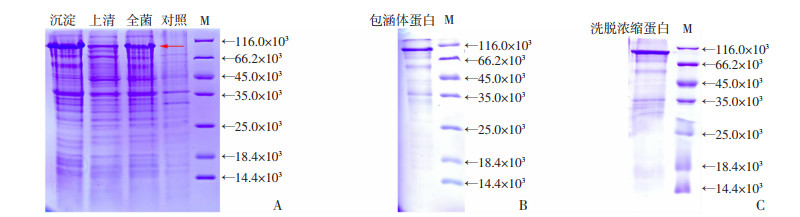
|
| A:阳性菌株全菌蛋白和小量表达的菌体破碎上清及沉淀SDS-PAGE电泳结果;B:纯化包涵体蛋白的SDS-PAGE电泳结果;C:洗脱浓缩蛋白的SDS-PAGE电泳结果 图 5 重组蛋白的表达与纯化 |
3 讨论
1954年,美国的TELFER[13]首次从古比惜天蚕蛾(Hyalophora cecropia)血淋巴中发现了一种雌性特有的蛋白质,并证明其参与了卵黄的形成。1969年,PAN等[14]证实该蛋白作为Vitellin (Vn)或卵黄蛋白(YP)的前体,主要来源于脂肪体,并将其命名为"卵黄蛋白原",后来这一名称被广泛用于特指雌性动物血浆中的卵黄蛋白原。然而,有研究表明在某些雄性昆虫中Vg也有少量表达[15-16]。Vg是几乎所有卵生动物卵黄蛋白的前体,为胚胎发育提供必要的营养物质,是卵生动物生殖、发育活动的重要参与蛋白[17-18]。同时,Vg蛋白在脂肪体中被水解、修饰后,还能协同促进碳水化合物、脂质和其他营养物质向卵巢的运输。在与卵母细胞结合后,Vg以晶体形式储存形成卵黄蛋白,作为未来胚胎的储备食物来源。
卵黄蛋白原已在众多动物中得到了广泛的研究,包括脊椎动物和无脊椎动物中的昆虫、甲壳动物以及寄生虫等[19-21]。在昆虫中,6个不同目25种昆虫的Vg序列的测定已完成[20]。昆虫Vg是一种以200×103左右的蛋白为前体合成的磷脂糖蛋白,其mRNA转录本较大,为(6~7)×103。不同昆虫卵黄蛋白原的比较表明,它们的结构高度保守,形成了一个超家族基因。昆虫的卵黄蛋白原也被证明与其他生物的卵黄蛋白原是同源的,如线虫和脊椎动物等[21]。
大劣按蚊是我国海南岛、西南地区及东南亚毗邻国家的重要传疟媒介[22-23],严重危害人类身体健康。目前,大劣按蚊Vg序列尚未解析。本研究通过RACE PCR技术成功获得了大劣按蚊Vg基因的全长序列共6 477 bp,其中包含117 bp 5′非编码区序列,6 168 bp开放阅读框序列及192 bp 3′非编码区序列。其氨基酸序列通过NCBI进行在线比对,与6种已知Vg序列的按蚊(斯氏按蚊、库态按蚊、微小按蚊、浅色按蚊、美彩按蚊和冈比亚按蚊)同源性均较高,进一步证实该序列置信度较高。通过对AdVg蛋白结构域的预测,得到3个主要结构域:Vit N结构域、DUF1943结构域和vWD结构域,与其他昆虫的结构域高度一致,具有较高的保守性。进一步分析显示,大劣按蚊具有3个多聚丝氨酸的区域,与埃及伊蚊卵黄蛋白原序列多聚丝氨酸的个数相同[21]。在Vit N结构域内编码了2个由连续丝氨酸组成的丝氨酸聚集区,是Vg的主要磷酸化位点。同时,Vit N结构域也是重要的蛋白修饰区域,且在该结构域内具有分泌信号肽和Vg与Vg受体的互作位点[24],因此我们对该结构域的蛋白进行了表达与纯化。通过构建重组质粒,转化进大肠杆菌后进行原核表达,并利用Ni-NTA柱进行纯化,成功获得了较高纯度的AdVg重组蛋白。在之后的研究中,我们将利用该重组蛋白对其在大劣按蚊体内的表达和功能进行分析研究。本研究结果将有助于对大劣按蚊生殖过程与机制开展更深入的研究,为蚊虫种群密度控制以及疟疾的防治工作提供新的线索和基础。
| [1] |
WHO. World malaria report 2019[EB/OL]. [2019-12-04]. https://www.who.int/publications/i/item/9789241565721.
|
| [2] |
FERGUSON N M. Challenges and opportunities in controlling mosquito-borne infections[J]. Nature, 2018, 559(7715): 490-497. |
| [3] |
RANSON H, LISSENDEN N. Insecticide resistance in African Anopheles mosquitoes: a worsening situation that needs urgent action to maintain malaria control[J]. Trends Parasitol, 2016, 32(3): 187-196. |
| [4] |
DUSFOUR I, VONTAS J, DAVID J P, et al. Management of insecticide resistance in the major Aedes vectors of arboviruses: Advances and challenges[J]. PLoS Negl Trop Dis, 2019, 13(10): e0007615. |
| [5] |
周红宁, 卢勇荣. 云南大劣按蚊生态习性, 地理分布和传疟作用研究[J]. 中国媒介生物学及控制杂志, 1998, 9(6): 455-459. ZHOU H N, LU Y R. Studies on geographical distribution, ecology and habits, role in malaria transmission of Anopheles dirus in Yunnan[J]. Chin J Vector Biol Control, 1998, 9(6): 455-459. |
| [6] |
RAIKHEL A S, KOKOZA V A, ZHU J, et al. Molecular biology of mosquito vitellogenesis: from basic studies to genetic engineering of antipathogen immunity[J]. Insect Biochem Mol Biol, 2002, 32(10): 1275-1286. |
| [7] |
RAIKHEL A S, DHADIALLA T S. Accumulation of yolk proteins in insect oocytes[J]. Annu Rev Entomol, 1992, 37: 217-251. |
| [8] |
NIRMALA X, MARINOTTI O, SANDOVAL J M, et al. Functional characterization of the promoter of the vitellogenin gene, AsVg1, of the malaria vector, Anopheles stephensi[J]. Insect Biochem Mol Biol, 2006, 36(9): 694-700. |
| [9] |
ISOE J, HAGEDORN H H. Mosquito vitellogenin genes: Comparative sequence analysis, gene duplication, and the role of rare synonymous Codon usage in regulating expression[J]. J Insect Sci, 2007, 7: 1-49. |
| [10] |
于莎莎, 王英, 李秋霞, 等. 大劣按蚊卵黄蛋白原cDNA的克隆及转录水平研究[J]. 中国热带医学, 2017, 17(4): 336-339. YU S S, WANG Y, LI Q X, et al. Molecular cloning and transcription research of vitellogenin c DNA in Anopheles dirus[J]. China Trop Med, 2017, 17(4): 336-339. |
| [11] |
MARCHLER-BAUER A, BO Y, HAN L Y, et al. CDD/SPARCLE: functional classification of proteins via subfamily domain architectures[J]. Nucleic Acids Res, 2017, 45(D1): D200-D203. |
| [12] |
任增亮, 堵国成, 陈坚, 等. 大肠杆菌高效表达重组蛋白策略[J]. 中国生物工程杂志, 2007, 27(9): 103-109. REN Z L, DU G C, CHEN J, et al. Strategies for high-level expression of recombinant protein in Escherichia coli[J]. China Biotechnol, 2007, 27(9): 103-109. |
| [13] |
TELFER W H. Immunological studies of insect metamorphosis[J]. J Gen Physiol, 1954, 37(4): 539-558. |
| [14] |
PAN M L, BELL W J, TELFER W H. Vitellogenic blood protein synthesis by insect fat body[J]. Science, 1969, 165(3891): 393-394. |
| [15] |
PIULACHS M D, GUIDUGLI K R, BARCHUK A R, et al. The vitellogenin of the honey bee, Apis mellifera: structural analysis of the cDNA and expression studies[J]. Insect Biochem Mol Biol, 2003, 33(4): 459-465. |
| [16] |
VALLE D. Vitellogenesis in insects and other groups: a review[J]. Mem Inst Oswaldo Cruz, 1993, 88(1): 1-26. |
| [17] |
张士璀, 孙旭彤, 李红岩. 卵黄蛋白原研究及其进展[J]. 海洋科学, 2002(7): 32-35. ZHANG S Y, SUN X T, LI H Y. Review on Vitellogenin[J]. Mar Sci, 2002(7): 32-35. |
| [18] |
李兆杰, 杨丽君, 王静, 等. 卵黄蛋白原的研究进展[J]. 生命科学, 2010, 22(3): 284-290. LI Z J, YANG L J, WANG J, et al. The progress in studies on vitellogenin[J]. Chin Bull Life Sci, 2010, 22(3): 284-290. |
| [19] |
罗永莉, 朱宏宏, 江艾耘, 等. 犬弓首蛔虫卵黄原蛋白DUF1943结构域的克隆及原核表达[J]. 西南大学学报(自然科学版), 2018(1): 15-20. LUO Y L, ZHU H H, JIANG A Y, et al. Cloning and prokaryotic expression of the DUF1943 domain of Toxocara canis vitellogenin[J]. J Southwest Agric Univ, 2018(1): 15-20. |
| [20] |
TUFAIL M, TAKEDA M. Molecular characteristics of insect vitellogenins[J]. J Insect Physiol, 2008, 54(12): 1447-1458. |
| [21] |
CHEN J S, CHO W L, RAIKHEL A S. Analysis of mosquito vitellogenin cDNA. Similarity with vertebrate phosvitins and arthropod serum proteins[J]. J Mol Biol, 1994, 237(5): 641-647. |
| [22] |
边长玲, 龚正达. 我国蚊类及其与蚊媒病关系的研究概况[J]. 中国病原生物学杂志, 2009, 4(7): 545-551. BIAN C L, GONG Z D. Mosquitoes and mosquito-borne diseases in China[J]. J Pathog Biol, 2009, 4(7): 545-551. |
| [23] |
WANG D, LI S, CHENG Z, et al. Transmission risk from imported Plasmodium vivax malaria in the China-Myanmar border region[J]. Emerg Infect Dis, 2015, 21(10): 1861-1864. |
| [24] |
霍岩, 陈晓英, 方荣祥, 等. 卵黄蛋白原的产生及其非营养功能的研究现状[J]. 生物技术通报, 2018, 34(02): 66-73. HUO Y, CHEN X Y, FANG R X, et al. Study on the production of vitellogenin and its non-nutritional functions[J]. Biotech Bull, 2018, 34(2): 66-73. |




