2. 610083 成都,中国人民解放军西部战区总医院全军普外中心胃肠病区;
3. 646000 四川 泸州,西南医科大学临床医学院
2. Section of Gastrointestinal Diseases, Center for General Surgery, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610083;
3. School of Clinical Medicine, Southwest Medical University, Luzhou, Sichuan Province, 646000, China
胃肠间质瘤(gastrointestinal stromal tumor, GIST) 是胃肠道最常见的间叶源性肿瘤,年发病率为14.5‰,外科手术切除是治疗GIST的“金标准”。GIST起源于Cajal间质细胞或胃肠道间充质干细胞,其发生、发展与c-KIT和PDGFRA基因突变密切相关[1-3]。酪氨酸激酶抑制剂(tyrosine kinase inhibitor, TKI)伊马替尼(imatinib, IM)作为GIST治疗的一线药物,可靶向结合c-KIT及血小板源性生长因子受体A(platelet-derived growth factor receptor A, PDGFRA),通过抑制酪氨酸激酶从而阻止其下游致癌基因启动, 已被证实对GIST治疗有效。但半数以上患者2年内可观察到继发性伊马替尼耐药并伴随疾病进展[4-5]。因此,加大药物剂量或改用舒尼替尼等其他昂贵的二、三线TKI成为必然选择。然而,尽管对这些靶向药物有初步的反应,GIST耐药的发生仍不可避免[6]。
近年来,随着药物萃取工艺的发展以及中药药理研究的深入,寻求廉价易得、疗效好且不易耐药的中药抗癌制剂成为研究热点。研究表明从具抗肿瘤作用的各种天然产物中提取的化合物可以诱导多种肿瘤细胞凋亡[7-8]。
川楝素(toosendanin,TSN)是从川楝树皮、树根中提取的四环三萜类化合物,最早用于寄生虫病的治疗,现已被证明是一种选择性突触前阻滞剂和有效的抗肉毒毒素剂[9-10]。研究证实:TSN对白血病、胶质母细胞瘤、肝癌、胰腺癌、尤文氏肉瘤、骨肉瘤、大肠癌等多种人类癌细胞具有抑制增殖和诱导凋亡的作用,其潜在机制包括抑制CDC42/MEKK1/JNK、Akt/mTOR、AKT/GSK-3β/β-catenin信号通路等[11-18],表明TSN具有良好的抑制肿瘤细胞增殖及促进细胞凋亡的能力,是一个极具潜力的候选、天然、高效的抗癌药物。然而,经查阅相关文献,发现TSN对胃肠间质瘤细胞生存的影响尚未阐明。本研究以GIST-T1细胞系作为研究对象,旨在探讨TSN对胃肠间质瘤细胞生长、凋亡的影响,并对其机制进行初步探索。
1 材料与方法 1.1 细胞培养人胃肠间质瘤细胞系GIST-T1(编号:337740)购于北京北纳创联生物技术研究院。用90% Mc Coy’s 5a培养液+10%FBS的完全培养基置于37 ℃、5%CO2的孵箱中培养。平均每2天换液,3~5 d传代1次。
1.2 实验用药TSN(分子式C30H38O11,纯度≥95%,中国食品药品检定研究院)用DMSO溶解至100 mmol/L,避光,-4 ℃保存。IM购自北京索莱宝公司,避光,-4 ℃保存。
1.3 细胞增殖抑制率测定取对数生长期细胞按2 000/孔接种于96孔板,待细胞贴壁后,分别加入终浓度为0、15、17、20、22、25、30 nmol/L TSN[对照组(CON)加入等量DMSO],每组设3~6复孔,37 ℃、5%CO2条件下继续培养48 h。各孔加入10 μL CCK-8试剂与90 μL新鲜培养基,避光孵育1 h。用酶标仪测定450 nm波长处的光密度值D(450),并计算细胞增殖抑制率。用SPSS 20.0软件计算其半抑制浓度IC50。用同样的方法检测72 h时细胞增殖抑制率,浓度设定为0、5、7、10、14、16、18、20 nmol/L。细胞增殖抑制率=(对照组-实验组)/(对照组-调零组)×100%。
1.4 Hoechst 33342/PI荧光双染检测细胞凋亡Hoechst 33342/PI双染试剂盒购自索莱宝公司。将细胞接种于预置细胞爬片的24孔板上,待细胞贴壁后,分别加入终浓度为0、15、30 nmol/L TSN,50 nmol/L IM作阳性对照。继续培养48 h后,弃上清,PBS洗2~3遍后,每孔添加1 mL细胞染色缓冲液及Hoechst、PI各5 μL,避光冰育20 min后,于荧光显微镜下观察,拍照。
1.5 流式细胞仪检测细胞凋亡与细胞周期凋亡及细胞周期检测试剂盒购自凯基公司。取对数生长期细胞接种于6孔板,细胞贴壁后加入0、15、30 nmol/L TSN,50 nmol/L IM作阳性对照,继续培养48 h。①细胞凋亡:用不含EDTA胰酶消化细胞、离心,PBS重悬洗涤1次后,离心。Binding Buffer重悬细胞,依次加入5 μL Annexin V- APC、PI染料,混匀,室温避光孵育15 min,上机检测。②细胞周期:胰酶消化细胞后,加75%预冷乙醇1 mL重悬细胞,4 ℃固定过夜。350×g离心5 min,PBS洗涤2次,收集沉淀。将RNase A ∶PI按1 ∶9体积配制成染色工作液,500 μL PI/RNase A染色工作液重悬细胞,避光孵育30 min后,上机检测。
1.6 qRT-PCR检测c-KIT/PI3K/AKT/mTOR mRNA表达TRIzol、PCR试剂盒购自日本TaKaRa公司,引物由四川生工科技有限公司设计完成。一步法qRT-PCR反应条件为:反转录反应42 ℃ 5 min,95 ℃ 10 s;PCR反应95 ℃ 5 s,60 ℃ 30 s,共40个循环。每孔为总体系25 μL含RNA的反应液,每组2~3复孔。引物序列见表 1。
| 基因名称 | 引物序列(5′→3′) | 产物长度/bp |
| c-KIT | 上游:CTGCTTCTGTACTGCCAGTGGATG 下游:GCCTTACATTCAACCGTGCCATTG |
125 |
| PI3K | 上游:CAGCCTTCAACAAAGATGCCCTTC 下游:CACAGTAGCCAGCACAGGACAG |
108 |
| AKT | 上游:TGAGCGACGTGGCTATTG 下游:CAGTCTGGATGGCGGTT |
315 |
| mTOR | 上游:CTTGCTGAACTGGAGGCTGATGG 下游:CCGTTTTCTTATGGGCTGGCTCTC |
140 |
| β-actin | 上游:AGCGAGCATCCCCCAAAGTT 下游:GGGCACGAAGGCTCATCATT |
205 |
1.7 Western blot检测c-KIT/PI3K/AKT/mTOR相关蛋白表达
BCA蛋白定量试剂盒购自上海碧云天公司,全蛋白提取试剂盒及相关试剂购自北京索莱宝公司;PVDF膜购自美国Milipore公司;c-KIT抗体购自武汉赛维尔公司,PI3K、p-PI3K、AKT购自北京博奥森公司,p-KITTyr719、p-AKTThr308、mTOR、p-mTOR购自美国CST公司,GAPDH购自武汉三鹰生物科技有限公司。提取各组蛋白进行凝胶电泳,上样量为20~30 μg;进行转膜、封闭,一抗孵育过夜;TBST洗去一抗,二抗孵育1 h,TBST清洗3次;ECL显色法显色,测定灰度值。
1.8 统计学分析采用SPSS 20.0统计软件,数据以 x±s表示。组间比较采用单因素方差分析,实验均重复3次。P < 0.05认为差异具有统计学意义。
2 结果 2.1 TSN可显著抑制GIST-T1细胞增殖TSN作用GIST-T1细胞48 h后,CCK-8检测结果显示:与CON组比较,TSN显著抑制了GIST-T1细胞系的增殖,且在一定浓度范围内,TSN抑制增殖的能力与剂量呈正相关(P < 0.01,图 1)。48 h时IC50为18.75 nmol/L。72 h呈现类似效果,经计算,72 h时IC50为17.93 nmol/L。选取48 h时相、TSN浓度15、30 nmol/L进行后续实验。
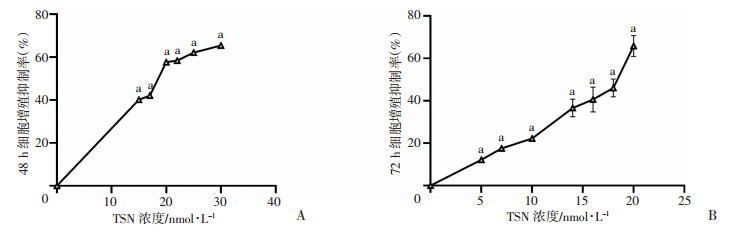
|
| a: P < 0.01,与0 nmol/L比较 图 1 不同浓度TSN作用48 h(A)、72 h(B)后GIST-T1细胞增殖抑制曲线 |
2.2 TSN促进GIST-T1细胞凋亡
流式细胞仪检测结果显示:与CON组(0 nmol/L)比较,药物组均出现细胞凋亡水平增加(P < 0.01),但15、30 nmol/L TSN,50 nmol/L IM 3组间差异无统计学意义(图 2)。Hoechst 33342/PI荧光双染佐证了这一结果,TSN与IM组镜下可见染色质固缩、呈强蓝色荧光的早期凋亡细胞(图 3)。细胞周期检测结果显示:与CON组(0 nmol/L)比较,15 nmol/L TSN组S期细胞增多,但差异无统计学意义;30 nmol/L TSN可使细胞周期发生S期阻滞(P < 0.01),见图 4。
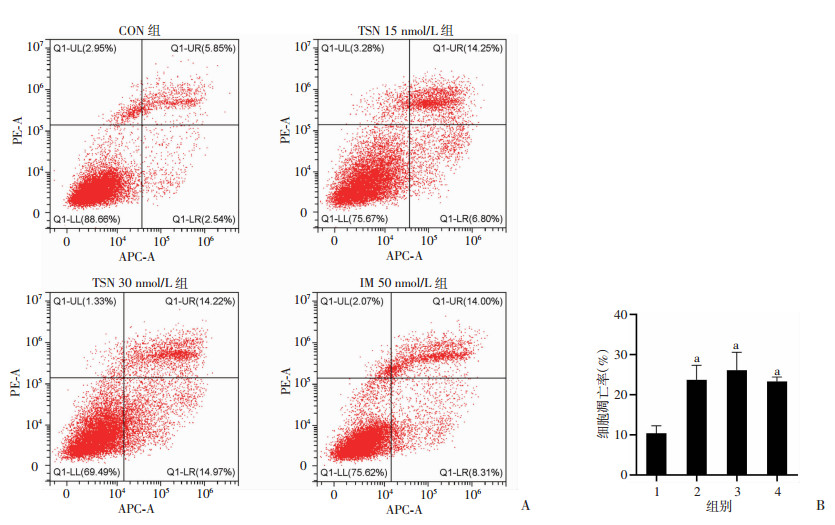
|
| A:流式细胞仪检测细胞凋亡;B:各组细胞凋亡率1:CON组;2:TSN 15 nmol/L组;3:TSN 30 nmol/L组;4:IM 50 nmol/L组;a: P < 0.01,与CON组(0 nmol/L)比较 图 2 TSN加速GIST-T1细胞凋亡 |
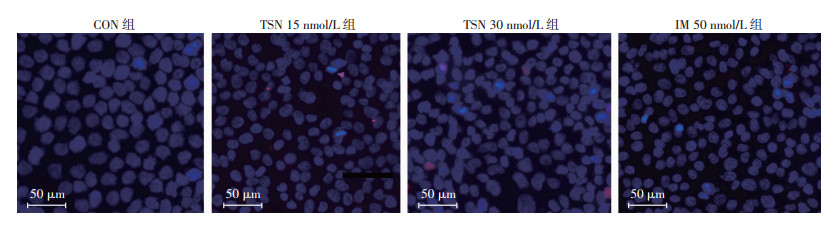
|
| 图 3 Hoechst 33342/PI荧光双染检测GIST-T1细胞凋亡 |
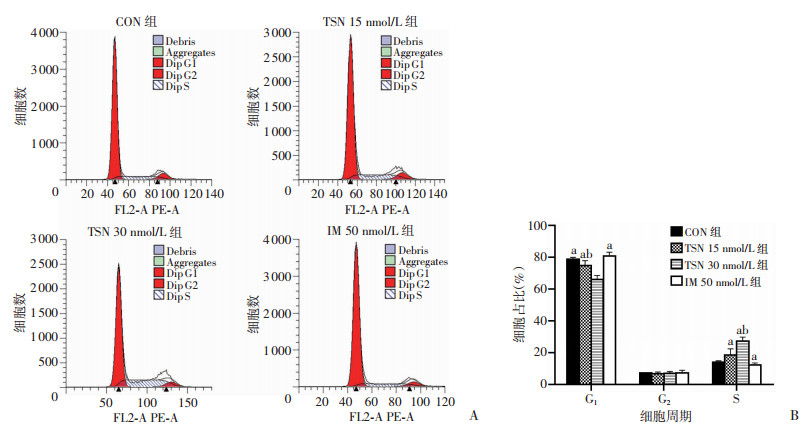
|
| A:流式细胞仪检测细胞周期;B:各期细胞所占百分比a: P < 0.05,与TSN 30 nmol/L组比较;b: P < 0.05,与IM 50 nmol/L组比较 图 4 TSN引起GIST-T1细胞周期阻滞 |
2.3 TSN可通过下调c-KIT表达,抑制PI3K/AKT/mTOR通路
qRT-PCR结果显示:TSN可下调c-KIT mRNA表达,但15 nmol/L TSN抑制效果不及30 nmol/L TSN和IM组(P < 0.05),30 nmol/L TSN与IM组差异无统计学意义(图 5A)。与CON组比较,15 nmol/L TSN即可抑制PI3K mRNA的表达(P<0.05,图 5B)。除此之外,15 nmol/L TSN对AKT及mTOR mRNA表达具有同样抑制效果,且15 nmol/L TSN对AKT mRNA抑制效果优于IM组(P<0.05,图 5C、D)。
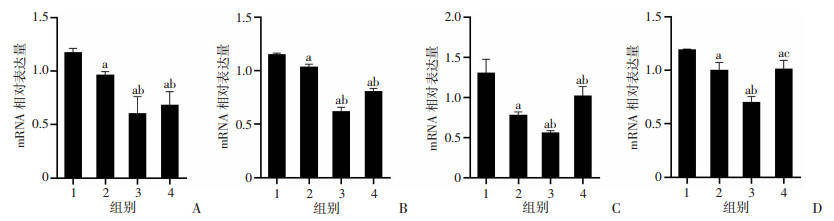
|
| 1:CON组;2:TSN 15 nmol/L组;3:TSN 30 nmol/L组;4:IM 50 nmol/L组;a: P < 0.05,与CON组比较;b: P < 0.05,与TSN 15 nmol/L组比较;c: P < 0.05,与TSN 30 nmol/L组比较 图 5 qRT-PCR检测GIST-T1细胞中c-KIT(A)、PI3K(B)、AKT(C)、mTOR(D) mRNA表达 |
Western blot结果显示(图 6):TSN明显抑制c-KIT蛋白表达,30 nmol/L TSN比15 nmol/L TSN抑制作用更强(P < 0.05)。与CON组比较,TSN明显抑制p-c-KIT蛋白表达,30 nmol/L TSN抑制效果优于IM组(P < 0.05)。与CON组比较,15 nmol/L TSN可抑制PI3K、p-PI3K、p-AKT、mTOR及p-mTOR蛋白表达,30 nmol/L TSN可抑制AKT蛋白表达(P<0.05)。
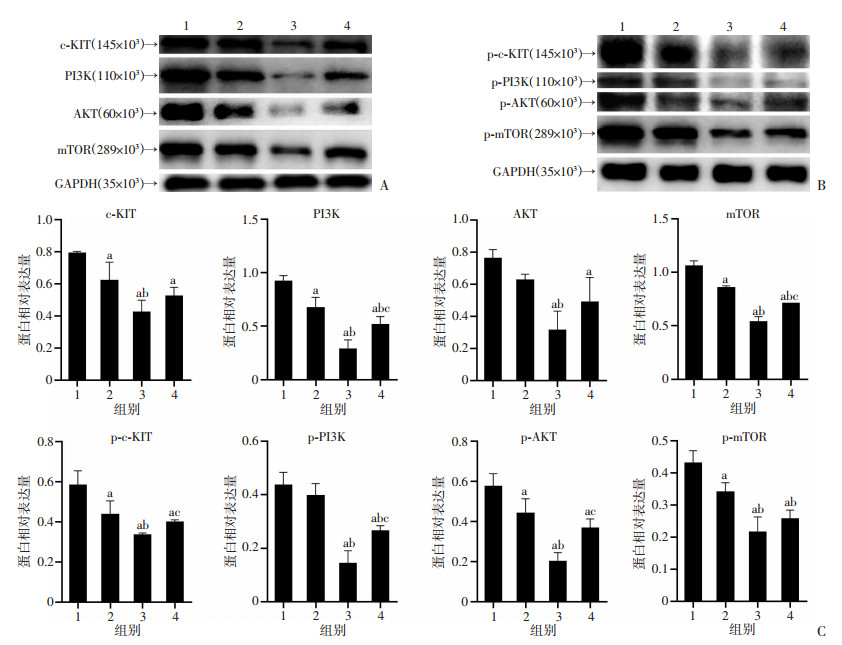
|
|
1:CON组;2:TSN 15 nmol/L组;3:TSN 30 nmol/L组;4:IM 50 nmol/L组;a: P < 0.05,与CON组比较;b: P < 0.05,与TSN 15 nmol/L组比较;c: P < 0.05,与TSN 30 nmol/L组比较 A、B: Western blot检测TSN作用48 h对GIST-T1细胞中蛋白表达的影响;C:半定量分析 图 6 Western blot检测GIST-T1细胞c-KIT/PI3K/AKT/mTOR相关蛋白表达 |
3 讨论
川楝素(TSN)作为新型抗肿瘤的候选药之一,已被证实可抑制多种肿瘤细胞增殖,促进其凋亡。在对人尤文氏肉瘤SK-ES-1细胞系研究中发现:TSN可上调Bax,下调Bcl-2的表达,从而改变Bax/Bcl-2比例。此外,TSN还可促进Cyt-c的释放,导致线粒体凋亡通路的激活[16]。在胃癌的体外研究中发现:TSN可引起G1/S阻滞和诱导caspase依赖性凋亡,从而抑制胃癌AGS和HGC-27细胞系增殖,机制可能与p38 MAPK通路的激活有关[19]。另外,TSN可通过Fas/FasL信号通路诱导人卵巢癌细胞凋亡[20]。综上所述,川楝素能抑制多种肿瘤细胞生长且效果明显,值得作为潜在抗肿瘤药物深入探索。然而,TSN对胃肠间质瘤(GIST)细胞的影响,目前研究尚少。
本研究结果证实:TSN对GIST-T1细胞系同样具备抑制增殖及促进其凋亡的作用。TSN可抑制GIST-T1细胞增殖,且在一定浓度范围内,其抑制增殖的能力与TSN浓度呈正相关,作用48 h IC50低至18.75 nmol/L。流式细胞仪及凋亡染色结果表明:较低浓度的TSN (15 nmol/L)即可引起GIST-T1细胞凋亡,但当TSN浓度增加时,并未观察到统计学意义上的凋亡增加。细胞周期检测结果显示:TSN抑制GIST-T1细胞系凋亡,可能与细胞周期S期阻滞相关。
PI3K/AKT信号通路在细胞生长及生存的生理、病理方面均起重要作用。磷脂酰肌醇-3-激酶(PI3K)位于胞膜上,由PIK3CA基因编码。Ia类PI3Ks由催化亚基p110和调节亚基p85组成,与RTK信号通路密切相关[21-23]。当PI3K被多种RTK激活时,磷脂酰肌醇-4, 5-二磷酸(PIP2)磷酸化,启动信号级联,导致磷脂酰肌醇-3, 4, 5-三磷酸(PIP3)积累[24]。Akt是一种具有广泛底物的细胞质丝氨酸-苏氨酸激酶,上述脂质产物可将Akt召集到细胞膜上,并使其磷酸化,通过激活底物,如哺乳动物雷帕霉素靶蛋白(mTOR)等,最终促进蛋白合成,细胞生长[25-26]。已有研究表明:突变的KIT或PDGFRA基因通过上调其下游的RAS/RAF/MAPK和PI3K/AKT/mTOR,促进GIST细胞增殖,减少凋亡,与GIST疾病发展密切相关[27]。
为了研究TSN是否可以抑制GIST致病突变c-KIT的表达,我们进行了相关实验。结果证实:TSN可从基因水平下调GIST-T1细胞系中c-KIT的表达,Western blot结果表明:与对照组比较,c-KIT总蛋白及磷酸化蛋白表达均明显受到抑制。对PI3K/AKT/mTOR通路进行检测,结果发现:15、30 nmol/L的TSN作用于GIST-T1细胞48 h后,亦可从基因及蛋白质水平下调PI3K/AKT/mTOR通路表达,从而抑制了GIST-T1细胞的增殖,促进其凋亡。结合以往文献可知,TSN可抑制GIST-T1细胞c-KIT的表达,且至少部分通过下调c-KIT表达,抑制了PI3K/AKT/mTOR通路的表达。至于TSN是否抑制其他通路或相关蛋白表达,还有待进一步研究。PI3K/AKT/mTOR通路的激活程度与其磷酸化程度密切相关,Western blot结果显示:TSN对c-KIT及其下游总蛋白、磷酸化蛋白水平均可抑制,但磷酸化蛋白/总蛋白比值水平差异无统计学意义,可见TSN主要是通过抑制总蛋白表达,从而间接实现蛋白磷酸化水平的降低,其总的效应仍旧是降低了c-KIT及其下游通路蛋白的磷酸化程度,使得PI3K/AKT/mTOR通路活性下调。
综上所述,TSN可通过下调GIST-T1细胞c-KIT及其下游PI3K/AKT/mTOR信号通路表达,从而抑制GIST-T1细胞增殖,促进凋亡,并使其细胞周期阻滞在S期。本研究仅从体外实验角度进行了初步探索,进一步的机制探索或者体内实验效果是否理想,均有待进一步研究证实。
| [1] |
HEMMING M L, LAWLOR M A, ANDERSEN J L, et al. Enhancer domains in gastrointestinal stromal tumor regulate KIT expression and are targetable by BET bromodomain inhibition[J]. Cancer Res, 2019, 79(5): 994-1009. |
| [2] |
DONG Y, LIANG C, ZHANG B, et al. Bortezomib enhances the therapeutic efficacy of dasatinib by promoting c-KIT internalization-induced apoptosis in gastrointestinal stromal tumor cells[J]. Cancer Lett, 2015, 361(1): 137-146. |
| [3] |
NILSSON B, BVMMING P, MEIS-KINDBLOM J M, et al. Gastrointestinal stromal tumors: the incidence, prevalence, clinical course, and prognostication in the preimatinib mesylate era: a population-based study in western Sweden[J]. Cancer, 2005, 103(4): 821-829. |
| [4] |
YAN L H, CHEN Z N, LI C J, et al. Prolonging gastrointestinal-stromal-tumor-free life, an optimal suggestion of imatinib intervention ahead of operation[J]. J Cancer, 2018, 9(21): 3850-3857. |
| [5] |
孙祥飞, 高晓东, 沈坤堂. 胃肠间质瘤中伊马替尼继发性耐药机制的研究进展[J]. 中华胃肠外科杂志, 2019, 22(9): 886-890. SUN X F, GAO X D, SHEN K T. Research advances in the secondary resistance mechanism of imatinib in gastrointestinal stromal tumors[J]. Chin J Gastrointest Surg, 2019, 22(9): 886-890. |
| [6] |
KANG Y K, RYU M H, YOO C, et al. Resumption of imatinib to control metastatic or unresectable gastrointestinal stromal tumours after failure of imatinib and sunitinib (RIGHT): a randomised, placebo-controlled, phase 3 trial[J]. Lancet Oncol, 2013, 14(12): 1175-1182. |
| [7] |
SOHRETOGLU D, HUANG S. Ganoderma lucidum polysaccharides as an anti-cancer agent[J]. Anticancer Agents Med Chem, 2018, 18(5): 667-674. |
| [8] |
KIM B, KIM E Y, LEE E J, et al. Panax notoginseng inhibits tumor growth through activating macrophage to M1 polarization[J]. Am J Chin Med, 2018, 46(6): 1369-1385. |
| [9] |
ZHOU Q, WU X, WEN C, et al. Toosendanin induces caspase-dependent apoptosis through the p38 MAPK pathway in human gastric cancer cells[J]. Biochem Biophys Res Commun, 2018, 505(1): 261-266. |
| [10] |
SHI Y L, LI M F. Biological effects of toosendanin, a triterpenoid extracted from Chinese traditional medicine[J]. Prog Neurobiol, 2007, 82(1): 1-10. |
| [11] |
PEI Z, FU W, WANG G. A natural product toosendanin inhibits epithelial-mesenchymal transition and tumor growth in pancreatic cancer via deactivating Akt/mTOR signaling[J]. Biochem Biophys Res Commun, 2017, 493(1): 455-460. |
| [12] |
JU J, QI Z, CAI X, et al. Toosendanin induces apoptosis through suppression of JNK signaling pathway in HL-60 cells[J]. Toxicol in Vitro, 2013, 27(1): 232-238. |
| [13] |
史杰, 王芳. 川楝素对TRAIL抗肝癌活性及其机制研究[J]. 浙江中西医结合杂志, 2017, 27(11): 936-939, 946. SHI J, WANG F. Effect of toosendanin on TRAIL inhibiting hepatocellular carcinoma and the related mechanism[J]. Zhejiang J Integr Tradit Chin West Med, 2017, 27(11): 936-939, 946. |
| [14] |
王进, 卢忠心, 何於娟. 川楝素诱导K562细胞自噬性死亡的实验研究[J]. 山东医药, 2013, 53(1): 24-26. WANG J, LU Z X, HE Y J. Experimental study on autophagy death of K562 cells induced by toosadirachtin[J]. Shandong Med J, 2013, 53(1): 24-26. |
| [15] |
CAO L, QU D D, WANG H, et al. Toosendanin exerts an anti-cancer effect in glioblastoma by inducing estrogen receptor β- and p53-mediated apoptosis[J]. Int J Mol Sci, 2016, 17(11): 1928. |
| [16] |
GAO T, XIE A, LIU X, et al. Toosendanin induces the apoptosis of human Ewing's sarcoma cells via the mitochondrial apoptotic pathway[J]. Mol Med Rep, 2019, 20(1): 135-140. |
| [17] |
ZHANG T, LI J, YIN F, et al. Toosendanin demonstrates promising antitumor efficacy in osteosarcoma by targeting STAT3[J]. Oncogene, 2017, 36(47): 6627-6639. |
| [18] |
WANG G, FENG C C, CHU S J, et al. Toosendanin inhibits growth and induces apoptosis in colorectal cancer cells through suppression of AKT/GSK-3β/β-catenin pathway[J]. Int J Oncol, 2015, 47(5): 1767-1774. |
| [19] |
ZHOU Q, WU X, WEN C, et al. Toosendanin induces caspase-dependent apoptosis through the p38 MAPK pathway in human gastric cancer cells[J]. Biochem Biophys Res Commun, 2018, 505(1): 261-266. |
| [20] |
李雨颖, 邵喜英, 金莉婷, 等. 川楝素通过Fas/FasL信号通路诱导人卵巢癌细胞凋亡[J]. 中国中西医结合杂志, 2019, 39(9): 1089-1094. LI Y Y, SHAO X Y, JIN L T, et al. Apoptosis of qvarian cancer cells induced by toosendanin through Fas/FasL signaling pathway[J]. Chin J Integr Trad West Med, 2019, 39(9): 1089-1094. |
| [21] |
TEWARI D, PATNI P, BISHAYEE A, et al. Natural products targeting the PI3K-Akt-mTOR signaling pathway in cancer: a novel therapeutic strategy[J]. Semin Cancer Biol, 2019. |
| [22] |
XIA P, XU X Y. PI3K/Akt/mTOR signaling pathway in cancer stem cells: from basic research to clinical application[J]. Am J Cancer Res, 2015, 5(5): 1602-1609. |
| [23] |
KITAGISHI Y, MATSUDA S. Diets involved in PPAR and PI3K/AKT/PTEN pathway may contribute to neuroprotection in a traumatic brain injury[J]. Alzheimers Res Ther, 2013, 5(5): 42. |
| [24] |
VIVANCO I, SAWYERS C L. The phosphatidylinositol 3-Kinase AKT pathway in human cancer[J]. Nat Rev Cancer, 2002, 2(7): 489-501. |
| [25] |
FRANKE T F, YANG S I, CHAN T O, et al. The protein kinase encoded by the Akt proto-oncogene is a target of the PDGF-activated phosphatidylinositol 3-kinase[J]. Cell, 1995, 81(5): 727-736. |
| [26] |
SARBASSOV D D, GUERTIN D A, ALI S M, et al. Phosphorylation and regulation of Akt/PKB by the rictor-mTOR complex[J]. Science, 2005, 307(5712): 1098-1101. |
| [27] |
DUENSING A, MEDEIROS F, MCCONARTY B, et al. Mechanisms of oncogenic KIT signal transduction in primary gastrointestinal stromal tumors (GISTs)[J]. Oncogene, 2004, 23(22): 3999-4006. |




