青蒿琥酯(Artesunate,AS)为青蒿素的一种衍生物,是从菊科植物黄花蒿叶中提取分离到的一种具有过氧桥的倍半萜内酯类化合物,主要用于间日疟和轻至重度疟疾的治疗,具有高效、见效快、低毒、不易产生耐药性等突出优势[1-2]。新近的研究显示,青蒿琥酯在肺、肝、肾中都具有抗纤维化和抗炎的作用[3-8],此外还具有抗病毒、抗肿瘤及免疫抑制等疗效[1]。
胆汁酸是胆固醇在肝脏以7α-羟化酶(CYP7A1)为关键酶合成的一种物质,是胆汁的主要成分。在生理浓度下具有重要的生理功能,可以促进脂肪代谢,帮助食物消化与吸收。胆汁酸在肝脏合成,在胆囊储存,经胆管排出十二指肠,在肠道微生物的作用下变成次级胆汁酸,在回肠末端通过门静脉返回肝脏,这个过程就是胆汁酸的肠肝循环,任何一个环节出现问题导致胆汁在肝内分泌及排泄障碍都会引起胆汁淤积[9-10]。胆汁酸在肝内淤积时其细胞毒性对肝细胞具有直接损伤作用,激活死亡受体使肝细胞凋亡,长期持续的胆汁酸刺激还会导致肝纤维化、肝硬化,甚至增加肝细胞癌和胆管细胞癌风险[11-12]。此外,胆汁酸还可诱导炎症反应,有研究发现中性粒细胞是胆汁淤积性肝损伤早期肝细胞毒性的主要原因[13-14]。中性粒细胞可以在各种炎性刺激因子的作用下产生IL-6[15],炎症因子IL-6在肝脏生理病理中具有重要作用,不仅参与肝脏的再生,还参与肝脏的代谢功能[16-17],胆汁酸能否诱导肝细胞IL-6的产生目前研究尚不清楚。
由于炎症反应在胆汁淤积性肝损伤的早期扮演着重要角色,青蒿琥酯又具有抗炎的功效,我们推测青蒿琥酯能够抑制胆汁酸诱导的IL-6产生减轻炎症反应。为了验证该假设,我们在此次实验中运用体外胆汁淤积细胞模型,用25 μmol/L牛磺胆酸(TCA)和牛磺鹅去氧胆酸(TCDCA)处理小鼠原代肝细胞,从mRNA水平和蛋白表达水平观察胆汁酸是否可以诱导肝细胞产生IL-6,同时观察青蒿琥酯是通过何种信号通路抑制结合型胆汁酸诱导的IL-6产生。
1 材料和方法 1.1 实验动物动物实验都是在研究方案获得第三军医大学实验动物福利和伦理委员会批准后进行,雄性12周龄C57BL/6J小鼠,平均体重25 g,购自第三军医大学实验动物中心。
1.2 试剂及仪器DMEM培养基、胎牛血清、胰蛋白酶(trypsin)购自Gibco公司;EGTA购自Sigma公司;蛋白酶抑制剂、磷酸酶抑制剂购自Roche公司;BCA试剂盒购自Thermo公司;CCK-8试剂盒和乳酸脱氢酶细胞毒性检测试剂盒购购自碧云天;GAPDH一抗购自Proteintech公司;p65, p-p65和IL-6一抗购自Abcam公司;兔二抗购自Sigma公司;Trizol购自Invitrogen公司;RNA提取试剂盒购自美国Promega公司;逆转录试剂盒购自TaKaRa公司;6孔细胞培养板和96孔细胞培养板购自美国Costar公司;CO2细胞培养箱购自美国Thermo Scientific公司;IL-6、GAPDH探针购自美国ABI公司;BAY 11-7082购自碧云天公司。
1.3 原代细胞分离与培养小鼠经麻醉后从门静脉插管,剪断下腔静脉,DMEM培养基驱除肝内血液后用胶原酶Ⅱ消化10 min,分离得到原代肝细胞悬液。具体按照胆汁淤积肝病中心原代肝细胞分离与培养的标准protocol进行。收集得到的肝细胞悬液4 ℃ 100×g离心5 min,弃上清,加入5%FBS William E培养基均匀铺到6孔板内,移至37 ℃、5% CO2培养箱,原代肝细胞贴壁后更换培养基并加入TCA、TCDCA,使其终浓度为25 μmol/L,12 h后收取总RNA,24 h后提取总蛋白。相同的原代肝细胞分离与培养,待小鼠原代肝细胞贴壁后更换新的培养基,用青蒿琥酯和BAY 11-7082预处理30 min后加入TCA,使其终浓度为25 μmol/L,24 h后提取总蛋白。相同的原代细胞分离与培养,收集得到的原代细胞悬液均匀得铺到96孔版中,待原代肝细胞贴壁后更换新的培养基,分别加入不同浓度青蒿琥酯和熊去氧胆酸(ursodeoxycholic acid, UDCA),使青蒿琥酯终浓度分别为0.125、0.5、2、8、32 mg/mL,使熊去氧胆酸终浓度分别为0.125、0.25、0.5、2 μmol/L,24 h后加入CCK-8,移至37 ℃、5% CO2培养箱继续培养,40 min后检测吸光度。
1.4 实时定量荧光PCR细胞总RNA的提取步骤按照Trizol试剂盒说明书,逆转录步骤按照TaKaRa逆转录试剂盒说明书,将RNA逆转录为cDNA后进行qRT-PCR扩增,TaqMan-qPCR体系(8 μL): 0.2 μL探针、1.8 μL 5×Taq缓冲液、4 μL ddH2O、2 μLcDNA样品。反应条件如下:95 ℃ 1 min; 95 ℃ 10 s, 60 ℃ 30 s, 72 ℃ 10 s, 49个循环; 95 ℃ 10 s, 4 ℃ 5 min。探针信息:GAPDH ABI Cat#4351370;IL-6 ABI Cat#433182。
1.5 蛋白免疫印迹反应把收集到的细胞用预冷的PBS洗3次,加入含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解缓冲液(Sigma公司)裂解细胞4 ℃ 1 200 r离心10 min,取上清用BCA法测定蛋白浓度。配置5%浓缩胶和10%分离胶,蛋白质上样量为每孔40 μg,浓缩胶60V电泳30 min,然后100V恒压至溴酚蓝完全跑出凝胶。100V转膜60 min,5%脱脂奶粉37 ℃摇床封闭1 h,4 ℃冰箱孵育一抗过夜(IL-6:1:1 000,p65:1:2 000,p-p65: 1:1 000,GAPDH: 1:5 000),TBST洗三次,二抗(山羊抗兔抗1:30 000) 37 ℃孵育90 min,ECL试剂显影。
1.6 CCK-8法检测AS和UDCA对原代小鼠肝细胞的活性影响把收集到的原代肝细胞悬液均匀得铺到96孔版中,待原代细胞贴壁后更换新的培养基,加入不同浓度的青蒿琥酯,使其终浓度分别为0.125、0.5、2、8、32 mg/mL,24 h后加入CCK-8溶液,每孔10 μL,然后移至37 ℃、5% CO2培养箱继续培养,40 min后在450 nm测定吸光度。把收集到的原代肝细胞悬液均匀得铺到96孔版中,待原代细胞贴壁后更换新的培养基,加入不同浓度的UDCA,使其终浓度分别为0.125、0.25、0.5、2 μmol/L,24 h后加入CCK-8溶液,每孔10 μL,然后移至37 ℃、5% CO2培养箱继续培养,40 min后在450 nm测定吸光度。
1.7 免疫荧光把收集到的原代肝细胞悬液均匀得铺到6孔版中,待原代细胞贴壁后更换新的培养基,加入TCA、TCDCA,使其终浓度为25 μmol/L。24 h后吸出培养基,PBS浸洗3次后加4%多聚甲醛室温固定20 min,之后换新的PBS浸洗3次,然后加入0.5%Triton X-100室温通透20 min,换PBS浸洗3次,每次5 min。封闭2 h,一抗过夜(1:250),PBS洗3次,二抗,PBS洗3次,DAPI复染细胞核,PBS洗3次,镜下观察。
1.8 统计学处理所有实验均重复3次,数据均使用GraphPad 6处理分析并作图,应用独立样本的t检验进行各组间的比较,P < 0.05表示差异具有统计学意义。
2 结果 2.1 结合型胆汁酸显著诱导小鼠原代肝细胞IL-6的表达牛磺胆酸(TCA)和牛磺鹅去氧胆酸(TCDCA)是动物体内胆汁酸的主要成分,胆汁淤积时可以激活炎症反应加重肝损伤。众所周知,IL-6参与了肝脏急性反应和感染防御[16],目前尚无研究报道TCA、TCDCA能诱导肝细胞生成IL-6。为了验证TCA、TCDCA是否可以诱导小鼠原代肝细胞IL-6的产生,我们体外建立了胆汁淤积的细胞模型,用25 μmol/L的胆汁酸处理小鼠原代肝细胞。研究结果表明,用TCA处理小鼠原代肝细胞后,能显著诱导IL-6的mRNA和蛋白水平(图 1A和图 1B)。同时,用结合型胆汁酸TCDCA处理小鼠原代肝细胞后,也能观察到IL-6 mRNA和蛋白水平均显著升高(图 1A和图 1B)。因此,我们的数据表明,结合型胆汁酸TCA,TCDCA可显著诱导小鼠原代肝细胞IL-6的表达。
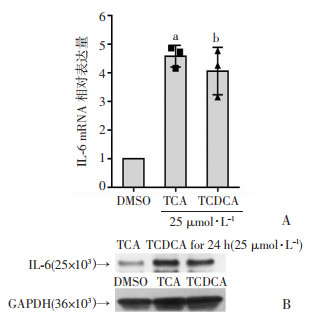
|
| A: 结合性胆汁酸诱导的小鼠原代肝细胞IL-6 mRNA的表达水平,TCA组与DMSO组比较增高4.6倍,a: P < 0.05;TCDCA组与DMSO组比较增高4倍,b: P < 0.05。B: 合性胆汁酸诱导的小鼠原代肝细胞IL-6蛋白质的相对表达量,TCA组与DMSO组比较增高3.4倍,a: P < 0.05;TCDCA组与DMSO组比较增高3.4倍,b: P < 0.05(独立实验开展3次,n=3) 图 1 结合型胆汁酸对原代小鼠肝细胞IL-6的影响 |
2.2 结合型胆汁酸可显著诱导小鼠原代肝细胞NF-KB的磷酸化和细胞因子IL-6表达
前面的研究表明结合型胆汁酸TCA、TCDCA可以诱导小鼠原代肝细胞IL-6的表达,但是其机制尚不清楚。众所周知,IL-6是NF-κB的下游基因,有文献报道NF-κB信号通路是肝脏损伤和炎症过程中较为重要的激活途径之一[18],P65和p-p65是NF-κB家族的重要成员,为了研究结合型胆汁酸诱导小鼠原代肝细胞IL-6产生的机制,我们用25 μmol/L的TCA和TCDCA处理小鼠原代肝细胞,24 h后检测p65和p-p65的蛋白质的表达含量以及p-p65在小鼠原代肝细胞的免疫荧光表达情况,研究结果显示在TCA、TCDCA组IL-6和p-p65的蛋白水平明显升高,用TCA、TCDCA处理后小鼠原代肝细胞的细胞核p-p65水平也明显增高,至此我们可以确定结合型胆汁酸TCA、TCDCA可以诱导小鼠原代肝细胞IL-6和p-p65的蛋白表达(图 2)。
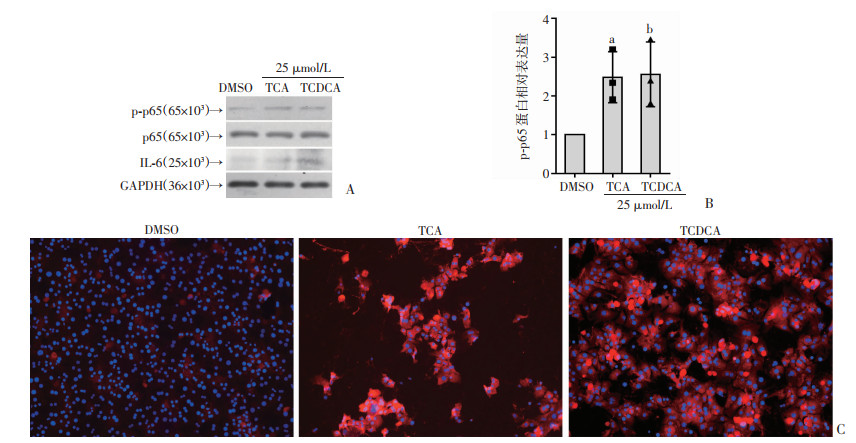
|
| A: 结合性胆汁酸诱导的小鼠原代肝细胞IL-6、p65、p-p65的蛋白表达水平。B: 合性胆汁酸诱导的小鼠原代肝细胞p-p65的蛋白质的相对表达量,TCA组与DMSO组比较增高2.5倍,a: P < 0.05;TCDCA组与DMSO组比较增高2.6倍,b: P < 0.05(独立实验开展3次,n=3)。C: 结合性胆汁酸诱导的小鼠原代肝细胞p-p65的免疫荧光表达情况 图 2 结合型胆汁酸可以诱导p-p65和IL-6的蛋白质表达 |
2.3 青蒿琥酯对原代小鼠肝细胞的毒性研究
青蒿琥酯在肝肺肾等疾病研究中都表现出具有抗炎的功效[3, 5, 8],炎症反应是胆汁淤积性肝损伤的重要环节,我们推测青蒿可以减轻胆汁酸诱导的炎症反应。高浓度的青蒿琥酯对肝细胞具有毒性作用,为了找到合适的治疗浓度,我们分别采用了0.125 mg/mL、0.5 mg/mL、2 mg/mL、8 mg/mL、32 mg/mL的青蒿琥酯处理小鼠原代肝细胞,24 h后加入CCK-8试剂,研究结果显示青蒿琥酯浓度在8 mg/mL、32 mg/mL时具有细胞毒性,在0.125 mg/mL、0.5 mg/mL、2 mg/mL时与control组比无明显差异(图 3),以上研究表明0.125 mg/mL、0.5 mg/mL、2 mg/mL浓度的青蒿琥酯可以用于后续研究。
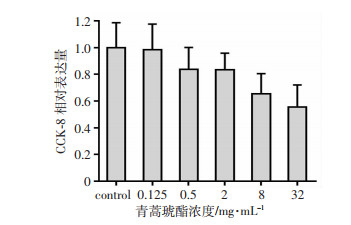
|
| 青蒿琥酯8 mg/mL组与control组比较下降了0.3倍,a: P < 0.05;青蒿琥酯32 mg/mL组与control组比较下降了0.4倍,b: P < 0.05(独立实验开展3次,n=3) 图 3 青蒿琥酯对小鼠原代肝细胞的毒性影响 |
2.4 青蒿琥酯显著抑制了TCA诱导的小鼠原代肝细胞IL-6 mRNA表达
青蒿琥酯在许多疾病研究中都具有一定的抗炎功效,但目前尚无研究报道青蒿琥酯对胆汁酸诱导的小鼠原代肝细胞IL-6的影响,为了验证青蒿琥酯是否可以减轻胆汁酸诱导的肝细胞IL-6的产生,我们选择了0 mg/mL、0.125 mg/mL、0.5 mg/mL、2 mg/mL浓度的青蒿琥酯预处理小鼠原代肝细胞,然后加入终浓度为25 μmol/L的TCA,12 h后检测各组IL-6 mRNA水平,研究表明青蒿琥酯能够抑制结合型胆汁酸诱导的小鼠原代肝细胞IL-6的mRNA水平,并且呈现剂量依赖性(图 4A)。UDCA是治疗肝内胆汁淤积最成熟的药物[19],我们分别采用了0.125 μmol/L、0.25 μmol/L、0.5 μmol/L、2 μmol/L的UDCA处理小鼠原代肝细胞,24 h后加入CCK-8试剂,研究结果显示UDCA浓度在2 μmol/L时具有细胞毒性(图 4B)。我们分别用2 mg/mL的青蒿琥酯和0.5 μmol/L的UDCA处理小鼠原代肝细胞,加入终浓度25 μmol/L的TCA,12 h后检测各组IL-6 mRNA水平,结果显示用青蒿琥酯处理后TCA诱导的小鼠原代肝细胞IL-6 mRNA水平与UDCA组比较下降更为明显(图 4C)。
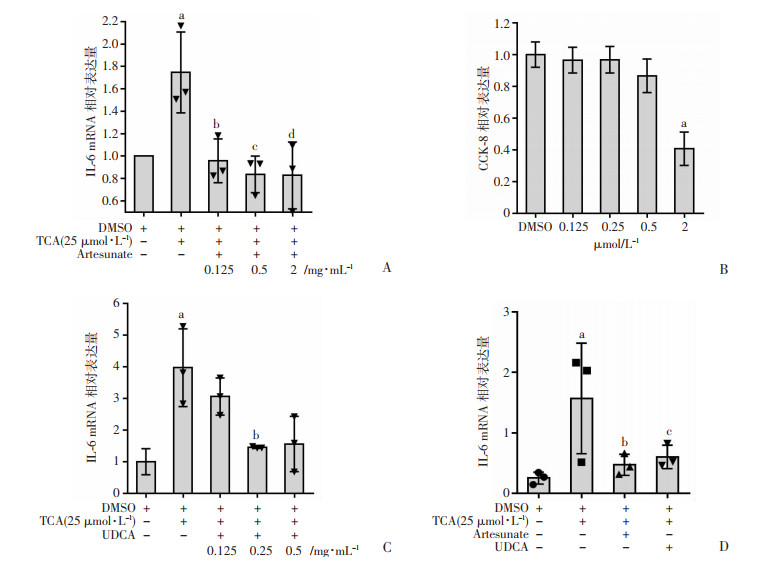
|
| A: 不同浓度的青蒿琥酯(0.125 mg/mL,0.5 mg/mL,2 mg/mL) 处理TCA诱导的小鼠原代肝细胞的IL-6 mRNA水平表达情况,TCA组DMSO组相比较,a: P < 0.05,青蒿琥酯组与TCA组相比较,b, c, d P < 0.05。图B: UDCA对原代小鼠干细胞的毒性研究,UDCAa P < 0.05。C: 不同浓度的UDCA对TCA诱导的小鼠原代肝细胞IL-6的影响,TCA组DMSO组相比较,a: P < 0.05,UDCA组与TCA组相比较,b: P < 0.05。D: 分别使用青蒿琥酯和UDCA处理TCA诱导的小鼠原代肝细胞的IL-6 mRNA水平表达情况,青蒿琥酯组与TCA组比较,b: P < 0.05;UDCA组与TCA组比较,c: P < 0.05,TCA组与DMSO组比较,a: P < 0.05(独立实验开展3次,n=3) 图 4 青蒿琥酯对TCA诱导的小鼠原代肝细胞IL-6表达的影响 |
2.5 青蒿琥酯明显抑制结合型胆汁酸TCA诱导的小鼠原代肝细胞p65的磷酸化和IL-6的表达
前面研究已经证实TCA、TCDCA可以诱导小鼠原代肝细胞IL-6的表达,青蒿琥酯可以抑制TCA诱导的小鼠原代肝细胞IL-6和p-p65的蛋白水平,但是青蒿琥酯抑制IL-6的产生其机制是否通过p-p65信号通路尚不清楚。为了解决这个问题,我们用NF-κB的抑制剂BAY 11-7082作为阳性参照,选择0.5 mg/mL、2 mg/mL浓度的青蒿琥酯分别预处理小鼠原代肝细胞,然后加入终浓度为25 μmol/L的TCA,24 h后检测各组IL-6和p-p65的蛋白表达水平。结果显示使用BAY 11-7082后的小鼠原代肝细胞IL-6的蛋白表达和p-p65的蛋白表达均明显减少;使用青蒿琥酯处理后,TCA诱导的小鼠原代肝细胞IL-6和p-p65的蛋白水平也明显减少(图 5),因此我们推测青蒿琥酯抑制p-p65信号通路减轻TCA诱导的小鼠原代肝细胞IL-6的产生。
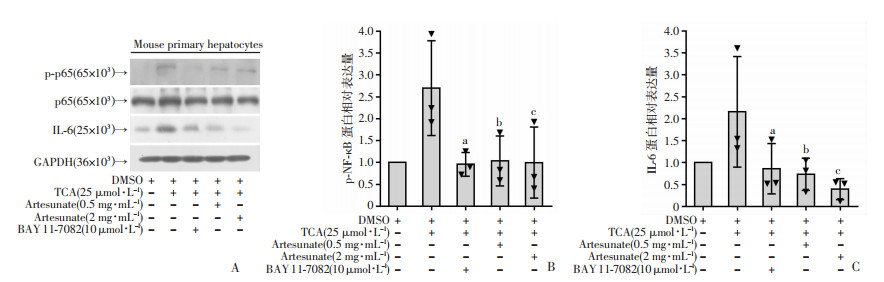
|
| A: BAY 11-7082组、青蒿琥酯组、DMSO组及TCA组的小鼠原代肝细胞IL-6、p65、p-p65的蛋白表达水平。B: BAY 11-7082组、青蒿琥酯组、DMSO组及TCA组的小鼠原代肝细胞p-p65的蛋白质的相对表达量,BAY 11-7082组与TCA组相比下降了2.8倍,a: P < 0.05;青蒿琥酯(0. 5 mg/mL) 组与TCA组相比下降了2.6倍,b: P < 0.05;青蒿琥酯(2 mg/mL)组与TCA组相比下降了2.7倍,c: P < 0.05。C: BAY 11-7082组、青蒿琥酯组、DMSO组及TCA组的小鼠原代肝细胞IL-6的蛋白质的相对表达量,BAY 11-7082组与TCA组相比下降了2.5倍,a: P < 0.05;青蒿琥酯(0.5 mg/mL)组与TCA组相比下降了2.9倍,b: P < 0.05;青蒿琥酯(2 mg/mL)组与TCA组相比下降了5.4倍,c: P < 0.05。(独立实验开展3次,n=3) 图 5 青蒿琥酯抑制TCA诱导的小鼠原代肝细胞p65的磷酸化和IL-6的表达 |
3 讨论
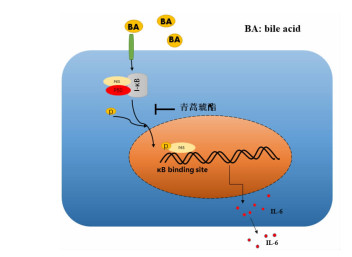
青蒿琥酯作为一种抗疟药,有文献报道具有抗炎、抗纤维化、抗癌的作用,在高糖诱导的大鼠肾小球系膜细胞损伤模型中,有研究发现青蒿琥酯可以抑制p-p65信号通路的表达[8],但是在胆汁淤积性肝病领域中,尚无研究报道青蒿琥酯是否对该疾病具有潜在的影响。在本次研究中我们发现结合型胆汁酸TCA、TCDCA能够诱导小鼠原代肝细胞IL-6的表达,青蒿琥酯能够抑制p65的磷酸化减轻结合型胆汁酸诱导的小鼠原代肝细胞IL-6的产生(图 6)。
|
| 青蒿琥酯抑制p65的磷酸化减轻结合型胆汁酸诱导的小鼠原代肝细胞IL-6的表达 图 6 青蒿琥酯抑制胆汁酸诱导的肝细胞产生IL-6机制示意图 |
结合型胆汁酸TCA,TCDCA是动物体内的主要胆汁酸成分,胆汁酸在肝内淤积可以激活一系列炎症反应损伤肝细胞[20],但尚无研究报道结合型胆汁酸可以诱导肝细胞IL-6的产生。在本次研究中,我们体外模拟了胆汁淤积时的细胞环境,用25 μmol/L的TCA,TCDCA处理小鼠原代肝细胞,研究结果表明结合型胆汁酸TCA,TCDCA可以诱导小鼠原代肝细胞IL-6的表达。为了验证青蒿琥酯是否可以抑制胆汁酸诱导的小鼠原代肝细胞IL-6的产生,我们选择了不同浓度的青蒿琥酯预处理小鼠原代肝细胞,发现青蒿琥酯能够抑制TCA诱导的小鼠原代肝细胞IL-6的mRNA水平,并且呈现剂量依赖性。为了进一步探讨青蒿琥酯减轻结合型胆汁酸诱导的小鼠原代肝细胞IL-6产生的机制,我们选择了NF-κB的抑制剂BAY 11-7082作为阳性对照,p65和p50是NF-κB家族的重要亚基,p65亚基负责NF-κB的启动转录,p50亚基仅在DNA结合中起辅助作用,因此我们检测了IL-6上游p-p65的信号通路[21]。研究发现使用BAY 11-7082预处理后小鼠原代肝细胞IL-6和p-p65蛋白水平明显减少,用青蒿琥酯预处理后p-p65蛋白表达水平和IL-6的蛋白表达水平也明显减轻。
此次研究我们在小鼠原代细胞上证实了结合性胆汁酸TCA、TCDCA能够诱导肝细胞IL-6的产生,青蒿琥酯可以抑制结合型胆汁酸诱导的小鼠原代肝细胞IL-6和p-p65的蛋白水平表达。但是由于此研究目前全部只在体外进行,尚无动物实验进一步体内验证,下一步计划我们将设计动物实验,体内验证青蒿琥酯是否可以减轻胆汁淤积性肝病的炎症反应。胆汁酸可以诱导许多炎症因子的表达,青蒿琥酯是否也可以减轻胆汁酸诱导的其他炎症因子的产生也有待进一步研究。
综上所述,我们首次发现青蒿琥酯能够通过p-p65信号通路抑制结合型胆汁酸诱导的小鼠原代肝细胞IL-6的产生。这不仅为胆汁酸在肝细胞内聚集导致肝细胞损伤的发病机制提供了理论基础,还为胆汁淤积性肝病的治疗提供了潜在的治疗靶点。
| [1] |
岑彦艳, 赵祷博, 李攀, 等. 青蒿琥酯的药代动力学以及相关药理作用研究进展[J]. 中国中药杂志, 2018, 43(19): 3970-3978. CEN Y Y, ZAO Y B, LI P, et al. Research progress on pharmacokinetics and pharmacological activities of artesunate[J]. China J Chin Materia Medica, 2018, 43(19): 3970-3978. |
| [2] |
ROUSSEL C, CAUMES E, THELLIER M, et al. Artesunate to treat severe malaria in travellers: review of efficacy and safety and practical implications[J]. J Travel Med, 2017, 24(2). |
| [3] |
LIU Z, ZHANG J, LI S, et al. Artesunate inhibits renal ischemia reperfusion-stimulated lung inflammation in rats by activating HO-1 pathway[J]. Inflammation, 2018, 41(1): 114-121. |
| [4] |
LIU Y, HUANG G, MO B, et al. Artesunate ameliorates lung fibrosis via inhibiting the Notch signaling pathway[J]. Exp Ther Med, 2017, 14(1): 561-566. |
| [5] |
QIAN P, ZHANG YW, ZHOU Z H, et al. Artesunate enhances γδ T-cell-mediated antitumor activity through augmenting γδ T-cell function and reversing immune escape of HepG2 cells[J]. Immuno- pharmacol Immunotoxicol, 2018, 40(2): 107-116. |
| [6] |
KONG Z, LIU R, CHENG Y. Artesunate alleviates liver fibrosis by regulating ferroptosis signaling pathway[J]. Biomed Pharmacother, 2019, 109: 2043-2053. |
| [7] |
CAO J, WANG W, LI Y, et al. Artesunate attenuates unilateral ureteral obstruction-induced renal fibrosis by regulating the expressions of bone morphogenetic protein-7 and uterine sensitization-associated gene-1 in rats[J]. Int Urol Nephrol, 2016, 48(4): 619-629. |
| [8] |
SUN Z, MA Y, CHEN F, et al. Artesunate ameliorates high glucose-induced rat glomerular mesangial cell injury by suppressing the TLR4/NF-κB/NLRP3 inflammasome pathway[J]. Chem Biol Interact, 2018, 293: 11-19. |
| [9] |
CHIANG J Y L, FERRELL J M. Bile acid metabolism in liver pathobiology[J]. Gene Expr, 2018, 18(2): 71-87. |
| [10] |
TAYLOR S A, GREEN R M. Bile acids, microbiota and metabolism[J]. Hepatology, 2018, 68(4): 1229-1231. |
| [11] |
ATTILI A F, ANGELICO M, CANTAFORA A, et al. Bile acid-induced liver toxicity: relation to the hydrophobic-hydrophilic balance of bile acids[J]. Med Hypotheses, 1986, 19(1): 57-69. |
| [12] |
JIA W, XIE G, JIA W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(2): 111-128. |
| [13] |
LI M, CAI S Y, BOYER J L. Mechanisms of bile acid mediated inflammation in the liver[J]. Mol Aspects Med, 2017, 56: 45-53. |
| [14] |
CAI S Y, BOYER J L. The role of inflammation in the mechanisms of bile acid-induced liver damage[J]. Dig Dis, 2017, 35(3): 232-234. |
| [15] |
宋传旺. 中性粒细胞产生IL-6的研究概述[J]. 泸州医学院学报, 2002, 25(6): 535-538. SONG C W. Overview of studies on the production of IL-6 by neutrophils[J]. J Luzhou Med Coll, 2002, 25(6): 535-538. |
| [16] |
SCHMIDT-ARRAS D, ROSE-JOHN S. IL-6 pathway in the liver: From physiopathology to therapy[J]. J Hepatol, 2016, 64(6): 1403-1415. |
| [17] |
GEIER A, JAHN D, HERMANNS H M. Interleukin-6: the dark side of liver regeneration in chronic liver disease[J]. Hepatology, 2017, 66(2): 667-668. |
| [18] |
HE G, KARIN M. NF-κB and STAT3-key players in liver inflammation and cancer[J]. Cell Res, 2011, 21(1): 159-168. |
| [19] |
BEUERS U, TRAUNER M, JANSEN P, et al. New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond[J]. J Hepatol, 2015, 62(1 suppl): S25-S37. |
| [20] |
CAI S Y, BOYER J L. Studies on the mechanisms of bile acid initiated hepatic inflammation in cholestatic liver injury[J]. Inflamm Cell Signal, 2017, 4(2): e1561. |
| [21] |
SCHMITZ M L, BAEUERLE P A. The p65 subunit is responsible for the strong transcription activating potential of NF-kappa B[J]. EMBO J, 1991, 10(12): 3805-3817. |




