2. 510000 广州, 广东省人民医院(广东省医学科学院)肾内科;
3. 515063 广东 汕头, 汕头大学医学院
2. Department of Nephrology, Guangdong Provincial People's Hospital (Guangdong Academy of Medical Sciences), Guangzhou, Guangdong Province, 510000;
3. Medical College of Shantou University, Shantou, Guangdong Province, 515000, China
膜性肾病(membranous nephropathy, MN)是成人肾病综合征(nephrotic syndrome, NS)的常见的病因之一[1-2]。在MN中,特发性膜性肾病(idiopathic membranous nephropathy,IMN)约占60%~80%[3],且发病率逐年升高[4-5]。尽管约三分之一的患者能自发缓解,仍有30%~40%未治疗的患者进展为终末期肾病(end-stage renal disease, ESRD),这也是进入终末期肾病的第二大原发性肾小球疾病[6-8]。环磷酰胺(cyclophosphamide, CTX)联合糖皮质激素治疗能明显提高IMN患者的尿蛋白缓解率[9]。其中,CTX冲击联合糖皮质激素方案有依从性高、CTX累积量不高等优点,而口服CTX联合糖皮质激素方案因方便执行,无须住院等优点在临床中经常使用,但静脉滴注和口服使用环磷酰胺的疗效及安全性是否一致,在真实世界研究中报道尚少。本研究回顾性评估了环磷酰胺静脉冲击联合糖皮质激素在IMN治疗中的有效性和安全性,为临床治疗IMN提供决策依据。
1 资料与方法 1.1 研究对象回顾性分析2007年1月至2019年6月在广东省人民医院诊断肾病综合征,肾活检病理类型确诊为IMN的患者。纳入标准: 肾病综合征(24 h尿蛋白>3.5 g且血清白蛋白 < 30 g/L);经肾活检病理类型确诊为特发性膜性肾病。完成了本研究的治疗方案;年龄>18周岁;排除标准:继发性IMN(与系统性红斑狼疮、恶性肿瘤、乙型肝炎等相关);估算的肾小球滤过率(estimated glomerular filtration rate,eGFR)小于15 mL/(min·1.73 m2);恶性肿瘤;正在或计划怀孕或哺乳的育龄妇女;无法控制的活动性感染。本研究通过广东省人民医院(广东省医学科学院)医学研究伦理委员会审批(GDREC2020017H),审批时间:2020年12月28日。
1.2 方法 1.2.1 资料收集收集患者临床资料:包括性别、年龄、血压、血糖、肾病理资料等;收集患者治疗3、6、12个月后的临床症状、体征、血清肌酐(Scr)、24 h尿蛋白(24 h UP)、血清白蛋白(sALB)、谷草转氨酶(aspartate transaminase, AST)、谷丙转氨酶(alanine aminotransferase, ALT)、胆固醇、甘油三酯、血清尿酸等资料。记录随访结束时不良反应的发生情况。
1.2.2 治疗方案及分组ICTX组:每个月静脉滴注环磷酰胺0.50~0.75 g/m2(每月不超过1 g),联合每日口服泼尼松0.5 mg/(kg·d),并逐步减量激素,每2周减量5 mg直至减为10 mg维持治疗。疗程6个月。OCTX组:第1、3、5个月静脉滴注甲强龙(methylprednisolone, MP)0.5 g qd×3 d,接口服泼尼松0.5 mg/ (kg·d)×27 d;第2、4、6个月口服CTX 2.5 mg/(kg·d) +泼尼松10 mg/d。疗程6个月。所有患者仍然继续使用支持治疗包括血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitors, ACEI)/血管紧张素受体拮抗剂(angiotensin receptor blockers, ARB)、利尿剂、他汀类药物、抗凝等药物。
1.2.3 观察指标及方法治疗开始后3、6、12个月时随访。主要终点:完全缓解和部分缓解。次要终点:24 h UP、sALB、Scr、eGFR变化及不良事件。eGFR通过慢性肾脏病流行病学(CKD-EPI)合作的公式计算。疗效及诊断标准:①完全缓解(complete remission,CR): 24 h尿蛋白定量 < 0. 3 g,血清白蛋白≥35 g/L,血清肌酐稳定(血清肌酐在±基线的15%)或改善;②部分缓解(partial remission,PR): 24 h尿蛋白定量较基线水平下降≥50%,24 h尿蛋白定量 < 3.5 g,血清白蛋白和血清肌酐稳定或改善;③无效: 24 h尿蛋白定量 > 3.5 g或下降幅度 < 基线水平的50%;④复发: 经治疗后缓解的患者重新出现24 h尿蛋白定量>3. 5 g[10]。⑤肾功能损害:与基线相比eGFR降低50%或Scr升高1倍或进展为ESRD[eGFR < 15 mL/(min·1.73 m2)]。⑥肝功能损害:ALT或AST超过正常值上限2倍。
1.3 统计学方法使用SPSS 25.0软件进行统计分析。符合正态分布的计量数据用平均值±标准差(x±s)表示,非正态分布数据以中位数(P25,P75)表示,治疗前后比较采用配对t检验或方差分析,两组间比较采用独立t检验,方差不齐则采用非参数秩和检验。计数资料以率表示,两组间比较采用卡方检验(χ2检验)或Fisher精确检验。采用Kaplan-Meier生存曲线比较两组患者缓解率的差异,Log-rank法进行显著性检验。P < 0.05具有统计学意义。
2 结果 2.1 基线资料共纳入78例患者,男性56例(71.8%),女性22例(28.2%),年龄为(51.54±13.10)岁。肾脏病理分型以Ⅱ期MN为主,其中Ⅰ期MN 7例,Ⅱ期MN 56例,Ⅲ期MN 9例,不典型MN 6例。ICTX组(n=39)和OCTX组(n=39) 的临床特征、实验室数据见表 1。两组的24 h UP、Scr、eGFR、年龄、性别、血压、血脂等指标差异无统计学意义。两组的中位随访时间均为6(6, 12)个月。
| 基线特点 | 合计(n=78) | ICTX组(n=39) | OCTX组(n=39) | P值 |
| 年龄/岁 | 51.54±13.10 | 53.54±13.77 | 49.07±12.22 | 0.179 |
| 男性比例 | 56(71.8) | 29(74.4) | 27(69.2) | 0.615 |
| 收缩压/mmHg | 141.53±22.98 | 138.13±23.18 | 144.92±22.58 | 0.193 |
| 舒张压/mmHg | 85.42±13.60 | 82.95±13.88 | 87.90±13.02 | 0.108 |
| 高血压 | 41(52.6) | 23(59.0) | 18(46.2) | 0.257 |
| 糖尿病 | 14(17.9) | 8(20.5) | 6(15.4) | 0.555 |
| 使用ACEI/ARB | 67(85.9) | 34(87.2) | 33(84.6) | 0.745 |
| 血清白蛋白/g·L-1 | 19.02±5.32 | 20.20±4.17 | 17.85±6.09 | 0.051 |
| 血清肌酐/μmol·L-1 | 102.62±41.60 | 110.26±44.04 | 94.98±38.05 | 0.105 |
| eGFR/mL·min-1·1.73 m-2 | 77.91±31.28 | 72.21±33.05 | 83.61±28.71 | 0.108 |
| 24 h尿蛋白/mg | 7 973.00(5 721.95, 12 287.39) | 9 228.00(6 483.10, 12 523.75) | 7 456.42(5 460.20, 10998.20) | 0.073 |
| 尿酸/μmol·L-1 | 404.55±107.50 | 398.44±113.30 | 410.82±102.34 | 0.617 |
| 丙氨酸转氨酶/U·L-1 | 17.05±6.67 | 16.21±6.65 | 17.93±6.66 | 0.262 |
| 谷草转氨酶/U·L-1 | 21.64±5.72 | 21.36±5.68 | 21.93±5.82 | 0.664 |
| 血清胆固醇/mmol·L-1 | 9.01±2.86 | 8.70±3.10 | 9.32±2.59 | 0.342 |
| 血清甘油三酯/mmol·L-1 | 3.77±2.37 | 3.66±2.18 | 3.88±2.56 | 0.683 |
| 血白细胞计数/109·L-1 | 9.39±3.37 | 9.23±3.03 | 9.55±3.72 | 0.672 |
| 病理分期 | ||||
| Ⅰ期 | 7(9.0) | 2(5.1) | 5(12.8) | |
| Ⅱ期 | 56(71.8) | 27(69.2) | 29(74.4) | |
| Ⅲ期 | 9(11.5) | 9(23.1) | 0 | |
| Ⅵ期 | 0 | 0 | 0 | |
| 不典型 | 6(7.7) | 1(2.6) | 5(12.8) | |
2.2 两组治疗前后指标对比
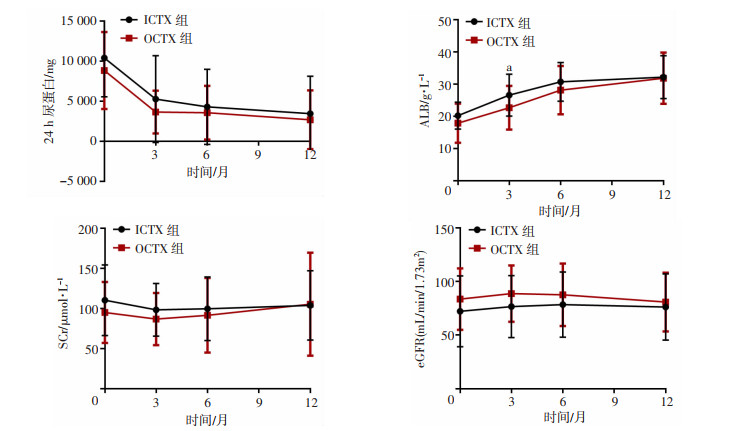
两组患者在治疗3、6、12个月后,sALB、eGFR较基线值均明显升高,24 h UP、Scr较基线值均明显下降(均P < 0.05,图 1)。治疗3个月时,ICTX组24 h尿蛋白较基线下降6 566.36 mg,OCTX组则下降了3 852.18 mg,但两组差异无明显统计学意义(P=0.300)。
|
| a: P < 0.05, 3个月时ICTX组与OCTX组的sALB比较 图 1 ICTX组和OCTX组的24 h尿蛋白、sALB、Scr、eGFR变化情况比较 |
2.3 治疗效果
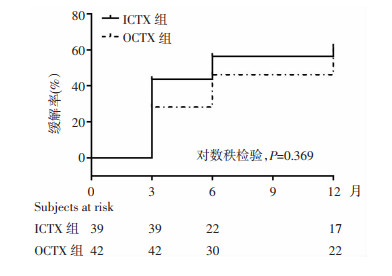
治疗3、6、12个月时,ICTX组和OCTX组的总缓解率分别为50.0% vs 46.4%,59.4% vs 50.0%,88.9% vs 75%,差异无统计学意义(图 2,表 2)。ICTX组Ⅰ期、Ⅱ期、Ⅲ期、不典型MN总缓解例数分别为:0/2例、19/27例、4/9例、1/1例,OCTX组Ⅰ期、Ⅱ期、不典型MN总缓解例数分别为:4/5例、15/29例、4/5例,差异无统计学意义。ICTX组中位缓解(CR/PR)时间为6(95%CI:0.282 2 ~0.885 8)个月,OCTX组为12(95%CI:1.129~3.543)个月。治疗3个月时,ICTX组sALB升高更显著(ICTX组升高6.2 g/L,OCTX升高4.8 g/L,P=0.013),ICTX组eGFR升高了6.17 mL/(min·1.73 m2),OCTX组eGFR升高了5.13 mL/(min·1.73m2)(P=0.059,图 2)。治疗后两组ALT、胆固醇、甘油三酯、血尿酸等指标较基线差异无统计学意义。
|
| 图 2 ICTX组和OCTX组蛋白尿缓解率的Kaplan-Meier分析 |
| 组别 | n | CR (例) | PR (例) | 无效 (例) | 总缓解 率(%) | 复发 (例) |
| ICTX组 | ||||||
| 3月 | 30 | 1 | 14 | 15 | 50.0 | - |
| 6月 | 32 | 1 | 18 | 11 | 59.4 | 1 |
| 12月 | 9 | 3 | 5 | 2 | 88.9 | 1 |
| OCTX组 | ||||||
| 3月 | 28 | 0 | 13 | 15 | 46.4 | - |
| 6月 | 26 | 2 | 11 | 11 | 50 | 2 |
| 12月 | 16 | 3 | 9 | 4 | 75 | 1 |
2.4 复发情况
在CR或PR后,ICTX组有2例(8.3%)复发,OCTX组有3例(13.0%)复发,两组的复发率差异无统计学意义。治疗6个月时,ICTX组有1例复发,OCTX组有2例。治疗12个月时,ICTX组及OCTX组均有1例复发(表 2)。
2.5 不良反应及CTX累计量ICTX组9例(23.1%)患者共发生了17次不良反应,OCTX组10例(25.6%)患者共发生13次不良反应。所有不良反应中,以感染为主,ICTX组发生感染15次(上呼吸道感染8次,下呼吸道感染2次,泌尿道感染3次,带状疱疹感染2次);OCTX组发生感染6次(上呼吸道感染4次,下呼吸道感染2次)。第3个月时,ICTX组血WBC计数较OCTX组高[(10.76±2.89)×109/L vs(8.85±3.02)×109/L, P=0.013]。肾功能损害仅出现在OCTX组,为2例,其中1例肌酐升高1倍,1例进展为终末期肾脏病。纳入病例中女性共22例,其中ICTX组10例,OCTX组12例;治疗过程中提前绝经0例,月经紊乱3例,其中ICTX组1例,OCTX组2例(表 3)。两组均未发现肝功能损害不良反应。OCTX组的CTX累积量明显高于ICTX组[(8.9± 2.3) vs(5.7±1.1)g,P < 0.001,t=-7.638]。
组别 | 例数 (%) | 次数 | 感染 [次(%)] | 血肌酐常升 高[例(%)] | 肝功能损 害[例(%)] | 胃肠道反应 [例(%)] | 关节肿痛 [例(%)] | 月经紊乱 [例(%)] | 高血压 [例(%)] |
| ICTX组 | 9(23.1) | 17 | 15(88.2) | 0 | 0 | 1(5.9) | 0 | 1(5.9) | 0 |
| OCTX组 | 10(25.6) | 13 | 6(46.2) | 2(15.4) | 1(7.7) | 0 | 1(7.7) | 2(15.4) | 1(7.7) |
3 讨论
MN是成人肾病综合征的常见病因之一,其中IMN在所有MN中约占60%~80%,发病率逐年升高[1, 4-5]。免疫抑制剂能显著提高蛋白尿的缓解率及改善肾脏的存活[11-12], 其中烷化剂仍是目前唯一能有效减少ESKD或死亡不良预后的药物[13-14]。PONTICELLI[15]提出了泼尼松及苯丁酸氮芥交替治疗6个月作为治疗MN的金标准。而人们对免疫抑制剂副作用(如感染、白细胞减少、性腺抑制等)的担忧阻碍了其应用。环磷酰胺的安全性比苯丁酸氮芥高[16-18],后来演变出不同的以泼尼松联合CTX治疗为主的方案[19]。本研究比较了以CTX作为主要免疫抑制剂的两种方案在IMN治疗中的疗效及安全性,以供临床医师提供临床决策证据。
本研究纳入了78名完成本研究治疗方案的临床表现为NS的IMN患者,比较了CTX静脉冲击联合糖皮质激素方案和口服CTX联合糖皮质激素方案在IMN治疗中的有效性和安全性。治疗3、6、12个月时,ICTX组蛋白尿总缓解率比OCTX组高,分别为50.0% vs 46.4%,59.4% vs 50.0%,88.9% vs 75.0%(均P>0.05)。OCTX组总缓解率比RAMACHANDRAN等[20]研究略低,ICTX组总缓解率比LIANG等[10]的研究偏低,可能与本研究两组患者基线24 h UP、Scr水平偏高及基线sALB、eGFR偏低有关。ICTX组中位缓解(CR/PR) 时间为6(95%CI:0.2822~0.8858)个月,OCTX组为12(95%CI:1.129~3.543)个月,表明ICTX组可能比OCTX组更快达到早期缓解。两组治疗3、6、12个月后24 h UP较基线值明显下降(P < 0.05),3个月时ICTX组24 h尿蛋白较基线下降6 566.36 mg,OCTX组则下降了3 852.18 mg,但两组差异无明显统计学意义(P=0.300)。治疗3个月时ICTX组sALB改善比OCTX组更为显著(P < 0.05)。结果表明,ICTX组比OCTX组能更快地提升血清白蛋白的水平。
两组不良反应以感染为主,经过治疗后均能好转。治疗第3个月时,ICTX组血WBC较OCTX组高(ICTX组[(10.76±2.89)×109/L vs OCTX (8.85±3.02)×109/L,P=0.013],提示ICTX组方案在早期更容易发生血白细胞计数升高,这与ICTX组发生感染比例较高的结果是一致的。本研究的不良反应发生率较既往研究低[19],这可能因为回顾性研究统计的均是住院事件,从而低估了这两种方案的不良反应的发生。OCTX组不良反应中出现了2例血肌酐异常升高,其中1例为血清肌酐升高1倍,1例进展为终末期肾病,这例进展为终末期肾病的患者可能与治疗前Scr水平较高、eGFR较低及CTX累积量较高有关。ICTX组和OCTX组中女性出现月经紊乱例数分别为1/10例、2/12例(P>0.05),表明CTX对育龄女性性腺抑制作用在两组治疗方案中无明显差异。因此,本研究结果显示:静脉冲击CTX联合糖皮质激素的方案能显著降低临床表现为NS的IMN患者尿蛋白,提高蛋白尿缓解率,改善肾功能,且治疗后复发率低,同时血清白蛋白改善更快速,进入终末期肾病的可能性更小,耐受性好,不良反应无明显增加。但本研究仍具有一些局限性。这是一个回顾性研究,研究样本量小,随访时间短,无法分析比较两种治疗方案长期疗效及肾脏存活情况。总之,未来需要开展更多随机对照试验,评估静脉冲击环磷酰胺方案在治疗临床表现为NS的IMN患者的疗效及安全性。
| [1] |
BOMBACK A S, FERVENZA F C. Membranous nephropathy: approaches to treatment[J]. Am J Nephrol, 2018, 47(Suppl 1): 30-42. |
| [2] |
GUO W, ZHANG Y, GAO C, et al. Retrospective study: clinicopathological features and prognosis of idiopathic membranous nephropathy with seronegative anti-phospholipase A2 receptor antibody[J]. Peer J, 2020, 8: e8650. |
| [3] |
DAHAN K, DEBIEC H, PLAISIER E, et al. Rituximab for severe membranous nephropathy: a 6-month trial with extended follow-up[J]. J Am Soc Nephrol, 2017, 28(1): 348-358. |
| [4] |
胡晓帆, 徐静, 陈楠. 利妥昔单抗治疗特发性膜性肾病的进展[J]. 中华内科杂志, 2016, 55(7): 558-560. HU X F, XU J, CHEN N. Progress of rituximab in the treatment of idiopathic membranous nephropathy[J]. Chin J Intern Med, 2016, 55(7): 558-560. |
| [5] |
XU X, WANG G, CHEN N, et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China[J]. J Am Soc Nephrol, 2016, 27(12): 3739-3746. |
| [6] |
Ronco P, Debiec H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care[J]. Lancet, 2015, 385(9981): 1983-1992. |
| [7] |
NIKOLOPOULOU A, CONDON M, TURNER-STOKES T, et al. Mycophenolate mofetil and tacrolimus versus tacrolimus alone for the treatment of idiopathic membranous glomerulonephritis: a randomised controlled trial[J]. BMC Nephrol, 2019, 20(1): 352. |
| [8] |
KERI K C, BLUMENTHAL S, KULKARNI V, et al. Primary membranous nephropathy: comprehensive review and historical perspective[J]. Postgrad Med J, 2019, 95(1119): 23-31. |
| [9] |
Group KDIGO. KDIGO clinical practice guideline for glomerulonephritis[J]. Kidney Int Suppl, 2012, 2(2): 186-197. |
| [10] |
LIANG Q, LI H, XIE X, et al. The efficacy and safety of tacrolimus monotherapy in adult-onset nephrotic syndrome caused by idiopathic membranous nephropathy[J]. Ren Fail, 2017, 39(1): 512-518. |
| [11] |
JHA V, GANGULI A, SAHA T K, et al. A randomized, controlled trial of steroids and cyclophosphamide in adults with nephrotic syndrome caused by idiopathic membranous nephropathy[J]. J Am Soc Nephrol, 2007, 18(6): 1899-1904. |
| [12] |
HOWMAN A, CHAPMAN T L, LANGDON M M, et al. Immunosuppression for progressive membranous nephropathy: a UK randomised controlled trial[J]. Lancet, 2013, 381(9868): 744-751. |
| [13] |
VAN DE LOGT A E, HOFSTRA J M, WETZELS J F. Pharmacological treatment of primary membranous nephropathy in 2016[J]. Expert Rev Clin Pharmacol, 2016, 9(11): 1463-1478. |
| [14] |
FLOEGE J, BARBOUR S J, CATTRAN D C, et al. Management and treatment of glomerular diseases (part 1): conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference[J]. Kidney Int, 2019, 95(2): 268-280. |
| [15] |
PONTICELLI C, ZUCCHELLI P, IMBASCIATI E, et al. Controlled trial of monthly alternated courses of steroid and chlorambucil for idiopathic membranous nephropathy[J]. Proc Eur Dial Transpl Assoc Eur Dial Transpl Assoc, 1983, 19: 717-723. |
| [16] |
REN S, WANG Y, WANG Y, et al. Comparative effectiveness and tolerance of immunosuppressive treatments for idiopathic membranous nephropathy: a network meta-analysis[J]. PLoS ONE, 2017, 12(9): e0184398. |
| [17] |
LI Y C, HUANG J, LI X, et al. A comparison of cyclophosphamide versus tacrolimus in terms of treatment effect for idiopathic membranous nephropathy: a meta-analysis[J]. Nefrologia, 2019, 39(3): 269-276. |
| [18] |
POZDZIK A, BROCHéRIOU I, DAVID C, et al. Membranous nephropathy and anti-podocytes antibodies: implications for the diagnostic workup and disease management[J]. Biomed Res Int, 2018, 2018: 6281054. |
| [19] |
Mathrani V, Alejmi A, Griffin S, et al. Intravenous cyclophosphamide and oral prednisolone is a safe and effective treatment option for idiopathic membranous nephropathy[J]. Clin Kidney J, 2017, 10(4): 450-454. |
| [20] |
RAMACHANDRAN R, HN H K, KUMAR V, et al. Tacrolimus combined with corticosteroids versus Modified Ponticelli regimen in treatment of idiopathic membranous nephropathy: Randomized control trial[J]. Nephrology (Carlton), 2016, 21(2): 139-146. |




