铜绿假单胞菌是一种机会感染革兰阴性菌,容易在烧伤等皮肤屏障破坏的创面内定植。这种局部的感染会导致全身性的脓毒血症,特别是对于重度烧伤患者,往往与高发病率和高病死率密切相关[1],并且随着抗生素的大量使用,多重耐药铜绿假单胞菌的出现迫使人们不断寻找新的抗菌技术[2-3]。
光动力抗菌疗法(antimicrobial photodynamic therapy, APDT)是近年兴起的一种治疗体表感染的新手段,其原理是通过特定波长的光激发光敏剂(photosensitizer, PS)发生光化学反应,产生羟自由基、过氧化氢、超氧阴离子等活性氧族(reactive oxygen species, ROS)和单线态氧(1O2),可以氧化损伤脂质、蛋白质或核酸等生物大分子,从而有效杀伤病原微生物[4]。APDT是一种独立于抗生素的杀菌模式,对宿主的损伤小,多次治疗不会诱导耐药[5],因此被认为是很有前途的治疗细菌感染方法之一,尤其是多重耐药菌引起的感染[6]。本研究分析波长为(635±5)nm的红光联合甲苯胺蓝O(toluidine blue O,TBO)对体外培养的铜绿假单胞菌标准株和临床分离的多重耐药菌株的杀伤效应,观察APDT前后铜绿假单胞菌微观形态学、抗生素敏感性的变化,检测APDT治疗前后多重耐药铜绿假单胞菌耐药基因的变化,从而为TBO介导的APDT杀伤多重耐药菌的临床应用打下良好的基础。
1 材料与方法 1.1 菌株和试剂铜绿假单胞菌标准株(WT, 购自ATCC, NO.27853)和临床分离的经鉴定为外排泵MexAB-OprM高表达的多重耐药铜绿假单胞菌株(MexAB-OprM菌株),由本院烧伤科微生物室馈赠。TBO、LIVE /DEAD® Kit试剂盒由美国Sigma公司提供,LB培养基由博浪生物科技公司提供,PBS缓冲液由索莱宝科技有限公司提供,GoTaq® qPCR Master Mix由美国Promega公司提供。
1.2 主要仪器LED半导体激光治疗仪,波长为(635±5)nm,输出功率密度为110 mW/cm2(深圳普门)。其他仪器包括:PM100D数字光功率计和能量计表头(美国Thorlabs公司);Varioskan Flash多功能酶标仪(美国Thermo Scientific公司);Zeiss LSM 880型激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)(德国Carl·Zeiss公司);S-3400N型扫描电子显微镜(scanning electron microscope,SEM)(日本HITACHI公司);PHILIPS-TECNAI 10型透射电子显微镜(transmission electron microscope,TEM)(荷兰PHILIPS公司);ABI ViiATM7实时荧光定量PCR仪(美国ABI公司)等。
1.3 方法 1.3.1 铜绿假单胞菌体外培养将-80 ℃保种的WT和MexAB-OprM菌株接种于血平板,37 ℃培养24 h。从血平板中挑取单菌落接种于装有5 mL的LB液体培养液中,然后恒温摇床培养过夜后离心(8 000 r/min,5 min),弃上清,PBS漂洗3次,调整菌液的浓度为108 CFU/mL标准混悬液。
1.3.2 APDT对铜绿假单胞菌的杀伤效应实验分APDT组和对照组。APDT组:108 CFU/mL细菌混悬液加入不同浓度TBO(2.5、5.0、7.5、10.0 μmol/L),分别予以不同剂量(10、20、30、40 J/cm2)的红光[(635±5)nm]照射;对照组:空白对照组(不加TBO,也不予以光照)、单纯TBO组(菌液加TBO,不予以光照)、单纯光照组(菌液不加TBO,单独予以光照)。细菌处理后,采用序列稀释法接种菌液于培养皿,37 ℃培养24 h后统计结果,实验重复3次。
1.3.3 亚致死量APDT对铜绿假单胞菌的杀伤效应及形态学影响 1.3.3.1 亚致死量APDT的确定根据CASSIDY等[7]研究,APDT对108 CFU/mL细菌的亚致死条件定义为菌量降低0.5 (log10)~1.0 (log10),根据杀菌实验结果,本实验取TBO浓度2.5 μmol/L、光照剂量10 J/cm2为亚致死量APDT;实验分APDT组、空白对照组、单纯TBO组和单纯光照组。
1.3.3.2 亚致死量APDT对铜绿假单胞菌的杀伤效应根据分组处理细菌后,立即加入LIVE /DEAD®Kit试剂,然后将混悬液滴加于洁净的载玻片,盖上盖玻片,用激光聚焦显微进行观察,用随机自带的软件进行荧光强度分析。从每个样本的3个位置随机获取图像。
1.3.3.3 亚致死量APDT处理后铜绿假单胞菌形态学变化将各组细菌处理后离心,经2.5%戊二醛固定、梯度乙醇法脱水、叔丁醇梯度置换干燥后喷金处理,制作成电镜标本后进行扫描电镜观察;另外标本经固定、冲洗、置换、浸透包埋后定位、超薄切片、铅染,进行透射电镜观察,每张玻片随机选择3个视野。
1.3.4 亚致死量APDT处理前后铜绿假单胞菌对抗生素敏感度变化亚致死APDT处理前后的菌株分别接种于血平板,37 ℃培养24 h,采用法国梅里埃公司的Vitek-2 Compact型全自动药敏分析系统检测细菌对抗生素最低抑菌浓度(MIC值)的变化,包括哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、亚胺培南、美罗培南等。
1.3.5 RT-qPCR法检测亚致死量APDT对MexAB-OprM菌株外排泵基因表达MexAB-OprM菌株在亚致死APDT处理前后分别接种于血平板,37 ℃培养24 h,挑取菌落,然后按下列步骤进行实验。提取细菌总RNA:用TRIzol试剂和氯仿处理细菌,用HiPure Universal RNA Kit试剂盒(广州MAGEN公司)进行细菌总RNA提取(参照试剂说明书进行),gDNA Eraser(日本TaKaRa公司)去除RNA细菌基因污染,用Prime ScriptTM RT reagent Kit(日本TaKaRa公司)进行cDNA反转录(参照试剂盒说明书进行)。取1 μL cDNA作为模板、加入5 μL GoTaq® qPCR Master Mix、上下游引物各1 μL、去离子水等构建qPCR反应体系,对MexAB-OprM菌株APDT处理前后外排泵基因mexB、mexD、mexY、mexF转录水平进行定量qPCR分析。RT-qPCR反应条件:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。
1.4 统计学分析采用SPSS 23.0统计软件,数据以x±s表示,两组间比较采用独立样本t检验。检验水准:α=0.05。
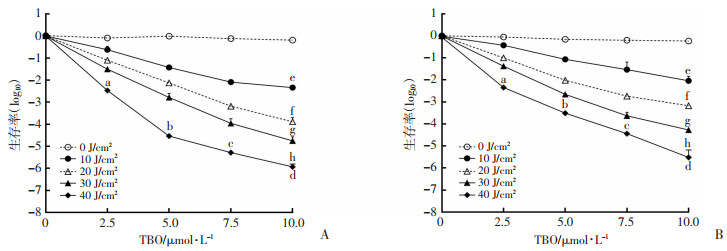
2 结果 2.1 APDT对两株铜绿假单胞菌杀伤效应的比较TBO在0~10 μmol/L,光照剂量一定时,APDT对两株细菌的杀伤效应随TBO浓度增大而增加(P < 0.05);当TBO浓度一定时,APDT对两株细菌的杀伤效应随光照剂量增加而增大(P < 0.05);TBO为10 μmol/L,光照剂量为40 J/cm2,APDT对两株细菌杀伤效应均达到最大,其中对WT菌株杀伤为6.0 (log10),对MexAB-OprM菌株的杀伤为5.5(log10),但二者的杀伤效应比较差异无统计学意义(图 1),说明APDT对铜绿假单胞菌的标准株和耐药菌株具有相似的杀伤效应。此外,空白对照组、单纯TBO组、单纯光照组两株细菌均未见杀伤。
|
|
a:P < 0.05,与0 μmol/L、40 J/cm2比较;b:P < 0.05,与2.5 μmol/L、40 J/cm2比较;c:P < 0.05,与5.0 μmol/L、40 J/cm2比较;d:P < 0.05,与7.5 μmol/L、40 J/cm2比较;e:P < 0.05,与10.0 μmol/L、0 J/cm2比较;f:P < 0.05,与10.0 μmol/L、10 J/cm2比较;g:P < 0.05,与10.0 μmol/L、20 J/cm2比较;h:P < 0.05,与10.0 μmol/L、30 J/cm2比较 A:WT菌株;B:MexAB-OprM菌株 图 1 TBO-APDT对两株铜绿假单胞菌的杀伤效应(n=3) |
2.2 亚致死量APDT处理后铜绿假单胞菌的染色变化
本实验LIVE /DEAD® Kit试剂盒包含SYTO®9和碘化丙啶(PI)两种成分,其中SYTO®9为高亲和力核酸染色剂,可以将所有细菌染成绿色,而PI只能渗透进入膜结构受损的细菌,取代SYTO®9的绿色荧光,将细菌染成红色,因此该染色方法是评价生存率的良好指标。激光共聚焦显微镜观察不同条件处理后细菌形态,空白对照组、单纯TBO组和单纯光照组中的两株铜绿假单胞菌均为绿色,未见红染细菌;APDT(TBO浓度为2.5 μmol/L、光照剂量为10 J/cm2)组中,两株细菌均可见红染细菌,并且与菌落定量计数实验中同等条件结果一致(图 2)。

|
| 图 2 激光共聚焦电子显微镜观察亚致死量APDT处理前后两株铜绿假单胞菌形态 |
2.3 透射电镜观察亚致死量APDT处理后铜绿假单胞菌形态变化
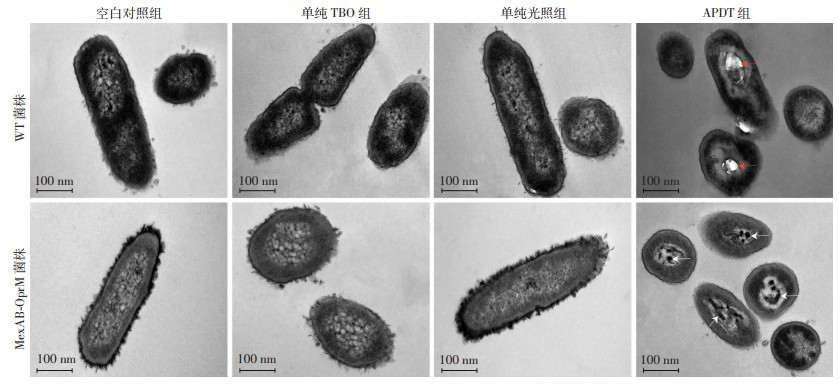
采用透射电镜观察铜绿假单胞菌经不同条件处理后细菌形态(图 3),空白对照组、单纯TBO组和单纯光照组中两株细菌均呈现正常的杆状,具有光滑连续的双层膜结构,细胞壁、细胞外膜、菌毛清晰可见。WT菌株细胞壁最外层可见菌毛,胞质呈颗粒状,亚细胞结构只能分辨出高电子密度和低电子密度区域。MexAB-OprM菌株细胞壁最外层可见大量菌毛,胞质整体呈浅灰色,胞质内亚结构呈丝状,电子密度较低、分布均匀。APDT处理后两株细菌整体变小,细胞壁外层菌毛完全消失,膜结构连续性、完整性中断,细胞壁和细胞质膜有分离现象。WT菌株胞质外围可见聚集的致密颗粒和胞质中部可见空泡样结构,分别表现为黑色和明亮的区域;MexAB-OprM菌株胞质电子密度升高,胞质中出现高电子密度的束状纤维样结构(箭头示)。
|
| 红色箭头示胞质出现空泡样结构;白色箭头示胞质出现束状纤维样结构 图 3 透射电镜观察亚致死量APDT处理前后两株铜绿假单胞菌形态 |
2.4 扫描电镜观察亚致死量APDT处理后铜绿假单胞菌形态变化
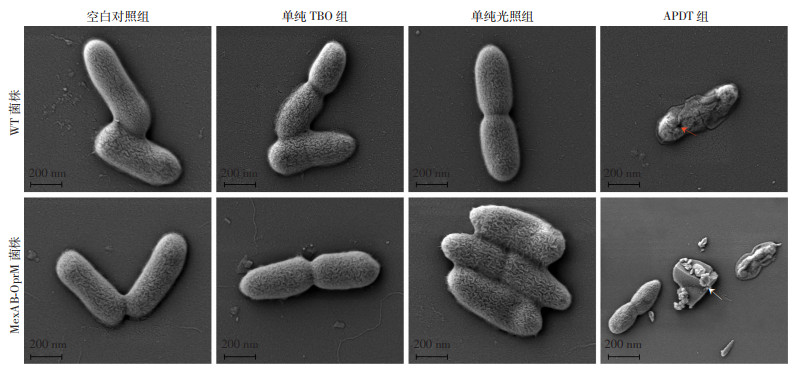
扫描电镜观察(图 4)结果显示:空白对照组、单纯TBO组和单纯光照组细菌均为明显正常的杆状和光滑的细胞形态,多成对出现,细菌表面可见菌毛;APDT处理后,细菌失去了正常的形态,两株细菌均出现不同程度皱缩、塌陷及裂解,WT菌株胞壁可见孔洞,MexAB-OprM菌株可见菌体裂解的碎片(箭头示)。
|
| 红色箭头示细胞壁出现空洞;白色箭头示菌体裂解的碎片 图 4 扫描电镜观察亚致死量APDT处理前后两株铜绿假单胞菌形态变化 |
2.5 亚致死量APDT处理前后铜绿假单胞菌对抗生素敏感度变化
WT菌株对检测抗生素均敏感,MexAB-OprM菌株对头孢吡肟、美罗培南不敏感,对其余抗生素耐药。亚致死量APDT处理后,WT菌株MIC值与未处理组相比未见明显改变;而MexAB-OprM菌株对哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、亚胺培南、美罗培南、阿米卡星、妥布霉素等抗生素变敏感,其中对阿米卡星、妥布霉素的MIC值降低32倍,对哌拉西林/他唑巴坦、头孢他啶、美罗培南的MIC值降低16倍,对环丙沙星MIC值降低2倍(表 1)。
| 抗生素 | WT菌株 | MexAB-OprM菌株 | |||
| APDT处理前 | APDT处理后 | APDT处理前 | APDT处理后 | ||
| 哌拉西林/他唑巴坦 | ≤4/4 | ≤4/4 | 128/4 | 16/4 | |
| 头孢他啶 | 2 | ≤2 | 64 | 4 | |
| 头孢吡肟 | ≤1 | 2 | 16 | 2 | |
| 亚胺培南 | 1 | 1 | 8 | 2 | |
| 美罗培南 | ≤0.25 | ≤0.25 | 4.00 | ≤0.25 | |
| 阿米卡星 | ≤2 | ≤2 | 64 | ≤2 | |
| 妥布霉素 | ≤1 | ≤1 | 32 | ≤1 | |
| 环丙沙星 | ≤0.25 | ≤0.25 | 4.00 | 2.00 | |
2.6 亚致死量APDT处理后多重耐药菌株外排泵基因表达的变化
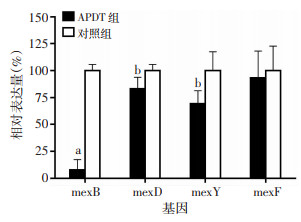
采用RT-qPCR检测APDT处理前(对照组)、后(APDT组)MexAB-OprM菌株外排泵基因表达(图 5),发现4种常见外排泵基因表达均下调,其中mexB基因的表达量为对照组的8%(P < 0.01),mexD为对照组的83%(P < 0.05),mexY为对照组的69%(P < 0.05),mexF为对照组的93%。
|
| a:P < 0.01,b:P < 0.05,与对照组比较 图 5 TBO-APDT处理后MexAB-OprM菌株外排泵基因相对表达量(n=3) |
3 讨论
迄今,多项体外实验证明APDT有良好的抗菌效果[8-10]。TBO是一种吩噻嗪类光敏剂,其介导的APDT具有良好的广谱抗菌活性[11-14],已证实吩噻嗪类光敏剂(TBO、MB等)是铜绿假单胞菌外排泵MexAB-OprM等的底物[15-16],从理论上讲,其介导的APDT对外排泵高表达的铜绿假单胞菌的杀伤会受到影响,然而不同学者研究结论不一致。有研究发现TBO介导的APDT对60多株外排泵高表达的耐药铜绿假单胞菌的杀伤均优于敏感菌株[14],而有研究发现MB介导的APDT对外排泵高表达的铜绿假单胞菌的杀伤效应低于敏感菌株,加入外排泵抑制剂可以增强APDT对耐药菌株的杀伤效应[15-16]。APDT杀菌机制的研究也不一致,比如DNA是否为APDT的靶点,目前存在较大争议,有学者认为APDT会氧化损伤细菌的DNA,进而影响基因的表达[17-18],而USACHEVA等[19]认为APDT不会引起DNA遗传学的改变。因此,目前APDT对耐药菌的杀伤效应、机制以及具体参数仍没有定论。
既往研究发现:在一定光敏剂浓度和光照剂量范围内,杀菌效应与光敏剂浓度和光照剂量均呈正相关[20-22]。本研究也发现APDT对两株菌的杀伤效应随TBO浓度和光照强度的增加而增强;此外,还发现TBO介导的APDT对两株铜绿假单胞菌的杀伤在相同条件下并无明显差异,这与之前TSENG等[14]和TEGOS等[15]的研究均不相同,分析原因可能是实验所用的光敏剂浓度、光照强度的参数以及菌株差异所致。TBO作为阳离子光敏剂,可以与带负电荷的细胞壁外膜上的脂多糖(LPS)结合,当LPS所带阴离子被带正电荷的TBO中和后,细胞壁外膜通过“自我促进”途径增加TBO的摄入[23],因此TBO通过细胞壁外膜进入细胞质间隙到达细胞质膜,光照后APDT产物攻击外膜和质膜的脂质分子导致细胞膜结构受损[24],进而致细菌通透性发生改变,胞质外渗,所以激光共聚焦显微镜观察到红染的细菌、透射电镜可见细菌胞质电子密度改变以及扫描电镜观察到细菌出现塌陷、孔洞等现象。
MexAB-OprM外排泵可识别碳青霉烯类、头孢菌素类、喹诺酮类、氨基糖苷类等抗生素[25-26],所以MexAB-OprM菌株对多种抗生素均耐药。本研究中发现亚致死量APDT处理后,MexAB-OprM菌株对多种抗生素的敏感度增加,并且透射电镜观察发现拟核DNA聚集成粗大的纤维条索状,同时RT-qPCR检测到外排泵基因表达下调。以上结果证实APDT可以作用于MexAB-OprM菌株拟核DNA,影响耐药基因表达,从而提升细菌对抗生素的敏感度;说明TBO介导的APDT可以对细菌产生光动力后遗效应,改变了细菌的生物学特性,PINTO等[11]也发现经TBO介导的APDT治疗后,白色念珠菌的生物膜形成能力显著降低。光敏剂进入胞质与DNA结合,单线态氧(1O2)大量产生,被认为是细菌发生核酸损伤的基础[27],这对反应条件的要求较高,过强的APDT效应会直接导致细菌裂解死亡,过低的APDT作用由于DNA强大的自我修复系统而不足以引起基因表达的改变,这解释了与CASSIDY等[7]报道结果不一致的可能原因。本研究未能解释不同外排泵基因相对表达量下调幅度不一致,原因可能是高表达基因处于活跃状态,因此被攻击的概率更大。APDT治疗后WT菌株的拟核区以及药敏实验与MexAB-OprM菌株不一致,原因可能与菌株自身的理化性质相关,因为TEM发现两株菌的亚细胞结构有明显差异。
多重耐药菌感染的治疗是临床十分棘手的问题,严重威胁人类生命健康,而TBO介导的APDT在体外对多重耐药铜绿假单胞菌表现出良好的杀伤作用,因此在治疗多重耐药菌感染方面具备巨大潜力。本研究通过观察、分析APDT治疗前后细菌微观形态学、抗生素敏感度和耐药菌外排泵基因的表达,初步证实TBO介导的APDT可以对细菌的细胞壁、质膜、DNA等多个靶点同时产生作用,从而对细菌产生有效杀伤,这相较于抗生素单一靶点有一定的优势。下一步,我们将收集更多的菌株进行体外和在体动物模型实验,不断验证和发现TBO介导的APDT对多重耐药菌的杀伤效应及机制,进而为临床应用打下良好的研究基础。
志谢 感谢本院烧伤科微生物室龚雅丽副主任技师为本研究提供菌株| [1] |
FELTS A G, GRAINGER D W, SLUNT A J B. Locally delivered antibodies combined with systemic antibiotics confer synergistic protection a gainst antibiotic-resistant burn wound infection[J]. J Trauma, 2000, 49(5): 873-878. DOI:10.1097/00005373-200011000-00014 |
| [2] |
LI X Z, PLÉSIAT P, NIKAIDO H. The challenge of efflux-mediated antibiotic resistance in Gram-negative bacteria[J]. Clin Microbiol Rev, 2015, 28(2): 337-418. DOI:10.1128/CMR.00117-14 |
| [3] |
PANG Z, RAUDONIS R, GLICK B R, et al. Antibiotic resistance in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies[J]. Biotechnol Adv, 2019, 37(1): 177-192. DOI:10.1016/j.biotechadv.2018.11.013 |
| [4] |
YIN R, DAI T, AVCI P, et al. Light based anti-infectives: ultraviolet C irradiation, photodynamic therapy, blue light, and beyond[J]. Curr Opin Pharmacol, 2013, 13(5): 731-762. DOI:10.1016/j.coph.2013.08.009 |
| [5] |
WANG Y, FERRER-ESPADA R, BAGLO Y, et al. Photoinactivation of Neisseria gonorrhoeae: a paradigm-changing approach for combating antibiotic-resistant gonococcal infection[J]. J Infect Dis, 2019, 220(5): 873-881. DOI:10.1093/infdis/jiz018 |
| [6] |
CIEPLIK F, DENG D, CRIELAARD W, et al. Antimicrobial photodynamic therapy—what we know and what we don't[J]. Crit Rev Microbiol, 2018, 44(5): 571-589. DOI:10.1080/1040841x.2018.1467876 |
| [7] |
CASSIDY C M, DONNELLY R F, TUNNEY M M. Effect of sub-lethal challenge with Photodynamic Antimicrobial Chemotherapy (PACT) on the antibiotic susceptibility of clinical bacterial isolates[J]. J Photochem Photobiol B: Biol, 2010, 99(1): 62-66. DOI:10.1016/j.jphotobiol.2010.02.004 |
| [8] |
ZHOU Z, PENG S, SUI M, et al. Multifunctional nanocomplex for surface-enhanced Raman scattering imaging and near-infrared photodynamic antimicrobial therapy of vancomycin-resistant bacteria[J]. Colloids Surf B Biointerfaces, 2018, 161: 394-402. DOI:10.1016/j.colsurfb.2017.11.005 |
| [9] |
HALILI F, ARBOLEDA A, DURKEE H, et al. Rose Bengal-and riboflavin-mediated photodynamic therapy to inhibit methicillin-resistant Staphylococcus aureus keratitis isolates[J]. Am J Ophthalmol, 2016, 166: 194-202. DOI:10.1016/j.ajo.2016.03.014 |
| [10] |
SUNG N, BACK S, JUNG J, et al. Inactivation of multidrug resistant (MDR)- and extensively drug resistant (XDR)-Mycobacterium tuberculosis by photodynamic therapy[J]. Photodiagnosis Photodyn Ther, 2013, 10(4): 694-702. DOI:10.1016/j.pdpdt.2013.09.001 |
| [11] |
PINTO A P, ROSSETI I B, CARVALHO M L, et al. Photodynamic Antimicrobial Chemotherapy (PACT), using Toluidine blue O inhibits the viability of biofilm produced by Candida albicans at different stages of development[J]. Photodiagnosis Photodyn Ther, 2018, 21: 182-189. DOI:10.1016/j.pdpdt.2017.12.001 |
| [12] |
DA SILVA PASSOS J C, LOPES CARVALHO M, VILLAÇA MORAIS F, et al. Photodynamic Antimicrobial Chemotherapy (PACT), using Toluidine blue (TBO) inhibits both growth and dimorphism in Paracoccidioides brasiliensis by a mechanism involving reactive oxygen species (ROS) production[J]. Photodiagnosis Photodyn Ther, 2019, 25: 421-424. DOI:10.1016/j.pdpdt.2019.01.003 |
| [13] |
SHEN J, LIANG Q F, SU G Y, et al. In vitro effect of toluidine blue antimicrobial photodynamic chemotherapy on Staphylococcus epidermidis and Staphylococcus aureus isolated from ocular surface infection[J]. Trans Vis Sci Tech, 2019, 8(3): 45. DOI:10.1167/tvst.8.3.45 |
| [14] |
TSENG S P, TENG L J, CHEN C T, et al. Toluidine blue O photodynamic inactivation on multidrug-resistant Pseudomonas aeruginosa[J]. Lasers Surg Med, 2009, 41(5): 391-397. DOI:10.1002/lsm.20765 |
| [15] |
TEGOS G P, HAMBLIN M R. Phenothiazinium antimicrobial photosensitizers are substrates of bacterial multidrug resistance pumps[J]. Antimicrob Agents Chemother, 2006, 50(1): 196-203. DOI:10.1128/aac.50.1.196-203.2006 |
| [16] |
TEGOS G P, MASAGO K, AZIZ F, et al. Inhibitors of bacterial multidrug efflux pumps potentiate antimicrobial photoinactivation[J]. Antimicrob Agents Chemother, 2008, 52(9): 3202-3209. DOI:10.1128/aac.00006-08 |
| [17] |
MACLEAN M, MACGREGOR S J, ANDERSON J G, et al. The role of oxygen in the visible-light inactivation of Staphylococcus aureus[J]. J Photochem Photobiol B, 2008, 92(3): 180-184. DOI:10.1016/j.jphotobiol.2008.06.006 |
| [18] |
HAMBLIN M R, VIVEIROS J, YANG C, et al. Helicobacter pylori accumulates photoactive porphyrins and is killed by visible light[J]. Antimicrob Agents Chemother, 2005, 49(7): 2822-2827. DOI:10.1128/aac.49.7.2822-2827.2005 |
| [19] |
USACHEVA M N, TEICHERT M C, USACHEV Y M, et al. Interaction of the photobactericides methylene blue and toluidine blue with a fluorophore in Pseudomonas aeruginosa cells[J]. Lasers Surg Med, 2008, 40(1): 55-61. DOI:10.1002/lsm.20593 |
| [20] |
LI J, QIN M, LIU C, et al. Antimicrobial photodynamic therapy against multidrug-resistant Acinetobacter baumannii clinical isolates mediated by Aloe-emodin: an in vitro study[J]. Photodiagnosis Photodyn Ther, 2020, 29: 101632. DOI:10.1016/j.pdpdt.2019.101632 |
| [21] |
QI M L, CHI M H, SUN X L, et al. Novel nanomaterial-based antibacterial photodynamic therapies to combat oral bacterial biofilms and infectious diseases[J]. Int J Nanomed, 2019, 14: 6937-6956. DOI:10.2147/IJN.S212807 |
| [22] |
VIEIRA C, GOMES A T P C, MESQUITA M Q, et al. An insight into the potentiation effect of potassium iodide on aPDT efficacy[J]. Front Microbiol, 2018, 9: 2665. DOI:10.3389/fmicb.2018.02665 |
| [23] |
DEMIDOVA T N, HAMBLIN M R. Effect of cell-photosensitizer binding and cell density on microbial photoinactivation[J]. Antimicrob Agents Chemother, 2005, 49(6): 2329-2335. DOI:10.1128/aac.49.6.2329-2335.2005 |
| [24] |
CABISCOL E, TAMARIT J, ROS J. Oxidative stress in bacteria and protein damage by reactive oxygen species[J]. Int Microbiol, 2000, 3(1): 3-8. |
| [25] |
WESTBROCK-WADMAN S, SHERMAN D R, HICKEY M J, et al. Characterization of a Pseudomonas aeruginosa efflux pump contributing to aminoglycoside impermeability[J]. Antimicrob Agents Chemother, 1999, 43(12): 2975-2983. DOI:10.1128/aac.43.12.2975 |
| [26] |
DUNHAM S A, MCPHERSON C J, MILLERA A. The relative contribution of efflux and target gene mutations to fluoroquinolone resistance in recent clinical isolates of Pseudomonas aeruginosa[J]. Eur J Clin Microbiol Infect Dis, 2010, 29(3): 279-288. DOI:10.1007/s10096-009-0852-z |
| [27] |
TAVARES A, DIAS S R, CARVALHO C M, et al. Mechanisms of photodynamic inactivation of a Gram-negative recombinant bioluminescent bacterium by cationic porphyrins[J]. Photochem Photobiol Sci, 2011, 10(10): 1659-1669. DOI:10.1039/c1pp05097d |




