2. 400038 重庆,陆军军医大学(第三军医大学)药学与检验医学系微生物与生化药学教研室;
3. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院普外科
2. Department of Microbiology and Biochemical Pharmacy, Faculty of Pharmacy and Laboratory Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of General Surgery, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038, China
肿瘤的发生、发展与机体免疫细胞介导的应答密切相关[1-2]。其中,CD8+ T细胞的抗肿瘤功能活性则是决定疾病进展与否的关键[3]。既往的研究认为,肿瘤浸润的CD8+ T细胞功能受到抑制,进而无法阻止肿瘤的生长[4]。然而,近年来的研究表明,肿瘤中的CD8+ T细胞可高表达CD103分子,并通过CD103与肿瘤细胞表面的E-钙粘蛋白结合,促使抗原特异性的CD8+ T细胞驻留于上皮组织中;此外,CD103的激活还可诱导CD8+ T细胞释放细胞毒性因子颗粒酶B和穿孔素,从而增强其抗肿瘤免疫应答[5]。目前,表达CD103分子的CD8+ T细胞已被确认为CD8+CD103+组织常驻记忆型T细胞(tissue-resident memory T cells, Trm),其在抗肿瘤免疫应答中发挥了重要作用[6]。在胃癌中,文献[7]报道CD8+CD103+ Trm细胞在肿瘤组织中的浸润与患者的临床预后成正相关。然而,这群细胞在胃癌患者组织中介导的免疫应答及其功能调控仍不清楚。因此,本研究拟通过收集胃癌患者的组织标本,分析CD8+CD103+ Trm细胞的应答特征,并探讨其功能下降的可能机制。
1 材料与方法 1.1 一般资料收集川北医学院附属医院肿瘤科(第1组,30例)和陆军军医大学第二附属医院普外科(第2组,16例)经病理组织学确认、临床资料保存完整的术前未经药物或其他方法治疗的胃癌患者组织标本,伴发严重感染性疾病、自生免疫性疾病以及多发肿瘤的胃癌患者排除纳入;第1组为2016年5月至2017年8月住院患者的手术切除标本经石蜡包埋后的切片组织,用于免疫组织化学染色检测,第2组为2020年7月至2020年12月住院患者的手术切除新鲜标本,用于流式细胞术检测,入组的患者根据国际抗癌联盟第8版恶性肿瘤TNM分期标准进行分组,其中第1组Ⅰ~Ⅱ期14例,Ⅲ~Ⅳ期16例;男性26例,女性4例;年龄43~78岁,平均61.6岁;第2组Ⅰ~Ⅱ期7例,Ⅲ~Ⅳ期9例;男性10例,女性6例;年龄39~86岁,平均63.1岁。第1组受试者为回顾性资料研究,第2组受试者对研究方案知情同意,本研究遵循的程序符合伦理学标准并经川北医学院附属医院和陆军军医大学第二附属医院伦理委员会审批批准(伦理批准号:2020-YD075-01)。
1.2 实验材料用于免疫组化染色的试剂:纯化的鼠抗人CD8抗体以及兔抗人CD103抗体均购自美国Abcam公司,ImmPRESS Duet双染色聚合物试剂盒购自美国Vectorlabs公司(包含阻断液、正常马血清、HRP标记马抗兔抗体、AP标记马抗鼠抗体以及DAB与坚固红显色底物);用于组织处理的消化酶购自德国Miltenyi公司;用于流式细胞术的试剂:APC-H7标记的抗人CD3抗体和细胞固定通透剂购自美国BD公司,PerCP/Cy5.5标记的抗人CD8抗体、APC标记的抗人CD103抗体、FITC标记的抗人CD45RA抗体、PE标记的抗人CCR7抗体、PE标记的抗人穿孔素抗体、FITC标记的抗人颗粒酶B抗体购自美国Biolegend公司,0.01 mol/L的PBS、RPMI1640培养基和胎牛血清购自美国HyClone公司,重组的TGF-β1购自美国Peprotech公司,淋巴细胞分离液购自美国GE公司,CD8细胞分选试剂盒购自加拿大Stem cell公司,BCA蛋白浓度测定试剂盒购自美国Invitrogen公司,TGF-β1 ELISA检测试剂盒购自深圳达科为公司。实验所用仪器:全自动组织分离器购自德国Miltenyi公司,流式细胞仪购自美国BD公司,水平离心机购自美国Beckman公司,HF240恒温培养箱、生物安全柜均购自力康生物,显微镜购自日本Niko公司。
1.3 手术标本的处理手术切除的组织标本及时运回实验室,无菌条件下剪成小块,转移至预先加有5 mL RPMI1640培养基和消化酶工作液的分离管中,将分离管置于全自动组织分离器上进行处理,随后37 ℃孵育1 h,消化的细胞悬液过200目钢网,离心收集细胞沉淀后用于流式细胞术染色。
1.4 流式细胞术染色及检测组织制成的单细胞悬液直接加入APC-H7标记的抗人CD3抗体、PerCP/Cy5.5标记的抗人CD8抗体、APC标记的抗人CD103抗体、FITC标记的CD69抗体、FITC标记的抗人CD45RA抗体、PE标记的抗人CCR7抗体、PE标记的抗人PD-1抗体,4 ℃避光染色30 min,PBS洗涤后利用BD流式细胞仪进行检测;若需检测颗粒酶B和穿孔素的表达水平,单细胞悬液经APC-H7标记的抗人CD3抗体、PerCP/Cy5.5标记的抗人CD8抗体、APC标记的抗人CD103抗体染色后,利用细胞固定通透剂处理,4 ℃避光孵育20 min,随后再加入FITC标记的抗人颗粒酶B抗体和PE标记的抗人穿孔素抗体继续染色30 min,利用流式细胞仪进行检测,然后用Flowjo分析软件对数据进行分析。
1.5 双重免疫组织化学染色经石蜡包埋的组织进行切片,然后二甲苯脱蜡2次,每次10 min;酒精梯度水化各5 min,柠檬酸缓冲液进行抗原修复;加入双染色聚合物试剂盒中的阻断液孵育10min,去除组织内源性的过氧化物酶和碱性磷酸酶;加入正常马血清封闭20 min;加入已预先混合好的鼠抗人CD8抗体和兔抗人CD103抗体,4 ℃孵育过夜,经PBS洗涤后加入已预先混合好的HRP标记马抗兔抗体和AP标记马抗鼠抗体,37 ℃孵育30 min;经PBS洗涤后加入DAB显色液,镜下观察显色情况并及时终止显色;随后加入坚固红底物显色液,镜下观察显色情况并及时终止显色。苏木精复染细胞核,水溶性封片剂封片后光学显微镜下采集图片。对CD8与CD103双阳性细胞进行计数,以平均每高倍镜视野(HPF,×400)中的CD8与CD103双阳性细胞数目来表示;其中,CD8细胞单阳性为粉红色,CD103细胞单阳性为浅棕色,CD8与CD103双阳性细胞为棕黑色。
1.6 ELISA检测组织标本提取蛋白,经BCA蛋白浓度测定试剂盒测定组织蛋白浓度,随后利用酶联免疫吸附试验(ELISA)检测TGF-β1的蛋白水平。
1.7 CD8+ T细胞的分离与培养采集健康人的外周血5 mL到肝素抗凝管中,利用PBS按照1 ∶1的比例进行稀释,然后采用淋巴细胞分离液分离获取外周血单个核细胞,再根据CD8细胞分选试剂盒分离纯化出CD8+ T细胞,以每孔2×105个细胞加入到预包被抗人CD3和CD28抗体的96孔圆底板中, 并加入终浓度为10 ng/mL的TGF-β1进行刺激,72 h后,收集细胞进行流式细胞染色,检测其表达颗粒酶B以及穿孔素的水平。
1.8 统计学处理采用GraphPad Prism 5软件进行数据处理和统计学分析,计量资料用x±s表示,2组之间的比较采用t检验,相关性分析采用Spearman相关检验,检验水准α=0.05。
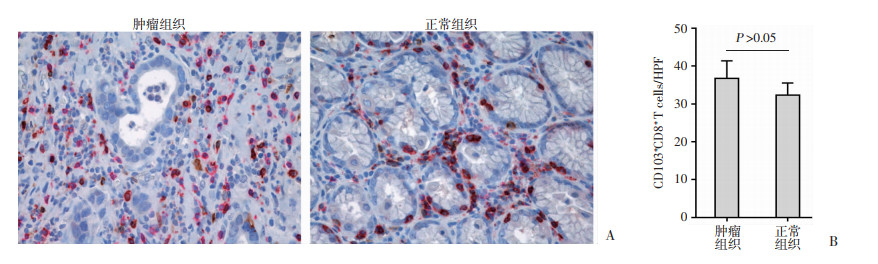
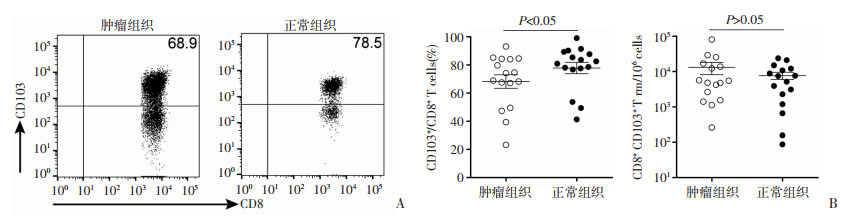
2 结果 2.1 胃癌组织中CD8+CD103+ Trm细胞的水平检测免疫组织化学染色结果显示:CD8与CD103双阳性细胞的数目在胃癌组织和正常组织中差异无统计学意义(37/HPF vs 33/HPF, 图 1);流式细胞术检测结果显示:与正常组织相比,CD8+CD103+ Trm细胞占CD8+ T细胞的频率在胃癌组织中显著下降,差异有统计学意义(68.2% vs 77.8%, P < 0.05, 图 2),然而,以流式细胞术检测到的每106个细胞进行均一化处理时,CD8+CD103+ Trm细胞数目在胃癌组织与正常组织中差异并无统计学意义(13 090/106 vs 7 682/106, 图 2)。
|
| 图 1 双重免疫组化染色观察胃癌患者肿瘤组织和正常组织中CD8+CD103+细胞(棕黑色)的变化(×400) |
|
| 图 2 流式细胞术检测胃癌患者肿瘤组织和正常组织中CD8+CD103+ Trm细胞的变化 |
2.2 胃癌组织中CD8+CD103+ Trm细胞与疾病分期的相关性分析
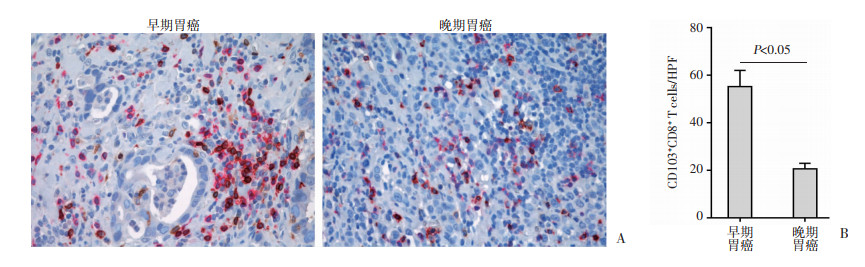
基于肿瘤的TNM分期,胃癌患者被分为早期(Ⅰ+Ⅱ期)和晚期(Ⅲ+Ⅳ期)两组,然后通过免疫组织化学染色检测CD8+CD103+ Trm细胞的数目并比较两组间差异。结果显示:早期胃癌患者CD8+CD103+ Trm细胞数目显著高于晚期患者(55/HPF vs 21/HPF, P < 0.05,图 3)。
|
| 图 3 早、晚期胃癌患者肿瘤组织中CD8+CD103+ Trm细胞的数目比较(×400) |
2.3 胃癌组织中CD8+CD103+ Trm细胞的表型分析
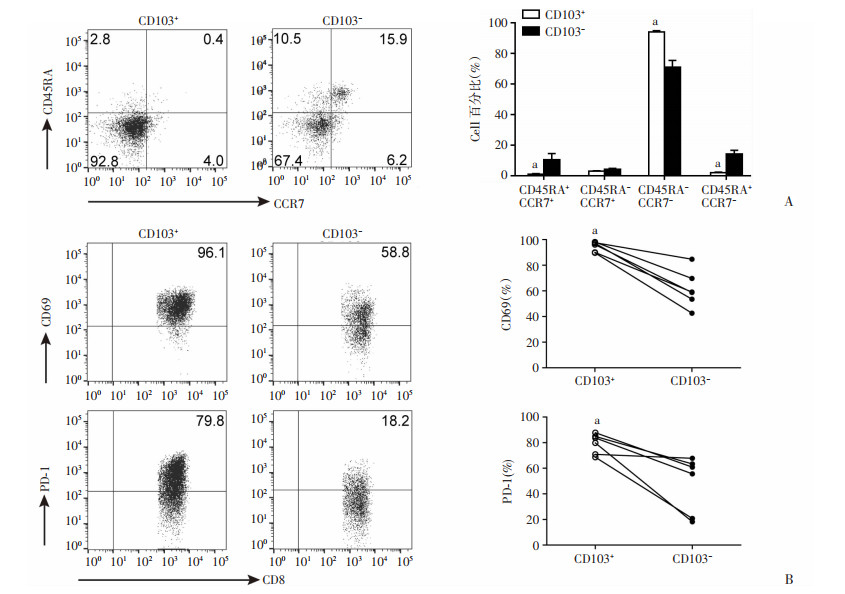
流式细胞术检测结果显示:与CD8+CD103- T细胞相比,胃癌组织浸润CD8+CD103+ Trm细胞中CD45RA+CCR7+亚群及CD45RA+CCR7-亚群的比例显著下降(1.0% vs 10.5%、2.0 vs 14.3%,P < 0.05),CD45RA-CCR7-亚群的比例则明显增加(94.1% vs 70.9%,P < 0.05),但CD45RA-CCR7+亚群在CD8+CD103- T细胞与CD8+CD103+ Trm细胞中的比例比较,差异无统计学意义(3.0% vs 4.3%,图 4A)。此外,与CD8+CD103- T细胞相比,CD8+CD103+ Trm细胞表达更高水平的CD69和PD-1(94.8% vs 61.4%、79.3 vs 47.8%,P < 0.05,图 4B)。
|
| A:CD45RA和CCR7分子在胃癌组织浸润的CD8+CD103+ Trm细胞及CD8+CD103- T细胞的共表达分析(n=7) a:P < 0.05, 与CD8+CD103- T细胞组比较;B: 胃癌组织浸润的CD8+CD103+ Trm细胞及CD8+CD103- T细胞表达CD69及PD-1的水平比较(n=6) a:P < 0.05, 与CD8+CD103- T细胞组比较 图 4 胃癌组织中CD8+CD103+ Trm细胞的表型分析 |
2.4 胃癌组织中CD8+CD103+ Trm细胞表达颗粒酶B及穿孔素的水平检测
流式检测结果显示:在胃癌组织中,CD8+CD103+ Trm细胞表达颗粒酶B的水平明显低于CD8+CD103- T细胞(31.7% vs 48.4%,P < 0.05);与CD8+CD103- T细胞比较,表达穿孔素的CD8+CD103+ Trm细胞比例也明显下降,二者比较差异有统计学意义(4.9% vs 11.7%,P < 0.05,图 5A)。此外,与正常组织相比,胃癌组织中CD8+CD103+ Trm细胞表达的颗粒酶B和穿孔素水平均显著下降(颗粒酶B:32.2% vs 42.3%,P < 0.05;穿孔素:4.8% vs 11.3%,P < 0.05,图 5B)。
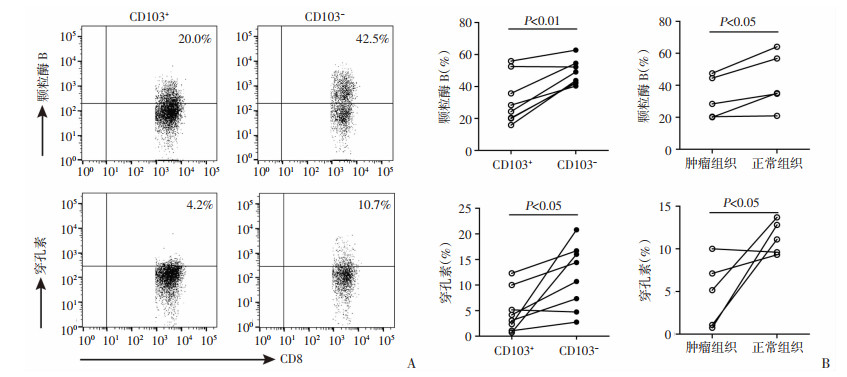
|
| A:胃癌组织浸润的CD8+CD103+ Trm细胞及CD8+CD103- T细胞表达颗粒酶B及穿孔素的水平比较(n=7);B: 胃癌组织与正常组织中CD8+CD103+ Trm细胞表达颗粒酶B及穿孔素的水平比较(n=5) 图 5 胃癌组织中CD8+CD103+ Trm细胞的颗粒酶B及穿孔素表达水平分析 |
2.5 TGF-β1对CD8+CD103+ Trm细胞中颗粒酶B及穿孔素表达的影响
ELISA结果显示:胃癌组织中的TGF-β1蛋白浓度与CD8+CD103+ Trm细胞表达的颗粒酶B及穿孔素水平成负相关(P < 0.05,图 6A)。进一步体外利用TGF-β1刺激培养显示,与未刺激组相比,刺激组CD8+CD103+ Trm细胞表达的颗粒酶B及穿孔素水平均显著下降(P < 0.05,图 6B)。
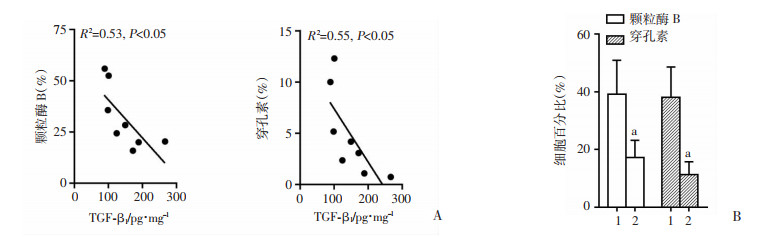
|
| A: 胃癌组织中TGF-β1蛋白浓度与表达颗粒酶B或穿孔素的CD8+CD103+ Trm细胞水平成负相关; B: 体外TGF-β1对CD8+CD103+ Trm细胞表达颗粒酶B或穿孔素的影响(n=4), 1:未刺激组,2:TGF-β1刺激组;a:P < 0.05, 与未刺激组比较 图 6 TGF-β1抑制CD8+CD103+ Trm细胞中颗粒酶B及穿孔素的表达 |
3 讨论
肿瘤免疫伴随着胃癌的发生、发展及其临床转归等疾病的进程[8]。近年来,随着对肿瘤患者免疫应答的深入研究,发现一群组织常驻记忆型CD8+ T细胞即CD8+CD103+ Trm细胞发挥了抗肿瘤活性,其在肿瘤组织中的浸润增加常预示着患者对治疗会产生有效的应答,同时生存时间亦会明显延长[9]。因此,深入探讨CD8+CD103+ Trm细胞在胃癌微环境中的应答及其功能调控可为其临床免疫治疗提供理论支撑。
本研究发现,与正常组织相比,胃癌组织中CD8+CD103+ Trm细胞的数目并未出现明显变化;但随着疾病的进展,这群细胞在晚期胃癌患者肿瘤组织中的数目显著低于早期胃癌患者,这与前期的文献[10]报道一致。然而,本研究还发现,胃癌组织中CD8+CD103+ Trm细胞占CD8+ T细胞的比例显著低于正常组织,这可能与胃癌微环境对其浸润的调控有关。有研究表明CD8+ T细胞在胃癌组织中的数目增加[11],但胃癌细胞可通过影响脂肪酸氧化途径诱导CD8+CD103+ Trm细胞死亡[12],由此可能导致CD8+ T细胞在胃癌组织浸润的同时,由于CD8+CD103+ Trm细胞的死亡增加而使得其占CD8+ T细胞的比例下降。
基于CD45RA和CCR7分子的共表达,CD8+ T细胞可被分为4个亚群:对抗原刺激敏感性较弱的初始型(CD45RA+CCR7+)、对抗原刺激具有较快增殖能力的中心记忆型(CD45RA-CCR7+)以及具有更快产生免疫应答的效应记忆型(CD45RA-CCR7-)和终末分化效应记忆型(CD45RA+CCR7-)[13-14]。本研究发现与CD8+CD103- T细胞相比,CD8+CD103+ Trm细胞中具有更高比例的效应记忆型细胞并高表达活化分子CD69;然而,胃癌组织中CD8+CD103+ Trm细胞表达的PD-1水平亦明显增加;由于PD-1分子是免疫细胞功能衰竭的标志[15],因此,尽管CD8+CD103+ Trm细胞在胃癌微环境中显示出活化的效应记忆表型,但其抗肿瘤能力很可能受到抑制。事实上,本研究的功能学分析显示胃癌组织中CD8+CD103+ Trm细胞表达的颗粒酶B和穿孔素水平显著低于正常组织,进一步证实胃癌组织中CD8+CD103+ Trm细胞产生杀肿瘤细胞毒性因子的能力显著下降。文献[16-17]报道调节性细胞因子TGF-β1可负向调控机体的免疫应答,并在胃癌的进程中发挥了重要作用。本研究发现,胃癌组织中的TGF-β1浓度与表达颗粒酶B和穿孔素的CD8+CD103+ Trm细胞水平成负相关,且体外TGF-β1刺激显著抑制CD8+CD103+ Trm细胞表达这两种因子,由此提示CD8+CD103+ Trm细胞的抗肿瘤功能很可能受到胃癌微环境TGF-β1的抑制,从而有助于胃癌的免疫逃逸。
总之,CD8+CD103+ Trm细胞在胃癌组织中的浸润与疾病的进展密切相关。此外,研究还发现其抗肿瘤功能的失调可能由胃癌组织来源的TGF-β1所介导。但是,本研究亦具有一定的局限性,比如用于流式细胞术检测的病例样本仍显较少,未能有效分析CD8+CD103+ Trm细胞频率变化与疾病进展及患者预后的关系。后续研究将进一步扩大样本收集,并深入阐明TGF-β1调控CD8+CD103+ Trm细胞抗肿瘤功能抑制的分子机制,将为胃癌的临床免疫治疗提供新的实验依据。
| [1] |
DENKERT C, VON MINCKWITZ G, DARB-ESFAHANI S, et al. Tumour-infiltrating lymphocytes and prognosis in different subtypes of breast cancer: a pooled analysis of 3771 patients treated with neoadjuvant therapy[J]. Lancet Oncol, 2018, 19(1): 40-50. |
| [2] |
LINETTE G P, CARRENO B M. Tumor-infiltrating lymphocytes in the checkpoint inhibitor era[J]. Curr Hematol Malig Rep, 2019, 14(4): 286-291. |
| [3] |
MILLER B C, SEN D R, AL ABOSY R, et al. Subsets of exhausted CD8+ T cells differentially mediate tumor control and respond to checkpoint blockade[J]. Nat Immunol, 2019, 20(3): 326-336. |
| [4] |
KURACHI M. CD8+ T cell exhaustion[J]. Semin Immunopathol, 2019, 41(3): 327-337. |
| [5] |
CORGNAC S, BOUTET M, KFOURY M, et al. The emerging role of CD8+ tissue resident memory T (TRM) cells in antitumor immunity: a unique functional contribution of the CD103 integrin[J]. Front Immunol, 2018, 9: 1904. |
| [6] |
WANG T, SHEN Y F, LUYTEN S, et al. Tissue-resident memory CD8+ T cells in cancer immunology and immunotherapy[J]. Pharmacol Res, 2020, 159: 104876. |
| [7] |
LI R C, LIU H, CAO Y F, et al. Identification and validation of an immunogenic subtype of gastric cancer with abundant intratumoural CD103 + CD8 + T cells conferring favourable prognosis[J]. Br J Cancer, 2020, 122(10): 1525-1534. |
| [8] |
ZHANG H M, CHEN J B. Current status and future directions of cancer immunotherapy[J]. J Cancer, 2018, 9(10): 1773-1781. |
| [9] |
PARK S L, GEBHARDT T, MACKAY L K. Tissue-resident memory T cells in cancer immunosurveillance[J]. Trends Immunol, 2019, 40(8): 735-747. |
| [10] |
王琰, 卢慧敏, 陈陆俊, 等. 胃癌组织中驻留CD8+T细胞的浸润程度及其意义[J]. 临床检验杂志, 2019, 37(4): 251-256. WANG Y, LU H M, CHEN L J, et al. Infiltration and significance of tissue-resident CD8+ T cells in gastric cancer[J]. Chin J Clin Lab Sci, 2019, 37(4): 251-256. |
| [11] |
ZHUANG Y, PENG L S, ZHAO Y L, et al. CD8(+) T cells that produce interleukin-17 regulate myeloid-derived suppressor cells and are associated with survival time of patients with gastric cancer[J]. Gastroenterology, 2012, 143(4): 951-962. |
| [12] |
LIN R, ZHANG H, YUAN Y J, et al. Fatty acid oxidation controls CD8 + Tissue-Resident memory T-cell survival in gastric adenocarcinoma[J]. Cancer Immunol Res, 2020, 8(4): 479-492. |
| [13] |
CALLENDER L A, CARROLL E C, BEAL R W J, et al. Human CD8+ EMRA T cells display a senescence-associated secretory phenotype regulated by p38 MAPK[J]. Aging Cell, 2018, 17(1): e12675. |
| [14] |
HENSON S M, RIDDELL N E, AKBAR A N. Properties of end-stage human T cells defined by CD45RA re-expression[J]. Curr Opin Immunol, 2012, 24(4): 476-481. |
| [15] |
HE X, XU C Q. PD-1: a driver or passenger of T cell exhaustion?[J]. Mol Cell, 2020, 77(5): 930-931. |
| [16] |
PENG L S, ZHANG J Y, TENG Y S, et al. Tumor-associated monocytes/macrophages impair NK-cell function via TGFβ1 in human gastric cancer[J]. Cancer Immunol Res, 2017, 5(3): 248-256. |
| [17] |
SHEN Y, TENG Y S, LV Y, et al. PD-1 does not mark tumor-infiltrating CD8+ T cell dysfunction in human gastric cancer[J]. J Immunother Cancer, 2020, 8(2): e000422. |




