2. 6100031 成都,西部战区总医院心血管内科;
3. 400010 重庆,陆军军医大学(第三军医大学)大坪医院心血管内科
2. Department of Cardiovascular Medicine, General Hospital of Western Theater Command, Chengdu, Sichuan Province, 610003;
3. Department of Cardiovascular Diseases, Daping Hospital, Army Medical University, Chongqing, 400010, China
高血压是严重影响我国国民健康的重要慢性非传染性疾病之一。2012-2015年全国高血压抽样显示,18岁以上成人高血压(≥140/90 mmHg,1 mmHg=0.133 kPa)患病率为27.9%[1],与2002年第4次全国营养与健康调查相比[2],高血压患病率升高9.1%。长期高血压状态可引起多器官系统的慢性并发症,其中高血压肾病是常见的慢性并发症之一,是造成终末期肾病的常见病因。1990-2016年全球疾病负担的研究分析显示,高血压继发的肾脏损害是高血压患者病死率增高的主要原因之一[3]。因此,寻找有效的干预靶点对于高血压肾病的早期防治具有十分重要的意义。
尽管高血压肾病的确切机制存在争议,但越来越多的证据表明炎症是一个重要因素[4]。炎症小体作为炎症反应的上游,感知来自病原体或受损宿主细胞发出的危险信号从而启动炎症级联反应[5]。研究表明,NLRP3炎症小体在高血压及其相关的肾损伤的发病机制中起基础性作用。在高血压模型中,NLRP3炎症小体明显激活,NLRP3抑制剂MCC950可逆转血压并减轻高血压小鼠的肾脏炎症和纤维化[6]。多种内源性和外源性危险信号可激活NLRP3炎症小体,其中包括活性氧(reactive oxygen species,ROS)。而NADPH氧化酶是细胞内产生超氧化物的关键酶。ZHANG等[7-9]人研究发现NADPH氧化酶抑制剂可减轻小鼠的高血压反应,表明NADPH氧化酶在高血压的发生中起关键作用。另外,体内活性氧的清除可抑制NLRP3炎症小体的激活,最终改善肾损伤[9-10]。综上所述,这些发现表明NADPH氧化酶/ROS/NLRP3炎症小体通路可能是高血压肾病的关键致病机制。
迷迭香酸是一种天然存在的多酚类化合物,是迷迭香的有效成分,广泛存在于多种植物中,具有很好的抗氧化和抗炎作用[11]。前期研究已经表明,迷迭香酸对于心血管系统和肾脏具有良好的保护作用[12-14]。因此,本实验主要研究迷迭香酸对高血压肾病的保护作用及其是否可以通过NADPH氧化酶/ROS/NLRP3炎症小体通路发挥作用。
1 材料与方法 1.1 实验动物6~8周龄SPF级雄性C57BL/6小鼠30只,体质量20~25 g,由北京维通利华实验动物技术有限公司提供,动物许可证号:SYXK(军)2017-0058。动物SPF级常规饲养,室温维持20~25 ℃,12 h光照和黑暗交替,给予常规饲料自由饮食。
1.2 主要试剂植入式胶囊渗透泵购于美国ALZET公司;迷迭香酸购于上海阿拉丁生物科技股份有限公司;小鼠尿微量白蛋白酶联免疫分析购于上海酶联生物科技有限公司;肌酐测定试剂盒、尿素氮测试盒购于南京建成生物科技公司;血管紧张素Ⅱ、改良masson三色染色液购于索莱宝科技有限公司;二氢乙啶超氧化物阴离子荧光探针、NADP+/NADPH检测试剂盒购自上海碧云天生物技术有限公司;实时定量聚合酶链式反应(qRT-PCR)试剂盒购于日本TaKaRa公司;qRT-PCR引物购于上海生工生物工程股份有限公司;NLRP3、IL-18、α-平滑肌肌动蛋白(α-SMA)、p22phox、p47phox抗体购于英国Abcam公司;ASC抗体购自武汉爱博泰克生物科技有限公司;Caspase-1抗体购于美国Adipogen公司;IL-1β抗体购于美国R & D Systems公司;F4/80、ASC、Ⅰ型胶原蛋白(Col-1)抗体购于美国Santa Cruz公司。
1.3 方法 1.3.1 动物分组及模型构建实验分组:将C57BL/6小鼠按随机数字表法分为3组:Control组、AngⅡ组、AngⅡ+RA组(n=10)。使用戊巴比妥(40 mg·kg-1)腹腔注射麻醉小鼠,剃除颈背部毛发后将其固定。颈背部常规消毒后作一小切口,分离颈背部皮下组织,将装有AngⅡ溶液的微量渗透泵埋于小鼠颈背部,以1.46 mg·kg-1·d-1的剂量进行泵注[15],缝合皮肤,待小鼠苏醒后放回饲养笼,连续泵注4周,完成高血压肾病模型的构建。Control组则泵注等体积生理盐水。模型建立1周后,AngⅡ+RA组按50 mg·kg-1·d-1迷迭香酸的剂量进行灌胃[12],其余两组给予等体积生理盐水,连续灌胃3周。实验开始前及模型建立后每周使用尾袖法定期监测小鼠血压。
1.3.2 尿白蛋白及血肌酐、血尿素氮的定量测定实验结束后,收集小鼠24 h尿液并记录尿量,期间禁食不禁水。利用小鼠尿微量白蛋白ELISA试剂盒测定尿微量白蛋白含量。摘眼球取血,室温静置1~2 h,3 000 r/min离心15 min,分离上层血清,用南京建成肌酐及尿素氮测定试剂盒测定血肌酐、尿肌酐及血尿素氮含量。
1.3.3 细胞培养及处理人肾小管上皮细胞HK-2购自ATCC。HK-2细胞在加入含10%胎牛血清的DMEM/F12培养基中培养。用迷迭香酸(50 μmol/L)预处理48 h[16],然后用过氧化氢(100 μmol/L)处理[17]。2 h后收集细胞进行ROS生成,NLRP3炎症小体相关分子表达分析。
1.3.4 Masson染色造模4周后取肾脏标本于4%多聚甲醛中固定,常规脱水、透明、浸蜡、石蜡包埋后,制作石蜡切片,脱蜡后,用Masson染色观察肾组织纤维化程度,具体方法按索莱宝Masson三色染色试剂盒说明书进行。采用显微成像系统进行拍照记录。
1.3.5 免疫荧光染色石蜡切片常规脱蜡、抗原修复、封闭后,PBS清洗,一抗4 ℃孵育过夜,第2天进行二抗孵育以及DAPI复染核,最后使用防荧光淬灭封片液进行封片,在激光共聚焦显微镜下观察巨噬细胞浸润情况。
1.3.6 二氢乙啶超氧阴离子探针染色参考文献[18]方法,实验结束处死小鼠取出肾脏后立即置于液氮中速冻,使用OCT包埋,冰冻切片机-26 ℃将组织切为10 μm厚的切片,PBS清洗3次,二氢乙啶探针(1 μmol/L)37 ℃孵育30~60 min,PBS清洗,利用荧光显微镜拍照。
1.3.7 Real-time q-PCR检测mRNA表达Trizol法提取肾组织RNA,反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)反转录(37 ℃ 15 min→85 ℃ 5 s→4 ℃)得到cDNA产物。各引物序列见表 1。
| 基因 | 引物序列(5′→3′) |
| Col-1 | 上游: CTCCCTAGACCAGCAAATGT |
| 下游: GCACTCTCTTCTCCCTTGTT | |
| α-SMA | 上游: CTCTATGCTAACAACGTCCTCTC |
| 下游: GCGTTCTGGAGGAGCAATAA | |
| NLRP3 | 上游: GATCTTCGCTGCGATCAACA |
| 下游: GGGATTCGAAACACGTGCATTA | |
| ASC | 上游: AACCCAAGCAAGATGCGGAAG |
| 下游: TTAGGGCCTGGAGGAGCAAG | |
| Caspase-1 | 上游: GCCTGTTCCTGTGATGTGGAG |
| 下游: TGCCCACAGACATTCATACAGTTTC | |
| IL-1β | 上游: CCAGGGACAGGATATGGAGCA |
| 下游: TTCAACACGCAGGACAGGTACAG | |
| IL-18 | 上游: CTGCCACCTGCTGCAGTCTA |
| 下游: TCTACTGGTTCAGCAGCCATCTTTA | |
| p22phox | 上游: GCCATTGCCAGTGTGATCTA |
| 下游: CTCCTCTTCGGCCTCACTT | |
| p47phox | 上游: CAGAATGTTGCCTGGTTG |
| 下游: GTCCCCTCCCTTAGATGA |
1.3.8 免疫印迹实验
取肾组织,PBS清洗后,加入Western及IP裂解液与苯甲基磺酰氟的混合液,超声,裂解,离心后取上清,BCA法测定蛋白浓度定量,加入上样缓冲液,100 ℃使蛋白变性。其后进行聚丙烯酰胺凝胶电泳,转膜,封闭,一抗4 ℃孵育过夜,TBST清洗后,孵育二抗,采用美国LI-COR公司的Odyssey双色红外荧光成像系统,扫描确定分析蛋白条带,计算条带灰度值。
1.4 统计学分析利用SPSS 20.0统计软件进行数据统计分析。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析。
2 结果 2.1 迷迭香酸对高血压肾病小鼠血压、肾功能的影响与Control组相比,AngⅡ组小鼠血压、尿蛋白、血清肌酐及尿素氮水平明显升高(P < 0.05)。迷迭香酸干预3周后,与AngⅡ组相比,AngⅡ+RA组可以显著降低血压,改善尿蛋白、血清肌酐及尿素氮水平(P < 0.05),见表 2。
| 组别 | 血压 /mmHg | 尿白蛋白/ 肌酐/mg·g-1 | 血清肌酐 /μmol·L-1 | 血清尿素氮 /mmol·L-1 |
| Control组 | 112.3±8.4 | 25.1±8.7 | 21.9±1.6 | 11.6±1.3 |
| AngⅡ组 | 172.2±5.6a | 94.0±18.9a | 44.3±6.6a | 22.3±3.9a |
| AngⅡ+RA组 | 145.0±8.7b | 57.4±11.2b | 33.0±4.5b | 17.7±1.6b |
| a:P < 0.05,与Control组比较;b:P < 0.05,与AngⅡ组比较 | ||||
2.2 迷迭香酸对高血压肾病小鼠肾纤维化的影响
肾间质纤维化是高血压肾损伤的关键途径之一。Masson染色显示,与Control组相比,AngⅡ组小鼠肾纤维化程度显著增强;迷迭香酸干预后,AngⅡ+RA组肾纤维化水平降低(P < 0.05,图 1A、B)。q-PCR及Western blot分析结果显示,与Control组相比,AngⅡ组小鼠Col-1和α-SMA mRNA及蛋白表达明显增加;与AngⅡ组相比,AngⅡ+RA组小鼠Col-1和α-SMA mRNA及蛋白表达水平均降低(P < 0.05,图 1C~G)。
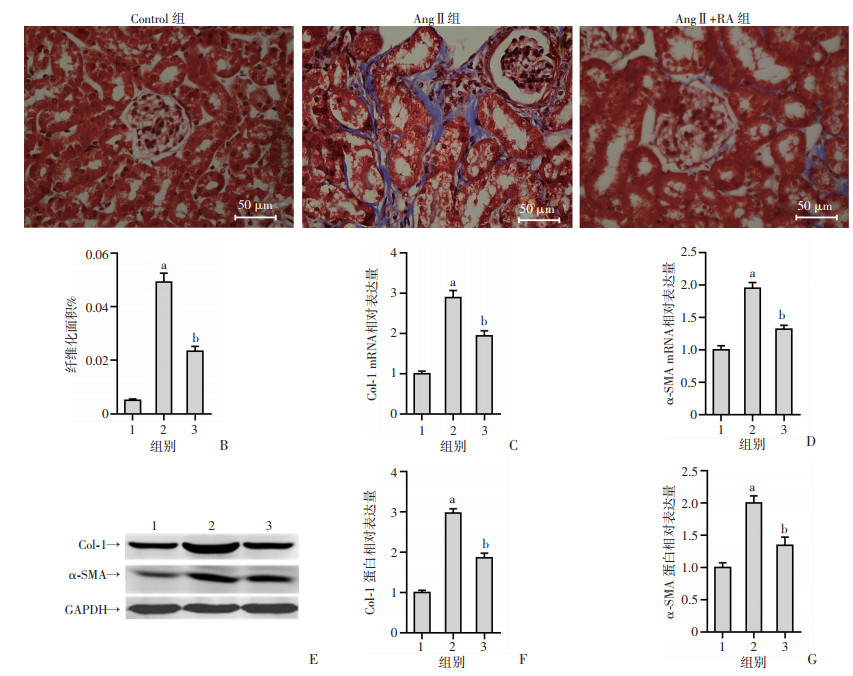
|
| A:masson染色观察各组肾组织纤维化情况(400×);B:纤维化面积统计;C、D:q-PCR检测肾组织Col-1、α-SMA mRNA的表达;E:Western blot检测肾组织Col-1、α-SMA的蛋白表达;F、G:Col-1、α-SMA蛋白半定量分析;1:Control组;2:AngⅡ组;3:AngⅡ+RA组;a:P < 0.05,与Control组比较;b:P < 0.05,与AngⅡ组比较 图 1 迷迭香酸对高血压肾病小鼠肾纤维化的影响(n=10,x±s) |
2.3 迷迭香酸对高血压肾病小鼠巨噬细胞浸润的影响
巨噬细胞标记物F4/80免疫荧光染色显示,与Control组相比,AngⅡ组小鼠肾组织巨噬细胞浸润显著增加;迷迭香酸干预后,AngⅡ+RA组肾组织巨噬细胞浸润减少(P < 0.05,图 2)。
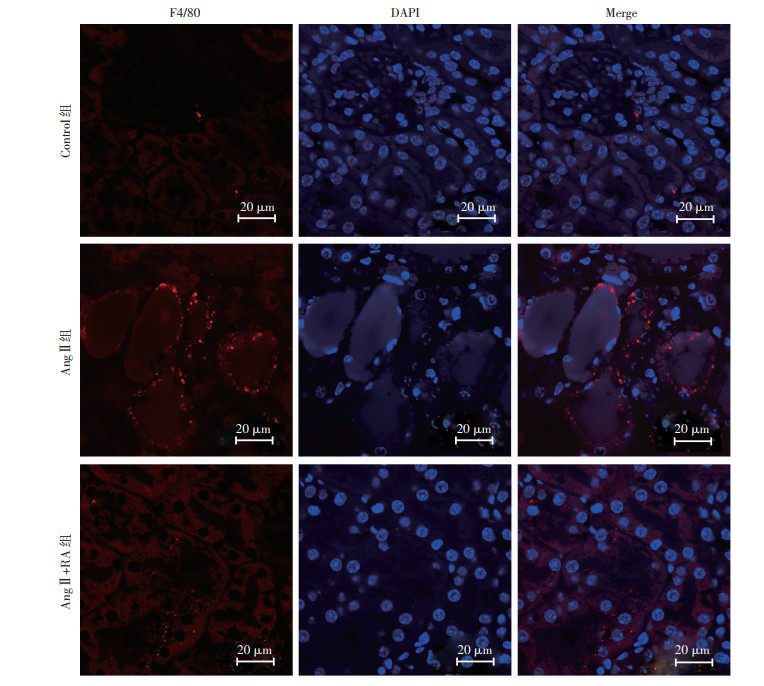
|
| 图 2 免疫荧光检测小鼠肾组织巨噬细胞浸润情况 |
2.4 迷迭香酸对NLRP3炎症小体相关分子表达的影响
为了探索迷迭香酸对NLRP3炎症小体相关分子表达的影响,我们检测了肾组织中NLRP3炎症小体相关分子NLRP3、ASC、Caspase-1及其下游IL-1、IL-18的mRNA及蛋白表达。结果显示,与Control组相比,AngⅡ组小鼠肾组织中NLRP3、ASC、Caspase-1、IL-1β、IL-18的mRNA及蛋白表达明显增加;迷迭香酸干预后,与AngⅡ组相比,AngⅡ+RA组NLRP3、ASC、Caspase-1、IL-1β、IL-18显著降低(P < 0.05,图 3)。提示迷迭香酸可通过抑制NLRP3炎症小体的激活对高血压肾病发挥保护作用。
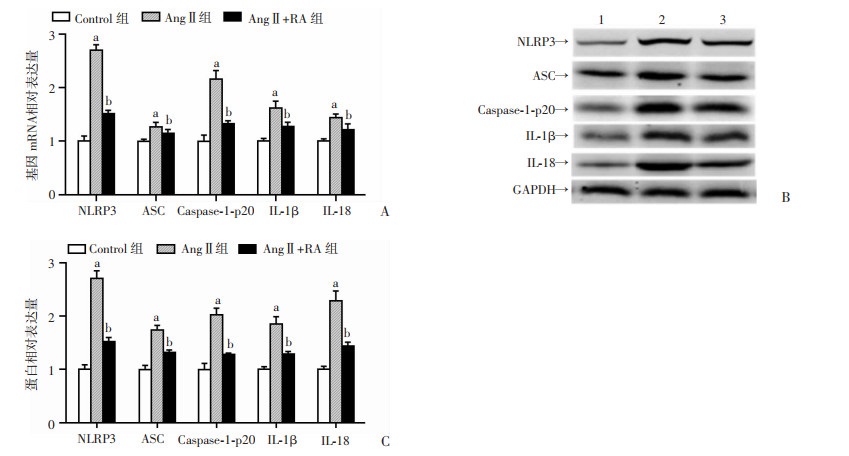
|
| A: q-PCR检测mRNA的表达;B: Western blot检测蛋白的表达,1: Control组;2:AngⅡ组;3:AngⅡ +RA组;C:蛋白半定量分析;a:P < 0.05,与Control组比较;b;P < 0.05,与Ang Ⅱ组比较 图 3 迷迭香酸对NLRP3炎症小体相关分子(NLRP3、ASC、Caspase-1-p20、IL-ip、IL-18)肾组织表达的影响(n=10, x±s) |
2.5 迷迭香酸对NADPH氧化酶及ROS的影响
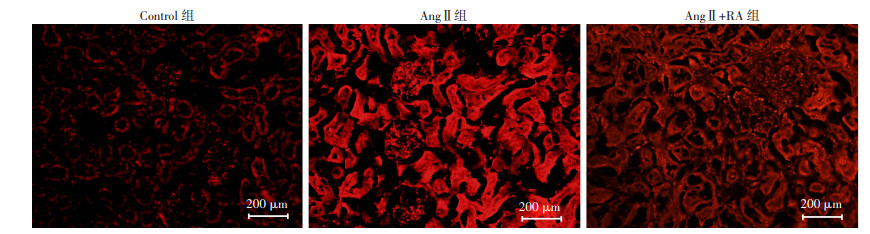
为了研究迷迭香酸对NADPH氧化酶及ROS表达的影响,我们首先检测了NADPH氧化酶其亚基p22phox、p47phox的mRNA及蛋白表达量。结果显示,与Control组相比,AngⅡ组p22phox、p47phox的mRNA及蛋白表达升高,提示NADPH氧化酶生成增加,这种升高可被迷迭香酸减弱(P < 0.05,图 4A~4E)。此外,NADPH作为亚细胞还原当量的主要提供者,可被氧化成NADP+。因此,NADP+/NADPH通常被用来反应NADPH氧化酶的激活和随后ROS的生成。结果显示,与Control组相比,AngⅡ组NADP+/NADPH比值升高,而AngⅡ+RA组比值降低(P < 0.05,图 4F)。最后我们进一步检测了肾组织ROS水平,与Control组相比,AngⅡ组肾组织ROS水平升高;迷迭香酸干预后ROS水平降低(P < 0.05,图 5)。以上研究表明迷迭香酸可通过抑制NADPH氧化酶的生成及活化,减少ROS的水平,从而抑制NLRP3炎症小体激活缓解高血压肾病。
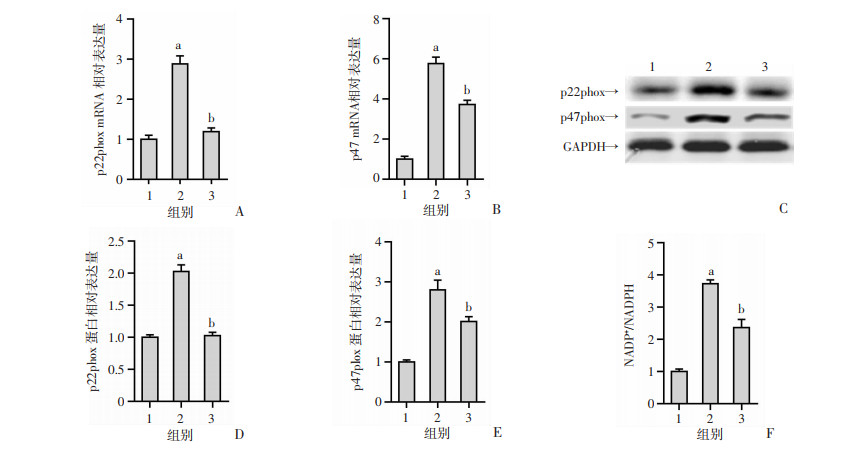
|
| A、B:q-PCR检测p22phox、p47phox mRNA的表达;C:Western blot检测p22phox、p47phox蛋白的表达;D、E:p22phox、p47phox蛋白半定量分析;F:NADP+/NADPH比值;1:Control组;2:AngⅡ组;3:AngⅡ+RA组;a:P < 0.05,与Control组比较;b:P < 0.05,与AngⅡ组比较 图 4 迷迭香酸对肾组织NADPH氧化酶生成、活化的影响(n=10,x±s) |
|
| 图 5 超氧阴离子探针(DHE)染色观察各组肾组织ROS水平(200×) |
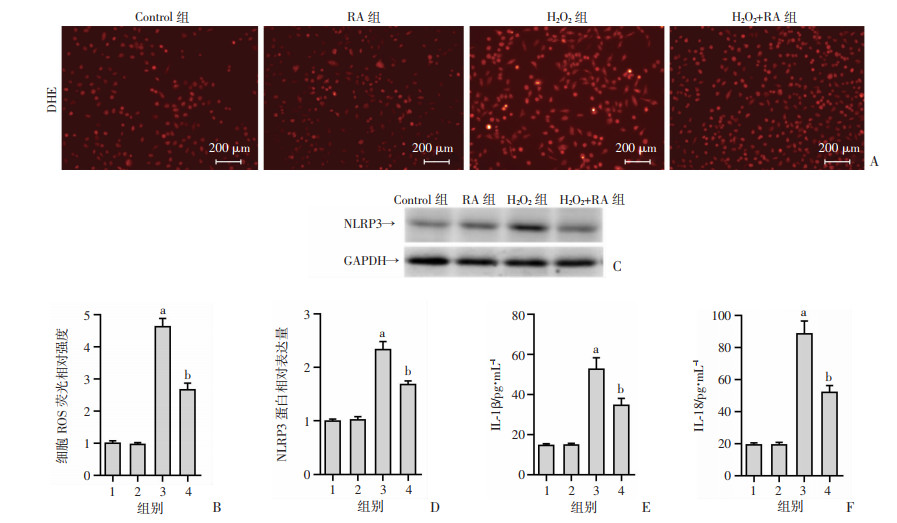
2.6 迷迭香酸对H2O2刺激的HK-2细胞NLRP3炎症小体相关分子表达的影响
H2O2刺激HK-2细胞后,与对照组相比,ROS水平增强,NLRP3、IL-1β、IL-18表达增加;给予迷迭香酸处理后,ROS水平降低,NLRP3、IL-1β、IL-18表达降低(P < 0.05,图 6)。这些结果表明,迷迭香酸对H2O2刺激的HK-2细胞NLRP3炎症小体的激活有抑制作用。
|
| A:超氧阴离子探针(DHE)染色观察各组细胞ROS水平(200×);B:ROS水平荧光强度统计比值;C:Western blot检测细胞NLRP3蛋白表达;D:NLRP3蛋白表达半定量分析;E、F:ELISA检测各组细胞上清IL-1β、IL-18水平;1:Control组;2:RA组;3:H2O2组;4:H2O2+RA组;a:P < 0.05,与Control组比较;b:P < 0.05,与H2O2组比较 图 6 迷迭香酸对H2O2刺激的HK-2细胞NLRP3炎症小体相关分子表达的影响(n=6,x±s) |
3 讨论
在本研究中,我们探讨了迷迭香酸在小鼠高血压肾病中的作用及其可能的机制。研究发现,迷迭香酸可以减轻由高血压所造成的肾脏损伤,包括血肌酐、血尿素氮指标回降,尿微量白蛋白减少,纤维化程度改善,炎性细胞浸润减少。为了探寻迷迭香酸对高血压肾病发挥保护作用的内在机制,本研究检测了NADPH氧化酶/ROS/NLRP3炎症小体通路相关分子的表达,发现迷迭香酸可以抑制肾脏NADPH氧化酶和随后ROS的生成,从而阻断NLRP3炎症小体的形成及激活。此外,迷迭香酸对过氧化氢刺激的NLRP3炎症小体信号通路的抑制作用在HK-2细胞中得到进一步的证实。以上研究表明,迷迭香酸可能通过抑制NADPH氧化酶/ROS/NLRP3炎症小体通路的激活对高血压肾病发挥保护作用。
药理研究表明,迷迭香酸具有抗炎、抗氧化及免疫调节等多种活性,对多种肾脏损伤具有一定的治疗作用[19-21]。本研究发现,与AngⅡ组相比,迷迭香酸干预后,AngⅡ+RA组血压,血肌酐、尿素氮,尿微量白蛋白明显下降,肾组织纤维化程度降低,炎症反应减轻,提示迷迭香酸能够改善血管紧张素Ⅱ所致的高血压肾病,然而目前机制尚不清楚。
炎症小体是一种细胞质内的信号复合体,通过感知病原体或受损宿主发出的危险信号启动炎症级联反应[5-6]。在迄今已鉴定的炎症小体中,NLRP3炎症小体是研究的最为广泛的,主要由模式识别受体NLRP3、接头蛋白ASC以及效应分子Caspase-1组成。NLRP3识别多种病原相关分子模式(pathogen-associated molecular pattern,PAMP)和危险相关分子模式(damage-associated molecular Pattern,DAMP),包括细菌脂多糖、活性氧、微晶和高浓度盐等[22]。在检测到PAMPS或DAMPS后,NLRP3炎症小体的亚基寡聚,导致自动切割,并激活caspase-1。激活的caspase-1将白介素1β和白介素18的前体水解为它们的活性形式,这些活化的白介素1β和白介素18从细胞中释放出来,并以邻近细胞为靶点,触发炎症反应[5]。研究表明,NLRP3炎症小体与高血压肾病的发病机制有着重要联系。前期研究表明1K/DOCA/盐诱导的肾脏炎症、纤维化和血压升高依赖于炎症小体的激活[6]。NLRP3炎症小体的活性抑制剂MCC950可以降低高血压小鼠的血压,抑制肾组织炎症,纤维化和功能障碍[23]。本研究发现,与Control相比,AngⅡ组NLRP3炎症小体相关分子NLRP3、ASC、Caspase-1、IL-1β及IL-18的表达明显增加,迷迭香酸干预后NLRP3、ASC、Caspase-1、IL-1β及IL-18的表达显著降低,提示迷迭香酸可以通过抑制NLRP3炎症小体的激活,减轻高血压引起的肾损伤。
目前研究表明,NLRP3炎症小体的激活机制主要有3条途径,分别为钾离子外流[24]、溶酶体的破坏和ROS的生成[25],有学者认为ROS生成是NLRP3炎症小体最主要的激活机制。NADPH氧化酶是细胞内产生ROS的关键酶,由p22phox、p47phox、gp91phox、p67phox、p40phox及Rac六种亚基组成。当收到胞外信号刺激时,活化的NADPH氧化酶可催化生成大量的ROS,而ROS的生成又可以导致NLRP3炎症小体的激活,释放炎症因子[26]。前期研究表明,迷迭香酸可以通过抑制NADPH氧化酶p22phox亚基的表达减轻果糖喂养高血压大鼠的血压和心脏异常[27]。本研究发现,与AngⅡ组相比,迷迭香酸干预后,AngⅡ+RA组肾内NADPH氧化酶亚基p22phox、p47phox的表达降低,NADP+/NADPH比值下降,肾脏ROS水平降低。说明迷迭香酸可以抑制NADPH氧化酶的生成、活化进而减轻ROS的水平。
综上所述,迷迭香酸可通过抑制NADPH氧化酶,降低ROS水平,从而抑制NLRP3炎症小体的激活减轻高血压造成的肾损伤。本研究首次探究了迷迭香酸在高血压肾病中的保护作用,这为高血压肾病提供了一种潜在的治疗方法。
| [1] |
WANG Z, CHEN Z, ZHANG L, et al. Status of hypertension in China: results from the China hypertension survey, 2012-2015[J]. Circulation, 2018, 137(22): 2344-2356. |
| [2] |
李立明, 饶克勤, 孔灵芝, 等. 中国居民营养与健康状况调查技术执行组.中国居民2002年营养与健康状况调查[J]. 中华流行病学杂志, 2005(07): 478-484. LI L M, RAO K Q, KONG L Z, et al. Survey on nutrition and health status of chinese residents in 2002[J]. Chin J Epidemiol, 2005(07): 478-484. |
| [3] |
XIE Y, BOWE B, MOKDAD A H, et al. Analysis of the Global Burden of Disease study highlights the global, regional, and national trends of chronic kidney disease epidemiology from 1990 to 2016[J]. Kidney Int, 2018, 94(3): 567-581. |
| [4] |
BANEK CT, GAUTHIER MM, HELDEN DAV, et al. Renal inflammation in DOCA-Salt hypertension: Role of renal nerves and arterial pressure[J]. Hypertension, 2019, 73(5): 1079-1086. |
| [5] |
LATZ E. The inflammasomes: mechanisms of activation and function[J]. Curr Opin Immunol, 2010, 22(1): 28-33. |
| [6] |
KRISHNAN S M, DOWLING J K, LING Y H, et al. Inflammasome activity is essential for one kidney/deoxycorticosterone acetate/salt-induced hypertension in mice[J]. Br J Pharmacol, 2016, 173(4): 752-765. |
| [7] |
ZHANG C, BOINI K M, MIN X, et al. Activation of Nod-like receptor protein 3 inflammasomes turns on podocyte injury and glomerular sclerosis in hyperhomocysteinemia[J]. Hypertension, 2012, 60(1): 154-162. |
| [8] |
GROSS O, THOMAS C J, GUARDA G, et al. The inflammasome: an integrated view[J]. Immunol Rev, 2011, 243(1): 136-151. |
| [9] |
ABAIS J M, ZHANG C, XIA M, et al. NADPH oxidase-mediated triggering of inflammasome activation in mouse podocytes and glomeruli during hyperhomocysteinemia[J]. Antioxid Redox Signal, 2013, 18(13): 1537-1548. |
| [10] |
DING W, GUO H, XU C, et al. Mitochondrial reactive oxygen species-mediated NLRP3 inflammasome activation contributes to aldosterone-induced renal tubular cells injury[J]. Oncotarget, 2016, 7(14): 17479-17491. |
| [11] |
NUNES S, MADUREIRA AR, CAMPOS D, et al. Therapeutic and nutraceutical potential of rosmarinic acid-Cytoprotective properties and pharmacokinetic profile[J]. Crit Rev Food Sci Nutr, 2017, 57(9): 1799-1806. |
| [12] |
JOARDAR S, DEWANJEE S, BHOWMICK S, et al. Rosmarinic acid attenuates cadmium-induced nephrotoxicity via inhibition of oxidative stress, apoptosis, inflammation and fibrosis[J]. Int J Mol Sci, 2019, 20(8). |
| [13] |
FERREIRA L G, EVORA P R B, CAPELLINI V K, et al. Effect of rosmarinic acid on the arterial blood pressure in normotensive and hypertensive rats: Role of ACE[J]. Phytomedicine, 2018, 38: 158-165. |
| [14] |
PRASANNARONG M, SAENGSIRISUWAN V, SURAPONGCHAI J, et al. Rosmarinic acid improves hypertension and skeletal muscle glucose transport in angiotensin Ⅱ-treated rats[J]. BMC Complement Altern Med, 2019, 19(1): 165. |
| [15] |
LIU GX, LI YQ, HUANG XR, et al. Smad7 inhibits AngⅡ-mediated hypertensive nephropathy in a mouse model of hypertension[J]. Clin Sci (Lond), 2014, 127(3): 195-208. |
| [16] |
CHOU ST, HO BY, TAI YT, et al. Glechoma hederacea Bidirect effects from cisplatin combine with rosmarinic acid (RA) or hot water extracts of (HWG) on renal cancer cells[J]. 2020, 15: 77. DOI: 10.21203/rs.3.rs-19778/v2.
|
| [17] |
ZHU M, WANG H, CHEN J, et al. Sinomenine improve diabetic nephropathy by inhibiting fibrosis and regulating the JAK2/STAT3/SOCS1 pathway in streptozotocin-induced diabetic rats[J]. Life Sci, 2021, 265: 118855. |
| [18] |
LIU M, DENG M, LUO Q, et al. High-salt loading downregulates Nrf2 expression in a sodium-dependent manner in renal collecting duct cells[J]. Front Physiol, 2019, 10: 1565. |
| [19] |
BAYOMY N A, ELBAKARY R H, IBRAHIM M A A, et al. Effect of lycopene and rosmarinic acid on gentamicin induced renal cortical oxidative stress, apoptosis, and autophagy in adult male albino rat[J]. Anat Rec (Hoboken), 2017, 300(6): 1137-1149. |
| [20] |
TAVAFI M, AHMADVAND H. Effect of rosmarinic acid on inhibition of gentamicin induced nephrotoxicity in rats[J]. Tissue Cell, 2011, 43(6): 392-397. |
| [21] |
JIANG WL, XU Y, ZHANG SP, et al. Effect of rosmarinic acid on experimental diabetic nephropathy[J]. Basic Clin Pharmacol Toxicol, 2012, 110(4): 390-395. |
| [22] |
KNAUF F, ASPLIN J R, GRANJA I, et al. NALP3-mediated inflammation is a principal cause of progressive renal failure in oxalate nephropathy[J]. Kidney Int, 2013, 84(5): 895-901. |
| [23] |
KRISHNAN S M, LING Y H, HUUSKES B M, et al. Pharmacological inhibition of the NLRP3 inflammasome reduces blood pressure, renal damage, and dysfunction in salt-sensitive hypertension[J]. Cardiovasc Res, 2019, 115(4): 776-787. |
| [24] |
KAHLENBERG JM, LUNDBERG KC, KERTESY SB, et al. Potentiation of caspase-1 activation by the P2X7 receptor is dependent on TLR signals and requires NF-kappaB-driven protein synthesis[J]. J Immunol, 2005, 175(11): 7611-7622. |
| [25] |
CRUZ C M, RINNA A, FORMAN H J, et al. ATP activates a reactive oxygen species-dependent oxidative stress response and secretion of proinflammatory cytokines in macrophages[J]. J Biol Chem, 2007, 282(5): 2871-2879. |
| [26] |
BABIOR B M, LAMBETH J D, NAUSEEF W. The neutrophil NADPH oxidase[J]. Arch Biochem Biophys, 2002, 397(2): 342-344. |
| [27] |
KARTHIK D, VISWANATHAN P, ANURADHA C V. Administration of rosmarinic acid reduces cardiopathology and blood pressure through inhibition of p22phox NADPH oxidase in fructose-fed hypertensive rats[J]. J Cardiovasc Pharmacol, 2011, 58(5): 514-521. |




