腔静脉旁部(腔旁部)位于Spiegel叶与右半肝之间,是整个肝脏的核心区域,其背侧为下腔静脉,下方为第一肝门,头侧为肝中静脉、肝右静脉根部,腹侧紧贴肝中静脉主干,起源于腔旁部的肿瘤大多与肝脏主要管道紧密邻接甚至侵犯[1]。由于腔旁部来源肿瘤位置深在,紧邻肝脏主要管道结构,血管损伤风险高,充分的切缘难以获得,手术的难度和风险很高,曾被认为是腹腔镜肝切除(laparoscopic liver resection,LLR)的禁忌证[2]。随着腹腔镜技术的发展,LLR的应用范围已扩展到包括尾状叶在内的所有肝段[3],尽管如此,腔旁部来源肿瘤切除仍然极具挑战性,加之腔旁部来源肿瘤较为少见,LLR治疗腔旁部肿瘤仅见少量个案报道[4-5],尚少见LLR与开腹肝切除(open liver resection,OLR)疗效的对比研究,LLR能否安全用于腔旁部肿瘤切除还有待进一步验证。本研究旨在分析LLR和OLR治疗腔旁部来源肿瘤的围术期结果和远期疗效,探讨LLR治疗腔旁部来源肿瘤的安全性、可行性。
1 资料与方法 1.1 一般资料纳入2013年5月至2020年5月我院收治的腔旁部来源肿瘤患者42例,接受LLR和接受OLR各21例。LLR组男性11例,女性10例,中位年龄47(17~64)岁,术前诊断:肝细胞癌6例,胆管细胞癌1例,神经内分泌癌1例,海绵状血管瘤6例,局灶性结节增生5例,血管平滑肌脂肪瘤2例。OLR组男性16例,女性5例,中位年龄54(25~71)岁,术前诊断:肝细胞癌13例,胆管细胞癌2例,混合细胞型肝癌1例,肝肉瘤1例,局灶性结节增生1例,血管平滑肌脂肪瘤3例。
纳入标准:①男女不限,年龄>18岁;②一般情况及重要器官功能良好,能耐受麻醉及肝切除术;③腔静脉旁部来源肿瘤诊断明确;④Child-Pugh分级A级或B级,ICG-R15<15%,剩余肝体积与标准肝体积之比>40%;⑤恶性肿瘤患者术前未接受RFA、TACE治疗,无确切放化疗史,未服用分子靶向药物、未行免疫治疗等抗癌处理。
排除标准:①肿瘤破裂出血、侵犯周围组织器官或远处转移;②存在严重肝硬化、门静脉高压症或活动性肝炎;③门静脉、肝静脉、胆管主干及下腔静脉存在癌栓。
两组患者术前均接受血液学、肝脏超声、上腹部CTA或MRI检查,怀疑胆道受累者还需行磁共振胰胆管造影(magnetic resonance cholangiopancreatography,MRCP)检查,肿瘤来源部位由两名或两名以上有经验的放射科医师确定。获取患者上腹部CTA亚毫米图像,导入三维可视化软件(IQQA-3D, EDDA Technology, USA)中,对肝脏进行三维重建,明确肿瘤与肝内主要管道的立体关系、门静脉灌注及肝静脉引流范围,测算标准肝体积、剩余肝体积及两者比值,初步制定手术方案。两组患者的治疗均由同一手术团队完成。手术切缘定义为从肿瘤边缘到标本切面的最短距离,术后并发症参照Clavien-Dindo系统进行分级[6]。本研究得到了本院伦理委员会的批准(KY2020125)。
1.2 手术方法对于大部分LLR组患者,我们采用了肝中裂劈开入路切除腔旁部来源肿瘤,小部分患者还接受了肝段切除、半肝切除等手术方式,其操作步骤见文献[7]的描述,这里主要介绍腹腔镜肝中裂劈开入路切除腔旁部来源肿瘤的操作步骤和技巧(图 1)。
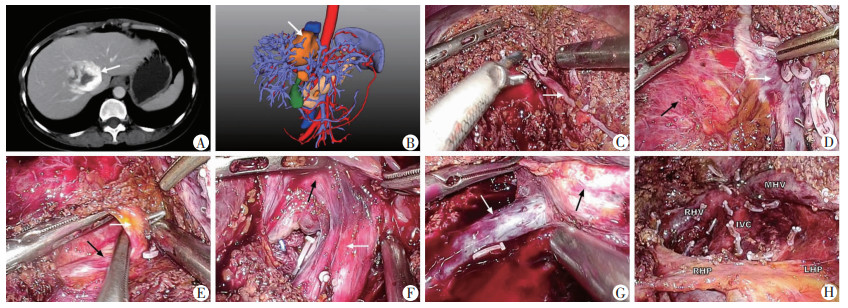
|
| A:术前CT表现 箭头示肿瘤;B:术前肝脏三维成像 箭头示肿瘤;C:肝中裂劈开 箭头示肝中静脉;D:将肿瘤与肝中静脉分离 白色箭头示肝中静脉,黑色箭头示肿瘤;E:将肿瘤与第一肝门分离 白色箭头示门短静脉,黑色箭头示左肝蒂;F:将肿瘤与下腔静脉分离 白色箭头示下腔静脉,黑色箭头示肿瘤;G:将肿瘤与肝右静脉分离 白色箭头示肝右静脉,黑色箭头示肿瘤;H:肿瘤切除后肝脏创面 MHV为肝中静脉,RHV为肝右静脉,IVC为下腔静脉,RHP为右肝蒂,LHP为左肝蒂 图 1 腹腔镜肝中裂劈开入路切除腔旁部来源肿瘤 |
患者接受静吸复合麻醉,取仰卧、头高脚低分腿位, 建立CO2气腹。采用五孔法入腹,Trocar围绕病灶呈扇形分布。预置第一肝门入肝血流阻断装置,必要时采用Pringle法间歇性阻断入肝血流,肝切除过程中控制中心静脉压在3~5 cmH2O。常规行腹腔镜探查,以排除肿瘤破裂出血、周围组织器官侵犯及腹腔、盆腔种植转移等。术中超声进一步明确肿瘤与肝脏主要管道关系,引导肝脏离断平面。
首先离断肝圆韧带、镰状韧带,解剖下腔静脉窝,游离完成后可将肝右静脉根部或肝左、肝中静脉共干处以血管带悬吊,便于在需要时快速进行血流阻断。结合三维可视化模型、术中超声及肝脏缺血线标记预切线。使用超声刀沿肝中裂平面由足侧向头侧离断肝实质,显露肝中静脉,Hem-o-lok、钛夹等处理所遇到的管道结构,肝中静脉主要分支可使用腔镜下直线切割闭合器离断。首先将肿瘤与肝中静脉分离,继续向头背侧劈开至腔静脉陷窝;接着沿肿瘤下缘解剖离断供应腔旁部的门短血管,将肿瘤与第一肝门分离;向上牵拉肿瘤,沿肿瘤背侧将其与下腔静脉、肝右静脉分离,完整切除病变。切除过程中应沿肿瘤包膜进行蚕食状钳夹破碎、切割凝闭,配合吸引器推拨、吸引,避免破坏肿瘤包膜及周围管道结构。当腔旁部来源肿瘤累及Spiegel叶或尾状突时,采用肝中裂入路很难完整切除,此时可联合左侧或右侧入路切除病变。右侧入路:将右肝完全游离,右肝蒂套带提拉,解剖离断尾状突肝蒂及肝短静脉,完全游离尾状突,将尾状突于右肝蒂后方牵拉至其上方,连同腔旁部肿瘤切除。左侧入路:将左肝完全游离,暴露Spiegel叶,左肝蒂套带提拉,解剖离断Spiegel叶肝蒂及肝短静脉,完全游离Spiegel叶,将Spiegel叶于左肝蒂后方牵拉至静脉韧带内侧,连同腔旁部肿瘤切除。如术中发生腔镜下难以控制的大出血、严重肝硬化导致肝段面渗血无法处理或腹腔粘连严重腹腔镜下无法完全分离粘连,则及时中转开腹。切除后的标本装入标本袋,经扩大上腹部Trocar孔或耻骨上横切口取出。肝断面使用双极电凝止血,活动性出血及胆漏采用Prolene线缝扎,反复冲洗直至确认无出血及胆漏,断面填塞止血材料,常规于肝断面及膈下放置腹腔引流管。OLR组与LLR组的麻醉和术中操作一致,仅进腹方式不同,常规为右上腹反“L”型切口。
1.3 随访患者均接受门诊或电话随访,术后前2年每3个月随访1次,第2年以后每6个月随访1次。复查项目包括肝功能、甲胎蛋白(AFP)及超声造影等,慢性乙型病毒肝炎患者需复查乙肝血清学标志物和病毒DNA定量,怀疑复发的患者行上腹部CTA或肝脏肿瘤特异性MRI检查以确认诊断。对于复发患者,根据肿瘤大小、位置和数目以及患者的病情提出个体化治疗方案。
1.4 统计学分析采用SPSS 26.0统计软件。计量资料用中位数(范围)表示,采用t检验或Wilcoxon秩和检验进行统计分析。计数资料采用χ2检验或Fisher确切概率法进行统计分析。采用Kaplan-Meier法绘制生存曲线,生存率比较采用Log-rank检验。所有检验为双侧检验,检验水准:α=0.05。
2 结果 2.1 一般情况共纳入42例符合标准的腔旁部来源肿瘤患者,LLR组21例,OLR组21例。患者Child-Pugh分级均为A级。两组患者的年龄、性别、乙肝病史、肝硬化、AFP、ICG-R15、肿瘤大小和数量等差异均无统计学意义(表 1)。根据肿瘤累及范围及其与周围管道结构的关系,将腔旁部来源肿瘤分为4型,其中A型20例、B型9例、C型9例、D型4例(表 2)。
| 组别 | 年龄/岁 | 性别(男/女) | BMI/kg·m-2 | HBsAg(+) | 肝硬化 | ICG-R15(%) | AFP > 20 ng/mL | 肿瘤直径/cm | 肿瘤数量 (单发/多发) |
| LLR组 | 47(17~64) | 11/10 | 22.9(16.0~27.0) | 9 | 2 | 2.4(0.1~9.2) | 4 | 5.0(1.0~16.0) | 19/2 |
| OLR组 | 54(25~71) | 16/5 | 23.6(19.1~27.1) | 14 | 7 | 3.5(0.3~21.0) | 8 | 5.0(1.5~13.0) | 19/2 |
| P值 | 0.082 | 0.107 | 0.114 | 0.121 | 0.133 | 0.449 | 0.172 | 0.389 | 1.000 |
| 组别 | 肝切除史 | 肿瘤类型 | 肝细胞癌 | 肝内胆管细胞癌 | 混合细胞型肝癌 | 神经内分泌癌 | 肝肉瘤 | 良性肿瘤 | |
| LLR组 | 0 | 21 | 6 | 1 | 0 | 1 | 0 | 13 | |
| OLR组 | 3 | 21 | 13 | 2 | 1 | 0 | 1 | 4 | |
| P值 | 0.280 | 0.058 | |||||||
| ICG-R15:吲哚菁绿15 min滞留率;AFP: 甲胎蛋白 | |||||||||
| 分型 | 例数 | 肿瘤累及范围 |
| A | 20 | 腔静脉旁部±Ⅳ、Ⅴ、Ⅷ段背侧 |
| B | 9 | 腔静脉旁部、尾状突及右肝蒂±Ⅳ、Ⅴ、Ⅷ段背侧 |
| C | 9 | 腔静脉旁部、Spiegel叶及左肝蒂±Ⅳ、Ⅴ、Ⅷ段背侧 |
| D | 4 | 全部尾状叶、左肝蒂及右肝蒂±Ⅳ、Ⅴ、Ⅷ段背侧 |
2.2 两组患者围术期情况
两组患者均未发生围术期死亡。9例行肝中裂劈开肿瘤切除,6例行肝中裂劈开联合右侧入路肿瘤切除,4例行肝中裂劈开联合左侧入路肿瘤切除,1例行肝中裂劈开联合左、右侧入路肿瘤切除,6例行解剖性肝段切除,8例行左半肝联合尾状叶切除,8例行右半肝联合尾状叶切除(表 3)。
| 组别 | 肝中裂劈开 肿瘤切除 |
肝中裂劈开联合 右侧入路肿瘤切除 |
肝中裂劈开联合 左侧入路肿瘤切除 |
肝中裂劈开联合 左、右侧入路肿瘤切除 |
Ⅳ段切除 |
| LLR组 | 7 | 5 | 2 | 1 | 0 |
| OLR组 | 2 | 1 | 2 | 0 | 1 |
| 组别 | Ⅷ段切除 | Ⅴ、Ⅷ段切除 | Ⅴ、Ⅷ+部分Ⅳ段切除 | 左半肝+尾状叶切除 | 右半肝+尾状叶切除 |
| LLR组 | 1 | 1 | 1 | 2 | 1 |
| OLR组 | 0 | 2 | 0 | 6 | 7 |
LLR组中1例患者因术中出血难以控制而中转开腹,中转开腹率4.7%。LLR组手术时间、术中失血量少于OLR组,但差异均无统计学意义(P=0.393、0.518)。两组患者术中输血率、恶性肿瘤切缘差异亦无统计学意义(P=0.513、0.075)。
LLR组中1例恶性肿瘤侵犯血管,OLR组中有7例,差异无统计学意义(P=0.330),其中3例接受门静脉切开取栓,3例接受下腔静脉切除重建,1例接受肝静脉切除重建,1例接受肝静脉和下腔静脉切除重建。与OLR组比较,LLR组术后进食时间早[2(1~5)d vs 3(2~10)d,P=0.042],术后住院时间短[9(4~20)d vs 13(5~35)d, P=0.008],术后第1、3、7天血清总胆红素水平低(P=0.004、0.010、0.018),术后第7天白蛋白水平高(P=0.005,表 4)。
| 组别 | 手术时间/min | 术中失血量/mL | 术中输血 | 恶性肿瘤手术切缘 零切缘/阴性 |
恶性肿瘤侵犯血管 | 术后进食时间/d |
| LLR组 | 355(100~780) | 400(100~3 600) | 6 | 5/3 | 1 | 2(1~5) |
| OLR组 | 394(215~641) | 500(200~5 400) | 8 | 3/14 | 7 | 3(2~10) |
| P值 | 0.393 | 0.518 | 0.513 | 0.075 | 0.330 | 0.042 |
| 组别 | 术后住院时间/d | 术后第1天 总胆红素/μmol·L-1 |
术后第3天 总胆红素/μmol·L-1 |
术后第7天 总胆红素/μmol·L-1 |
术后第1天 ALT/U·L-1 |
|
| LLR组 | 9(4~20) | 15.6(8.5~60.1) | 15.7(7.6~49.5) | 15.4(5.9~53.6) | 423.0(119.0~1 363.3) | |
| OLR组 | 13(5~35) | 29.6(12.2~119.6) | 33.0(11.0~78.7) | 26.1(10.4~52.1) | 347.5(81.4~1 222.1) | |
| P值 | 0.008 | 0.004 | 0.010 | 0.018 | 0.489 | |
| 组别 | 术后第3天ALT/U·L-1 | 术后第7天ALT/U·L-1 | 术后第1天白蛋白/g·L-1 | 术后第3天白蛋白/g·L-1 | 术后第7天白蛋白/g·L-1 | |
| LLR组 | 237.0(66.9~849.5) | 92.7(33.7~327.4) | 34.4(27.5~45.9) | 34.4(26.4~42.4) | 38.0(29.8~46.6) | |
| OLR组 | 246.9(36.2~1 292.7) | 103.4(27.4~410.9) | 30.5(22.0~49.6) | 34.2(27.2~49.0) | 32.5(24.6~42.4) | |
| P值 | 0.8111 | 0.434 | 0.168 | 0.546 | 0.005 | |
2.3 两组患者术后并发症情况
LLR组与OLR组的总体并发症发生率分别为47.6%、61.9%,差异无统计学意义(P=0.352)。两组患者各级并发症发生率也无明显差异:LLR组和OLR组分别有5例、2例患者发生Ⅲa级并发症,上述患者在接受经皮穿刺引流后恢复。OLR组有1例患者术后24 h出现腹腔出血,输血后血压仍进行性下降,经急诊手术行肝断面止血后恢复。LLR组中1例患者术后第2天出现呼吸功能障碍,转入重症监护室予以吸氧等保守治疗后好转。OLR组1例患者术后15 d突发原因不明的低血压休克,予以补液、血管升压药物持续泵注等处理维持血压,血压稳定后逐渐减少药量,停药后血压能维持正常水平(表 5)。
| 组别 | 总体并发症 | GradeⅠ | Grade Ⅱ | ||||||
| 胸腔积液伴肺不张 | 腹水 | 肺部感染 | 腹腔感染 | ||||||
| LLR组 | 10 | 4 | 0 | 0 | 0 | ||||
| OLR组 | 13 | 3 | 2 | 2 | 2 | ||||
| P值 | 0.352 | 1.000 | 0.115 | ||||||
| 组别 | Grade Ⅲa | GradeⅢb | Grade Ⅳ | ||||||
| 断面积液 | 胸腔积液 | 胆漏 | 腹腔出血 | 呼吸功能障碍 | 低血压休克 | ||||
| LLR组 | 2 | 2 | 1 | 0 | 1 | 0 | |||
| OLR组 | 1 | 1 | 0 | 1 | 0 | 1 | |||
| P值 | 0.408 | 1.000 | 1.000 | ||||||
2.4 随访
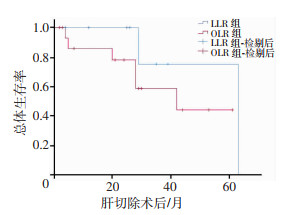
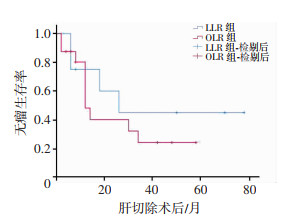
对于恶性肿瘤患者,LLR组与OLR组的中位随访时间分别为27.5、26.0个月,差异无统计学意义(P=0.622)。LLR组与OLR组的总体生存时间(P=0.275)、无瘤生存时间(P=0.455)差异均无统计学意义。LLR组与OLR组的1年总生存率分别为100.0%、87.5%(P=0.292),3年总生存率分别为87.5%、68.8% (P=0.326),1年无瘤生存率分别为62.5%、50.0%(P=0.488),3年无瘤生存率分别为50.0%、37.5%(P=0.455),差异均无统计学意义(图 2、3)。
|
| 图 2 两组恶性肿瘤患者总体生存时间曲线 |
|
| 图 3 两组恶性肿瘤患者无瘤生存时间曲线 |
3 讨论
根据KUMON[1]的描述,尾状叶可分为3个部分:Spiegel叶、腔静脉旁部和尾状突。腔静脉旁部位置深在,被下腔静脉、中肝静脉、右肝静脉等肝脏主要管道结构包围,起源于腔旁部的肿瘤常紧贴甚至侵犯这些管道结构。由于腔旁部肿瘤独特的解剖特点,使其并不适用于肝移植术,采用射频消融治疗腔旁部来源肿瘤,易损伤重要管道结构,并且主肝静脉、下腔静脉的冷却效应常导致消融不彻底[8],经导管肝动脉化疗栓塞因腔旁部多存在双边血供亦效果不佳[9]。OLR仍然是治疗腔旁部来源肿瘤的主要方式,但腔旁部肿瘤位置深在,紧邻肝脏主要管道结构,即使在开腹条件下,仍然是一类极具挑战性的术式,有时甚至需行离体肝切除联合自体肝移植术[10-11]。随着腹腔镜技术的进步和手术经验的积累,腹腔镜手术已开始尝试用于治疗腔旁部来源肿瘤,但尚处于探索阶段,仅有少量病例被报道[4-5],LLR治疗腔旁部肿瘤的疗效尚需与开腹手术进行对照研究予以验证。
在围术期,与OLR组相比,LLR组患者的术后住院时间短、术后进食时间早,体现了腹腔镜手术创伤小、疼痛轻的固有优势。LLR组术后总胆红素水平低于OLR组,可能与两组手术方式差异有关,LLR组主要采用肝中裂劈开肿瘤切除等保留肝实质术式,OLR组主要采用半肝联合尾状叶切除等大范围肝切除,甚至包括离体肝切除联合自体肝移植,导致剩余肝体积减小、缺血再灌注时间延长,延缓患者术后肝功能恢复。由于手术器械活动受限、镜头不稳定等限制因素,血管切除重建技术是腹腔镜手术的局限性之一[12-13],因此,对于术前预判存在恶性肿瘤侵犯血管的患者,我们更多地采用开腹手术以确保手术的安全性。LLR组的中位手术时间为355 min,中位失血量为400 mL,明显少于OLR组(407.5 min、550 mL),但差异无统计学意义,可能与样本量少导致检验效能降低有关。从临床角度分析,两组手术时间相差52.5 min,失血量相差150 mL,显然具有参考意义。LLR组患者术后并发症发生率为47.6%,OLR组为66.7%,差异无统计学意义。腔旁部来源肿瘤切除的主要并发症包括断面积液、胸腔积液、肺不张等。OLR组1例患者发生术后肝断面出血,行急诊手术予以止血;1例患者术后发生原因不明的低血压休克,经补液、血管升压药物泵注等处理后好转,可能与术中大量失血导致循环功能衰竭有关。LLR组1例患者术后发生呼吸功能障碍,经吸氧等保守治疗后好转,可能与肝实质潜在淤血、坏死及炎症反应有关,手术时间延长及上腹部手术本身也是呼吸系统并发症的独立危险因素[14-16]。腔旁部来源肿瘤紧邻肝脏主要管道,血管损伤的风险高,术中止血困难,且手术创面深、管道断端多,这些因素均会延长手术时间、增大失血量,导致并发症发生率相对升高。随访结果显示两组恶性肿瘤患者的1年、3年总生存率、无瘤生存率差异均无统计学意义。
由于腔旁部来源肿瘤邻近或累及肝脏主要管道,对于生长速度较快的良性肿瘤,我们认为应及早手术干预,以免进一步破坏重要管道结构,增加手术难度和风险。对于有恶变倾向、性质不明的肿瘤,尤其是合并乙型病毒肝炎的良性肿瘤,也应予以切除。对于各类有手术指征的腔旁部良性肿瘤及交界性肿瘤,包括海绵状血管瘤、血管平滑肌脂肪瘤、局灶性结节增生(focal nodular hyperplasia,FNH)、神经内分泌肿瘤等,采用腹腔镜肝中裂劈开入路切除肿瘤是安全可行的。对于腔旁部来源恶性肿瘤,要在所有维度都获得充分的切缘几乎是不可能的,并且我国肝脏恶性肿瘤患者大多患有慢性肝炎和不同程度的肝硬化,肝脏储备功能受限,因此必须在切缘宽度和预留肝体积间取得平衡,以免术后发生肝功能衰竭等严重并发症[17]。对于无法耐受大范围肝切除且术前影像学预判肿瘤包膜完整、无血管侵犯及癌栓的生物学行为较好的腔旁部肝细胞癌(hepatocellular carcinoma,HCC)患者,我们也采用了腹腔镜肝中裂劈开入路切除肿瘤,牺牲手术切缘,保留肝脏主要管道结构,避免发生可能的术后肝功能衰竭。MATSUI等[18]报道了零切缘组和切缘组患者在生存率、无复发率和复发模式上无明显差异,SAKAMOTO等[19]也报道了无论是否获得更小的手术切缘,尾状叶肿瘤患者与其他肝段肿瘤患者的预后相似,且肿瘤包膜、血管内皮屏障也具有限制肿瘤侵犯、改善预后的作用[20-22]。本研究8例零切缘患者中,只有OLR组中1例患者出现切缘局部复发,可能与残留的显微镜下病灶有关[23],对于窄切缘HCC患者,术后辅助放疗可能改善其预后[24]。
QIU等[25]和FANG等[26]都曾提出中央型肝肿瘤的分型和手术策略,但对于腔旁部来源肿瘤的分型和手术策略目前尚少见报道。参考上述中央型肝肿瘤的分型和手术策略,结合本中心经验,根据肿瘤累及范围及其与周围管道结构的关系,我们总结了腔旁部来源肿瘤的类型及腔镜手术策略,即以肝中裂劈开联合左侧或右侧入路为主的腔旁部来源肿瘤腹腔镜手术策略。对于A型肿瘤,行腹腔镜肝中裂劈开肿瘤±Ⅳ、Ⅴ、Ⅷ段背侧切除;对于B型肿瘤,行腹腔镜肝中裂劈开联合右侧入路肿瘤±Ⅳ、Ⅴ、Ⅷ段背侧切除;对于C型肿瘤,行腹腔镜肝中裂劈开联合左侧入路肿瘤±Ⅳ、Ⅴ、Ⅷ段背侧切除;对于D型肿瘤,行腹腔镜肝中裂劈开联合左、右侧入路肿瘤±Ⅳ、Ⅴ、Ⅷ段背侧切除。对于同时侵犯多支主肝静脉、肝后下腔静脉和(或)第一肝门的腔旁部来源肿瘤,常规LLR和OLR都无法予以切除,离体肝切除联合自体肝移植术为这类肿瘤提供了根治机会,这一术式涉及众多复杂的肝脏外科技术, 其总体并发症发生率为58.1%,90 d病死率高达19.5%,在实施该术前应当慎重考虑[10-11]。
尽管在技术上存在一定的挑战性,但对于选择性患者,腹腔镜腔旁部来源肿瘤切除仍然是一种安全可行的手术方式。接受LLR的恶性肿瘤患者能达到与OLR相当的远期疗效,同时还具有术后住院时间短、进食早的近期优势。腔旁部来源肿瘤分型和腔镜手术策略可能对手术方案规划和风险预判有所帮助。由于LLR治疗腔旁部来源肿瘤的临床实践及研究尚处于探索阶段,同其他文献报道的一样,本研究纳入的样本量较少,原因包括腔旁部肿瘤的罕见性和手术的高风险性,使得部分患者放弃手术或者选择接受射频消融和介入治疗,这在一定程度上影响了两组间的可比性,是本研究存在的主要局限。因此,关于腔旁部来源肿瘤的微创手术治疗,尚需进行大规模的前瞻性多中心随机对照研究,以获得更高级别证据的支持。
| [1] |
KUMON M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application[J]. Liver Cancer, 2017, 6(2): 161-170. DOI:10.1159/000454682 |
| [2] |
BUELL J F, CHERQUI D, GELLER D A, et al. The international position on laparoscopic liver surgery: The Louisville Statement, 2008[J]. Ann Surg, 2009, 250(5): 825-830. DOI:10.1097/sla.0b013e3181b3b2d8 |
| [3] |
ISHIZAWA T, GUMBS A A, KOKUDO N, et al. Laparoscopic segmentectomy of the liver: from segment I to Ⅷ[J]. Ann Surg, 2012, 256(6): 959-964. DOI:10.1097/SLA.0b013e31825ffed3 |
| [4] |
ARAKI K, KUBO N, WATANABE A, et al. Systematic review of the feasibility and future of laparoscopic liver resection for difficult lesions[J]. Surg Today, 2018, 48(7): 659-666. DOI:10.1007/s00595-017-1607-6 |
| [5] |
YOON Y S, HAN H S, CHO J Y, et al. Laparoscopic liver resection for centrally located tumors close to the hilum, major hepatic veins, or inferior vena cava[J]. Surgery, 2013, 153(4): 502-509. DOI:10.1016/j.surg.2012.10.004 |
| [6] |
DINDO D, DEMARTINES N, CLAVIEN P A. Classification of surgical complications: a new proposal with evaluation in a cohort of 6336 patients and results of a survey[J]. Ann Surg, 2004, 240(2): 205-213. DOI:10.1097/01.sla.0000133083.54934.ae |
| [7] |
HAN H S, CHO J Y, YOON Y S. Techniques for performing laparoscopic liver resection in various hepatic locations[J]. J Hepato-Biliary-Pancreat Surg, 2009, 16(4): 427-432. DOI:10.1007/s00534-009-0118-2 |
| [8] |
NISHIGAKI Y, TOMITA E, HAYASHI H, et al. Efficacy and safety of radiofrequency ablation for hepatocellular carcinoma in the caudate lobe of the liver[J]. Hepatol Res, 2013, 43(5): 467-474. DOI:10.1111/j.1872-034x.2012.01095.x |
| [9] |
SHIBATA T, MAETANI Y, AMETANI F, et al. Efficacy of nonsurgical treatments for hepatocellular carcinoma in the caudate lobe[J]. Cardiovasc Interv Radiol, 2002, 25(3): 186-192. DOI:10.1007/s00270-001-0111-x |
| [10] |
吐逊吐尔洪江, 艾尼阿卜杜萨拉木, 李玉鹏, 等. 非原位肝切除技术安全性、可行性和有效性的系统评价[J]. 中华医学杂志, 2016, 96(28): 2251-2257. TUXUN T, AINI A, LI Y P, et al. Systematic review of feasibility, safety and efficacy of ex situ liver resection and autotransplantation[J]. Natl Med J China, 2016, 96(28): 2251-2257. DOI:10.3760/cma.j.issn.0376-2491.2016.28.011 |
| [11] |
BAKER M A, MALEY W R, NEEDLEMAN L, et al. Ex vivo resection of hepatic neoplasia and autotransplantation: a case report and review of the literature[J]. J Gastrointest Surg, 2015, 19(6): 1169-1176. DOI:10.1007/s11605-015-2806-3 |
| [12] |
GIULIANOTTI P C, BIANCO F M, DASKALAKI D, et al. Robotic liver surgery: technical aspects and review of the literature[J]. Hepatobiliary Surg Nutr, 2016, 5(4): 311-321. DOI:10.21037/hbsn.2015.10.05 |
| [13] |
AFANEH C, KLUGER M. Laparoscopic liver resection: lessons at the end of the second decade[J]. Semin Liver Dis, 2013, 33(3): 226-235. DOI:10.1055/s-0033-1351780 |
| [14] |
KANEKO T, KANEKO K, SUGIMOTO H, et al. Intrahepatic anastomosis formation between the hepatic veins in the graft liver of the living related liver transplantation: observation by Doppler ultrasonography[J]. Transplantation, 2000, 70(6): 982-985. DOI:10.1097/00007890-200009270-00018 |
| [15] |
SUH S W, LEE J M, YOU T, et al. Hepatic venous congestion in living donor grafts in liver transplantation: is there an effect on hepatocellular carcinoma recurrence?[J]. Liver Transpl, 2014, 20(7): 784-790. DOI:10.1002/lt.23877 |
| [16] |
YANG C K, TENG A, LEE D Y, et al. Pulmonary complications after major abdominal surgery: National Surgical Quality Improvement Program analysis[J]. J Surg Res, 2015, 198(2): 441-449. DOI:10.1016/j.jss.2015.03.028 |
| [17] |
STRATOPOULOS C, SOONAWALLA Z, BROCKMANN J, et al. Central hepatectomy: the golden mean for treating central liver tumors?[J]. Surg Oncol, 2007, 16(2): 99-106. DOI:10.1016/j.suronc.2007.05.002 |
| [18] |
MATSUI Y, TERAKAWA N, SATOI S, et al. Postoperative outcomes in patients with hepatocellular carcinomas resected with exposure of the tumor surface: clinical role of the no-margin resection[J]. Arch Surg Chic Ill, 2007, 142(7): 596-602. DOI:10.1001/archsurg.142.7.596 |
| [19] |
SAKAMOTO Y, NARA S, HATA S, et al. Prognosis of patients undergoing hepatectomy for solitary hepatocellular carcinoma originating in the caudate lobe[J]. Surgery, 2011, 150(5): 959-967. DOI:10.1016/j.surg.2011.03.005 |
| [20] |
ZERVANTONAKIS I K, HUGHES-ALFORD S K, CHAREST J L, et al. Three-dimensional microfluidic model for tumor cell intravasation and endothelial barrier function[J]. Proc Natl Acad Sci USA, 2012, 109(34): 13515-13520. DOI:10.1073/pnas.1210182109 |
| [21] |
LOCKWOOD D S R, YEADON T M, CLOUSTON A D, et al. Tumor progression in hepatocellular carcinoma: relationship with tumor stroma and parenchymal disease[J]. J Gastroenterol Hepatol, 2003, 18(6): 666-672. DOI:10.1046/j.1440-1746.2003.03018.x |
| [22] |
NG I O, LAI E C, FAN S T, et al. Prognostic significance of pathologic features of hepatocellular carcinoma. A multivariate analysis of 278 patients[J]. Cancer, 1995, 76(12): 2443-2448. DOI:10.1002/1097-0142(19951215)76:122443:aid-cncr2820761207>3.0.co;2-f |
| [23] |
ERSTAD D J, TANABE K K. Prognostic and therapeutic implications of microvascular invasion in hepatocellular carcinoma[J]. Ann Surg Oncol, 2019, 26(5): 1474-1493. DOI:10.1245/s10434-019-07227-9 |
| [24] |
YU W B, WANG W H, RONG W Q, et al. Adjuvant radiotherapy in centrally located hepatocellular carcinomas after hepatectomy with narrow margin(1 cm): a prospective randomized study[J]. J Am Coll Surg, 2014, 218(3): 381-392. DOI:10.1016/j.jamcollsurg.2013.11.030 |
| [25] |
QIU J, WU H, BAI Y, et al. Mesohepatectomy for centrally located liver tumours[J]. Br J Surg, 2013, 100(12): 1620-1626. DOI:10.1002/bjs.9286 |
| [26] |
FANG C H, AN J, BRUNO A, et al. Consensus recommendations of three-dimensional visualization for diagnosis and management of liver diseases[J]. Hepatol Int, 2020, 14(4): 437-453. DOI:10.1007/s12072-020-10052-y |




