2. 300202 天津, 天津医科大学第二医院
2. Second Hospital of Tianjin Medical University, Tianjin, 300202, China
肝纤维化(hepatic fibrosis, HF)是肝组织长期受各种致病因素诱导与刺激所致的结缔组织异常增生, 肝内弥漫性细胞外基质过度沉淀的慢性病理结果[1],肝组织在反复炎性损伤与修复过程中,诱导并促进了肝星状细胞(hepatic stellate cells,HSCs)的活化与增殖、肝内细胞外基质(extracellular matrix,ECM)的增生与降解失衡,导致肝脏实质细胞数量减少和功能减退[2]。HF若未得到有效控制与逆转,可能发展为肝硬化、肝癌并出现各种严重并发症。HSC是位于肝脏Disse间隙的一种间质细胞,肝内ECM主要由活化的HSC产生,各种炎症、损伤因素可促进HSC的活化与增殖,从而导致HF的发生[3]。因此,抑制HSC的活化与增殖,促进其凋亡是逆转HF的细胞学基础所在。
钙网蛋白(calreticulin,CALR)是一种高度保守的内质网Ca2+结合蛋白,主要定位于内质网,具有分子伴侣活性、调节细胞内钙稳态以及细胞凋亡等多种生物学功能[4]。研究显示,CALR与多种肿瘤细胞有着密切的联系,多项实验通过外源性影响CALR的表达来抑制肿瘤细胞的生长,如敲除人膀胱癌细胞J82中的CALR能抑制细胞的增殖、迁移和黏附[5]。但CALR在HSC中的作用尚未发现被研究。因此该研究在细胞水平上探讨沉默CALR是否引起HSC细胞发生相关凋亡以及CALR与促纤维化因子转化生长因子-β1(transforming growth factor-β1, TGF-β1)的相互关系,进一步阐明CALR抗HF的相关机制, 为HF的逆转提供新的思路。
1 材料与方法 1.1 细胞株及主要试剂人源性肝星状细胞株(LX-2)购于上海美轩生物科技有限公司;DMEM高糖培养基购于美国BI公司;胎牛血清(FBS)购于美国Gibco公司;CALR的siRNA干扰序列(CALR-siRNA)及非特异性序列(Nc-siRNA)由锐博公司设计并合成;转染试剂盒Lipofectamine(lip)2 000购于Invitrogen公司;Cell Counting Kit-8(CCK-8)试剂盒、反转录试剂盒、PCR荧光定量试剂盒购于北京庄盟国际生物基因科技有限公司;PCR引物由北京睿博兴科生物技术有限公司合成;兔抗大鼠CALR、GRP78、Caspase-12、Caspase-3一抗,兔抗β-actin多克隆抗体,辣根过氧化物酶(HRP)标记的山羊抗兔IgG,均购于美国Arigo公司。
1.2 细胞培养及转染将存放于液氮中的人肝星状细胞复苏传代,于含有10 %胎牛血清,100 μg/mL青霉素和100 μg/mL链霉素的高糖培养基中进行常规培养,细胞孵育箱条件为37 ℃,5% CO2。选取形态规则良好的细胞,当其融合度达到80 %,做转染及加药处理。用空白培养基分别稀释Lip 2000和siRNA至所需浓度, 室温静置5 min。将稀释后的siRNA与Lip 2000按照1 ∶1混匀, 室温静置20 min, 使其形成稳定的siRNA-脂质体混合物。随后弃去细胞培养液, 将上述混合物加入到转染组细胞, 6 h后更换为空白培养基。
1.3 细胞分组及处理实验分为以下5组:对照组、阴性siRNA组、CALR-siRNA组、TGF-β1(5 ng/mL)组和CALR-siRNA+TGF-β1 (5 ng/mL)组。CALR-siRNA组和TGF-β1 (5 ng/mL)组分别将CALR-siRNA转入细胞作用48 h及5 ng/mL TGF-β1作用24 h,CALR-siRNA+TGF-β1组将CALR-siRNA转入细胞24 h后加入5 ng/mL的TGF-β1继续作用24 h后进行指标测量,阴性siRNA组及对照组分别将Nc-siRNA及等量的空白培养基转入细胞作用48 h。
1.4 倒置显微镜观察细胞形态变化将细胞培养瓶中生长至80%的细胞,胰蛋白酶消化成单个细胞,1 000 r/min离心5 min,调整细胞浓度为2×106/mL接种至6孔板,转染及加药处理后更换空白培养基,倒置显微镜(Nikon)下观察细胞形态及凋亡情况。
1.5 TUNEL法检测细胞凋亡取无菌玻片提前放入24孔板内,各孔加入500 μL细胞悬液,用以制备细胞爬片。转染结束后,PBS洗3次,加入4%多聚甲醛固定细胞,室温孵育30 min后,PBS洗1次。各孔滴加20 μg/mL的Proteinase K 100 μL,使其覆盖爬片,室温孵育5 min,PBS洗涤3次。配制TUNEL检测液,现用现配,避光操作及保存,按每孔体积50 μL配制[5 μL TdT Enzyme (10×),45 μL TRITC-dUTP Labeling Mix]加入各孔,周围孔加生理盐水以防干燥,避光操作,37℃孵育30 min,PBS洗3次。将载玻片放置于避光湿盒中并分组标记,于载玻片上滴DAPI 20 μL,爬片放于载玻片上,室温条件下复染5 min。调定荧光显微镜,激发波长、发射波长分别为546 nm、570 nm,取随机视野3个观察并拍照。凋亡率=凋亡数(红色标记数)/细胞总数(红、蓝色标记总数)×100%。
1.6 激光共聚焦显微镜检测细胞内Ca2+浓度将细胞以103~104/mL接种至共聚焦小皿中,每孔200 μL,置于细胞培养箱中,各组处理完成后,PBS洗2次,避光条件下加入Fluo-3探针(KPL),细胞培养箱中放置40 min, PBS清洗3次,加入2 mL完全培养基静置20 min, 激光共聚焦显微镜(Olympus Japan Co., Ltd.)下观察Ca2+荧光强度。FV10-ASW 4.2 Viewer 软件分析各组细胞内Ca2+平均荧光强度。
1.7 Western blot法检测细胞CALR、GRP78、Caspase-12、Caspase-3蛋白表达将细胞以2×106/mL接种至6孔板,向各处理组细胞中加入200 μL细胞裂解液提取总蛋白。BCA法进行蛋白浓度测定,蛋白变性保存于-20 ℃冰箱。10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳制备试剂盒(Beyotime Biotechnology)用于测定CALR、GRP78、Caspase-12、Caspase-3蛋白表达,经SDS-PAGE凝胶电泳, 将蛋白湿转至PVDF膜,5%脱脂奶粉封闭1 h,一抗4 ℃过夜: CALR(1 ∶1 000; Arigo), GRP78 (1 ∶1 000; Arigo), caspase-12 (1 ∶1 000; Arigo) and caspase-3 (1 ∶1 000; Arigo)。HRP标记的二抗37℃孵育1 h, ECL发光显色,ImageJ软件对各条带灰度值进行分析,计算每组各蛋白的相对表达量。
1.8 统计学分析实验数据采用统计学软件SPSS 20.0分析,结果以x±s表示,多组均数比较用单因素方差分析(one-way ANOVA),组间两两均数比较用LSD-t检验,P < 0.05表明差异具有统计学意义。
2 结果 2.1 各处理组细胞形态变化情况倒置显微镜下不同处理组LX-2细胞形态改变如图 1所示。对照组(图 1A)细胞贴壁生长,紧密相连呈星状梭形,形态规则。阴性siRNA组(图 1B)细胞状态同对照组,出现少许死亡细胞,TGF-β1组(图 1D)细胞间隙变宽,呈长梭形改变,向扁平状肌成纤维样细胞转变。CALR-siRNA组(图 1C)细胞明显缩短,体积变小,空隙增大,细胞连接性变差,凋亡细胞显著增加。CALR-siRNA+ TGF-β1组(图 1E)细胞也出现严重的凋亡现象,但凋亡细胞较CALR-siRNA组有所减少且有部分细胞转变为长梭形。

|
| A: 对照组;B: 阴性siRNA组;C: CALR-siRNA组;D: TGF-β1组;E: CALR-siRNA+ TGF-β1组 图 1 倒置显微镜观察细胞形态变化(×200) |
2.2 各处理组细胞凋亡情况
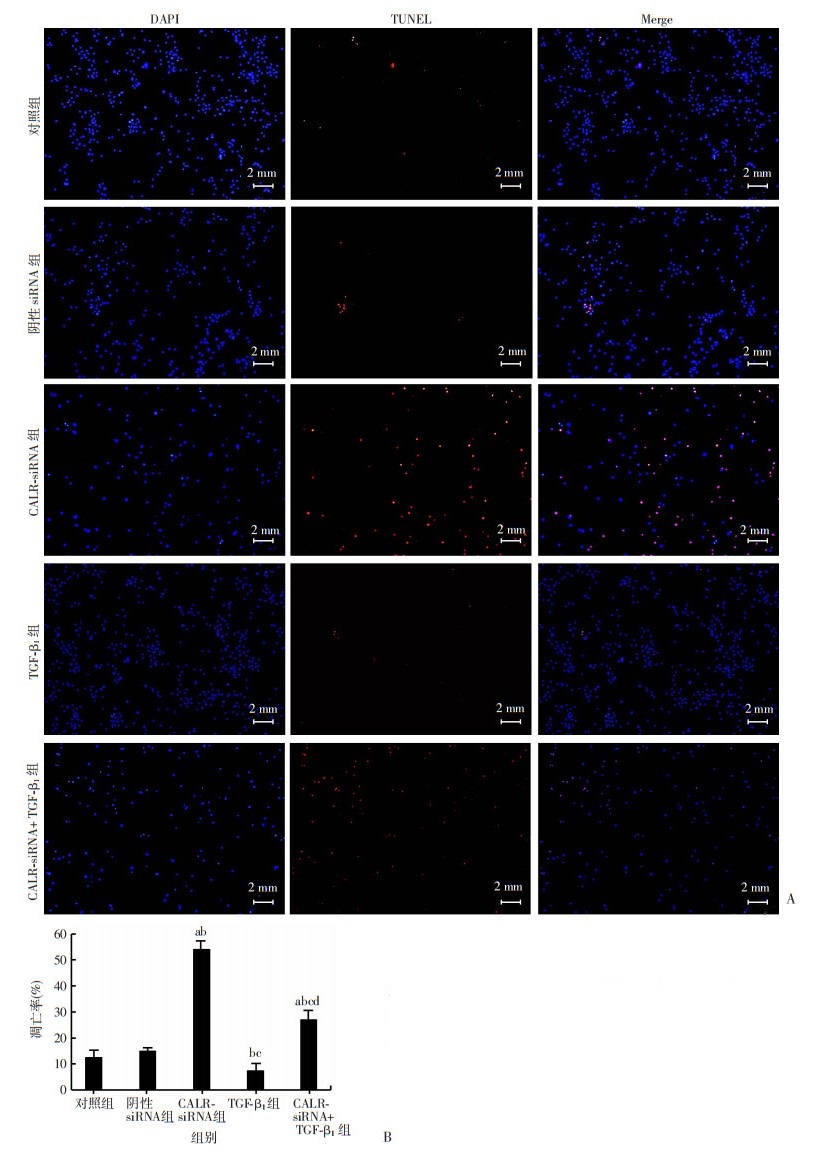
TUNEL法检测细胞凋亡结果如图 2A,对照组与阴性siRNA组凋亡率组间差异无显著性(P>0.05);较对照组和阴性siRNA组,CALR-siRNA组凋亡率明显升高(P < 0.05),TGF-β1组无显著性差异(P>0.05),CALR-siRNA+ TGF-β1组凋亡率明显低于CALR-siRNA组(P < 0.05)。各组HSC细胞凋亡率间均有明显差异(P < 0.05,图 2B)。
|
| A: TUNEL法检测细胞凋亡结果; B: 定量分析(n=3, x±s) a: P < 0.05,与对照组比较; b: P < 0.05,与阴性siRNA组比较; c: P < 0.05, 与CALR-siRNA组比较; d: P < 0.05, 与TGF-β1组比较 图 2 各处理组细胞凋亡情况 |
2.3 各处理组细胞内Ca2+荧光强度变化
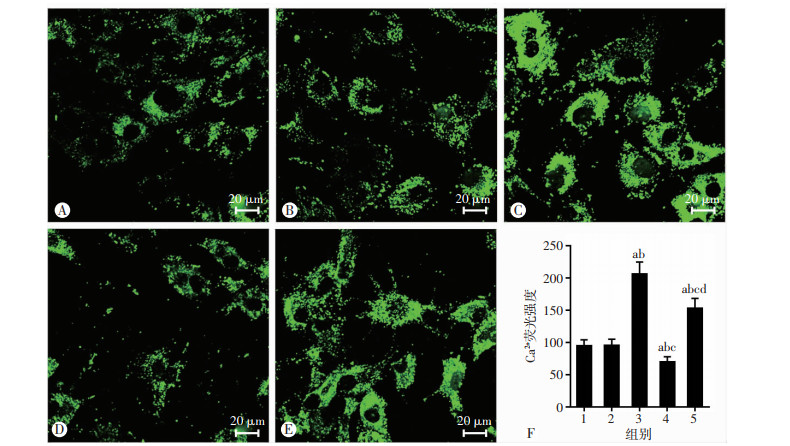
激光共聚焦显微镜扫描结果显示,CALR-siRNA组(图 3C)Ca2+浓度高于对照组(图 3A)和阴性siRNA组(图 3B),差异显著(P < 0.05),TGF-β1组(图 3D)Ca2+浓度显著低于对照组,CALR-siRNA+ TGF-β1组(图 3E)Ca2+浓度介于CALR-siRNA组和TGF-β1组之间(P < 0.05),对照组与阴性siRNA组间Ca2+浓度差异无统计学意义(P>0.05)。各组间Ca2+荧光强度均有显著性差异(P < 0.05,图 3F)。
|
| A: 对照组;B: 阴性siRNA组;C: CALR-siRNA组;D: TGF-β1组;E: CALR-siRNA+ TGF-β1组;F:定量分析(n=3,x±s) 1:对照组;2:阴性siRNA组;3:CALR-siRNA组;4:TGF-β1组;5:CALR-siRNA+ TGF-β1组;a:P < 0.05,与对照组比较;b:P < 0.05,与阴性siRNA组比较;c:P < 0.05,与CALR-siRNA组比较;d:P < 0.05,与TGF-β1组比较 图 3 各处理组细胞内Ca2+荧光强度变化 |
2.4 各处理组间CALR、GRP78、Caspase-12、Caspase-3蛋白表达
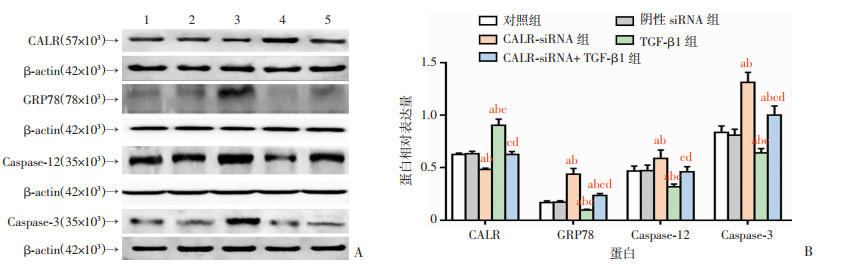
Western blot法检测结果(图 4A)显示:对照组和阴性siRNA组比较无显著差异(P>0.05),与这两组比较,CALR-siRNA组细胞CALR蛋白表达明显减少(P < 0.05),GRP78、Caspase-12、Caspase-3蛋白表达显著升高(P < 0.05),TGF-β1组CALR表达较对照组显著升高(P < 0.05),其余3种蛋白表达明显降低(P < 0.05),CALR-siRNA+ TGF-β1组CALR蛋白的表达量显著高于CALR-siRNA组,GRP78、Caspase-12、Caspase-3显著降低(P>0.05)。各组间CALR、GRP78、Caspase-12、Caspase-3蛋白表达差异有统计学意义(P < 0.05,图 4B)。
|
| A: Western blot检测结果1:对照组;2:阴性siRNA组;3:CALR-siRNA组;4:TGF-β1组;5:CALR-siRNA+ TGF-β1组;B: 定量分析(n=3,x±s) a:P < 0.05,与对照组比较;b:P < 0.05,与阴性siRNA组比较;c:P < 0.05,与CALR-siRNA组比较;d:P < 0.05,与TGF-β1组比较 图 4 各处理组细胞CALR、GRP78、Caspase-12、Caspase-3蛋白表达 |
3 讨论
内质网应激(endoplasmic reticulum stress,ERS)所诱导的细胞凋亡是近年来才被了解的一种新的凋亡途径, 可引起细胞内Ca2+平衡紊乱,激活未折叠蛋白反应、内质网超负荷反应和Caspase-12介导的凋亡通路等信号途径[6-7]。葡萄糖调节蛋白78(glucose regulated protein 78 kD, GRP78) 是位于内质网上重要的分子伴侣,其表达的持续性升高是细胞发生ERS的重要特征[8]。ERS在HF的发生发展中具有重要作用,文献报道, ERS能够降低激活的HSC分泌α-平滑肌肌动蛋白(Alpha-smooth muscle actin, α-SMA)和Ⅰ型胶原蛋白(Collagen Ⅰ), 促进活化的HSC凋亡,从而抑制HF的形成[9]。
含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase, Caspase)是一组存在于细胞质中具有类似结构的蛋白酶,Caspase家族在细胞凋亡过程中发挥至关重要的作用。当内质网中的Ca2+稳态被破坏时,Caspase-12被激活,它可以进一步剪切Caspase-3。Caspase-3是细胞凋亡过程中关键蛋白酶[10-11]。细胞凋亡3个信号传导通路都能激活凋亡执行者Caspase-3,它会水解各种各样的细胞成分使细胞发生凋亡[12]。
CALR是位于内质网内腔的质量控制分子伴侣,能够结合Ca2+以调节细胞内Ca2+稳态,其参与许多信号通路,包括细胞凋亡[13]。近年研究发现,与人正常肝细胞相比,CALR在人肝癌细胞系中表达也明显上调,同时CALR表达的下调可有效抑制肝癌细胞的生长和侵袭,促进其凋亡[14]。TGF-β1是目前已知最强的促纤维化细胞因子之一,是激活静态HSC的最强因子[15]。目前被认为是重要的HF始动因子之一,经常在体外实验中被用来刺激HSC成为成纤维细胞[16]。CALR是否与ERS介导的细胞凋亡之间有关以及和促纤维化因子TGF-β1的关系,尚未发现被提及。在这项研究中,我们发现以5 ng/mL TGF-β1刺激HSC 24 h后,细胞间隙增宽,呈长梭形改变,向扁平状肌成纤维样细胞转变,同时,细胞增殖能力增强,提示TGF-β1可促进HSC活化,与相关报道一致[17]。
本研究结果显示,siRNA沉默CALR后,细胞密度和体积均变小,发生脱落、皱缩,细胞碎片增加,出现大量凋亡细胞,凋亡率显著升高,提示CALR的siRNA能够明显促使HSC发生凋亡。阴性siRNA组也出现少许凋亡细胞,可能是转染试剂lip2000的细胞毒性所致,但影响不大。此外,HSC中CALR的减少能够引起细胞内Ca2+荧光强度增强,浓度升高。同时,CALR-siRNA转染细胞后,ERS指示剂GRP78和ERS相关蛋白Caspases-12表达上调,并伴有凋亡相关蛋白Caspase-3上调。由此推断,Ca2+可能充当凋亡相关基因的中间信使。CALR为Ca2+结合蛋白,能够结合细胞内Ca2+以维持Ca2+稳态和细胞正常生理功能,当CALR表达减少,细胞质内游离Ca2+增多,出现钙超载现象,激活ERS通路,引起细胞凋亡。我们之前的研究也发现,在体外实验过程中,Ca2+浓度升高与细胞凋亡有关[18]。
转染后在细胞中加入TGF-β1,和单纯转染组细胞相比,CALR表达明显增加,凋亡细胞数减少,凋亡率降低,Ca2+荧光强度减弱,GRP78、Caspases-12、Caspase-3表达明显升高。提示在HSC中TGF-β1能够直接或间接促进CALR的表达,减轻siRNA诱导的细胞凋亡。有研究证实[19]通过沉默人牙龈成纤维细胞(Human gingival fibroblasts,HGFs) 中CALR的表达,HGFs中TGF-β1的表达量也有显著下降。CALR在HGFs表达TGF-β1的过程中,起重要作用。CALR的致纤维化作用,是近些年来国内外学者研究的热点。国外学者PRAKOURA[20]用野生型小鼠和CALR部分缺陷的杂合子小鼠做动物实验,研究在纤维化发展的过程中,CALR对TGF-β1的影响。结果发现,CALR缺陷,会导致可调节TGF-β1活化的TSP1表达受到抑制,也会使TGF-β1信号传导的中心介质——磷酸化的Smad3表达量降低,则可以推断出,CALR可通过影响TSP1表达,来调节TSP1介导的TGF-β1活化。由此推断,CALR在致纤维化过程中发挥重要作用,它可以与TGF-β1相互作用,相互促进,在HSC的纤维化进展中发挥作用。
我们的发现证实了沉默CALR能够引起HSC凋亡,可能的机制为CALR表达下调能够引起HSC内Ca2+稳态失调,介导ERS,从而启动细胞Caspase凋亡程序。同时,CALR和TGF-β1的表达能够相互影响,提示CALR可能在促纤维化过程中也有重要作用。
| [1] |
徐旭东, 段光琦, 刘洁, 等. 坎地沙坦酯对酒精性肝纤维化小鼠TGF-β1/Smads信号通路的影响[J]. 实用医学杂志, 2020, 36(03): 38-43. XU X D, DUAN G Q, LIU J, et al. Effects of candesartan on TGF-β1/Smads signaling pathway in a mice model of alcoholic liver fibrosis[J]. J Prat Med, 2020, 36(03): 38-43. DOI:10.3969/j.issn.1006-5725.2020.03.007 |
| [2] |
HAMADA-TSUTSUMI S, ONISHI M, MATSUURA K, et al. Inhibitory effect of a human microRNA, miR-6133-5p, on the fibrotic activity of hepatic stellate cells in culture[J]. Int J Mol Sci, 2020, 21(19): E7251. DOI:10.3390/ijms21197251 |
| [3] |
DENG L, LI T Y, LIAO Y Y, et al. Peritumoral activated hepatic stellate cells are associated with hepatic recurrence for resectable colorectal adenocarcinoma liver metastasis following ]resection[J]. Oncol Lett, 2020, 20(6): 287. DOI:10.3892/ol.2020.12150 |
| [4] |
PANDYA U M, MANZANARES M A, TELLECHEA A, et al. Calreticulin exploits TGF-β for extracellular matrix induction engineering a tissue regenerative process[J]. FASEB J, 2020, 34(12): 15849-15874. DOI:10.1096/fj.202001161R |
| [5] |
唐香玲, 魏浩然, 周建文, 等. 钙网织蛋白在肿瘤发生发展中的作用研究进展[J]. 中国医药科学, 2019, 9(19): 41-45. TANG X L, WEI H R, ZHOU J W, et al. Research progress on the role of calreticulin in tumorigenesis and development[J]. China Med Pharm, 2019, 9(19): 41-45. DOI:10.3969/j.issn.2095-0616.2019.19.012 |
| [6] |
顾静, 郭超, 车敏, 等. 黄芪对高血压大鼠血管重构中内质网应激反应的影响[J]. 中国实验动物学报, 2019, 27(1): 65-71. GU J, GUO C, CHE M, et al. Effect of astragalus on endoplasmic reticulum stress during the vascular remodeling in hypertensive rats[J]. Acta Lab Anim Sci Sin, 2019, 27(1): 65-71. |
| [7] |
JIANG L, QIAO Y, WANG Z, et al. Inhibition of microRNA-103 attenuates inflammation and endoplasmic reticulum stress in atherosclerosis through disrupting the PTEN-mediated MAPK signaling[J]. J Cell Physiol, 2020, 235(1): 380-393. DOI:10.1002/jcp.28979 |
| [8] |
王旭, 邵鑫, 许海燕, 等. 糖脂清对糖尿病大鼠海马内质网应激相关因子GRP78、CHOP、Caspase-12表达的影响[J]. 南京中医药大学学报, 2019, 35(1): 73-77. WANG X, SHAO X, XU H Y, et al. Effects of tangzhiqing on the expression of endoplasmic reticulum stress related factors GRP78, CHOP and caspase 12 in the Hippocampus of diabeticrats[J]. J Nanjing Univ Tradit Chin Med Nat Sci, 2019, 35(1): 73-77. DOI:10.14148/j.issn.1672-0482.2019.0073 |
| [9] |
ZOU H, LIU G. Inhibition of endoplasmic Reticulum stress through activation of MAPK/ERK signaling pathway attenuates hypoxia-mediated cardiomyocytedamage[J]. J Recept Signal Transduct Res, 2020, 1-6. DOI:10.1080/10799893.2020.1831534 |
| [10] |
张闰哲, 徐露, 姚庆华. 姜黄素联合5-氟尿嘧啶对结肠癌SW620细胞体外抑制的影响[J]. 中成药, 2020, 042(004): 1021-1025. ZHANG R Z, XU L, YAO Q H. Effect of curcumin combined with 5-fluorouracil on the inhibition of colon cancer SW620 cells in vitro[J]. Chin Tradit Patent Med, 2020, 042(004): 1021-1025. DOI:10.3969/j.issn.1001-1528.2020.04.038 |
| [11] |
刘迪, 张浩, 张寒雪, 等. 人参皂苷F2干预Caspase级联反应抑制H2O2诱导的细胞凋亡[J]. 现代食品科技, 2020, 36(7): 11-16. LIU D, ZHANG H, ZHANG H X, et al. Ginsenoside F2 interferes with the cascade reactions of caspase to inhibit HO-induced apoptosis[J]. Mod Food Sci Technol, 2020, 36(7): 11-16. DOI:10.13982/j.mfst.1673-9078.2020.7.0006 |
| [12] |
GUO Q, JING F J, QU H J, et al. Ubenimex reverses MDR in gastric cancer cells by activating caspase-3-mediated apoptosis and suppressing the expression of membrane transport proteins[J]. Biomed Res Int, 2019, 2019: 4390839. DOI:10.1155/2019/4390839 |
| [13] |
HASSAN E M, WALKER G C, WANG C, et al. Anti-leukemia effect associated with down-regulated CD47 and up-regulated calreticulin by stimulated macrophages in co-culture[J]. Cancer Immunol Immunother, 2021, 70(3): 787-801. DOI:10.1007/s00262-020-02728-z |
| [14] |
FENG R, YE J, ZHOU C, et al. Calreticulin down-regulation inhibits the cell growth, invasion and cell cycle progression of human hepatocellular carcinoma cells[J]. Diagn Pathol, 2015, 10: 149. DOI:10.1186/s13000-015-0382-1 |
| [15] |
肖政华, 邹艳, 杨辉, 等. 扶肝化纤汤含药血清对TGF-β1诱导HSC-T6细胞增殖及TGF-β1/Smad信号通路的影响[J]. 中医杂志, 2019, 60(19): 1673-1678. XIAO Z H, ZHOU Y, YANG H, et al. Effects of serum containing fugan huaxian decoction(扶肝化纤汤) on TGF-β1 induced HSC-T6 proliferation and TGF-β 1/Smad signaling pathway[J]. J Tradit Chin Med, 2019, 60(19): 1673-1678. DOI:10.13288/j.11-2166/r.2019.19.012 |
| [16] |
GONG Y, YANG Y. Activation of Nrf2/AREs-mediated antioxidant signalling, and suppression of profibrotic TGF-β1/Smad3 pathway: a promising therapeutic strategy for hepatic fibrosis—A review[J]. Life Sci, 2020, 256: 117909. DOI:10.1016/j.lfs.2020.117909 |
| [17] |
TAO L, WU L, ZHANG W, et al. Peroxisome proliferator-activated receptor γ inhibits hepatic stellate cell activation regulated by miR-942 in chronic hepatitis B liver fibrosis[J]. Life Sci, 2020, 253: 117572. DOI:10.1016/j.lfs.2020.117572 |
| [18] |
LI Y N, YAN Y, LIU F, et al. Effects of calcium Ionophore A23187 on the apoptosis of hepatic stellate cells stimulated by transforming growth factor-β1[J]. Cell Mol Biol Lett, 2018, 23: 1. DOI:10.1186/s11658-017-0063-z |
| [19] |
樊宇, 莫水学. 机械压应力对人牙龈成纤维细胞表达钙网蛋白的影响[J]. 广西医科大学学报, 2018, 35(3): 294-297. FAN Y, MO S X. The effect of mechanical stress on the expression of calreticulin in human gingival fibroblasts[J]. J Guangxi Med Univ, 2018, 35(3): 294-297. DOI:10.16190/j.CNKI.45-1211/y.2018.03.004 |
| [20] |
PRAKOURA N, POLITIS P K, IHARA Y, et al. Epithelial calreticulin up-regulation promotes profibrotic responses and tubulointerstitial fibrosis development[J]. Am J Pathol, 2013, 183(5): 1474-1478. DOI:10.1016/j.AJPATH.2013.07.014 |




