2. 1400010 重庆,重庆医科大学:超声影像学研究所
2. Department of Nuclear Medicine, Chongqing Key Laboratory of Ultrasound Molecular Imaging, Chongqing Medical University, Chongqing, 400010, China
恶性肿瘤已成为威胁人类健康的主要原因之一[1],目前的治疗方式虽能在一定程度上抑制肿瘤生长,但其不良反应不容忽视[2],因此,寻找新的抗肿瘤治疗方法迫在眉睫。声动力治疗(sonodynamic therapy,SDT)是近年来兴起的新型治疗方法,是将超声波和声敏剂结合,通过超声空化作用、氧自由基产生氧化损伤等机制诱导细胞凋亡,抑制肿瘤增殖,具有无创、低成本、高选择性、高组织穿透性等优点[3-4]。声敏剂是SDT发生的关键因素。然而,传统有机声敏剂水溶性低,化学、生物稳定性差,血流清除快,从而导致肿瘤聚集性差、治疗效果差等问题[5]。纳米医学的快速发展为解决这一问题带来了希望,基于各种敏化剂的纳米颗粒得到广泛应用,如基于华卟啉钠(sinoporphyrin sodium,DVDMS)的仿生纳米粒EXO-DVDMS、基于IR780的脂质体纳米粒IR780-NDs等[6-7]。现有研究表明:DVDMS、IR780均是性能良好的声敏剂,主要位于肿瘤细胞的线粒体中,可被超声有效激活,导致肿瘤细胞的损伤,对正常细胞的毒性较小[7-8]。全氟己烷(perfluorinated hexane,PFH)作为液态氟碳中的一员,支持通过液气相变进行超声成像[9]。
基于此研究现状,我们设想将DVDMS、IR780包载到同一纳米粒中,以达到1+1>2的效果。为了验证这一科学假设,本研究选用FDA认证的聚乳酸-乙醇酸(poly lactic-co-glycolic acid,PLGA)纳米材料,制备搭载DVDMS、IR780和PFH的多功能复合纳米粒DIPP-NPs,旨在探讨其协同增强SDT作用,为进一步开发靶向SDT分子探针提供新的可能。考虑到超声/光声成像技术更适用于浅表肿瘤的诊断与监控,故选用乳腺癌为本实验研究模型。
1 材料与方法 1.1 主要试剂与仪器 1.1.1 主要试剂包括:羧基端乳酸-羟基乙酸共聚物(PLGACOOH,聚合比50:50,济南岱罡);IR780碘化物(美国Sigma公司);DVDMS(青龙高科技股份有限公司);PFH(上海麦克林生化科技有限公司);Dil(碧云天生物公司);DAPI(博士德生物公司);单线氧荧光探针(singlet oxygen sensor green reagent,SOSG,美国Thermo Fisher公司);CCK-8试剂盒(东仁化学有限公司);小鼠乳腺癌4T1细胞(重庆医科大学超声影像学研究所)。
1.1.2 主要仪器包括:声振仪(Sonic,美国);磁力搅拌器(DF-101,德国);光学显微镜(Olympus IX71,日本);透射电镜(HITACHI,日本);粒径测量仪(Malvern公司,英国);紫外可见光分光光度计(岛津2500UV-VIS,日本);激光共聚焦显微镜(Nikon公司,日本);流式细胞仪(Beckman coulter公司,美国);多功能酶标仪(Thermo公司,美国);小动物光声成像仪(Vevo® LAZR2100,加拿大);低强度聚焦超声治疗仪(LIFU,重庆医科大学超声分子影像学研究所研制)。
1.2 方法 1.2.1 DIPP-NPs的制备及表征超声双乳化法制备纳米粒,将1 mg DVDMS溶解于100 μL PBS溶液中,25 mg PLGA、1 mg IR780溶解于1 mL三氯甲烷溶液中(油相);再将溶解好的DVDMS溶液(水相)、PFH溶液(水相)各100 μL加到溶解好的油相溶液中,用声震仪(3 min,震5 s、停5 s,功率45%)进行第1次乳化;再向其中加入4 mL 4% PVA溶液,再次声震仪乳化(3 min,震5 s、停5 s,功率30%);最后加入5 mL 2%的异丙醇,混合乳液磁力搅拌4~6 h;待三氯甲烷完全挥发后,双蒸水离心洗涤(11 000 r/min,5 min)3次,制备获得DIPP-NPs,于4 ℃条件下保存备用。以上所有步骤均在避光、冰浴条件下进行。DPP-NPs(未添加IR780)、IPP-NPs(未添加DVDMS)、PP-NPS(IR780、DVDMS均未添加)3种纳米粒的制备与上述过程类似。
DIPP-NPs制备成功后,肉眼观察其外观性状;光镜、激光共聚焦显微镜、透射电镜下观察其形态及结构特征;Malvern粒径仪检测其粒径大小、电位分布;紫外分光光度计检测其光密度值,绘制紫外吸收光谱图;标准曲线法计算DVDMS、IR780的包封率。DVDMS/IR780包封率=M1/M2×100%,M1表示包载于PLGA纳米粒中的DVDMS/IR780含量,M2表示DVDMS/IR780的投入总量。
1.2.2 DIPP-NPs体外超声/光声成像实验将DIPP-NPs(1 mL,1 mg/mL)加入凝胶模型后进行超声辐照(3 W,0、60、180、300 s;辐照条件根据本实验室既往研究选定),光镜下观察、记录纳米粒的变化,超声成像系统评价其体外超声成像能力,DFY-Ⅱ型超声图像定量分析仪分析各靶区声强值。
将DIPP-NPs(200 μL,1 mg/mL)加入凝胶模型后,光声成像系统行全波长(680~970 nm)扫描,选取光声值最大处对应波长的激光,激发不同浓度DIPP-NPs(0.5、1.0、1.5、2.0、2.5 mg/mL),采集各组光声图像,并定量分析各组光声信号强度。
1.2.3 DIPP-NPs体外靶向实验将处于对数期的4T1细胞(1×105/皿)接种于共聚焦培养皿中,24 h后将细胞分为以下4组:PP-NPs组、DPP-NPs组、IPP-NPs组、DIPP-NPs组。各组加入等量(50 mg/mL,1 mL/皿)DiI标记的相应纳米粒,与细胞共培养4 h后,PBS多次洗涤、清除未靶向的纳米粒,4%多聚甲醛1 mL固定细胞15 min,DAPI染料200 μL染色细胞核15 min。激光共聚焦显微镜观察纳米粒与细胞的结合情况。
1.2.4 DIPP-NPs体外活性氧检测实验用SOSG作为单线态氧指示剂。将DIPP-NPs(1.2 mL,100 μg/mL)、SOSG甲醇溶液(0.3 mL)、PBS(1.5 mL)充分混匀,混合物经由超声辐照(3 W,0、15、30、60、120、240 s;辐照条件根据本实验室既往研究选定),荧光分光光度计记录500~700 nm上SOSG的荧光强度。
1.2.5 DIPP-NPs的细胞毒性及其体外声动力治疗实验在5%CO2、37 ℃培养箱中用DMEM完全培养基(10%胎牛血清、1%双抗)培养4T1细胞,实验均采用对数期生长细胞。将4T1细胞(1×104/孔)接种于96孔板中,24 h后分为6组,每组3~5个复孔。各组加入等量(200 μL/孔)不同浓度DIPP-NPs培养基稀释液(0、20、40、60、80、100 μg/mL),与细胞共培养24 h后,加入CCK-8试剂,继续培养1~4 h,多功能酶标仪检测并计算细胞存活率。
将4T1细胞(1×104/孔)接种于96孔板中,24 h后分为以下6组:阴性对照组、仅US组、仅DIPP-NPs组、DPP-NPs+US组、IPP-NPs+US组、DIPP-NPs+US组,每组3~5个复孔。各组加入等量(50 μg/mL,200 μL/孔)相应纳米粒后进行超声辐照(3 W,30 s;辐照条件根据本实验室既往研究选定)。于辐照后2 h加入CCK-8试剂继续培养1~4 h,多功能酶标仪检测并计算细胞存活率。
1.2.6 动物模型的建立及DIPP-NPs的体内声动力治疗实验选取6~8周龄的雌性BALB/c小鼠(16~20 g)18只,将4T1细胞悬液(1×106/mL)皮下注射于小鼠右侧腹部(0.1 mL/只)建立荷瘤鼠模型,待肿瘤体积长至约100 mm3,用于体内声动力治疗研究。
将18只荷瘤小鼠分为以下6组(n=3):阴性对照组、仅US组、仅DIPP-NPs组、DPP-NPs+US组、IPP-NPs+US组、DIPP-NPs+US组。各组经尾静脉注射等量(3 mg/mL,200 μL)相应纳米粒或生理盐水后24 h,用涂抹了耦合剂的超声探头对荷瘤鼠肿瘤部位进行垂直辐照(3 W,3 min;辐照条件根据本实验室既往研究选定)。上述治疗过程每3天重复1次,肿瘤体积每2天记录1次,连续16 d。肿瘤体积(mm3)=(短径2×长径)/2。治疗周期结束后,剖离瘤块并称其质量,计算肿瘤体积/质量抑制率。肿瘤体积抑制率=(V对照组-V实验组)/V对照组×100%,肿瘤质量抑制率=(M对照组-M实验组)/M对照组×100%。
1.3 统计学分析采用SPSS 22.0统计软件。计量资料以x±s表示,两变量比较采用线性相关分析,多样本均数比较采用单因素方差分析,两组间进一步比较采用LSD-t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 DIPP-NPs的基本理化性质成功制备DIPP-NPs,肉眼观察呈墨绿色乳化液(图 1A);光镜下大小均一、分散性良好(图 1B);激光共聚焦显微镜下DiI标记的DIPP-NPs呈均一的红色颗粒(图 1C);透射电镜下呈圆球形(图 1D);马尔文粒径仪测得其粒径、电位分别为(341.17±16.97)nm(图 1E)、(-12.77±0.88)mV(图 1F);紫外吸收光谱图显示:DIPP-NPs于405、795 nm处各出现了1个特征吸收峰(图 1G),说明DVDMS、IR780成功包载于PLGA纳米粒中;根据DVDMS、IR780的紫外吸收光谱图(图 1H、I)绘制DVDMS、IR780的标准曲线回归方程分别为:y=0.093 2x+0.021 9,R2=0.998 9、y=0.320 3x-0.183 3,R2=0.996 2。最后计算得到DVDMS、IR780的包封率分别为(92.84±1.58)%、(96.57±1.48)%。
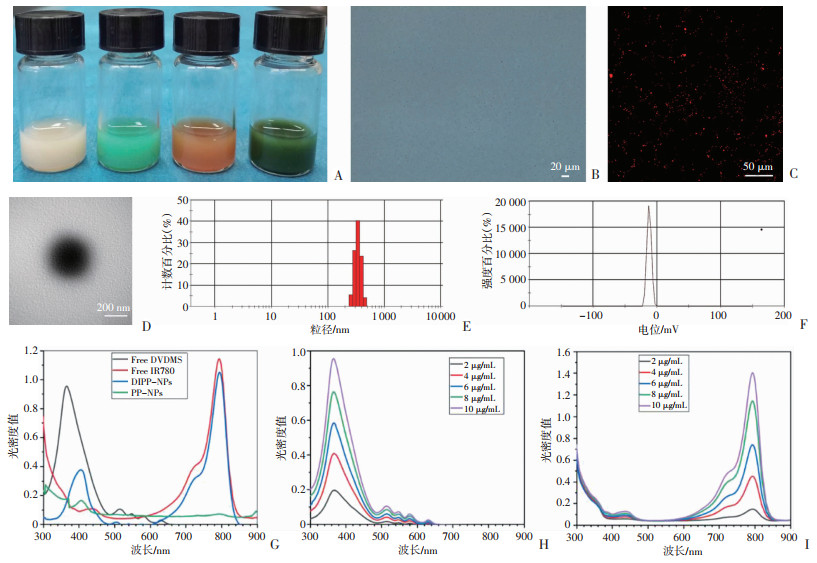
|
| A:纳米粒外观性状,从左到右依次为PP-NPs、IPP-NPs、DPP-NPs、DIPP-NPs;B:DIPP-NPs的光镜图;C:DIPP-NPs的激光共聚焦显微镜图;D:DIPP-NPs的透射电镜图;E:DIPP-NPs的粒径分布;F:DIPP-NPs的电位分布;G:不同纳米粒/材料的紫外吸收光谱图;H:DVDMS的紫外吸收光谱图;I:IR780的紫外吸收光谱图 图 1 DIPP-NPs的基本理化性质 |
2.2 DIPP-NPs的体外超声/光声成像能力
光镜下观察到随着超声辐照时间的延长,大量DIPP-NPs转化为微泡,其直径也由原来的300 nm左右增加至20 μm左右(图 2A),超声成像结果显示其回声信号随辐照时间逐渐增强(图 2B),回声强度定量分析结果与图像结果一致(图 2C);光声成像结果显示,DIPP-NPs行全波长扫描后,于795 nm处出现光声信号最大值,在λ=795 nm的激光辐照下,光声信号随DIPP-NPs浓度线性增加(图 2D),光声信号定量分析结果与图像结果一致(图 2E)。以上结果表明DIPP-NPs具有良好的超声、光声成像能力。
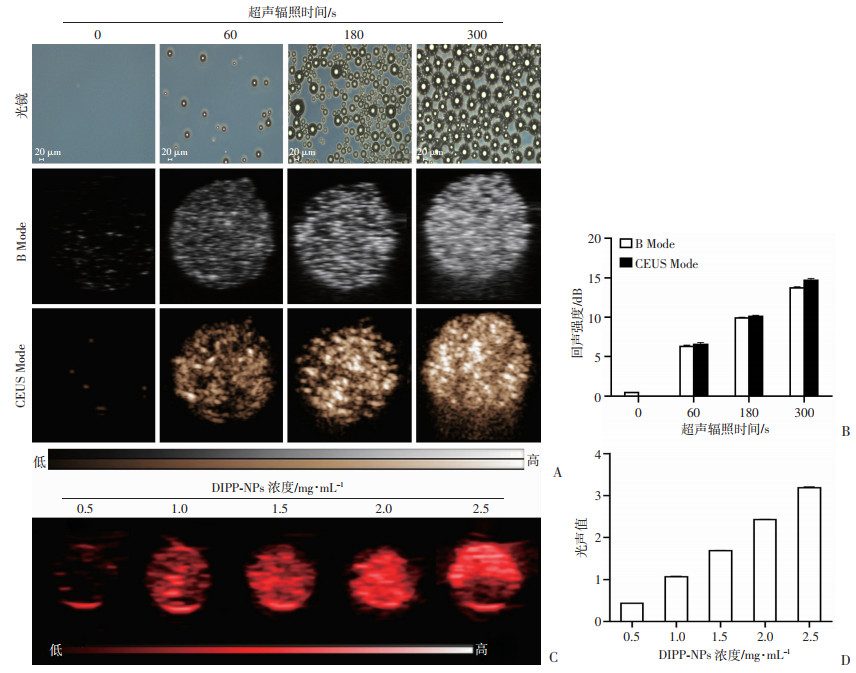
|
| A:不同超声辐照条件下DIPP-NPs的体外相变光镜观察及超声/造影成像;B:不同超声辐照条件下DIPP-NPs体外超声/造影成像定量分析(n=3);C:不同浓度DIPP-NPs的体外光声成像;D:不同浓度DIPP-NPs的体外光声成像定量分析(n=3) 图 2 DIPP-NPs的相变、体外超声/光声成像及定量分析 |
2.3 DIPP-NPs与4T1细胞的体外结合情况
与4T1细胞共培养4 h后,PP-NPs组可见蓝染的细胞核周围仅有极少量DiI标记的红色纳米粒聚集,而DPP-NPs组、IPP-NPs组、DIPP-NPs组细胞核周围均可见大量红色纳米粒聚集,且DIPP-NPs组周围的红色纳米粒多于其他两组(图 3)。结果表明DVDMS、IR780均有助于纳米粒在肿瘤细胞的摄取,当DVDMS、IR780联合作用时,摄取作用增强。
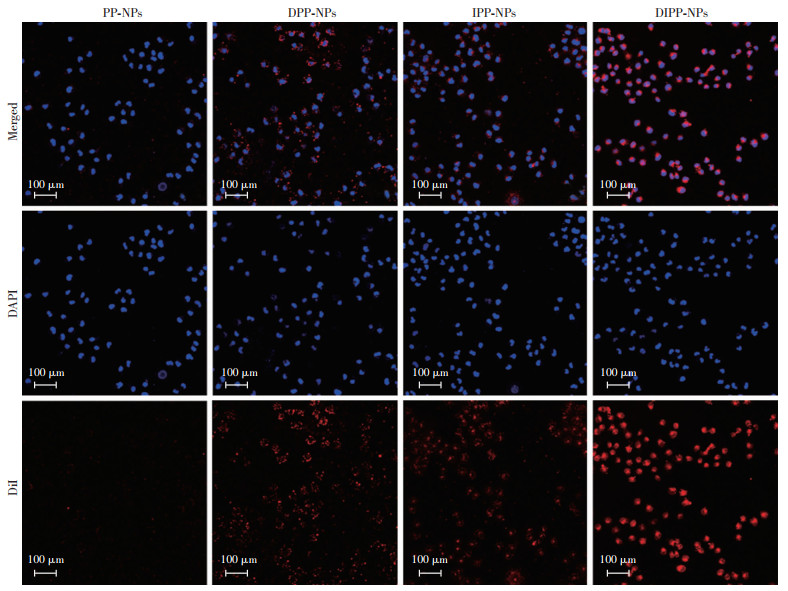
|
| 图 3 激光共聚焦显微镜观察DIPP-NPs与4T1细胞的结合情况 |
2.4 DIPP-NPs的体外活性氧产生情况
随着超声辐照时间的延长,含DIPP-NPs的SOSG甲醇溶液的荧光强度逐渐增强(图 4A)。表明产生的活性氧逐渐增多。
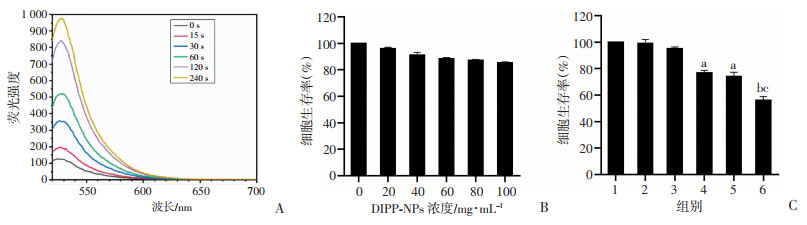
|
| A:不同超声辐照条件下SOSG荧光强度;B:DIPP-NPs的细胞毒性(n=3);C:DIPP-NPs的体外声动力治疗效果(n=3) 1:阴性对照组;2:仅US组;3:仅DIPP-NPs组;4:DPP-NPs+US组;5:IPP-NPs+US组;6:DIPP-NPs+US组;a:P < 0.05,与阴性对照组比较;b:P < 0.05,与DPP-NPs+US组比较;c:P < 0.05,与IPP-NPs+US组比较 图 4 DIPP-NPs的体外活性氧产量、细胞毒性及体外声动力治疗效果评价 |
2.5 DIPP-NPs的细胞毒性及体外声动力治疗效果
细胞毒性结果显示(图 4B):4T1细胞与不同浓度DIPP-NPs共培养24 h后,细胞存活率均无明显降低,表明DIPP-NPs具有较高的生物安全性,可进行下一步实验。
体外声动力治疗结果显示(图 4C):仅US组、仅DIPP-NPs组的细胞存活率与阴性对照组比较,差异无统计学意义,表明单纯超声辐照、单纯DIPP-NPs没有明显的细胞毒性;DPP-NPs+US组、IPP-NPs+US组与阴性对照组比较,差异具有统计学意义(P < 0.05),表明DVDMS、IR780介导的SDT抑制了肿瘤细胞的生长;此外,DIPP-NPs+US组与DPP-NPs+US组、IPP-NPs+US组比较,差异具有统计学意义(P < 0.05),表明当DVDMS、IR780联合作用时,SDT作用增强。
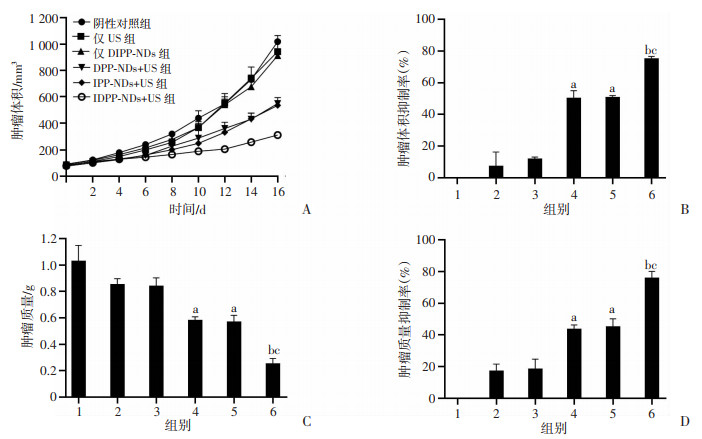
2.6 DIPP-NPs的体内声动力治疗效果阴性对照组、仅US组、仅DIPP-NPs组对肿瘤生长无明显影响,差异不具有统计学意义,表明单纯超声辐照、单纯DIPP-NPs没有明显的抗肿瘤活性;DPP-NPs+US组、IPP-NPs+US组与阴性对照组比较,差异具有统计学意义(P < 0.05),表明DVDMS、IR780介导的SDT抑制了肿瘤的生长;DIPP-NPs+US组与DPP-NPs+US组、IPP-NPs+US组比较,差异具有统计学意义(P < 0.05),表明当DVDMS、IR780联合作用时,SDT作用增强(图 5)。
|
|
1:阴性对照组;2:仅US组;3:仅DIPP-NPs组;4:DPP-NPs+US组;5:IPP-NPs+US组;6:DIPP-NPs+US组;a:P < 0.05,与阴性对照组比较;b:P < 0.05,与DPP-NPs+US组比较;c:P < 0.05,与IPP-NPs+US组比较 A:肿瘤体积变化;B:肿瘤体积抑制率;C:肿瘤质量;D:肿瘤质量抑制率 图 5 DIPP-NPs的体内声动力治疗效果评价(n=3) |
3 讨论
近年来,随着对SDT的深入研究,越来越多的优质声敏剂被发现、合成并应用。DVDMS作为基于光卟啉合成的新一代声敏剂,其化学纯度为98.7%,声活性远高于血卟啉单甲氧醚(HMME)等其他卟啉衍生物,具有水溶性强、皮肤敏感性较短、单线态氧产率高等优点,已获得中国自主知识产权[10-11]。IR780作为具有肿瘤靶向性的经典敏化剂,其靶向性与肿瘤细胞质膜电位相对较高、肿瘤细胞上过表达的有机阴离子转运体多肽(OATPs)有关[12-13]。
受上述研究成果的启发,本研究成功构建复合纳米粒DIPP-NPs。DIPP-NPs的紫外图谱呈现双特征吸收峰,标准曲线法计算得到DVDMS、IR780的包封率分别为(92.84±1.58)%、(96.57±1.48)%,说明DVDMS、IR780成功且有效包载于PLGA纳米粒中。此外,本研究发现DVDMS包载于PLGA纳米粒中发生了红移现象,其紫外特征吸收峰从367 nm左右移动到405 nm,这可能与包载后DVDMS的疏水作用、溶剂极性的变化有关[14]。体外靶向结果表明IR780的主动靶向性、DVDMS的肿瘤聚集效应,使得DIPP-NPs可在肿瘤部位有效聚集。此外,结合肿瘤新生血管内皮间隙为380~780 nm[15-16]、DIPP-NPs的粒径为(341.17±16.97)nm,说明DIPP-NPs也可通过EPR效应聚集于肿瘤部位。敏化剂的有效包载与纳米粒肿瘤部位的有效聚集,为下一步发挥SDT作用奠定了基础。现有研究表明:纳米微泡介导的肿瘤SDT效应涉及多种机制,包括氧自由基损伤作用、超声空化效应、超声靶向肿瘤血管破坏技术等,尽管机制复杂,但活性氧的产生是关键因素之一[17-18]。本研究SOSG体外活性氧检测结果表明DIPP-NPs可在超声辐照下产生活性氧,结合体外细胞存活率的降低、体内肿瘤体积/质量抑制率的提高,均说明DVDMS、IR780介导的SDT抑制了肿瘤的生长,而当两者联合作用时,SDT作用增强。本研究也存在一定的不足,如缺少其他肿瘤模型SDT作用对比研究,且结果尚需进一步体内实验验证。
综上所述,本研究成功构建肿瘤靶向多功能复合纳米粒DIPP-NPs,实现了双敏化剂协同增强SDT作用,为建立高效、安全的肿瘤分子成像与靶向治疗方法提供了新的思路。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
MILLER K D, SIEGEL R L, LIN C C, et al. Cancer treatment and survivorship statistics, 2016[J]. CA Cancer J Clin, 2016, 66(4): 271-289. DOI:10.3322/caac.21349 |
| [3] |
YAN P, LIU L H, WANG P. Sonodynamic therapy (SDT) for cancer treatment: advanced sensitizers by ultrasound activation to injury tumor[J]. ACS Appl Bio Mater, 2020, 3(6): 3456-3475. DOI:10.1021/acsabm.0c00156 |
| [4] |
MCHALE A P, CALLAN J F, NOMIKOU N, et al. Sonodynamic therapy: concept, mechanism and application to cancer treatment[M]//ESCOFFRE J M, BOUAKAZ A. Therapeutic Ultrasound. Cham: Springer International Publishing, 2016.
|
| [5] |
QIAN X, HAN X, CHEN Y. Insights into the unique functionality of inorganic micro/nanoparticles for versatile ultrasound theranostics[J]. Biomaterials, 2017, 142: 13-30. DOI:10.1016/j.biomaterials.2017.07.016 |
| [6] |
LIU Y, BAI L, GUO K, et al. Focused ultrasound-augmented targeting delivery of nanosonosensitizers from homogenous exosomes for enhanced sonodynamic cancer therapy[J]. Theranostics, 2019, 9(18): 5261-5281. DOI:10.7150/thno.33183 |
| [7] |
ZHANG L, YI H, SONG J, et al. Mitochondria-targeted and ultrasound-activated nanodroplets for enhanced deep-penetration sonodynamic cancer therapy[J]. ACS Appl Mater Interfaces, 2019, 11(9): 9355-9366. DOI:10.1021/acsami.8b21968 |
| [8] |
HU J M, WANG X B, ZHANG K, et al. Sinoporphyrin sodium: a novel sensitizer in sonodynamic therapy[J]. Anti-Cancer Drugs, 2014, 25(2): 174-182. DOI:10.1097/CAD.0000000000000031 |
| [9] |
韩鹏, 汪洋, 朱斌. 全氟己烷脂质体纳米粒在超声造影方面价值的实验研究[J]. 现代肿瘤医学, 2018, 26(19): 3038-3042. HAN P, WANG Y, ZHU B. The application assessment of perfluorohexane based liposome nanoparticles on ultrasound enhanced imaging[J]. J Mod Oncol, 2018, 26(19): 3038-3042. DOI:10.3969/j.issn.1672-4992 |
| [10] |
HUANG J, LIU F, HAN X, et al. Nanosonosensitizers for highly efficient sonodynamic cancer theranostics[J]. Theranostics, 2018, 8(22): 6178-6194. DOI:10.7150/thno.29569 |
| [11] |
MAI B, WANG X, LIU Q, et al. The application of DVDMS as a sensitizing agent for sono-/photo-therapy[J]. Front Pharmacol, 2020, 11: 19. DOI:10.3389/fphar.2020.00019 |
| [12] |
TAN X, LUO S, WANG D, et al. A NIR heptamethine dye with intrinsic cancer targeting, imaging and photosensitizing properties[J]. Biomaterials, 2012, 33(7): 2230-2239. DOI:10.1016/j.biomaterials.2011.11.081 |
| [13] |
YUAN A, WU J, TANG X, et al. Application of near-infrared dyes for tumor imaging, photothermal, and photodynamic therapies[J]. J Pharm Sci, 2013, 102(1): 6-28. DOI:10.1002/jps.23356 |
| [14] |
JIANG C, CHENG H, YUAN A, et al. Hydrophobic IR780 encapsulated in biodegradable human serum albumin nanoparticles for photothermal and photodynamic therapy[J]. Acta Biomater, 2015, 14: 61-69. DOI:10.1016/j.actbio.2014.11.041 |
| [15] |
何雨蓓, 郝兰, 李倩茹, 等. 基于酞菁铁的靶向乳腺癌纳米粒多模态成像和光热效应的实验研究[J]. 第三军医大学学报, 2020, 42(8): 772-782. HE Y B, HAO L, LI Q R, et al. Multimodal imaging and photothermal effect of targeted breast cancer nanoparticles based on iron phthalocyanine[J]. J Third Mil Med Univ, 2020, 42(8): 772-782. DOI:10.16016/J.1000-5404.201911260 |
| [16] |
MAEDA H, NAKAMURA H, FANG J. The EPR effect for macromolecular drug delivery to solid tumors: Improvement of tumor uptake, lowering of systemic toxicity, and distinct tumor imaging in vivo[J]. Adv Drug Deliv Rev, 2013, 65(1): 71-79. DOI:10.1016/j.addr.2012.10.002 |
| [17] |
YANG W, XU H T, LIU Q H, et al. 5-Aminolevulinic acid hydrochloride loaded microbubbles-mediated sonodynamic therapy in pancreatic cancer cells[J]. Artif Cells Nanomed Biotechnol, 2020, 48(1): 1178-1188. DOI:10.1080/21691401.2020.1813743 |
| [18] |
PAN X, WANG H, WANG S, et al. Sonodynamic therapy (SDT): a novel strategy for cancer nanotheranostics[J]. Sci China Life Sci, 2018, 61(4): 415-426. DOI:10.1007/s11427-017-9262-x |




