类鼻疽伯克霍尔德菌(简称类鼻疽菌,Burkholderia pseudomallei)是一种革兰阴性杆菌,属于伯克霍尔德菌属。类鼻疽菌感染所致疾病称为类鼻疽(Melioidosis),是一种热带医学传染病,主要流行于东南亚及澳大利亚北部,而我国的海南、香港、台湾等地也是重要的疫区[1-3]。类鼻疽临床表现复杂多变,似“百样病”,多数急重症患者可快速进展为败血症和多脏器脓肿,死亡率高达40%[1]。再加上类鼻疽菌潜在的生物危害性,美国疾病预防控制中心将其列为类鼻疽Ⅰ类生物恐怖剂严加防范[4]。因此,加强类鼻疽菌致病机制及防控关键技术的研究具有重要的军事意义和社会价值。
线粒体是真核细胞内重要的代谢调节器,在凋亡、自噬、焦亡等多种细胞信号通路中发挥重要调控作用[5]。由于线粒体在生命活动中的关键作用,维持线粒体稳态至关重要,而多种应激刺激(如缺氧、饥饿以及病原体入侵等)所造成的细胞内环境压力均能导致线粒体稳态破坏,引起线粒体结构或功能障碍,通常表现为线粒体形态结构破坏、线粒体膜电位降低、ATP合成减少等。线粒体稳态破坏是诱发线粒体自噬的前提,而线粒体自噬是一种选择性自噬,是指自噬小体包裹受损、老化、功能异常的线粒体并与溶酶体融合,再由溶酶体降解线粒体的过程。因此,线粒体自噬是宿主细胞内调控内环境稳态的一个重要作用机制[6]。近年来,越来越多的研究表明线粒体自噬在感染性疾病发生、发展中具有重要调控作用,有研究表明病原体(尤其是胞内菌)可以通过胁迫宿主细胞线粒体自噬达到免疫逃逸的目的。笔者所在课题组长期围绕类鼻疽菌如何逃逸宿主免疫清除开展研究工作,前期研究发现类鼻疽菌作为一种胞内感染病原体,利用多种手段及途径逃避宿主免疫清除[7-8],本实验以类鼻疽菌感染人单核细胞THP-1为模型,初步探讨线粒体自噬在类鼻疽菌胞内生存中的作用,为阐明类鼻疽菌胞内持续性感染的致病机制提供新的线索。
1 材料与方法 1.1 菌株、细胞及主要试剂类鼻疽菌BPC006菌株由本室鉴定并保存,THP-1细胞由陆军军医大学病原生物学教研室徐文岳教授惠赠,GFP-LC3质粒由日本大阪大学细胞生物系Tamotsu Yoshimori教授惠赠。MitoTrackerTM Red CMXRos、CCCP、AlexaFluor405标记山羊抗兔、AlexaFluor555标记山羊抗鼠、LipofectamineTM 3000、2-巯基乙醇均购自InvitrogenⅡ公司,TMRM、DAPI、Mdivi-1、PMA均购自Sigma公司,ATP检测试剂盒、抗体HSP60、BeyoECL Plus试剂盒、4%多聚甲醛、卡那霉素购自上海碧云天公司。TIM23抗体购自BD公司,MiniBEST Universal Genomic DNA Extraction Kit、TB GreenTM Premix Ex TaqTM Ⅱ均购自TaKaRa公司,GAPDH抗体、辣根过氧化物酶标记山羊抗鼠IgG、辣根过氧化物酶标记山羊抗兔IgG购自CST公司,RPMI1640培养基、胎牛血清购自Gibco公司。
1.2 透射电镜(transmission electron microscope, TEM)THP-1细胞培养于含有10%胎牛血清和0.05 mmol/L 2-巯基乙醇的RPMI1640完全培养基中,37 ℃、5% CO2孵箱中培养。在感染前,用终浓度为100 ng/mL PMA刺激THP-1细胞48 h,诱导其分化为巨噬细胞后进行后续实验。设置未感染组和细菌感染组(2 h),挑取单克隆阳性BPC006菌落摇瓶培养过夜,按照感染复数MOI=10加入菌液,共孵育1 h后,弃掉培养基,PBS洗细胞3次,加入预热好的含250 μg/mL卡那霉素的完全1640培养基,继续培养1 h,收集细胞样品,固定后送至本校生物医学测试中心透射电镜室,经过脱水、包埋、超薄切片后在透射电镜下观察线粒体形态。
1.3 TMRM检测线粒体膜电位设置未感染组和细菌感染组(2、4、6 h),具体感染方法同上,用100 nmol/L TMRM对细胞染色30 min,PBS漂洗3次,收集细胞至1.5 mL离心管中待流式细胞仪(BD)上样分析细胞膜电位。
1.4 ATP含量检测设置未感染组和细菌感染组(2、4、6 h),加入ATP裂解液裂解细胞。将标准溶液稀释为0.01、0.03、0.1、0.3、1、3和10 μmol/L以测定标准曲线,将检测工作液加至96孔板中,再加入样品或标准品,用全波长酶标仪测定RLU值,根据标准曲线计算细胞内ATP浓度。
1.5 Western blot实验设置未感染组和细菌感染组(2、4、6 h),提取各组蛋白并用BCA法测定蛋白浓度,加入5×loading buffer和PBS调节蛋白浓度一致后放入金属浴加热变性,-20 ℃暂存。取10 μL样品进行SDS-PAGE电泳,半干转法转至PVDF膜,室温封闭1 h后与一抗4 ℃孵育过夜。次日,TBST洗3遍,室温孵育二抗1 h,TBST清洗3遍,BeyoECL Plus室温孵育1 min,化学发光分子成像仪(Bio-Rad)曝光成像。
1.6 Quantitative real time polymerase chain reaction (Q-PCR)检测mtDNA表达水平变化设置未感染组和细菌感染组(2、4、6 h),用核酸提取试剂盒提取DNA,并测定DNA浓度,于-80 ℃储存。SYBR Green荧光PCR反应总体积为20 μL,反应条件为95 ℃预变性1 min;95 ℃变性5 s,60 ℃退火30 s,75 ℃延伸30 s,共40个循环。序列mtCO1-1:上游5′-CAGGAGTAGGAGAGAGGGAGGTAAG-3′,下游5′-TA-CCCATCATAATCGGAGGCTTTGG-3′, RPL13A:上游5′-CGCCCTACGACAAGAAAAAG-3′,下游5′-CCGTA-GCCTCATGAGCTGTT-3′。
1.7 免疫荧光实验将3×105个/孔细胞接种到已放入无菌细胞爬片的12孔细胞培养板中,根据实验设计进行如下处理:①MitoTrackerTM Red CMXRos染色:分别设置未感染组和细菌感染组(2 h),用100 nmol/L染料染色30 min,固定透膜后用0.1 μg/mL的DAPI染核,PBS漂洗后封片,放于避光湿盒4 ℃保存。结果由激光共聚焦显微镜(Zeiss)进行采集。②线粒体与自噬小体共聚观察:分别设置未感染组和细菌感染组(6 h),转染GFP-LC3质粒24 h后感染,然后固定、透膜,按1∶500比例稀释TIM23一抗,4 ℃孵育过夜;次日,按1 ∶1 000比例稀释AlexaFluor555二抗,室温孵育1 h,加入1 ∶200稀释的类鼻疽菌兔抗血清室温孵育1 h,再1 ∶1 000比例稀释的AlexaFluor405二抗,室温孵育1 h,DAPI染色,以上每一步染色后均用PBS清洗3遍,最后用抗荧光淬灭剂封片。激光共聚焦显微镜观察,每个片子随机挑选3个视野,共计观察50个细胞,计数线粒体与自噬小体共定位的细胞数。
1.8 细菌胞内生存实验分别设置DMSO(对照组)、CCCP组、Mdivi-1组,感染前2 h加入DMSO、10μmol/L CCCP、20 μmol/L Mdivi-1预处理THP-1细胞,感染前更换新鲜培养液,感染具体方法同上,到达各感染时间点(2、4、6 h)后用PBS洗涤3次,加入0.1% TritonX-100裂解细胞,倍比稀释菌液后取10 μL稀释液或原液涂布于LB平板上,37 ℃培养36 h后进行菌落计数。
1.9 统计学分析实验均独立重复3次,数据以x±s表示,利用SPSS 19.0和GraphPad Prism 7.0统计软件进行分析,两组间样本比较采用独立样本t检验,检验水准:α=0.05。
2 结果 2.1 类鼻疽菌感染THP-1细胞后引起宿主细胞内线粒体损伤 2.1.1 线粒体形态的变化使用透射电镜和激光共聚焦观察类鼻疽菌感染THP-1细胞后线粒体的形态,如图 1A所示,透射电镜结果显示未感染组细胞的线粒体内外双层膜结构完整,可见线粒体嵴样结构,形态结构清晰;而感染组线粒体嵴样结构错乱并消失,出现空泡样结构,并且线粒体肿胀明显,部分线粒体膜溶解。激光共聚焦结果(图 1B)显示未感染组的线粒体呈红色管状或丝状,舒展地分布在核周;感染组的线粒体呈断裂、浓点状,线粒体分布不均,荧光强度深浅不一。
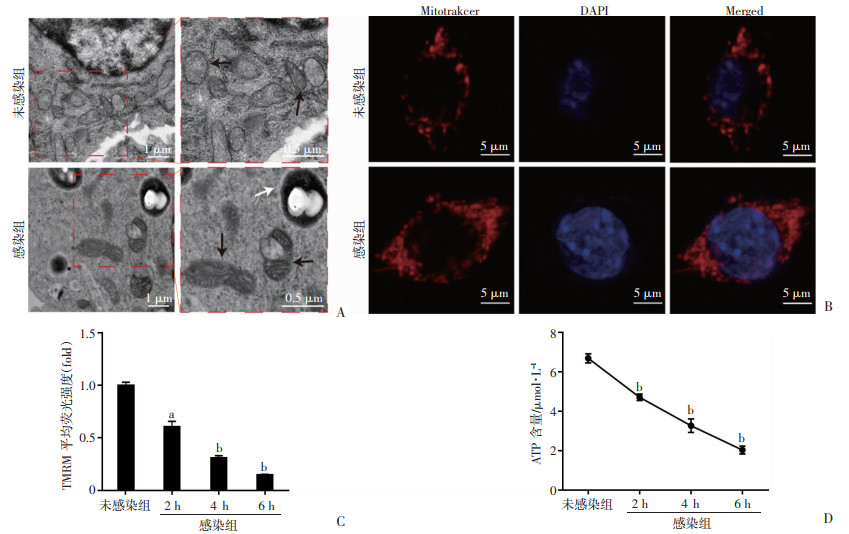
|
| A:透射电镜观察类鼻疽菌感染2 h后线粒体形态的变化黑色箭头表示线粒体,白色箭头表示类鼻疽菌;B:激光共聚焦显微镜观察类鼻疽菌感染2 h后线粒体形态和分布变化红色表示线粒体,蓝色表示细胞核;C:流式细胞仪检测类鼻疽菌感染不同时间线粒体膜电位变化;D: 类鼻疽菌感染不同时间细胞内ATP含量变化;a: P < 0.05, b: P < 0.01,与未感染组比较 图 1 类鼻疽菌感染引起线粒体结构和功能受损 |
2.1.2 线粒体功能的变化
采用流式细胞仪检测线粒体膜电位和全波长酶标仪检测胞内ATP含量,结果显示,与未感染组相比,感染组线粒体膜电位和胞内ATP含量均明显降低(均P < 0.05,图 1C、D),且呈时间递减趋势。
以上结果说明类鼻疽菌感染THP-1细胞后引起了宿主细胞线粒体结构和功能受损。
2.2 类鼻疽菌感染THP-1细胞后诱导宿主细胞内线粒体自噬的发生为了探索类鼻疽菌感染引起的线粒体损伤后是否诱导线粒体自噬的发生,采用Western blot和Q-PCR分别检测线粒体蛋白(HSP60、TIM23)和线粒体DNA(mtCO1)在感染后表达水平的变化,并通过激光共聚焦观察线粒体蛋白和自噬小体的共定位。
2.2.1 Western blot检测线粒体蛋白(HSP60、TIM23)结果如图 2A所示,与未感染组相比,类鼻疽菌感染THP-1细胞后线粒体基质蛋白HSP60和线粒体内膜蛋白TIM23表达减少,并随着感染时间的延长呈时间递减趋势。
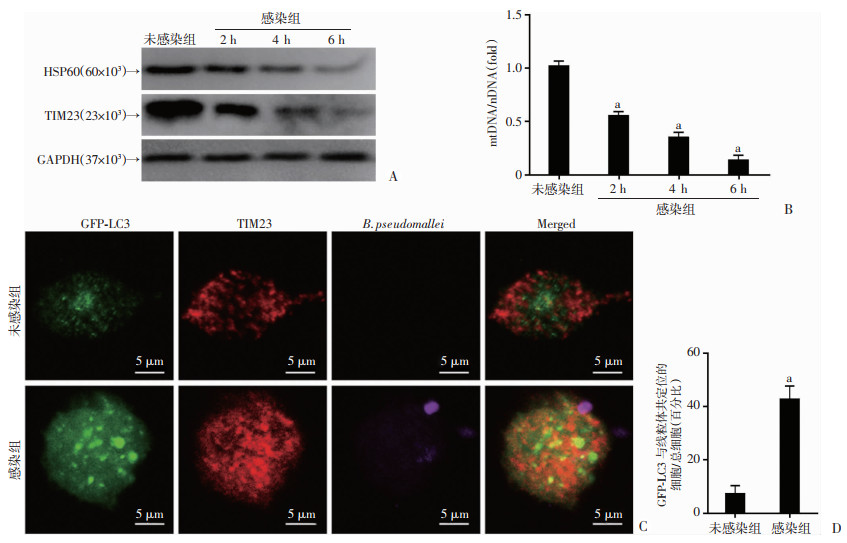
|
|
A:Western blot检测未感染组和类鼻疽菌感染组线粒体蛋白HSP60和TIM23的表达变化;B:Q-PCR检测未感染组和类鼻疽菌感染组线粒体DNA(mtCO1)变化;C:激光共聚焦观察感染前后线粒体蛋白与自噬小体共定位变化 绿色荧光表示GFP-LC3,红色荧光表示线粒体蛋白TIM23,紫红色表示类鼻疽菌;D:线粒体与自噬小体共定位细胞数的百分比;a: P < 0.01,与未感染组比较 图 2 类鼻疽菌感染后诱导线粒体自噬 |
2.2.2 Q-PCR检测线粒体DNA(mtCO1)结果
如图 2B所示,与未感染组相比,类鼻疽菌感染后宿主细胞线粒体基因mtCO1表达减少,并随着感染时间的延长呈时间递减趋势(P < 0.01)。
2.2.3 激光共聚焦观察线粒体蛋白和自噬小体的共定位结果如图 2C所示,与未感染组比,感染组中红色荧光标记的线粒体蛋白TIM23与绿色荧光标记的LC3小体共定位明显增多(P < 0.01)。表明类鼻疽菌感染THP-1细胞后诱导宿主细胞线粒体自噬的发生。
2.3 激活线粒体自噬有利于类鼻疽菌的胞内存活为了探究线粒体自噬对类鼻疽菌胞内增殖的作用,分别用线粒体自噬激活剂CCCP或抑制剂Mdivi-1预处理THP-1细胞2 h,细菌胞内生存实验分析线粒体自噬改变对类鼻疽菌胞内存活的影响。如图 3所示,与DMSO处理的对照组相比,在不同感染时间点(2、4、6 h)激活线粒体自噬类鼻疽菌胞内细菌计数均增多(P < 0.05),而抑制线粒体自噬类鼻疽菌胞内细菌计数均减少(P < 0.05)。以上结果提示类鼻疽菌感染THP-1细胞后诱导线粒体自噬,从而有利于类鼻疽菌的胞内存活。
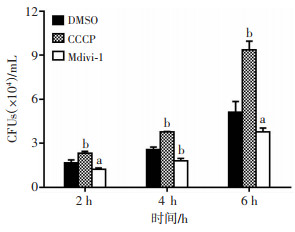
|
| a: P < 0.05, b: P < 0.01,与DMSO比较 图 3 诱导或抑制线粒体自噬对类鼻疽菌胞内生存的影响 |
3 讨论
病原菌与宿主的相互作用是决定其感染和致病的前提。作为一种胞内病原体,类鼻疽菌入侵宿主细胞后立即被吞噬囊泡所包裹,随后类鼻疽菌通过自身效应蛋白逃逸吞噬囊泡并在宿主胞质中复制和播散[9-11]。因此,如何逃避宿主胞质免疫清除是类鼻疽菌成功建立感染的关键环节。另一方面,宿主主要通过3种方式在胞质中抵御细菌感染:先天免疫系统识别“异己成分”激活免疫信号通路;产生活性氧杀菌;启动自噬途径清除胞内菌[10]。已有研究表明类鼻疽菌可通过操纵细菌蛋白减轻宿主杀菌反应,但目前相关研究报道较少,需要继续深入探讨类鼻疽菌的致病机制为将来开发新的防治策略提供重要理论指导[12-15]。
线粒体不仅是真核细胞的能量工厂,而且在宿主先天免疫应答中也具有重要作用。线粒体受到应激刺激时,线粒体膜通透性改变,线粒体产生的副产物释放到胞质中作为损伤相关分子被多个模式识别受体识别并促发先天免疫反应[16]。同时,研究表明线粒体还是调控多种炎症通路的重要中间平台[17]。由此可见,线粒体与宿主免疫反应存在着非常密切的关系。另外,越来越多的研究显示线粒体成为病原体影响宿主内环境稳态的操纵靶标之一,如霍乱弧菌蛋白VopE可以直接与线粒体外膜蛋白作用,扰乱线粒体动力学干扰先天免疫反应的信号传导[18];脑膜炎奈瑟菌入侵宿主后分泌外膜囊泡靶向线粒体并释放PorB引起线粒体膜电位的丧失[19]。本实验通过建立类鼻疽菌感染人THP-1细胞模型,观察到类鼻疽菌感染后宿主细胞线粒体形态和功能受到损伤,表明类鼻疽菌入侵造成的环境压力导致宿主细胞线粒体功能障碍。
病原体入侵所造成的线粒体稳态失衡是线粒体自噬触发的重要信号,已有研究表明病原体可以通过诱导宿主细胞线粒体自噬来调控多种细胞信号通路的转导,进而逃逸宿主免疫清除,帮助其胞内存活来达到持续性感染的目的[20]。文献[21]报道呼吸道合胞病毒通过诱导线粒体自噬减轻细胞色素酶C的释放以及抑制细胞凋亡;JABIR等[22]发现铜绿假单胞菌通过激活线粒体自噬减轻NLRC4引起的炎症反应,进一步研究表明,铜绿假单胞菌的CRISPR-Cas系统调节自身毒力从而诱导宿主线粒体自噬进而造成宿主长期慢性感染[23];中国科学院钱友存团队也发现单核细胞增生李斯特菌(简称李斯特菌)通过诱导非经典途径的线粒体自噬实现免疫逃逸,首次提出了线粒体自噬在胞内病原菌感染免疫过程中的作用机制[24]。类鼻疽菌与李斯特菌都属于胞内感染病原体,两者在宿主细胞中的生活周期非常相似,而目前尚未有线粒体功能改变在类鼻疽菌持续性感染致病机制中的研究报道。本研究显示,类鼻疽菌感染宿主细胞后诱导线粒体自噬的发生,而激活宿主细胞线粒体自噬有利于类鼻疽菌的胞内生存。这一发现拓展了类鼻疽菌与宿主细胞相互作用的已有研究发现,提出了类鼻疽菌可能通过胁迫宿主细胞器建立感染的新观点。因此,进一步明确类鼻疽菌如何诱导宿主细胞线粒体自噬的具体分子机制以及线粒体自噬与宿主免疫反应之间的关系,不仅对阐明类鼻疽菌致病机制具有重要意义,而且具有潜在的治疗应用前景。
综上,本研究发现类鼻疽菌感染宿主细胞诱导线粒体自噬的发生,阐明了线粒体自噬对类鼻疽菌胞内存活的作用,拟在后续研究中重点探讨类鼻疽菌、线粒体自噬、宿主免疫三者之间的相互作用和具体分子机制,以期揭示类鼻疽菌新的致病机制,为将来制定类鼻疽菌的防治手段提供重要理论依据。
| [1] |
LIMMATHUROTSAKUL D, GOLDING N, DANCE D A, et al. Predicted global distribution of Burkholderia pseudomallei and burden of melioidosis[J]. Nat Microbiol, 2016, 1(1): 15008. DOI:10.1038/nmicrobiol.2015.8 |
| [2] |
MERRITT A J, INGLIS T J J. The role of climate in the epidemiology of melioidosis[J]. Curr Trop Med Rep, 2017, 4(4): 185-191. DOI:10.1007/s40475-017-0124-4 |
| [3] |
LUI G, TAM A, TSO E Y K, et al. Melioidosis in Hong Kong[J]. Trop Med Infect Dis, 2018, 3(3): 91. DOI:10.3390/tropicalmed3030091 |
| [4] |
WILLIAMSON C H D, WAGNER D M, KEIM P, et al. Developing inclusivity and exclusivity panels for testing diagnostic and detection tools targeting Burkholderia pseudomallei, the causative agent of melioidosis[J]. J AOAC Int, 2018, 101(6): 1920-1926. DOI:10.5740/jaoacint.18-0014 |
| [5] |
MILANE L, TRIVEDI M, SINGH A, et al. Mitochondrial biology, targets, and drug delivery[J]. J Control Release, 2015, 207: 40-58. DOI:10.1016/j.jconrel.2015.03.036 |
| [6] |
YOO S M, JUNG Y K. A molecular approach to mitophagy and mitochondrial dynamics[J]. Mol Cells, 2018, 41(1): 18-26. DOI:10.14348/molcells.2018.2277 |
| [7] |
HU Z Q, RAO C L, TANG M L, et al. Rab32 GTPase, as a direct target of miR-30b/c, controls the intracellular survival of Burkholderia pseudomallei by regulating phagosome maturation[J]. PLoS Pathog, 2019, 15(6): e1007879. DOI:10.1371/journal.ppat.1007879 |
| [8] |
TANG M, HU Z Q, RAO C L, et al. Burkholderia pseudomallei interferes with host lipid metabolism via NR1D2-mediated PNPLA2/ATGL suppression to block autophagy-dependent inhibition of infection[J]. Autophagy, 2020, 1-16. DOI: 10.1080/15548627.2020.1801270.[Onlineaheadofprint].
|
| [9] |
BALDER R, LIPSKI S, LAZARUS J J, et al. Identification of Burkholderia mallei and Burkholderia pseudomallei adhesins for human respiratory epithelial cells[J]. BMC Microbiol, 2010, 10(1): 1-19. DOI:10.1186/1471-2180-10-250 |
| [10] |
WIERSINGA W J, VIRK H S, TORRES A G, et al. Melioidosis[J]. Nat Rev Dis Primers, 2018, 4: 17108. DOI:10.1038/nrdp.2017.108 |
| [11] |
RAY K, MARTEYN B, SANSONETTI P J, et al. Life on the inside: the intracellular lifestyle of cytosolic bacteria[J]. Nat Rev Microbiol, 2009, 7(5): 333-340. DOI:10.1038/nrmicro2112 |
| [12] |
VANAPORN M, WAND M, MICHELL S L, et al. Superoxide dismutase C is required for intracellular survival and virulence of Burkholderia pseudomallei[J]. Microbiology (Reading), 2011, 157(Pt 8): 2392-2400. DOI:10.1099/mic.0.050823-0 |
| [13] |
WILLCOCKS S J, DENMAN C C, ATKINS H S, et al. Intracellular replication of the well-armed pathogen Burkholderia pseudomallei[J]. Curr Opin Microbiol, 2016, 29: 94-103. DOI:10.1016/j.mib.2015.11.007 |
| [14] |
KRAKAUER T. Inflammasomes, autophagy, and cell death: the trinity of innate host defense against intracellular bacteria[J]. Mediat Inflamm, 2019, 2019: 2471215. DOI:10.1155/2019/2471215 |
| [15] |
CHIENG S, MOHAMED R, NATHAN S. Transcriptome analysis of Burkholderia pseudomallei T6SS identifies Hcp1 as a potential serodiagnostic marker[J]. Microb Pathog, 2015, 79: 47-56. DOI:10.1016/j.micpath.2015.01.006 |
| [16] |
BANOTH B, CASSEL S L. Mitochondria in innate immune signaling[J]. Transl Res, 2018, 202: 52-68. DOI:10.1016/j.trsl.2018.07.014 |
| [17] |
MEYER A, LAVERNY G, BERNARDI L, et al. Mitochondria: an organelle of bacterial origin controlling inflammation[J]. Front Immunol, 2018, 9: 536. DOI:10.3389/fimmu.2018.00536 |
| [18] |
SUZUKI M, DANILCHANKA O, MEKALANOS J J. Vibrio cholerae T3SS effector VopE modulates mitochondrial dynamics and innate immune signaling by targeting Miro GTPases[J]. Cell Host Microbe, 2014, 16(5): 581-591. DOI:10.1016/j.chom.2014.09.015 |
| [19] |
RAMOND E, JAMET A, COUREUIL M, et al. Pivotal role of mitochondria in macrophage response to bacterial pathogens[J]. Front Immunol, 2019, 10: 2461. DOI:10.3389/fimmu.2019.02461 |
| [20] |
CHO D H, KIM J K, JO E K. Mitophagy and innate immunity in infection[J]. Mol Cells, 2020, 43(1): 10-22. DOI:10.14348/molcells.2020.2329 |
| [21] |
LI M, LI J, ZENG R, et al. Respiratory syncytial virus replication is promoted by autophagy-mediated inhibition of apoptosis[J]. J Virol, 2018, 92(8). DOI:10.1128/JVI.02193-17 |
| [22] |
JABIR M S, HOPKINS L, RITCHIE N D, et al. Mitochondrial damage contributes to Pseudomonas aeruginosa activation of the inflammasome and is downregulated by autophagy[J]. Autophagy, 2015, 11(1): 166-182. DOI:10.4161/15548627.2014.981915 |
| [23] |
WU Q, WANG B, ZHOU C, et al. Bacterial Type Ⅰ CRISPR-Cas systems influence inflammasome activation in mammalian host by promoting autophagy[J]. Immunology, 2019, 158(3): 240-251. DOI:10.1111/imm.13108 |
| [24] |
ZHANG Y, YAO Y, QIU X, et al. Listeria hijacks host mitophagy through a novel mitophagy receptor to evade killing[J]. Nat Immunol, 2019, 20(4): 433-446. DOI:10.1038/s41590-019-0324-2 |




