肝移植是终末期肝病的有效治疗手段,但肝源长期供不应求[1]。近年来各移植中心尝试放宽接纳标准以扩大捐献池,但这可能导致供肝质量参差不齐[2],与供肝质量高度相关的诸如早期移植物功能障碍(early allograft dysfunction, EAD)等术后并发症亦将是棘手的难题[3]。EAD发病率从10.8%到36.3%不等[4]。罹患EAD的受体死亡风险增加10.7倍,供肝功能丧失风险增加7.4倍[5],急慢性排斥反应、败血症等发生率也随之升高,受体远期预后不良[6-7]。如何最好地利用质量相对较差的供肝是一个值得探讨的课题[8-9]。对供肝质量的精准评估有助于指导移植医师制定择用决策、预判受体转归,尽早实施有效的医疗干预。因此,探索可有效反映供肝质量的生物标记物意义重大。
1 材料与方法 1.1 肝移植受体临床资料本次观察性临床研究的病例纳入标准如下:受体首次接受同种异体肝移植术;手术方式为原位肝移植;年龄介于18到65岁;术前1周无重症感染、心脑血管相关不良事件及肝肾综合征;术后治疗方案一致;供肝经本移植中心器官获取组织(organ procurement organizations, OPO)成员经验性评估合格,保存方式为静态冷保存,运输过程中未受损伤和污染。排除标准如下:受体术后1周内发生血管栓塞事件(肝动脉、门静脉、下腔静脉)、心脑血管不良事件、SIRS/ARDS/MODS以及重症感染,需行肾脏替代治疗或体外循环支持治疗;受体术后发生急性器官排斥反应或药物性肝损伤;多脏器联合移植。研究过程中共计3例因术后血管并发症、围术期重症感染和死亡被排除,最终入组2018年6月至2020年8月在我院行肝移植术的100个病例。供肝均是公民自愿捐献,供体直系亲属和受体签署知情同意书,并经陆军军医大学第一附属医院伦理委员会批准(KY20200029)。我们在研究期间未获取死刑犯器官,未纳入弱势群体。供肝获取和肝移植手术步骤参照2019版中国肝移植供肝获取技术规范和中国成人活体肝移植操作规范执行[10-11]。
1.2 实验步骤采集供肝获取时标本:器官获取时在供肝边缘剪取绿豆样大小肝组织2粒,1粒在离体后立即过液氮1 min并置于-80 ℃医用低温箱冻存待代谢组学分析,另1粒在离体后立即置于10倍于组织体积的10%中性福尔马林液中固定待组织病检。在供肝再灌注后1小时用相同方法采集保存再灌注后标本。记录A、B两组标本采集时间并将标本编号存放。试验人员用人溶血磷脂酰胆碱酶联免疫分析ELISA试剂盒(http://www.mmbio.cn) 对标本中的溶血磷脂酰胆碱组织浓度进行检测。病理科医师对标本进行HE染色观察,并参考SUZUKI标准[12],从实质细胞水肿、坏死、中性粒细胞浸润、胆汁淤积、脂肪化、纤维化6个方面对供肝进行评分:每一项指标按无、轻中度、重度分别赋值0、1、2分,总分取值范围0~12分,0~2分视为正常形态,3~4分为轻度损伤,5~8分为中度损伤,9~12分为重度损伤(详细实验步骤及病理形态学评分表见附件1-4)。研究为单盲设计,实验室人员和病理科医师均不知道标本对应的受体术后临床结局。按是否发生EAD为观察终点将入组病例分为EAD组和非EAD组进行对比分析:受体基线资料中,无吸烟史、饮酒史者分类记为0,小于20年者分类记为1,大于等于20年者分类记为2。根据Olthoff的标准定义[13],满足下列其中一项即可定义为EAD:受体术后第7天胆红素≥170 mol/L或INR≥1.6;术后7 d内ALT/AST峰值≥2 000 U/L。
1.3 统计学分析统计分析软件为SPSS 22.0 (IBM, Armonk, New York, United States) 和package of rms in R 3.3.0 for Windows。分类自变量比较采用χ2检验或Fisher精确检验,连续自变量先经直方图观察和K-S分析检验数据分布的正态性,正态分布的用( x±s)表示,用两组独立样本的t检验;不符合正态分布的用M(P75-P25)表示,使用Mann-Whitney U检验进行比较。用ROC曲线分析连续型变量的预测效能。回归模型构建时,随机抽取75%的样本作为建模集,用其余的25%的样本作为验证集进行验证。在模型验证中,用建模集构建的回归系数构建回归表达式,在验证集中计算出预测值,之后用预测值与实测值之差作为残差,用公式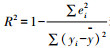
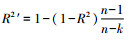
文中所有数据来源于实验室标本检测结果和临床医疗记录。我们通过严格的质量保证策略对所有标本进行收集、保存和分析,并实时监测仪器的性能和数据质量。
2 结果 2.1 受体围术期一般临床资料入组病例中36例术后发生EAD,发病率为36%。受体围术期基线资料详见表 1。由表中数据可知,非EAD组与EAD组中,受体血型、手术时长、供肝冷缺血时间差异有统计学意义,其余术前临床数据均无显著差异。而在用于诊断EAD的3个指标中,只有转氨酶峰值一项差异有统计学意义。
| 非EAD组(n=64) | EAD组(n=36) | 统计参数 | P值 | ||
| 性别 | 男性 | 55 | 28 | χ2=1.087 | 0.297 |
| 女性 | 9 | 8 | |||
| 心血管疾病 | 无 | 58 | 30 | χ2=0.572 | 0.449 |
| 有 | 6 | 6 | |||
| 呼吸系统疾病 | 无 | 63 | 35 | — | 1.000 |
| 有 | 1 | 1 | |||
| 糖尿病 | 无 | 53 | 33 | χ2=1.500 | 0.221 |
| 有 | 11 | 3 | |||
| ABO血型 | A | 18 | 19 | χ2=9.256 | 0.025 |
| B | 14 | 4 | |||
| AB | 11 | 1 | |||
| O | 21 | 12 | |||
| 吸烟史 | 无 | 34 | 20 | χ2=0.392 | 0.822 |
| < 20年 | 12 | 5 | |||
| ≥20年 | 18 | 11 | |||
| 饮酒史 | 无 | 44 | 26 | χ2=1.240 | 0.538 |
| < 20年 | 6 | 5 | |||
| ≥20年 | 14 | 5 | |||
| 慢性乙肝病史 | 无 | 20 | 7 | χ2=3.221 | 0.200 |
| < 20年 | 15 | 6 | |||
| ≥20年 | 29 | 23 | |||
| 慢性丙肝病史 | 无 | 20 | 7 | χ2=0.219 | 0.640 |
| < 20年 | 15 | 6 | |||
| ≥20年 | 29 | 23 | |||
| 术前腹水情况 | 无 | 35 | 19 | U=1 043.5 | 0.389 |
| 可控 | 17 | 4 | |||
| 难控 | 12 | 13 | |||
| 术前肝性脑病 | 无 | 60 | 31 | χ2=1.883 | 0.343 |
| 轻度 | 3 | 3 | |||
| 中重度 | 1 | 2 | |||
| 年龄/岁 | 50(41-57) | 54(43-59) | U=1 022.5 | 0.352 | |
| BMI/kg·m-2 | 22.60±3.71 | 23.37±2.93 | U=917.5 | 0.092 | |
| 术前肌酐/μmoI·L-1 | 62.50(55.25-78.00) | 64.50(51.00-77.75) | U=1 124.5 | 0.843 | |
| 术前血钠/mmol·L-1 | 139.00(137.00-140.75) | 140(137-142) | U=1 032.5 | 0.389 | |
| 术前ALT/U·L-1 | 34(27-56) | 41.50(24.25-84.75) | U=1 031.0 | 0.385 | |
| 术前AST/U·L-1 | 47.00(32.00-56.75) | 46.50(32.75-101.25) | U=999.5 | 0.273 | |
| 术前ALB/g·L-1 | 37.470±7.089 | 37.250±6.398 | t=0.153 | 0.878 | |
| 术前TB/μmoI·L-1 | 35.00(20.50-72.25) | 40.00(20.00-322.75) | U=1 032.5 | 0.391 | |
| 术前INR | 1.215(1.030-1.420) | 1.170 0(1.027 5-1.562 5) | U=1 139.5 | 0.928 | |
| MELD评分 | 11(8-16) | 11.00(8.25-23.00) | U=1 108.0 | 0.751 | |
| ChildPugh评分 | 7.00(5.25-8.00) | 7(6-9) | U=1 035.0 | 0.393 | |
| 术中出血量/mL | 1 000(600-195 0) | 800(600-1 500) | U=1 083.500 | 0.621 | |
| 术中尿量/mL | 1 500(100 0-200 0) | 1 820±777 | U=928.000 | 0.107 | |
| 手术时长/min | 465.190±100.471 | 586.86±167.68 | t′=-3.971 | 0.000 | |
| 冷缺血时间/min | 306.250±82.155 | 477.00(447.25-534.50) | U=10 | 0.000 | |
| 无肝期/min | 88.360±10.136 | 90.33±7.84 | t′=-1.084 | 0.281 | |
| 术后第7天转氨酶峰值/U·-1 | 949.50(721.75-1 223.50) | 2 588.00(2 250.25-3113.75) | U=46.000 | 0.000 | |
| 术后第7天TB值/μmoI·-1 | 31.00(22.25-49.25) | 41.00(24.00-77.75) | U=959.500 | 0.167 | |
| 术后第7天INR值 | 1.060 0(1.010 0-1.177 5) | 1.060 0(0.990 0-1.177 5) | U=1 145.000 | 0.960 |
2.2 供肝组织标本病理形态学评分
供肝获取时供肝组织病理形态学评分范围在0-2分,基本表现为正常的镜下病理学形态;再灌注后供肝组织病理形态学评分虽高于供肝获取时,但也仅仅表现为轻中度损伤。两个时间点的标本中,EAD组病理形态学评分均高于非EAD组,有统计学差异,但同样只局限于轻中度损伤,见表 2。
| 分组 | n | 供肝获取时 | 再灌注后 | |||||||
| 0分 | 1分 | 2分 | 1分 | 2分 | 3分 | 4分 | 5分 | |||
| 非EAD组 | 64 | 50 | 14 | 0 | 7 | 32 | 22 | 3 | 0 | |
| EAD组 | 36 | 13 | 21 | 2 | 0 | 0 | 8 | 23 | 5 | |
| 统计参数 | U=654.0 | U=146.5 | ||||||||
| P值 | 0 | 0 | ||||||||
2.3 溶血磷脂酰胆碱组织浓度检测结果
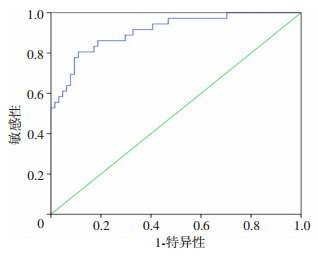
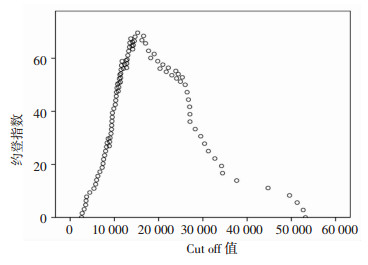
再灌注后溶血磷脂酰胆碱组织浓度均高于供肝获取时。再灌注后标本中,EAD组溶血磷脂酰胆碱组织浓度均显著高于非EAD组(P < 0.05),见表 3。ROC曲线分析显示,再灌注后溶血磷脂酰胆碱组织浓度对EAD的发生具有良好预测价值(AUC=0.909, 95%CI:0.849~0.969, 图 1)。以最大约登指数(0.696)确定的cut-off值为15 258 fg/mg(图 2)。这提示溶血磷脂酰胆碱组织浓度可以作为EAD发生的较好替代终点,溶血磷脂酰胆碱可视为反映供肝质量的生物标记物。
| 分组 | n | 供肝获取时 | 再灌注后 |
| 非EAD组 | 64 | 7 023.03±3 540.40 | 10 910.38±4 931.27 |
| EAD组 | 36 | 11 173.72±5 038.10 | 26 107.39±11 839.46 |
| P值 | 0.000 | 0.000 |
|
| 图 1 再灌注后LPC组织浓度对EAD发生预测的ROC曲线分析 |
|
| 图 2 不同的再灌注后LPC浓度对EAD发生预测的约登指数 |
2.4 肝组织标本中溶血磷脂酰胆碱组织浓度变化的回归模型构建及验证
相关分析提示,两时间点之间LPC的变化量(ΔLPC)与总缺血时间存在相关性(详见表 4),进一步通过散点图观察发现ΔLPC与总缺血时间呈现较明显的线性关系(见图 3)

|
| 图 3 ΔLPC与总缺血时间关系的散点图 |
根据图形形态,本研究分别试用单因素线性回归和多因素线性回归分析灌注后LPC与总缺血时间和供肝获取时LPC浓度的关系,并随机选取3/4(75例)患者资料作为建模集,以其余1/4(25例)为验证集,比较两种回归模型的预测价值。
① 单因素线性回归
以ΔLPC为应变量,总缺血时间为自变量,构建单因素线性回归模型,结果如表 5所示:
| 模型参数 | 非标准化系数 | 标准化系数β′ | t | P | |
| β | SE | ||||
| 常数项 | -21 867.261 | 1710.465 | -12.784 | 0.000 | |
| 总缺血时间 | 51.719 | 2.938 | 0.900 | 17.604 | 0.000 |
据此构建的LPC浓度变化值的预测模型为ΔLPC= -21 867.261+51.719×t,其中t为总缺血时间。建模集中的决定系数(R2)为0.809(调整后R2=0.807)用此模型在验证集中预测ΔLPC,并根据公式计算验证集中模型的的R2为0.839 8(调整后R2=0.832 9)。

|
| 图 4 模型1在建模集中的拟合曲线及数据散点图 |
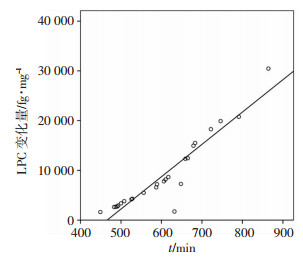
|
| 图 5 模型1在验证集中的拟合曲线及数据散点图 |
② 不考虑交互效应的多因素线性回归
以灌注后LPC浓度为应变量,以供肝获取时LPC浓度和总缺血时间为自变量,构建多因素线性回归模型,结果表 6所示:
| 模型参数 | 非标准化系数 | 标准化系数β′ | t | P | |
| β | SE | ||||
| 常数项 | -20 847.827 | 1 653.907 | -12.605 | 0.000 | |
| 总缺血时间 | 45.510 | 3.443 | 0.537 | 13.218 | 0.000 |
| 供肝获取时LPC浓度 | 1.299 | 0.098 | 0.540 | 13.299 | 0.000 |
据此构建的预测模型为Y=-20 847.827+45.510×t+1.299×X0,其中,Y为再灌注后溶血磷脂酰胆碱组织浓度,视为应变量;t为总缺血时间,X0为供肝获取时溶血磷脂酰胆碱组织浓度,均视为自变量。在建模集中决定系数(R2)为0.922 4(调整后R2=0.920 2)。用此模型在验证集中预测再灌注后LPC,并根据公式计算验证集中模型的R2为0.909 8(调整后R2=0.905 9)。
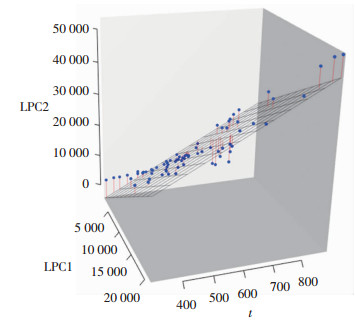
|
| 图 6 模型2在建模集中的拟合平面及数据残差图 |
③ 考虑交互效应的多因素线性回归
以灌注后LPC浓度为应变量,以供肝获取时LPC浓度和总缺血时间为自变量,并且考虑供肝获取时LPC浓度和总缺血时间之间的交互效应,构建多因素线性回归模型,结果如表 7所示:
| 模型参数 | 非标准化系数 | 标准化系数β′ | t | P | |
| β | SE | ||||
| 常数项 | -7554 | 269 3 | -2.805 | 0.006 49 | |
| 总缺血时间 | 22.64 | 4.906 | 0.267 2 | 4.614 | 0.000 017 |
| 供肝获取时LPC浓度 | -0.169 2 | 0.268 3 | -0.070 4 | -0.631 | 0.530 31 |
| 总缺血时间×供肝获取时LPC浓度 | 0.002 345 | 0.000 408 5 | 0.8152 | 5.742 | 0.000 000 215 |
据此构建的预测模型为Y=-755 4+22.64×t-0.169 2×X0+0.000 345×t×X0,其中,Y为再灌注后溶血磷脂酰胆碱组织浓度,视为应变量;t为总缺血时间,X0为供肝获取时溶血磷脂酰胆碱组织浓度,视为自变量,并考虑两者的交互效应(t×X0)。在建模集中决定系数(R2)为0.947 0(调整后R2=0.944 7)。用此模型在验证集中预测再灌注后LPC,并根据公式计算验证集中模型的的R2为0.918 9(调整后R2=0.915 4)。

|
| 图 7 模型2在验证集中的拟合平面及数据残差图 |

|
| 图 8 模型3在建模集中的拟合曲面及数据残差图 |
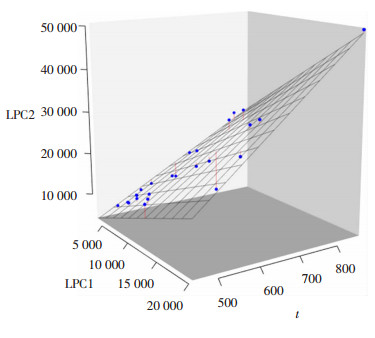
|
| 图 9 模型3在验证集中的拟合曲面及数据残差图 |
2.5 几种预测模型的比较
比较以上几种模型发现,考虑总缺血时间和供肝获取时LPC组织浓度交互效应的多因素线性回归模型(模型3)对样本数据具有最好的符合程度,其在建模集和验证集中的调整后决定系数R2′分别达到0.944 7和0.915 4,见表 8。
| 模型 | 表达式 | 决定系数R2 | 调整后决定系数R2′ | |||
| 建模集 | 验证集 | 建模集 | 验证集 | |||
| 模型1 | ΔLPC=-21 867.261+51.719×t | 0.809 0 | 0.839 8 | 0.807 0 | 0.832 9 | |
| 模型2 | Y=-20 847.827+45.510×t+1.299×X0 | 0.922 4 | 0.909 8 | 0.920 2 | 0.905 9 | |
| 模型3 | Y=-7 554+22.64×t-0.169 2×X0+0.000 345×t×X0 | 0.947 0 | 0.918 9 | 0.944 7 | 0.915 4 | |
3 讨论
数量充足、结构完整、功能无损的肝实质细胞是良好供肝质量的基础[14],但供体原发疾病或创伤应激以及冷热缺血-再灌注过程中产生的各类有害因子都会对供肝造成损伤且程度随缺血时间延长而加重[15]。热缺血导致的缺氧性损伤主要破坏肝脏实质细胞[16],冷热缺血-再灌注期间所产生的大量氧自由基和脂质过氧化物则会加重上述损伤[15]。供肝再灌注后的质量状态对受体预后评估价值最高,这一观点已在GAFFEY等[17]在通过观察术中病理切片来评估供肝缺血再灌注损伤的研究中得到证实。但在临床实践中,却要求移植医师在获取时即快速对供肝进行精确的质量评估以决定使用和分配。目前最常见的方法是对视觉触觉评估存疑的供肝取材行快速病检,组织病理检查也因可从脂肪化、纤维化、肝窦中性粒细胞浸润、实质细胞肿胀、凋亡和坏死程度等病理形态学层面反映肝组织微结构状况而一度成为评估供肝质量的金标准。
但El-BADRY等[18]的研究声称组织病理活检并不能很好地预测术后移植物功能,因获取时取材并无法评估供肝离体后因冷热缺血-再灌注导致的代谢紊乱程度和毒性代谢产物的累积,而后者也与供肝的损伤程度和受体预后高度相关[17, 19]。病理医师之间和其本人不同时期诊断水平的差异也会妨碍评估的标准化与客观化[18],目前也不存在可供病理医师判断供肝质量的统一标准[19]。KAKIZOE等[20]研究表明植入前的供肝组织标本通常表现为正常的病理形态,这与本次研究中观察到的情形基本一致。ALI等[14]的研究表明,即使再灌注过程加重供肝损伤后,也只有严重程度的组织损伤能预示受体存活率降低,但这仅仅在小于5%的小部分活检标本的中可被观察到,而轻度和中度IRI损伤均无统计学意义。本次研究同样发现,再灌注后标本中EAD组和非EAD组病理形态学指标虽有差异,但都局限于轻中度,本研究中,供肝获取时供肝组织病理形态学评分范围在0-2分,基本表现为正常的镜下病理学形态,临床中很难以此为依据区分供肝质量或预测术后EAD的发生。ALI等[14]通过分析供肝植入前的组织标本,也未能证明其病理形态与移植物的长期结局有关联,这与GAFFEY等[17]分析术中供肝病理切片的观察结果一致,他们也发现常规的显微镜并无法观察到初始阶段的肝窦血管内皮损伤,这表明供肝植入前的病理形态学并不能充分反映再灌注后变得明显的损伤[14, 17]。这些现象表明,在可控的冷缺血时间范围内,供肝组织可能不会呈现镜下可见的明显的微结构损伤性改变,它的损伤是一个持续、动态、渐进、积累的过程,而围术期活检多无法检测到进行性的损伤。这就促使我们从代谢组学的角度寻找验证可靠且灵敏度高的损伤性生物标记物。
溶血磷脂酰胆碱是磷脂酶A2催化磷脂水解产生的毒性代谢产物。它既可导致肝细胞由GSK / JNK和caspase激活介导的凋亡[21],也可通过G蛋白偶联受体的MAPK、NF-κB途径和Toll样受体介导多种生物学功能,如诱导淋巴细胞和巨噬细胞的迁移,增加促炎细胞因子的产生和释放,加剧氧化应激,促进细胞凋亡[22]。Han等的研究发现溶血磷脂酰胆碱类物质是肝细胞脂性凋亡的一个死亡效应器[23],其含量与肝脏损伤状态和储备功能密切相关[24]。有研究表明溶血磷脂酰胆碱的大量累积使供肝发生脂质依赖性细胞凋亡的风险更高[21, 23]。此外,与肝移植中缺血预处理相关的基因表达谱还揭示了参与脂质生物合成基因的重大变化,包括磷脂代谢的关键调节剂,以及这些基因与供肝氧化应激和凋亡的潜在关系。这种基因谱和代谢物之间的一致性更加体现了溶血磷脂酰胆碱作为肝脏脂质相关性损伤的生物标志物的潜在用途[25-26]。
我们研究发现,虽然供肝获取时标本基本表现出正常的镜下病理形态,但溶血磷脂酰胆碱组织浓度却在供肝获取时标本中EAD组和非EAD组之间就已表现出明显的差异,这说明在获取前肝脏受到的损伤程度已经不同,但并未在病理形态学层面表现出来。供肝获取时、植入再灌注后两时间点的标本中,EAD组溶血磷脂酰胆碱组织浓度均显著高于非EAD组(P < 0.05),所有标本中再灌注后溶血磷脂酰胆碱组织浓度均显著高于供肝获取时。供肝获取时、植入再灌注后两时间点标本中溶血磷脂酰胆碱组织浓度呈现以总缺血时间t为变量的回归关系。同时,在对定义EAD的3项指标进行分析后发现,仅术后7 d内转氨酶峰值这一指标在EAD组和非EAD组之间表现出明显的统计学差异,这与LPC组织浓度代表肝实质细胞损伤这一推论基本一致。
在肝脏植入再灌注后的肝组织细胞损伤情况是与术后EAD发生关系最密切的,本研究结果也显示,再灌注后LPC浓度对EAD的发生具有较好的预测效能(AUC=0.909,95%CI:0.849~0.969)。但是此时的LPC是在供肝组织基础LPC浓度和经历总缺血影响之后的,我们观察也显示供肝获取时LPC浓度与植入再灌注后LPC浓度具有相当大的差值。但如何利用供肝获取时的LPC浓度和总缺血时间两个变量尽量准确地预测植入再灌注后的LPC浓度就是本研究关注的一个重点,因为肝脏离体后的保存条件相对一致,基本只有缺血时间一个变量的影响,因此本研究探索了三种不同的回归模型,最后发现,考虑基础LPC浓度和总缺血时间交互作用的多因素线性回归具有最好的预测效能(调整后决定系数R2达到0.9154),能为临床上在供肝获取时即可估算植入后肝组织LPC浓度,进而预测EAD的发生提供较为可靠的模型。
以上结果和回归模型的建立,不仅验证了溶血磷脂酰胆碱反映供肝组织实质细胞损伤的良好效能,而且使移植医师可根据供肝获取时标本测量值,结合预估的总缺血时间,推算出再灌注后标本的测量值,从而以此来预测EAD发生的概率。这带给我们从代谢组学层面进行供肝质量评估的全新视角,为基于代谢产物分析构建相关评估模型奠定良好的基础。代谢产物所反映的是已经明确发生了的生物学终点事件,它是机体对遗传、疾病和环境因素的最终应答反应。如本研究中发现溶血磷脂酰胆碱组织浓度变化所示,分子层面的变化能迅速表现出来而被检测到[27],具有较好的敏感性和准确性[28]。通过检测最终代谢产物的含量,我们就无须对供体术前冗杂的临床数据进行分析鉴别[29],减少了混杂因素的干扰。随着供肝保存技术的不断改进,机械灌注保存的临床应用正在逐步兴起[1],这使得以代谢产物分析动态监测肝脏质量具备了可能性,同时也促使我们积极探索这类高敏感度的生物标志物。
本次研究存在某些局限性。首先,作为单中心前瞻性研究,纳入样本量有限,缺乏更大数据量的校正和外部验证,这仅仅是提供一种方法论,所得出的CUT-OFF值和相关模型系数会随着样本量和更多代表性能良好的生物标记物的持续加入而发生改变。其次,标本收集时间点固定,无法进行即时动态检测。有研究声称快速蒸发电离质谱(REIMS)和高分辨率魔角旋转磁共振(HR-MAS-NMR)等方式已显示出其临床应用潜力,可实时分析组织样本的代谢组学特征并在短时间内(< 1 min)进行原位组织鉴定[25-26]。此类技术联合应用机械灌注保存方式[30],或是未来供肝质量评估的研究热点与技术突破所在。
总之,溶血磷脂酰胆碱可作为有效反映供肝组织实质细胞损伤程度的生物标记物,其组织浓度变化敏感,与缺血时间呈高度相关,能即时反映供肝在冷热缺血再灌注过程中的损伤。移植医师可根据文中构建的模型,在获取时取材进行检测来推算再灌注后的检测值,具有临床应用价值。这一损伤标记物的确认也为我们基于代谢产物分析构建更全面的供肝质量评估模型奠定了基础。
利益冲突:所有作者均声明不存在利益冲突
作者贡献声明:王宏、胡鹏:设计课题思路和文章撰写;李传红、刘炜:标本收集和存放;欧晏娇:临床数据分析指导;张雷达:总体把关,审定文稿
| [1] |
NASRALLA D, COUSSIOS C C, MERGENTAL H, et al. A randomized trial of normothermic preservation in liver transplantation[J]. Nature, 2018, 557(7703): 50-56. DOI:10.1038/s41586-018-0047-9 |
| [2] |
FAITOT F, BESCH C, BATTINI S, et al. Impact of real-time metabolomics in liver transplantation: Graft evaluation and donor-recipient matching[J]. J Hepatol, 2018, 68(4): 699-706. DOI:10.1016/j.jhep.2017.11.022 |
| [3] |
D'ERRICO A, RIEFOLO M, SERENARI M, et al. The histological assessment of liver fibrosis in grafts from extended criteria donors predicts the outcome after liver transplantation: a retrospective study[J]. Dig Liver Dis, 2020, 52(2): 185-189. DOI:10.1016/j.dld.2019.05.013 |
| [4] |
HUDCOVA J, SCOPA C, RASHID J, et al. Effect of early allograft dysfunction on outcomes following liver transplantation[J]. Clin Transplant, 2017, 31(2): e12887. DOI:10.1111/ctr.12887 |
| [5] |
NEMES B, GELLEY F, ZÁDORI G, et al. Outcome of liver transplantation based on donor graft quality and recipient status[J]. Transplant Proc, 2010, 42(6): 2327-2330. DOI:10.1016/j.transproceed.2010.05.018 |
| [6] |
MOR E, KLINTMALM G B, GONWA T A, et al. The use of marginal donors for liver transplantation. A retrospective study of 365 liver donors[J]. Transplantation, 1992, 53(2): 383-386. DOI:10.1097/00007890-199202010-00022 |
| [7] |
SALVALAGGIO P, AFONSO R C, FELGA G, et al. A proposal to grade the severity of early allograft dysfunction after liver transplantation[J]. Einstein (Sao Paulo), 2013, 11(1): 23-31. DOI:10.1590/s1679-45082013000100006 |
| [8] |
VOLK M L, LOK A S, PELLETIER S J, et al. Impact of the model for end-stage liver disease allocation policy on the use of high-risk organs for liver transplantation[J]. Gastroenterology, 2008, 135(5): 1568-1574. DOI:10.1053/j.gastro.2008.08.003 |
| [9] |
BONNEY G K, ALDERSLEY M A, ASTHANA S, et al. Donor risk index and MELD interactions in predicting long-term graft survival: a single-centre experience[J]. Transplantation, 2009, 87(12): 1858-1863. DOI:10.1097/TP.0b013e3181a75b37 |
| [10] |
中华医学会器官移植学分会. 中国肝移植供肝获取技术规范(2019版)[J]. 中华移植杂志(电子版), 2019, 13(3): 167-170. Branch of Organ Transplantation of Chinese Medical Association. Technical specifications for liver transplantation in China (2019 edition)[J]. Chin J Transplant (Electronic Version), 2019, 13(3): 167-170. |
| [11] |
中华医学会器官移植学分会. 中国成人活体肝移植操作规范(2019版)[J]. 中华移植杂志(电子版), 2019, 13(03): 177-180. Branch of Organ Transplantation of Chinese Medical Association. Chinese Adult Living Donor Liver Transplantation Practice (2019 Edition)[J]. Chin J Transplant (Electronic Version), 2019, 13(3): 177-180. |
| [12] |
SUZUKI S, TOLEDO-PEREYRA L H, RODRIGUEZ F J, et al. Neutrophil infiltration as an important factor in liver ischemia and reperfusion injury. Modulating effects of FK506 and cyclosporine[J]. Transplantation, 1993, 55(6): 1265-1272. DOI:10.1097/00007890-199306000-00011 |
| [13] |
OLTHOFF K M, KULIK L, SAMSTEIN B, et al. Validation of a current definition of early allograft dysfunction in liver transplant recipients and analysis of risk factors[J]. Liver Transplant, 2010, 16(8): 943-949. DOI:10.1002/lt.22091 |
| [14] |
ALI J M, DAVIES S E, BRAIS R J, et al. Analysis of ischemia/reperfusion injury in time-zero biopsies predicts liver allograft outcomes[J]. Liver Transpl, 2015, 21(4): 487-499. DOI:10.1002/lt.24072 |
| [15] |
王丹, 程烽. 血清透明质酸的变化与供肝冷缺血时间的关系[J]. 医学研究生学报, 2008, 21(8): 848-850. WANG D, CHENG F. Study on the correlation of intra-operative hyaluronic acid changes with hepatic allografts cold ischemia-reperfusion injury in liver transplantation[J]. J Med Postgrad, 2008, 21(8): 848-850. DOI:10.3969/j.issn.1008-8199.2008.08.017 |
| [16] |
MCKEOWN C M, EDWARDS V, PHILLIPS M J, et al. Sinusoidal lining cell damage: the critical injury in cold preservation of liver allografts in the rat[J]. Transplantation, 1988, 46(2): 178-191. DOI:10.1097/00007890-198808000-00001 |
| [17] |
GAFFEY M J, BOYD J C, TRAWEEK S T, et al. Predictive value of intraoperative biopsies and liver function tests for preservation injury in orthotopic liver transplantation[J]. Hepatology, 1997, 25(1): 184-189. DOI:10.1002/hep.510250134 |
| [18] |
EL-BADRY A M, BREITENSTEIN S, JOCHUM W, et al. Assessment of hepatic steatosis by expert pathologists: the end of a gold standard[J]. Ann Surg, 2009, 250(5): 691-697. DOI:10.1097/SLA.0b013e3181bcd6dd |
| [19] |
VERHOEVEN C J, FARID W R, DE JONGE J, et al. Biomarkers to assess graft quality during conventional and machine preservation in liver transplantation[J]. J Hepatol, 2014, 61(3): 672-684. DOI:10.1016/j.jhep.2014.04.031 |
| [20] |
KAKIZOE S, YANAGA K, STARZL T E, et al. Evaluation of protocol before transplantation and after reperfusion biopsies from human orthotopic liver allografts: considerations of preservation and early immunological injury[J]. Hepatology, 1990, 11(6): 932-941. DOI:10.1002/hep.1840110605 |
| [21] |
KAKISAKA K, CAZANAVE S C, FINGAS C D, et al. Mechanisms of lysophosphatidylcholine-induced hepatocyte lipoapoptosis[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(1): G77-G84. DOI:10.1152/ajpgi.00301.2011 |
| [22] |
LIU P, ZHU W, CHEN C, et al. The mechanisms of lysophosphatidylcholine in the development of diseases[J]. Life Sci, 2020, 247: 117443. DOI:10.1016/j.lfs.2020.117443 |
| [23] |
HAN M S, PARK S Y, SHINZAWA K, et al. Lysophosphatidylcholine as a death effector in the lipoapoptosis of hepatocytes[J]. J Lipid Res, 2008, 49(1): 84-97. DOI:10.1194/jlr.M700184-JLR200 |
| [24] |
张磊, 武玉晶, 范志娟, 等. 溶血磷脂酰胆碱在乙肝相关性肝细胞肝癌患者中的诊断价值[J]. 现代中西医结合杂志, 2019, 28(24): 2629-2633+2637. ZHANG L, WU Y J, FAN Z J, et al. The diagnostic value of lysophosphatidylcholine in patients with hepatitis B-related hepatocellular carcinoma[J]. Mod J Integrated Chin Tradit Western Med, 2019, 28(24): 2629-2633+2637. |
| [25] |
NAVARRO-SABATÉ A, PERALTA C, CALVO M N, et al. Mediators of rat ischemic hepatic preconditioning after cold preservation identified by microarray analysis[J]. Liver Transpl, 2006, 12(11): 1615-1625. DOI:10.1002/lt.20863 |
| [26] |
RAZA A, DIKDAN G, DESAI K K, et al. Global gene expression profiles of ischemic preconditioning in deceased donor liver transplantation[J]. Liver Transpl, 2010, 16(5): 588-599. DOI:10.1002/lt.22049 |
| [27] |
XIE H Y, ZHANG L, GUO D J, et al. Protein profiles of pretransplant grafts predict early allograft dysfunction after liver transplantation from donation after circulatory death[J]. Transplantation, 2020, 104(1): 79-89. DOI:10.1097/TP.0000000000002787 |
| [28] |
张毅, 杨卿, 吕海金, 等. 代谢组学在心脏死亡器官捐献供肝评估中的应用[J]. 器官移植, 2017, 8(6): 472-475. ZHANG Y, YANG Q, LYU H J, et al. Application of metabolomics in the evaluation of donated liver from heart dead organs[J]. Organ Transplant, 2017, 8(6): 472-475. |
| [29] |
李恩有, 王常松, 董冉. 代谢组学在器官移植中的应用[J]. 中华移植杂志(电子版), 2011, 5(1): 49-51. LI E Y, WANG C S, DONG R. Metabonomics in organ transplantation[J]. Chin J Transplanat (Electron Version), 2011, 5(1): 49-51. |
| [30] |
贾俊君, 李建辉, 郑树森. "陆止于此, 海始于斯": 机械灌注将成为供肝保存修复新常态[J]. 中华移植杂志(电子版), 2018, 12(03): 102-105. JIA J J, LI J H, ZHENG S S. "Land ends here, sea begins here": machine perfusion becomes the new normal for liver graft preservation[J]. Chin J Transplanat (Electron Version), 2018, 12(03): 102-105. |




