糖尿病是一组以高血糖为特征的代谢紊乱性疾病。糖尿病患者心血管疾病的发病率为非糖尿病患者的2~4倍[1],而合并急性心肌梗死的病死率是血糖正常者的2~8倍[2]。糖尿病性心肌病(diabetic cardiomyopathy,DCM)是糖尿病的主要并发症,是慢性糖尿病患者死亡的重要原因。在DCM中,慢性心脏炎症的特征是心肌细胞的持续丢失,从而导致心脏收缩功能受损 [3-4],但确切的损伤机制仍尚未阐明。
越来越多的证据表明,焦亡是DCM心肌炎症的关键因素[5-6]。细胞焦亡是一种坏死性和炎症性细胞程序性死亡,与细胞坏死和细胞凋亡的机制不同[7]。在DCM中,高血糖诱导活性氧(reactive oxygen species,ROS)升高,刺激核苷酸结合寡聚化结构域样受体蛋白3 (nucleotide binding oligomerization domain-like receptor protein 3,NLRP3)炎症小体的激活[8-9],促使半胱天冬酶1(Caspase-1)被募集到炎性小体中并通过自身加工而被激活[10]。活化的Caspase-1作用于IL-1β、IL-18和成孔蛋白gasdermin D (GSDMD),最终导致细胞强力裂解并快速释放促炎细胞因子[11]。NLRP3和Caspase-1作为信号级联的核心被认为是DCM的炎性标志物和药物靶点[12]。
骨髓源性生长因子(myeloid-derived growth factor,Mydgf)是来源于骨髓单核巨噬细胞的旁分泌蛋白,在小鼠心肌梗死的动物实验中,与野生型小鼠相比,心肌梗死后Mydgf基因敲除小鼠的心肌细胞死亡增加,梗死区域血管生成减少,心功能下降[13]。研究发现Mydgf可通过c-Myc/FoxM1通路促进心肌细胞增殖,改善小鼠心脏损伤后的心脏再生[14]。此外,Mydgf还能通过调控足细胞自噬和凋亡水平改善糖尿病肾脏损害[15]。可见Mydgf具有心脏保护作用,并可改善高糖诱导的细胞损伤。但Mydgf是否参与改善高糖诱导的心肌细胞焦亡及相关机制,目前尚不清楚。近年来研究发现,Mydgf主要定位于细胞内质网[16],而内质网应激可介导NLRP3调控细胞焦亡及炎症反应[17]。因此,本研究拟通过观察Mydgf在高糖诱导H9c2细胞焦亡中的作用,并阐明其是否通过介导NLRP3表达,从而调控H9c2细胞焦亡。
1 材料与方法 1.1 主要试剂低糖、高糖DMEM培养基和胰蛋白酶购自美国Gibco公司。胎牛血清(fetal bovine serum,FBS)购自美国BI公司。葡萄糖粉购自美国Simga公司。NLRP3 mRNA引物和cDNA反转录试剂盒购自广州锐博生物科技有限公司。RT-qPCR试剂盒和IL-1β、IL-18的ELISA检测试剂盒购自生工生物工程(上海)股份有限公司。cleaved Caspase-1、NLRP3、ACS、GSDMD、β-actin兔抗大鼠一抗购自武汉博士德生物工程有限公司。ECL化学发光试剂盒购自美国Thermo Scientific公司。过表达NLRP3基因和空载体携带EGFP的慢病毒载体购自南京凯基生物公司。
1.2 H9c2细胞系传代培养及体外DCM模型建立H9c2细胞系(大鼠胚胎心肌细胞株)购自中国科学院上海细胞库,在含10%FBS的低糖DMEM培养基中,置于37 ℃、5%CO2的培养箱中传代培养。选取第5~8代生长良好的细胞用于后续实验。采用含50 mmol/L葡萄糖的高糖DMEM培养基处理细胞24 h,建立体外DCM模型[9, 18]。
1.3 实验分组及方法为了观察过表达Mydgf对高糖所致的H9c2细胞焦亡及相关蛋白表达的影响,取培养的第5~8代H9c2心肌细胞分为4组。正常组(Nor):H9c2细胞由低糖DMEM培养,无干预。高糖组(HG):H9c2细胞由低糖DMEM培养同前,24 h后加入50 mmol/L高糖DMEM培养。Mydgf组:采用重组Mydgf(25 ng/mL)处理细胞12 h[14],随后以50 mmol/L高糖DMEM干预H9c2细胞24 h。Necrosulfonamide组(NSA):予32 μmol/L NSA处理细胞30 min[19],随后50 mmol/L葡萄糖干预H9c2细胞24 h。
为进一步验证Mydgf通过调控NLRP3发挥抗高糖诱导的细胞焦亡作用,以细胞过表达NLRP3做回复实验,将细胞分为3组。高糖组(HG组):50 mmol/L高糖DMEM干预H9c2细胞24 h。Mydgf组:H9c2细胞予以人重组Mydgf蛋白处理12 h后,再予以50 mmol/L高糖处理24 h。Mydgf+携带NLRP3基因的绿色荧光蛋白慢病毒组(Mydgf + NLRP3-EGFP组):采用携带增强型绿色荧光蛋白的慢病毒转染NLRP3至H9c2细胞48 h,随后予以重组Mydgf蛋白处理细胞12 h,然后予以50 mmol/L高糖处理24 h。
1.4 实时荧光定量PCR(RT-qPCR)检测细胞中NLRP3 mRNA表达水平按RNA抽提试剂盒说明书进行,提取总RNA,按mRNA反转录试剂盒进行操作,以β-actin为内参,随后按荧光定量PCR试剂盒进行cDNA扩增。数据通过Ct比较法进行分析、定量(2-ΔΔCt)。实验独立重复3次。
1.5 Western blot检测按产品说明书提取总蛋白,采用BCA法测定蛋白浓度。将提取的总蛋白与5×蛋白上样缓冲液按4 ∶1比例充分混匀后,蛋白变性(99 ℃,10 min)。等量上样至十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,55 V跑积层胶55 min,100 V跑至胶底部,然后转膜至PVDF膜,用封闭液室温封闭1 h,加入NLRP3、ACS、cleaved Caspase-1和GSDMD的一抗,4 ℃孵育过夜;TBST缓冲液洗3次后, 加入山羊抗兔二抗室温摇床孵育1 h,最后曝光显影进行分析。以β-actin为内参照。实验独立重复3次。
1.6 ELISA法检测细胞培养液中IL-1β和IL-18的分泌按分组分别干预细胞后,收集细胞培养液,随后按试剂盒说明书操作。
1.7 CCK-8法测定细胞存活率96孔板中培养H9c2细胞,待细胞融合达标时,按Mydgf浓度梯度处理细胞12 h后或按分组条件处理细胞24 h后,PBS液充分洗涤,加入DMEM稀释的CCK-8溶液100 μL(DMEM和CCK-8原液体积比为9 ∶1),37 ℃培养箱内孵育2 h,酶标仪上测定波长在450 nm处的吸光密度值[D(450)]。每组设6个复孔。
1.8 统计学分析采用SPSS19.0统计软件进行分析。正态分布的计量资料以x±s表示,两组间比较应用独立样本t检验, 多组间均数比较采用单因素方差分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 Mydgf对高糖诱导H9c2细胞焦亡的影响H9c2细胞系经消化后传代培养,取5~8代细胞按分组条件处理细胞。经Western blot检测结果发现(图 1),与Nor组相比,HG组中ASC、cleaved Caspase-1、NLRP3、GSDMD表达明显增高(P < 0.05),而Mydgf组中表达显著下降(P < 0.05),但下降程度低于NSA组。ELISA检测结果发现(图 2),与Nor组相比,IL-1β和IL-18的表达量在HG组明显增高,而在Mydgf组中显著下降(P < 0.05),但NSA组下降程度更大。提示重组Mydgf蛋白具有抗高糖诱导H9c2细胞焦亡的作用,但其抗焦亡效应较NSA弱。
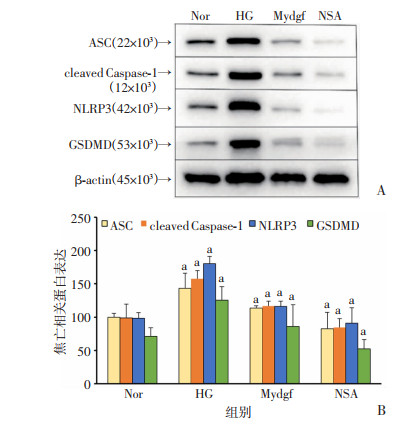
|
| A:Western blot检测结果;B:半定量分析结果(n=3, x±s)a: P < 0.05,与Nor组比较 图 1 Western blot检测各组H9c2细胞中焦亡相关蛋白的表达 |
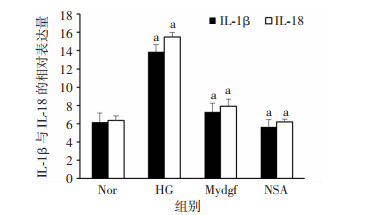
|
| a: P < 0.05,与Nor组比较 图 2 各组细胞培养液中IL-1β和IL-18的相对表达量(n=6, x±s) |
2.2 CCK-8法测定不同浓度的Mydgf对H9c2细胞活力的影响
CCK-8结果显示,< 25 ng/mL的Mydgf对H9c2细胞活力没有明显的影响,但Mydgf >25 ng/mL后,细胞活力随着浓度增加成逐渐下降趋势(P < 0.05,图 3),因此后续实验中,采用25 ng/mL Mydgf处理细胞。
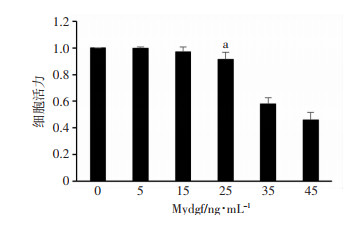
|
| a: P < 0.05,与0 ng·mL-1 Mydgf比较 图 3 不同浓度Mydgf对H9c2细胞活力的影响(n=6, x±s) |
2.3 慢病毒转染过表达H9c2细胞系中的NLRP3基因
由于慢病毒携带绿色荧光蛋白(EGFP),将其转入H9c2细胞后,采用荧光显微镜检测发现,细胞绿色荧光转染效率超过95%。RT-qPCR及Western blot检测结果发现(图 4、5):与Nor组相比,EGFP组中NLRP3在mRNA和蛋白水平上的表达水平无明显变化。而与EGFP组相比,NLRP3-EGFP组中NLRP3的mRNA及蛋白水平均显著增高(P < 0.05),提示成功过表达了H9c2细胞系中的NLRP3基因。
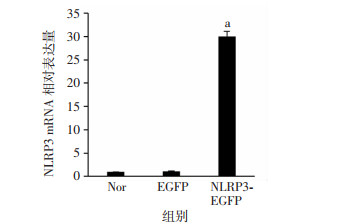
|
| a: P < 0.05,与EGFP组比较 图 4 RT-qPCR检测转染后NLRP3 mRNA的相对表达量(n=3, x±s) |

|
| a: P < 0.05,与EGFP组比较 图 5 Western blot检测各组H9c2细胞中NLRP3蛋白的表达(A)与半定量分析(B) (n=3, x±s) |
2.4 过表达NLRP3对H9c2细胞活力的影响
为了验证慢病毒转染对细胞活力的影响,采用CCK-8法检测各组细胞活力。可见EGFP、NLRP3转染的细胞存活率无明显变化(图 6),说明在正常情况下,过表达EGFP和NLRP3对细胞存活率没有影响。而在予以高糖处理后(图 6),与Nor组相比,HG组和HG+EGFP组细胞存活率下降(P < 0.05);与HG组相比,HG+NLRP3-EGFP组活力进一步下降(P < 0.05),说明过表达NLRP3使HG条件下的细胞活力明显下降。
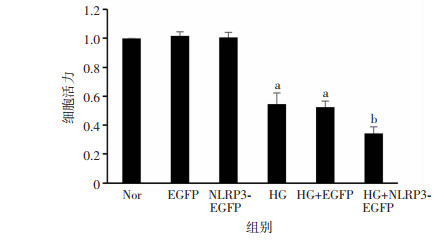
|
| a: P < 0.05,与Nor组比较;b: P < 0.05,与HG组比较 图 6 不同处理组H9c2细胞活力(n=6, x±s) |
2.5 Mydgf调控NLRP3对高糖诱导心肌细胞焦亡的作用
Western blot结果表明(图 7),与HG相比,Mydgf组中的ASC、cleaved Caspase-1、NLRP3表达明显下降(P < 0.05),Mydgf+NLRP3-EGFP组中表达则显著增加(P < 0.05)。ELISA检测结果发现(图 8),与HG组相比,IL-1β和IL-18的表达量在Mydgf组明显下降,而在Mydgf+NLRP3-EGFP组中显著升高(P < 0.05),表明NLRP3的过表达可以阻断Mydgf的抗高糖诱导H9c2细胞焦亡作用。
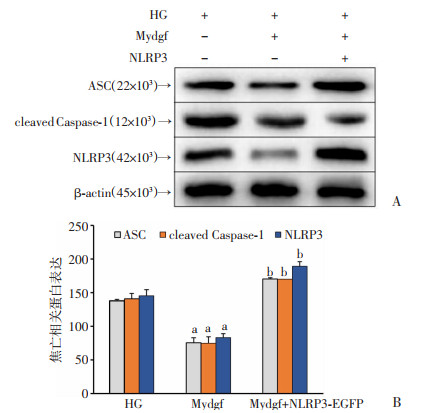
|
| a: P < 0.05,与HG组比较;b: P < 0.05,与HG组比较 图 7 Western blot检测各组H9c2细胞中焦亡相关蛋白的表达(n=3, x±s) |
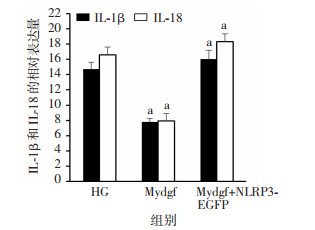
|
| a: P < 0.05,与HG组比较 图 8 各组细胞培养液中IL-1β和IL-18的相对表达量(n=6, x±s) |
3 讨论
本研究旨在探讨Mydgf对高糖诱导的心脏损伤中焦亡的作用及其可能机制,发现Mydgf可能通过调控NLRP3减轻高糖诱导的H9c2细胞系焦亡。
糖尿病性心肌病(diabetic cardiomyopathy,DCM)是独立于冠心病、高血压心脏病以及心脏瓣膜病等的特异性心肌病,危害极大[20]。研究显示,免疫炎症反应参与了DCM的病理生理发展过程,在DCM患者或动物模型中,均发现了炎症相关因子如IL-6、IL-1β,肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、NLRP3炎症小体等的表达[21]。炎症反应是一把双刃剑,在早期是应对高血糖的保护性反应,而后期持续的慢性炎症则会导致心肌细胞的损失,最终导致心力衰竭。其中NLRP3炎症小体参与高血糖诱导的细胞毒性反应并启动细胞焦亡的进程[8]。焦亡是与炎症相关的程序性细胞死亡,参与了DCM的发生发展。高糖诱导的活性氧(ROS)可触发NLRP3炎症小体的激活,促进裂解的Caspase-1的产生,从而加速IL-1β、IL-18的释放[22]。因此抑制高糖诱导的心肌细胞焦亡可能成为DCM的治疗靶点。
既往研究表明,Mydgf可以通过调控PI3K/Akt信号通路的激活,减少心肌缺血诱导的心肌细胞的凋亡[13]。同时通过调控MAPKl/3,Cyclin D1和STAT3相关信号通路促进内皮细胞增殖[23]。在2型糖尿病小鼠模型中,Mydgf可促进肠道胰高血糖素样肽-1 (GLP-1)的产生,改善糖/脂代谢[24]。此外,Mydgf通过保护高糖诱导的肾小囊脏层上皮细胞损伤,激活Akt/BAD通路改善肾小囊脏层上皮细胞功能,在阻止糖尿病肾病的发展中发挥了重要作用[15]。但Mydgf是否能够改善高糖诱导的心肌细胞焦亡,目前尚不清楚。本研究发现高糖可诱导H9c2细胞高表达焦亡相关蛋白,如NLRP3、ASC、cleaved Caspase-1、GSDMD等,而加入重组人Mydgf蛋白可使NLRP3、ASC、cleaved Caspase-1、GSDMD蛋白表达水平降低,上清液中IL-1β和IL-18的表达水平降低,说明重组人Mydgf蛋白可以降低高糖诱导的NLRP3炎症小体的激活和焦亡。
NLRP3炎症小体可在各种疾病条件下识别非微生物危险信号(如过量的葡萄糖、活性氧、低密度脂蛋白等)进而导致非细菌性炎性反应。有研究发现,NLRP3的激活在糖尿病心肌病的心肌炎症反应过程中起到了举足轻重的作用[21]。越来越多的证据表明,抑制NLPR3可以减少高糖诱导心肌细胞死亡,调节钙稳态和心肌细胞骨架结构[25-26]。NLRP3在高糖诱导心肌细胞损伤过程中的作用可见一斑。既往研究显示,Mydgf主要定位于细胞内质网[16],而内质网应激可激活NLRP3介导的细胞焦亡[17]。我们猜想Mydgf的抗焦亡作用可能通过调控NLRP3的表达。为进一步验证该假设,予以过表达H9c2细胞中的NLRP3做回复实验,结果表明,采用慢病毒转染,可有效过表达H9c2细胞中的NLRP3。并且在正常培养的细胞中,过表达NLRP3对细胞活力无明显影响,而高糖环境中,NLRP3可促使细胞活力进一步下降。此外,过表达的NLRP3可抑制重组人Mydgf蛋白对抗高糖诱导细胞焦亡作用。
综上所述,本研究表明,重组人Mydgf蛋白可能改善高糖诱导的H9c2细胞焦亡,该作用可能通过抑制NLRP3炎症小体的激活来对抗高血糖诱导的细胞焦亡,但Mydgf调控NLRP3炎症小体的具体机制还有待进一步研究。
| [1] |
BERTOLUCI M C, ROCHA V Z. Cardiovascular risk assessment in patients with diabetes[J]. Diabetol Metab Syndr, 2017, 9: 25. DOI:10.1186/s13098-017-0225-1 |
| [2] |
SEVERINO P, D'AMATO A, NETTI L, et al. Myocardial ischemia and diabetes mellitus: Role of oxidative stress in the connection between cardiac metabolism and coronary blood flow[J]. J Diabetes Res, 2019, 2019: 9489826. DOI:10.1155/2019/9489826 |
| [3] |
FRATI G, SCHIRONE L, CHIMENTI I, et al. An overview of the inflammatory signalling mechanisms in the myocardium underlying the development of diabetic cardiomyopathy[J]. Cardiovasc Res, 2017, 113(4): 378-388. DOI:10.1093/cvr/cvx011 |
| [4] |
JIA G, HILL M A, SOWERS J R. Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity[J]. Circ Res, 2018, 1224(4): 624-638. DOI:10.1161/CIRCRESAHA.117.311586 |
| [5] |
LUO B, HUANG F, LIU Y, et al. NLRP3 inflammasome as a molecular marker in diabetic cardiomyopathy[J]. Front Physiol, 2017, 8: 519. DOI:10.3389/fphys.2017.00519 |
| [6] |
YANG F, QIN Y, LV J, et al. Silencing long non-coding RNA Kcnq1ot1 alleviates pyroptosis and fibrosis in diabetic cardiomyopathy[J]. Cell Death Dis, 2018, 9(10): 1000. DOI:10.1038/s41419-018-1029-4 |
| [7] |
CHEN Y, HUA Y, LI X, et al. Distinct types of cell death and the implication in diabetic cardiomyopathy[J]. Front Pharmacol, 2020, 11: 42. DOI:10.3389/fphar.2020.00042 |
| [8] |
LUO B, LI B, WANG W, et al. NLRP3 gene silencing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model[J]. PLoS ONE, 2014, 9(8): e104771. DOI:10.1371/journal.pone.0104771 |
| [9] |
王艳, 赵然尊, 陈攀科, 等. 微小RNA-214改善高糖诱导的H9c2细胞焦亡的机制探讨[J]. 中华心血管病杂志, 2019, 47(10): 820-828. WANG Y, ZHAO R Z, CHEN P K, et al. Impact and related mechanism on the improvement of hyperglycemia-induced pyroptosis in H9c2 cells by microRNA-214[J]. Chin J Cardiol, 2019, 47(10): 820-828. DOI:10.3760/cma.j.issn.0253-3758.2019.10.009 |
| [10] |
FRANCHI L, EIGENBROD T, MUÑOZ-PLANILLO R, et al. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis[J]. Nat Immunol, 2009, 10(3): 241-247. DOI:10.1038/ni.1703 |
| [11] |
BROUGH D, ROTHWELL N J. Caspase-1-dependent processing of pro-interleukin-1beta is cytosolic and precedes cell death[J]. J Cell Sci, 2007, 120(pt 5): 772-781. DOI:10.1242/jcs.03377 |
| [12] |
ZHOU W, CHEN C, CHEN Z, et al. NLRP3: a novel mediator in cardiovascular disease[J]. J Immunol Res, 2018, 2018: 5702103. DOI:10.1155/2018/5702103 |
| [13] |
KORF-KLINGEBIEL M, REBOLL M R, KLEDE S, et al. Myeloid-derived growth factor (C19orf10) mediates cardiac repair following myocardial infarction[J]. Nat Med, 2015, 21(2): 140-149. DOI:10.1038/nm.3778 |
| [14] |
WANG Y Y, LI Y, FENG J, et al. Mydgf promotes cardiomyocyte proliferation and neonatal heart regeneration[J]. Theranostics, 2020, 10(20): 9100-9112. DOI:10.7150/thno.44281 |
| [15] |
HE M, LI Y, WANG L, et al. MYDGF attenuates podocyte injury and proteinuria by activating Akt/BAD signal pathway in mice with diabetic kidney disease[J]. Diabetologia, 2020, 63(9): 1916-1931. DOI:10.1007/s00125-020-05197-2 |
| [16] |
BORTNOV V, ANNIS D S, FOGERTY F J, et al. Myeloid-derived growth factor is a resident endoplasmic reticulum protein[J]. J Biol Chem, 2018, 293(34): 13166-13175. DOI:10.1074/jbc.ac118.002052 |
| [17] |
WANG J, WEN Y, LV L L, et al. Involvement of endoplasmic reticulum stress in angiotensin Ⅱ-induced NLRP3 inflammasome activation in human renal proximal tubular cells in vitro[J]. Acta Pharmacol Sin, 2015, 36(7): 821-830. DOI:10.1038/aps.2015.21 |
| [18] |
YANG F, QIN Y, WANG Y, et al. LncRNA KCNQ1OT1 mediates pyroptosis in diabetic cardiomyopathy[J]. Cell Physiol Biochem, 2018, 50(4): 1230-1244. DOI:10.1159/000494576 |
| [19] |
RATHKEY J K, ZHAO J, LIU Z, et al. Chemical disruption of the pyroptotic pore-forming protein gasdermin D inhibits inflammatory cell death and sepsis[J]. Sci Immunol, 2018, 3(26): eaat2738. DOI:10.1126/sciimmunol.aat2738 |
| [20] |
LORENZO-ALMORÓS A, TUÑÓN J, OREJAS M, et al. Diagnostic approaches for diabetic cardiomyopathy[J]. Cardiovasc Diabetol, 2017, 16(1): 28. DOI:10.1186/s12933-017-0506-x |
| [21] |
FRATI G, SCHIRONE L, CHIMENTI I, et al. An overview of the inflammatory signalling mechanisms in the myocardium underlying the development of diabetic cardiomyopathy[J]. Cardiovasc Res, 2017, 113(4): 378-388. DOI:10.1093/cvr/cvx011 |
| [22] |
SHARMA A, TATE M, MATHEW G, et al. Oxidative stress and NLRP3-inflammasome activity as significant drivers of diabetic cardiovascular complications: therapeutic implications[J]. Front Physiol, 2018, 9: 114. DOI:10.3389/fphys.2018.00114 |
| [23] |
ZHAO L, FENG S, WANG S, et al. Production of bioactive recombinant human myeloid-derived growth factor in Escherichia coli and its mechanism on vascular endothelial cell proliferation[J]. J Cell Mol Med, 2020, 24(2): 1189-1199. DOI:10.1111/jcmm.14602 |
| [24] |
LI W, LI Y, GUO B, et al. Myeloid-derived growth factor promotes intestinal glucagon-like peptide-1 production in male mice with type 2 diabetes[J]. Endocrinology, 2020, 1612(2): bqaa003. DOI:10.1210/endocr/bqaa003 |
| [25] |
李雪莲, 李智洋, 李宾公, 等. 槲皮素抑制糖尿病大鼠炎症小体激活并减轻心肌损伤[J]. 中国病理生理杂志, 2019, 35(8): 1345-1351. LI X L, LI Z Y, LI B G, et al. Quercetin inhibits inflammasome activation in diabetic rats and attenuates myocardial injury[J]. Chin J Pathophysiol, 2019, 35(8): 1345-1351. DOI:10.3969/j.issn.1000-4718.2019.08.001 |
| [26] |
XUE Y, DU M, ZHU M. Quercetin suppresses NLRP3 inflammasome activation in epithelial cells triggered by Escherichia coli O157: H7[J]. Free Radic Biol Med, 2017, 108: 760-769. DOI:10.1016/j.freeradbiomed.2017.05.003 |




