2. 110016 沈阳,北部战区总医院心血管外科
2. Department of Cardiovascular Surgery, General Hospital of Northern Theater Command, Shenyang, Liaoning Province, 110016, China
心房颤动(atrial fibrillation,AF)是最常见的、严重的心血管疾病,人群患病率为0.4%~1.0%[1-2],有高致残率和致死率。房颤患者不仅表现为心电图的变化,更表现为心房结构的变化,而单纯依靠心电图进行房颤的分型及评价临床治疗,远远不能满足房颤治疗多样性的需求[3-6],超声心动图在房颤的诊断中有其独特的表现形式和应用价值。
目前房颤还可分为瓣膜性与非瓣膜性房颤,但这已不单是房颤的病因学分类,更强调抗凝强度的不同[7-9]。非瓣膜性房颤其房室瓣结构和功能的独立病理生理学特点逐渐受到重视[10-13],超声表现为二尖瓣和/或三尖瓣瓣环扩张、瓣环的马鞍形状破坏、瓣环的收缩功能障碍以及瓣叶的栓系角度异常,其左室大小和功能可以正常,即心房功能性房室瓣反流(atrial functional regurgitation of atrioventricular valve, AFR)。房颤的发病率随年龄增长明显增加,房颤患病时间较长的患者其瓣膜也会出现不同程度的损害[3, 5],从而进一步促进心房重构,房室瓣反流程度较重者其生活质量明显下降,单纯行内科治疗效果很差。但考虑到外科治疗的危险性和预后效果的不确定性,目前此类患者的外科瓣膜治疗并没有受到广大心血管科医师的认可和重视,但是临床上存在大量的持续性或长久性房颤患者,因心房明显增大、房室瓣大量反流,并伴有不同程度的肺动脉收缩压升高,已经不适于行恢复窦性心律的内科消融治疗[14]。这类房颤患者在心理功能上更容易出现焦虑症、健康相关生活质量(health-related quality of life, Hr-QOL)较差等现象[15-16]。
本研究将因心房功能性房室瓣明显反流并伴有健康相关生活质量评分较低、有焦虑倾向的房颤,定义为终末期心房颤动。其中部分患者同意并接受了外科瓣膜手术治疗,本研究对这部分患者的术前术后超声及临床指标进行分析,从超声角度分析房颤的诊断及评价外科瓣膜手术对终末期房颤的疗效。
1 资料与方法 1.1 研究对象及设计2012年1月至2019年6月来我院心外科门诊就诊并行心脏超声检查的患者总计35 827例(不含复诊),术前或者首诊时伴有房颤的患者2 802例(7.8%),不包括术后房颤的患者,以“心房颤动”为超声诊断的患者693例(1.94%),均伴有二尖瓣和/或三尖瓣不同程度的关闭不全。其中124例房颤合并房室瓣明显反流的患者同意并接受了瓣膜手术治疗。生活质量相关评价包括NYHA的心功能分级、焦虑自评量表(SAS)。
本研究分析纳入患者术前术后的超声及临床指标。基于既往报告的研究中693例心脏超声诊断为“心房颤动”患者,根据房室瓣不同的反流情况,分为4组,A组(188例)为二尖瓣和/或三尖瓣微量或轻度关闭不全,B组(109例)仅以三尖瓣中度及以上关闭不全,C组(127例)仅以二尖瓣中度及以上关闭不全,D组(269例)二尖瓣及三尖瓣均有中度及以上关闭不全。后3组纳入患者共计505例,其中124例进行了心脏瓣膜手术治疗。本研究已获得我院伦理委员会批准[k(2020)10号]。
1.2 超声报告中“心房颤动”的定义[17]心房颤动包括两个方面,一是心脏节律为R-R间期绝对不齐,房室瓣瓣口前向血流为单峰,或E峰后仅为很小的A峰(说明心房尚有一定的收缩功能);二是房室瓣瓣叶及其附属结构的独特表现:瓣叶回声均匀,无明显增厚,瓣叶、腱索及乳头肌结构完整,无瓣叶冗长,开放不受限,同时具有下列表现中至少两项者即可诊断:①反复多次、多切面测量二尖瓣瓣环内径(mitral annulus diameter,MAD)≥33 mm和/或三尖瓣瓣环内径(tricuspid annulus diameter,TAD)≥34 mm;②瓣叶收缩期闭合点达到或超过瓣环水平;③瓣叶收缩期闭合缘达到瓣叶边缘,即瓣叶收缩期接触面积减小;④瓣叶闭合缘高度<4 mm(正常的闭合缘高度在4~8 mm);⑤局部或多处瓣叶、腱索延长;⑥收缩期于双房探及中心性反流束。符合上述诊断的患者还需除外合并其他心脏病,如先天性心脏病、主动脉瓣病变、马凡综合征、肥厚性心肌病、扩张性心肌病、冠心病等,见图 1。
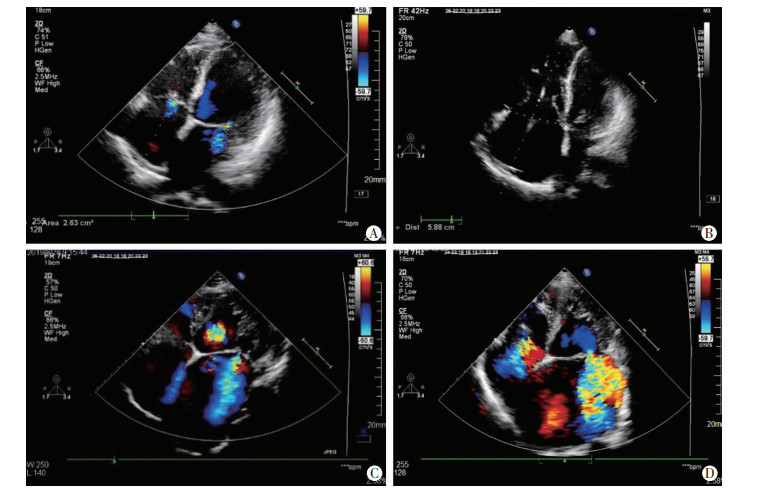
|
| A:二、三尖瓣均为轻度反流;B:三尖瓣重度反流;C:二尖瓣中等-大量反流;D:二、三尖瓣均为中等量以上反流 图 1 房室瓣不同程度反流的超声表现 |
1.3 心脏超声的测量
采用Philips iE33彩色多普勒超声诊断仪检查,探头频率1~5 MHz。根据美国心脏超声学会(ASE)的指南推荐进行心脏超声的测量和计算[18-19],二维测量各心腔内径及房室瓣内径(于舒张期多切面测量获取最大值);每个患者常规行PW采集二尖瓣和三尖瓣的舒张早期峰速(Em、Et)、舒张晚期峰速(Am、At),房颤患者多数为单峰或者E峰后仅为很小的A峰。二尖瓣反流(MI)及三尖瓣反流(TI)进行分级评价,分为轻微(1级)、轻度(2级)、中度(3级)和重度(4级)。
1.4 手术方式采用静脉复合麻醉气管内插管,浅低温(30~33 ℃)体外循环下行心内直视手术,正中切口开胸,建立体外循环,阻断上下腔静脉,阻断主动脉,灌注冷血心脏停搏液,心脏停跳,根据术前超声心动图的房室瓣检查结果,术中再次探查,完成的手术术式有:单纯二尖瓣成形术或置换术22例,其中同期行迷宫手术6例;单纯行三尖瓣成形术或置换术10例,其中同期行迷宫手术2例;二、三尖瓣同期行成形术39例,其中同期行迷宫手术3例;二尖瓣置换术及三尖瓣成形术53例,其中同期行迷宫手术5例。停体外循环后行食道超声监测各瓣膜的启闭情况。
1.5 统计学处理计数资料采用频数(%)进行统计描述,计量资料采用中位数和四分位数[M(P25,P75)]进行统计描述。手术组和未手术组患者间各变量的比较计数资料采用χ2检验,计量资料采用两独立样本的秩和检验。手术组患者术前及术后6个月的资料比较采用配对设计的Wilcoxon符号秩和检验,采用心功能分级和焦虑自评量表评分对患者手术前后的生活质量进行评价,统计学检验同样采用配对设计的Wilcoxon符号秩和检验。应用SPSS 22.0软件进行统计分析, 检验水准α=0.05。
2 结果 2.1 四组心房颤动患者的单因素分析693例患者的房室瓣反流程度不断变化,有65例患者通过给予控制心室率、内科对症治疗后,房室瓣反流程度减轻,其中23例患者进行了内科房颤射频消融术;而505例患者的房室瓣反流加重、生活质量明显下降,其中124例患者同意并行外科手术治疗。
693例患者中共有男性436例(62.91%),组间比较发现各组间男性患者的比例差异有统计学意义(P < 0.05),其中A组男性占比最高75.0%,随着房室瓣反流量增加,女性患者比例开始上升,B组男性比例58.7%,C组男性比例64.6%,D组男性比例55.4%。具体数据见前期研究[17]。
2.2 瓣膜较重的手术组和未手术组之间的比较505例瓣膜较重患者中根据是否选择手术治疗分为两组,即手术组124例和未手术组381例。手术组患者的年龄、性别与未手术组之间比较差异无统计学意义;但未手术组患者房颤病史时间明显长于手术组(P < 0.001)。超声指标方面,两组间比较发现未手术组患者的LVEDDI明显大于手术组(P=0.02);但LVEF、左房内径、肺动脉收缩压、右房内径、右室流出道等指标两组间差异无统计学意义。未手术组患者二尖瓣侧壁和房间隔瓣环处组织多普勒收缩期峰速(即TDI-mvs和TDI-ivs)明显低于手术组(P < 0.001),且未手术组患者的左室和右室舒张功能明显低于手术组(即Em/Em’、Em/Ei’及Et/Et’明显高于手术组,P值分别为0.014、0.014和0.012),见表 1。说明未手术组患者的左室收缩和舒张功能及右室舒张功能均明显低于手术组。
| 组别 | n | 性别[男,n(%)] | 年龄/岁 | 房颤病史/年 | LVEF(%) | LADI/mm·m-2 | LVEDDI/mm·m-2 | SPAP/mmHg | PADI/mm·m-2 | RVOTI/mm·m-2 | 右房上下径指数/mm·m-2 | 右房左右径指数/mm·m-2 | TDI-mvs | TDI-ivs | TDI-tvs | Em/Em’ | Em/Ei’ | Et/Et’ |
| 手术组 | 124 | 72(58.1) | 63.7(51.5, 75.9) | 3.5(1.6, 5.7) | 51.2(45.1, 52.7) | 29.6(26.4, 34.9) | 30.6(26.8, 34.2) | 46.1(38.7, 53.5) | 14.2(12.5, 16.5) | 17.5(15.7, 20.4) | 38.8 (31.2, 39.0) | 28.3 (26.1, 35.4) | 8.5(6.6, 10.4) | 7.1(5.9, 8.2) | 11.2(9.0, 13.4) | 9.4(6.3, 12.5) | 13.0(8.8, 17.1) | 4.1(2.9, 5.3) |
| 未手术组 | 381 | 249(65.4) | 62.6(52.3, 72.9) | 4.6(2.4, 7.2) | 51.9(42.1, 59.7) | 29.6(22.5, 36.7) | 32.6(24.4, 39.8) | 45.8(35.9, 54.7) | 14.8(12.1, 17.4) | 17.9(14.7, 21.2) | 36.1 (28.9, 41.6) | 28.7 (22.1, 34.3) | 7.5(6.1, 9.1) | 6.3(5.2, 7.4) | 10.4(7.1, 14.7) | 10.6(7.2, 14.1) | 14.4(10.9, 17.9) | 4.8(2.7, 6.9) |
| χ2/Z | -1.172 | 0.959 | -4.361 | -0.649 | -0.254 | -3.071 | 1.021 | -1.272 | -1.673 | 1.992 | -1.162 | 4.366 | 4.505 | 1.625 | -2.457 | -2.462 | -2.514 | |
| P | 0.242 | 0.338 | < 0.001 | 0.516 | 0.8 | 0.02 | 0.148 | 0.098 | 0.059 | 0.048 | 0.142 | < 0.001 | < 0.001 | 0.105 | 0.014 | 0.014 | 0.012 | |
| LVEF:左室射血分数;LADI:左房内径指数;LVEDDI:左室舒张末期内径指数;PADI:肺动脉内径指数;RVOTI:右室流出道内径指数:SPAP:肺动脉收缩压;TDI-mvs、TDI-ivs及TDI-tvs分别为二尖瓣侧壁、室间隔、三尖瓣侧壁瓣环处的收缩期速度;Em、Et分别为二尖瓣和三尖瓣的舒张期峰速;Em’、Ei’、Et’分别为二尖瓣侧壁、室间隔、三尖瓣侧壁瓣环处的舒张期峰速 | ||||||||||||||||||
2.3 手术患者术后心脏超声指标的变化情况
123例患者术后随访6~94个月,平均随访时间为63.03(54.61~71.44)个月。配对分析术前、术后的心脏超声指标,发现左房、左室、肺动脉的内径、右室流出道内径、肺动脉收缩压等指标均明显减小(P < 0.001)。同时发现术后LVEF并未得到进一步的改善,24例患者出现LVEF降低,但差异尚无统计学意义(P=0.067),见表 2。
| 时间 | LVEF(%) | LADI/mm·m-2 | LVEDDI/mm·m-2 | PADI/mm·m-2 | RVOTI/mm·m-2 | SPAP/mmHg | 右房上下径指数/mm·m-2 | 右房左右径指数/mm·m-2 |
| 术前 | 51(45, 53) | 29.63(26.42, 34.96) | 30.66(26.82, 34.24) | 14.24(12.56, 16.49) | 17.51(15.73, 20.42) | 46(39, 52) | 38.84(31.21, 38.99) | 27.75(26.01, 32.37) |
| 术后 | 50(43, 53) | 27.67(24.36, 31.93) | 28.41(25.76, 31.15) | 13.55(12.22, 14.66) | 15.54(14.21, 17.93) | 35(33, 41) | 34.13(28.95, 35.26) | 30.10(25.74, 32.44) |
| Z | -1.834 | -6.227 | -7.259 | -4.127 | -5.981 | -7.647 | -2.645 | -2.392 |
| P | 0.067 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.008 | 0.017 |
2.4 手术前后生活质量的变化
123例患者术前、术后生活质量评价结果显示,心功能分级均有明显改善(P < 0.001),焦虑自评量表(SAS)评分明显下降(P < 0.001),见表 3。
| 时间 | 心功能分级[n(%)] | 焦虑自评量表评分[M(P25, P75)] | |||
| 1 | 2 | 3 | 4 | ||
| 术前 | 1(0.81) | 2(1.63) | 69(55.65) | 52(41.94) | 63(52, 78) |
| 术后 | 103(94.50) | 6(5.54) | 0(0) | 0(0) | 43(33, 58) |
| P | < 0.001 | < 0.001 | |||
2.5 手术患者术后的心脏节律变化
123例患者中16例在瓣膜手术的同时行迷宫术,其中14例恢复并维持了窦性心律(87.5%);单纯行瓣膜手术107例,其中18例患者可以恢复并维持了窦性心律(16.8%)。
3 讨论心房颤动的首发诊断需要依靠心电图,房颤相关的流行病学研究多数为横断面研究,缺乏心脏结构和功能随着房颤患病时间延长如何变化的研究。本研究回顾性地分析了我院超声心动图中病因学诊断为“心房颤动”患者的临床资料,从超声角度分析房颤的诊断及评价外科瓣膜手术对终末期房颤的疗效。
3.1 “心房颤动”患者的瓣膜病变分析目前,临床上心电图或者动态心电图表现为持续性心房颤动、长程持续性心房颤动或永久性心房颤动的患者大致可以分为三类:①伴有明显的二尖瓣和/或三尖瓣器质性改变,如风湿性心脏病、二尖瓣脱垂等;②心房不同程度扩大,房室瓣环扩张,瓣叶及其附属结构未见明显的病变,伴有或不伴有不同程度的房室瓣中心性反流;③继发于其他疾病,如肥厚性梗阻性心肌病、先天性心脏病、冠心病、主动脉瓣病变等。第二类房颤患者的房室瓣特点即为心房功能性房室瓣反流[20]。这一概念区别于第一类患者的器质性房室瓣膜病变,也区别于心室功能性房室瓣反流,其主要表现为缺血性二尖瓣反流。
在我们临床超声诊断观察及文献检索中发现,房颤患者的房室瓣病理特点与房室瓣非典型脱垂有很多相似之处[21]。房室瓣脱垂样改变的人群发生率在15%~35%[22-24]。1988年JACC仅将其中瓣叶增厚大于5 mm的患者定义为典型脱垂,人群患病率在2%~3%,除此之外的个体则定义为非典型脱垂,目前认为这部分个体属于正常群体范畴[25]。房室瓣脱垂常伴有心律失常[26],除瓣膜及其附属结构异常,常伴有非缺血性心肌纤维化[27-28],可能是某些心源性猝死患者唯一可以发现的心脏异常[29]。
所有房颤患者中瓣膜性、非瓣膜性和孤立性房颤所占比例分别为12.9%、65.2%和21.9%[30]。我们针对病因学诊断“心房颤动”患者的临床治疗观察中发现,此类患者的房室瓣反流程度随着观察时间及药物治疗的变化也发生着变化。693例患者在本研究期间共进行超声心动图检查人均3.7次,一部分患者通过控制心室率、内科对症治疗后,房室瓣反流程度可减轻,其中23例患者还进行了内科房颤射频消融术;另一部分患者因房室瓣反流加重、生活质量明显下降而进行了外科手术治疗。房颤与心脏结构之间的相互作用,决定了房颤的治疗应该是一个连续过程,面对每一个阶段的患者需要采取相应的措施,心脏超声的恰当评价是治疗策略制定的关键。
以上表明,心房功能性房室瓣反流,应该与非瓣膜性房颤所属同一群体,是一种特殊类型的瓣膜病。我们认为心房颤动应该是一系列心脏病理生理的变化过程,而不只是单纯的心律失常。这个变化应该是包括心肌组织、心脏瓣膜及瓣环、心律失常及心脏功能等多个因素相互作用的病理过程。在超声心动图检查中,针对心房颤动患者应重点描述瓣膜及瓣环的结构及形态,并要注意各项指标的量化评价,以便进行治疗前后的对比,为房颤的个性化治疗提供有力依据。
3.2 未手术患者的临床特点分析本研究发现未手术组患者的房颤病史明显长于手术组,左室舒张末期内径明显大于手术组,左室的舒张和收缩功能及右室舒张功能明显低于手术组,说明未手术组患者的临床症状及心功能分级较手术组重[14]。我们考虑此种情况与房颤病史较长未予及时纠正房室瓣反流有关,结果不仅心房内径增大,而且左室内径也有增大;不仅表现为气短、乏力等较重的临床症状,还表现出明显的焦虑以及消极的生活态度。这类患者一般不会主动选择外科瓣膜手术治疗,且考虑到术前危险因素太多以及手术风险较大等情况[15-16],很多医师也不会积极劝说患者进行瓣膜手术治疗。因此大量的长年房颤患者未能及时止损,使得病情拖延,错过了最佳的治疗时期。
3.3 外科瓣膜手术治疗的效果505例房室瓣反流较重患者中,同意瓣膜手术治疗有124例。围术期死亡1例,123例术后随访6~94个月,平均随访时间为63.03(54.61~71.44)个月,术后心功能分级均有明显改善(P < 0.001),焦虑自评量表(SAS)评分明显下降(P < 0.001)。本研究为回顾性分析,发现123例患者中16例在瓣膜手术同时行迷宫术,其中14例恢复并维持了窦性心律(87.5%);单纯行瓣膜手术107例,其中18例患者可以恢复并维持窦性心律(16.8%)。由此说明,外科瓣膜手术中断了房室瓣反流与房颤之间的恶性循环,结合迷宫手术使得窦性心律的维持率提高[31],同时也有少部分患者因为房室瓣反流终止、心房逆重构而自行恢复了窦性心律,这在我们的前期研究中也有论述[32]。
本研究进一步证明了房室瓣反流的因素在房颤的始发和维持中具有关键作用,这就提醒临床医师,针对房室瓣环扩张、房室瓣大量反流且内科治疗效果差的终末期房颤患者,更应该积极推荐患者行瓣膜同时加做迷宫的手术,这样可以及时遏制病情进展并使患者获得良好的预后效果,即房颤的治疗需要考虑房室瓣反流特点。本研究为回顾性研究,多数患者来源于门诊,只有手术患者的术后随访资料,缺乏未手术患者的随访资料,所以结论可能存在一定的局限性。
临床中应注意结合房颤的不同阶段及房室瓣反流的特点制定个性化治疗方案。若发现房室瓣反流较前明显增加或房室瓣瓣环扩张明显,不应一味地行内科保守治疗,避免贻误手术时机,应消除对外科手术的恐惧与抵触,尽早地行外科瓣膜手术,使房颤患者获得良好的预后。
| [1] |
KANNEL W B, WOLF P A, BENJAMIN E J, et al. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates 11 Reprints are not available[J]. Am J Cardiol, 1998, 82(7): 2N-9N. DOI:10.1016/s0002-9149(98)00583-9 |
| [2] |
HEERINGA J, VAN DER KUIP D A M, HOFMAN A, et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study[J]. Eur Heart J, 2006, 27(8): 949-953. DOI:10.1093/eurheartj/ehi825 |
| [3] |
SPOSATO L A, CIPRIANO L E, SAPOSNIK G, et al. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack: a systematic review and meta-analysis[J]. Lancet Neurol, 2015, 14(4): 377-387. DOI:10.1016/s1474-4422(15)70027-x |
| [4] |
ANGIOLILLO D J, GOODMAN S G, BHATT D L, et al. Antithrombotic therapy in patients with atrial fibrillation treated with oral anticoagulation undergoing percutaneous coronary intervention: A north American perspective-2018 update[J]. Circulation, 2018, 138(5): 527-536. DOI:10.1161/circulationaha.118.034722 |
| [5] |
WESTERMAN S, WENGER N. Gender differences in atrial fibrillation: a review of epidemiology, management, and outcomes[J]. Curr Cardiol Rev, 2019, 15(2): 136-144. DOI:10.2174/1573403x15666181205110624 |
| [6] |
GASPARINI M, GALIMBERTI P. Atrial fibrillation and cardiac resynchronization therapy[J]. Curr Opin Cardiol, 2018, 33(1): 1-6. DOI:10.1097/hco.0000000000000472 |
| [7] |
MOLTENI M, POLO FRIZ H, PRIMITZ L, et al. The definition of valvular and non-valvular atrial fibrillation: results of a physicians' survey[J]. Europace, 2014, 16(12): 1720-1725. DOI:10.1093/europace/euu178 |
| [8] |
DE CATERINA R, CAMM A J. What is 'valvular' atrial fibrillation? A reappraisal[J]. Eur Heart J, 2014, 35(47): 3328-3335. DOI:10.1093/eurheartj/ehu352 |
| [9] |
FAUCHIER L, PHILIPPART R, CLEMENTY N, et al. How to define valvular atrial fibrillation?[J]. Arch Cardiovasc Dis, 2015, 108(10): 530-539. DOI:10.1016/j.acvd.2015.06.002 |
| [10] |
DEFERM S, BERTRAND P B, VERBRUGGE F H, et al. Atrial functional mitral regurgitation[J]. J Am Coll Cardiol, 2019, 73(19): 2465-2476. DOI:10.1016/j.jacc.2019.02.061 |
| [11] |
SILBIGER J J. Mechanistic insights into atrial functional mitral regurgitation: Far more complicated than just left atrial remodeling[J]. Echocardiography, 2019, 36(1): 164-169. DOI:10.1111/echo.14249 |
| [12] |
MACHINO-OHTSUKA T, SEO Y, ISHIZU T, et al. Novel mechanistic insights into atrial functional mitral regurgitation-3-dimensional echocardiographic study[J]. Circ J, 2016, 80(10): 2240-2248. DOI:10.1253/circj.cj-16-0435 |
| [13] |
MURARU D, GUTA A C, OCHOA-JIMENEZ R C, et al. Functional regurgitation of atrioventricular valves and atrial fibrillation: an elusive pathophysiological link deserving further attention[J]. J Am Soc Echocardiogr, 2020, 33(1): 42-53. DOI:10.1016/j.echo.2019.08.016 |
| [14] |
LOMBARD F W, LIANG Y. Risk factors for mitral valve surgery: atrial fibrillation and pulmonary hypertension[J]. Semin Cardiothorac Vasc Anesth, 2019, 23(1): 57-69. DOI:10.1177/1089253218821694 |
| [15] |
SERPYTIS R, NAVICKAITE A, SERPYTIENE E, et al. Impact of atrial fibrillation on cognitive function, psychological distress, quality of life, and impulsiveness[J]. Am J Med, 2018, 131(6): 703.e1-703.e5. DOI:10.1016/j.amjmed.2017.12.044 |
| [16] |
WALTERS T E, WICK K, TAN G, et al. Symptom severity and quality of life in patients with atrial fibrillation: Psychological function outweighs clinical predictors[J]. Int J Cardiol, 2019, 279: 84-89. DOI:10.1016/j.ijcard.2018.10.101 |
| [17] |
金岩, 张誉籍, 于岩, 等. 病因学诊断"心房颤动"患者心脏超声特点及临床应用[J]. 临床军医杂志, 2020, 48(6): 634-637, 648. JIN Y, ZHANG Y J, YU Y, et al. Echocardiographic features and clinical application of etiological diagnosis in patients with atrial fibrillation[J]. J Clin Mil Med, 2020, 48(6): 634-637, 648. |
| [18] |
NISHIMURA R A, TAJIK A J. Quantitative hemodynamics by Doppler echocardiography: a noninvasive alternative to cardiac catheterization[J]. Prog Cardiovasc Dis, 1994, 36(4): 309-342. DOI:10.1016/s0033-0620(05)80037-4 |
| [19] |
NISHIMURA R A, CARABELLO B. Operationalizing the 2014 ACC/AHA guidelines forvalvular heart disease: a guide for clinicians[J]. J Am Coll Cardiol, 2016, 67(19): 2289-2294. DOI:10.1016/j.jacc.2016.02.065 |
| [20] |
UDO E O, HASSINK R J. Pulmonary vein isolation as a treatment for severe atrial functional mitral regurgitation in a patient with atrial fibrillation[J]. Int J Cardiol, 2014, 175(3): 578-579. DOI:10.1016/j.ijcard.2014.05.025 |
| [21] |
MTOUR S, ROSENMANN D, JUBEH R, et al. Mitral regurgitation improvement after conversion of atrial fibrillation to sinus rhythm[J]. Eur Heart J, 2013, 34(suppl 1): P4749. DOI:10.1093/eurheartj/eht310.p4749 |
| [22] |
SAVAGE DD, DEVEREUX R B, GARRISON R J, et al. Mitral valve prolapse in the general population. 2. Clinical features: The Framingham Study[J]. Am Heart J, 1983, 106(3): 577-581. DOI:10.1016/0002-8703(83)90705-6 |
| [23] |
WARTH D C, KING M E, COHEN J M, et al. Prevalence of mitral valve prolapse in normal children[J]. J Am Coll Cardiol, 1985, 5(5): 1173-1177. DOI:10.1016/s0735-1097(85)80021-8 |
| [24] |
SAVAGE D D, GARRISON R J, DEVEREUX R B, et al. Mitral valve prolapse in the general population. Ⅰ. Epidemiologic features: The Framingham Study[J]. Am Heart J, 1983, 106(3): 571-576. DOI:10.1016/0002-8703(83)90704-4 |
| [25] |
LEVINE R A, STATHOGIANNIS E, NEWELL J B, et al. Reconsideration of echocardiographic standards for mitral valve prolapse: Lack of association between leaflet displacement isolated to the apical four chamber view and independent echocardiographic evidence of abnormality[J]. J Am Coll Cardiol, 1988, 11(5): 1010-1019. DOI:10.1016/s0735-1097(98)90059-6 |
| [26] |
BASSO C, PERAZZOLO MARRA M, RIZZO S, et al. Arrhythmic mitral valve prolapse and sudden cardiac death[J]. Circulation, 2015, 132(7): 556-566. DOI:10.1161/circulationaha.115.016291 |
| [27] |
BALLESTER M, PRESBITERO P, FOALE R, et al. Prolapse of the mitral valve insecundum atrial septal defect: a functional mechanism[J]. Eur Heart J, 1983, 4(7): 472-476. DOI:10.1093/oxfordjournals.eurheartj.a061504 |
| [28] |
MA S Y, MA J, TU Q Q, et al. Isoproterenol increases left atrial fibrosis and susceptibility to atrial fibrillation by inducing atrial ischemic infarction in rats[J]. Front Pharmacol, 2020, 11: 493. DOI:10.3389/fphar.2020.00493 |
| [29] |
MARON B J, DOERER J J, HAAS T S, et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980-2006[J]. Circulation, 2009, 119(8): 1085-1092. DOI:10.1161/CIRCULATIONAHA.108.804617 |
| [30] |
周自强, 胡大一, 陈捷, 等. 中国心房颤动现状的流行病学研究[J]. 中华内科杂志, 2004(7): 15-18. ZHOU Z Q, HU D Y, CHEN J, et al. Epidemiology of atrial fibrillation in China[J]. Chin J Intern Med, 2004(7): 15-18. |
| [31] |
MACHINO-OHTSUKA T, SEO Y, ISHIZU T, et al. Efficacy, safety, and outcomes of catheter ablation of atrial fibrillation in patients with heart failure with preserved ejection fraction[J]. J Am Coll Cardiol, 2013, 62(20): 1857-1865. DOI:10.1016/j.jacc.2013.07.020 |
| [32] |
金岩, 王辉山, 汪曾炜, 等. 心房颤动对不同病因的二尖瓣手术治疗预后的影响[J]. 中华胸心血管外科杂志, 2014, 30(4): 213-217. JIN Y, WANG H S, WANG Z W, et al. The influence of atrial fibrillation on prognosis after mitral valve surgery in rheumatic mitral valve Stenosis and mitral valve prolapse patients[J]. Chin J Thorac Cardiovasc Surg, 2014, 30(4): 213-217. |




