原发性肝癌(primary hepatic carcinoma,PLC)是世界上最常见的恶性肿瘤之一,而肝细胞癌(hepatocellular carcinoma,HCC)占90%以上,它是全球第五大最常见的癌症,也是导致癌症相关性死亡的第三大主要原因[1]。此外,乙型肝炎病毒(hepatitis B virus,HBV)慢性感染在导致HCC发生的相关因素中占60%[2]。由于HBV-HCC的发病率和死亡率,它已成为发展中国家一个困难的公共卫生问题,并且由于其局限的早期诊断和治疗,情况正逐渐严峻[3]。此外,HBV感染还可以引起一系列其他临床疾病,包括无症状携带者、急性重症肝炎、慢性肝炎和肝硬化等[1]。研究表明乙型肝炎病毒X(hepatic B virus, HBx)是HBV的核心功能蛋白[4],并在HBV-HCC中起重要作用。但是,HBx导致HCC的具体机制尚不清楚,因此对HBx功能的研究显得极为迫切。Notch信号通路是一条进化中高度保守的通路。它参与许多发育过程,例如细胞命运确定、终末分化和增殖[5]。研究表明,Notch信号通路的异常激活可以诱导癌细胞增殖、转移和恶化[6-7],这是影响HCC发生发展中最为重要的因素之一。在对肿瘤相关通路深入研究的基础上,Notch信号通路已被认为是治疗HCC的潜在分子靶标[8]。研究表明,HBx可以通过影响Notch1和Notch4来激活Notch信号通路[9]。
因此,我们通过肝门静脉将HBx-EGFP-14-19细胞注射入昆明小鼠体内,以此建立正常免疫下感染HBx的慢性动物模型。我们的目的是监测从HBx感染到HCC发生过程中,Notch信号通路的长期动态变化,并探索HBx在小鼠体内的功能,为HCC的早期诊断和治疗奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞永生化的小鼠肝前体细胞株14-19由美国芝加哥大学分子肿瘤实验室捐赠,慢病毒稳转细胞系EGFP-14-19和HBx-EGFP-14-19由课题组前期构建并保存于实验室[10]。
1.1.2 动物无特定病原体(specificpathogen free,SPF)级的雄性昆明小鼠由重庆医科大学实验动物中心提供并代养。
1.1.3 主要试剂DMEM细胞高糖培养基购自HyClone公司,FBS胎牛血清购自Cell Box公司,抑制剂DAPT购自Selleck公司,总RNA提取试剂盒购自北京康为世纪生物科技有限公司,反转录试剂盒购自南京诺唯赞生物科技有限公司,SYBR Green mix实时荧光定量试剂盒购自Bimake公司,SDS-PAGE凝胶配置试剂盒购自碧云天生物技术公司,GAPDH抗体和Notch1抗体购自Cell Signaling Technology公司,HBx抗体购自Abcam公司,Notch4抗体和Hes1抗体购自爱博泰克生物有限公司,Bcl-2抗体购自上海泊湾生物科技有限公司,Bax抗体购自南京巴傲得生物科技有限公司,CDK4和CyclinE抗体购自万类生物科技有限公司,CyclinD1抗体购自Bimake公司,ECL发光液购自Advansta公司。
1.2 方法 1.2.1 细胞培养将小鼠肝前体细胞14-19,EGFP-14- 19和HBx-EGFP-14-19复苏后培养在添加10%胎牛血清和1%双抗的DMEM(高糖)培养基中,于5%CO2、37 ℃的培养箱中培养。
1.2.2 动物模型构建及抑制剂40只6~8周雄性昆明小鼠随机分为3组:正常(生理盐水)组(n=5)、EGFP-14-19组(n=5)和HBx-EGFP-14-19组(下设6个时相点,每个时相点5只)。手术前将小鼠禁食1 d,麻醉后固定四肢,用酒精消毒腹部,然后按腹中线切口暴露肝脏。找到肝脏后的肝门静脉,并缓慢注入生理盐水(每只小鼠200 μL)、EGFP-14-19或HBx-EGFP-14-19细胞悬液(5×105细胞数的200 μL PBS悬液),轻压棉球止血,缝合腹腔。分别在30、90、180和360 d对小鼠实施安乐死,取肝组织。
另取180 d HBx-EGFP-14-19小鼠15只,随机分为3组(n=5):阴性对照组(HBx-EGFP-14-19)、阳性对照组(DMSO)和治疗组(DAPT)。DMSO对照组给予等量4% DMSO,治疗组给予DAPT(100 mg/kg),腹腔注射后72 h,对动物实施安乐死,并切除肝脏组织。
将所有肝脏样品切取部分新鲜组织浸泡于4%多聚甲醛中,其余保存在液氮中,用于后续实验。
1.2.3 HE染色脱蜡后对组织切片行HE染色,并用中性树脂固定载玻片,然后在光学显微镜下观察并拍照。
1.2.4 RT-qPCR检测用总RNA提取试剂盒提取每组小鼠的总RNA。按照反转录试剂盒的操作说明将RNA转录为cDNA,然后用无酶水将cDNA稀释10倍。每个RT-qPCR反应系统均由5 μL SYBR Green混合物、2 μL cDNA模板、0.5 μL正向引物和反向引物(5 μmol/L)和无酶水组成,总体积为10 μL,使用GAPDH作为内参,引物序列见表 1。每组有3个复孔,实验重复3次。用CFX Manager软件系统分析数据。
| 基因 | 引物序列 | |
| HBx | 上游 | 5′-TGCGGACGACCCTTCTCGGG-3′ |
| 下游 | 5′-GGGCAACATTCGGTGGGCGT-3′ | |
| Notch1 | 上游 | 5′-GATGGCCTCAATGGGTACAAG-3′ |
| 下游 | 5′-TCGTTGTTGTTGATGTCACAGT-3′ | |
| Notch4 | 上游 | 5′-GAACGCGACATCAACGAGTG-3′ |
| 下游 | 5′-GGAACCCAAGGTGTTATGGCA-3′ | |
| Hes1 | 上游 | 5′-TCAACACGACACCGGACAAAC-3′ |
| 下游 | 5′-ATGCCGGGAGCTATCTTTCTT-3′ | |
| Bcl-2 | 上游 | 5′-TCCATCTGACCCTCCGCC-3′ |
| 下游 | 5′-CCCAGTTCACCCCATCCCT-3′ | |
| Bax | 上游 | 5′-TGAAGACAGGGGCCTTTTTG-3′ |
| 下游 | 5′-AATTCGCCGGAGACACTCG-3′ | |
| CDK4 | 上游 | 5′-TCAGCACAGTTCGTGAGGTG-3′ |
| 下游 | 5′-TCCATCAGCCGTACAACATTG-3′ | |
| CyclinE | 上游 | 5′-CTCCGACCTTTCAGTCCGC-3′ |
| 下游 | 5′-CACAGTCTTGTCAATCTTGGCA-3′ | |
| CyclinD1 | 上游 | 5′-GCGTACCCTGACACCAATCTC-3′ |
| 下游 | 5′-ACTTGAAGTAAGATACGGAGGGC-3′ | |
| GAPDH | 上游 | 5′-CTCGTCCCGTAGACAAAATGGT-3′ |
| 下游 | 5′-GAGGTCAATGAAGGGGTCGTT-3′ |
1.2.5 Western blot检测
剪取适量小鼠肝脏组织于液氮中研磨,加入预先配好的裂解液缓冲液(RIPA ∶PMSF=100 ∶1),于冰上孵育40 min后在4 ℃以12 000 r/min离心20 min,收集上清液作为总蛋白,使用BCA试剂盒测量总蛋白浓度。在上清液中加入蛋白上样缓冲液,于100 ℃煮沸变性15 min。通过SDS-PAGE电泳分离总蛋白(40 μg),并将其转印至PVDF膜上。室温下5%脱脂牛奶中封闭2 h后,将膜孵育于一抗,4 ℃过夜。用TBST洗掉膜上多余的一抗后,于二抗中室温孵育2 h,然后用ECL发光液于自动凝胶成像系统中显影,Image Lab软件测量灰度值,GAPDH作为内参。
1.3 统计学分析所有实验数据均以x±s表示,各组间的差异采用单因素方差分析。使用GraphPad Prism 5.0进行统计分析。
2 结果 2.1 HBx在小鼠肝前体细胞中的表达鉴定经复苏培养后,Western blot和RT-qPCR显示与14-19和EGFP-14-19细胞相比,HBx-EGFP-14-19细胞中HBx仍呈现显著高表达(P < 0.01, P < 0.001, 图 1),说明HBx在肝前体细胞中转染成功。
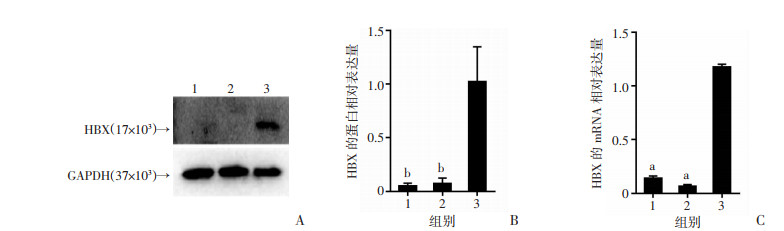
|
| 1:14-19组;2:EGFP-14-19组;3:HBx-EGFP-14-19组; A:Western blot检测细胞株中HBx的蛋白表达; B:蛋白表达半定量分析;C:RT-qPCR检测细胞株中HBx的mRNA表达; a:P < 0.001,b:P < 0.01,与HBx-EGFP-14-19组比较 图 1 肝前体细胞株中HBx的鉴定(n=3,x±s) |
2.2 HBx在小鼠肝脏组织中的表达鉴定
采用RT-qPCR和Western blot检测正常、EGFP-14-19组以及HBx-EGFP-14-19 30、90、180、360 d等6组中HBx的表达,以鉴定动物模型。Western blot结果表明,与EGFP-14-19组和正常组相比,HBx在HBx-EGFP-14-19组中显著过表达(P < 0.001,图 2A、B),RT-qPCR结果一致(P < 0.05,图 2C)。表明HBx在小鼠模型中能持续性过表达,动物模型构建成功。

|
| 1:正常组;2:EGFP-14-19组;3~6分别为HBx-EGFP-14-19 30、90、180、360 d组;A:Western blot检测小鼠肝脏组织中HBx的蛋白表达;B:蛋白表达半定量分析;C:RT-qPCR检测小鼠肝脏组织中HBx的mRNA表达a:P < 0.001,b:P < 0.01,c:P < 0.05,与正常组、EGFP-14-19组比较 图 2 小鼠肝脏组织中HBx的鉴定(n=5,x±s) |
2.3 小鼠肝肿瘤鉴定
本研究在收集HBx-EGFP-14-19 360 d小鼠肝脏样本时发现部分小鼠肝脏出现肿瘤,且肝脏表面有结节性病灶突起,直径约为1 cm。HE染色镜下观显示,与正常肝组织相比,肿瘤组织中肝小叶结构基本消失且癌细胞大小不同,异型性明显(图 3)。上述结果为HBx可致癌性提供了直接证据。
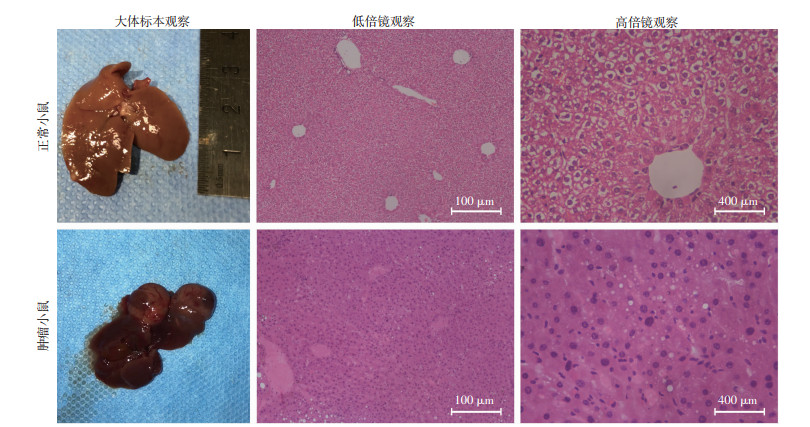
|
| 图 3 正常组与肿瘤组360 d小鼠肝脏大体标本及HE染色病理学观察 |
2.4 Notch信号通路在感染HBx后不同时间点的动态变化
为了探讨HBx对Notch信号通路的影响,本研究使用RT-qPCR和Western blot检测了HBx-EGFP-14-19组中不同天数的Notch1、Notch4和下游靶基因Hes1的表达。结果显示,Notch1、Notch4和Hes1在不同天数HBx-EGFP-14-19组中的蛋白表达持续升高,且显著高于正常组和EGFP-14-19组(P < 0.05,P < 0.05,P < 0.01,图 4A~D),mRNA水平与此一致(图 4E~G)。这表明HBx在体内通过促进Notch1和Notch4的表达持续性激活Notch信号通路,且Notch信号通路的持续激活可能是导致HBx-HCC发生的最重要的原因之一。

|
| 1:正常组;2:EGFP-14-19组;3~6分别为HBx-EGFP-14-19 30、90、180、360 d组;A~D:Western blot检测不同时间点小鼠肝脏组织中Notch1、Notch4、Hes1的蛋白表达及半定量分析;E~G:RT-qPCR检测不同时间点小鼠肝脏组织中Notch1、Notch4、Hes1的mRNA表达;a:P < 0.001,b:P < 0.01,c:P < 0.05,与正常组、EGFP-14-19组比较 图 4 不同时间点Notch信号通路的动态监测(n=5,x±s) |
2.5 HBx抗凋亡和促进细胞周期进程的作用是依赖于Notch信号通路
为了进一步证明HBx的抗凋亡和细胞周期加速作用与Notch信号通路之间的关系,我们对HBx-EGFP-14-19 180 d小鼠给予了Notch信号通路抑制剂DAPT,同时以DAPT溶剂(4%的等量DMSO)为阳性对照。Western blot结果显示给予DAPT后,Notch1、Notch4和Hes1的蛋白水平均显著降低(P < 0.001,图 5A~D),RT-qPCR结果与此一致(P < 0.001,图 5E~F)。
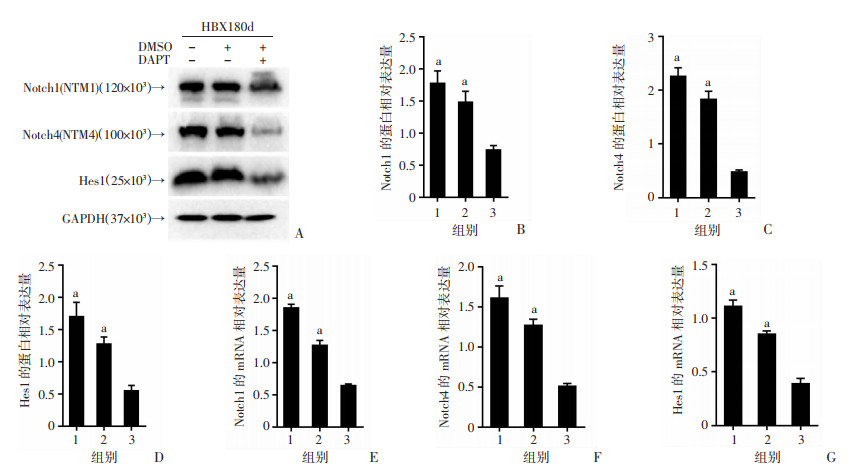
|
| 1:HBx-EGFP-14-19 180 d组;2:HBx-EGFP-14-19 180 d-DMSO组;3:HBx-EGFP-14-19 180 d-DAPT组;A~D:Western blot检测使用DAPT后的Notch1、Notch4和Hes1的蛋白表达及半定量分析;E~G:RT-qPCR检测使用DAPT后的Notch1、Notch4和Hes1的mRNA水平;a:P < 0.001,与HBx-EGFP-14-19 180 d-DAPT组比较 图 5 Notch信号通路在小鼠体内被显著抑制(n=5,x±s) |
抗凋亡因子Bcl-2的蛋白水平在HBx-EGFP-14-19 180 d显著增加,而促凋亡因子Bax显著降低(P < 0.001,图 6A~C),mRNA水平与蛋白表达一致(P < 0.05,P < 0.001,图 6D、E)。Western blot检测细胞周期相关因子的结果显示CDK4、CyclinE和CyclinD1在HBx-EGFP-14-19 180 d的蛋白表达均显著上调(P < 0.01,P < 0.001,P < 0.01,图 6F~I),RT-qPCR显示其基因水平与蛋白表达一致(P < 0.001,P < 0.001,P < 0.01,图 6J~L)。然而上述因子的异常表达均被DAPT显著扭转。基于以上数据,我们推测HBx在小鼠体内可以通过持续激活Notch信号通路,以此调节肝细胞凋亡并加速细胞周期进程,进而促进肝细胞癌的发生。
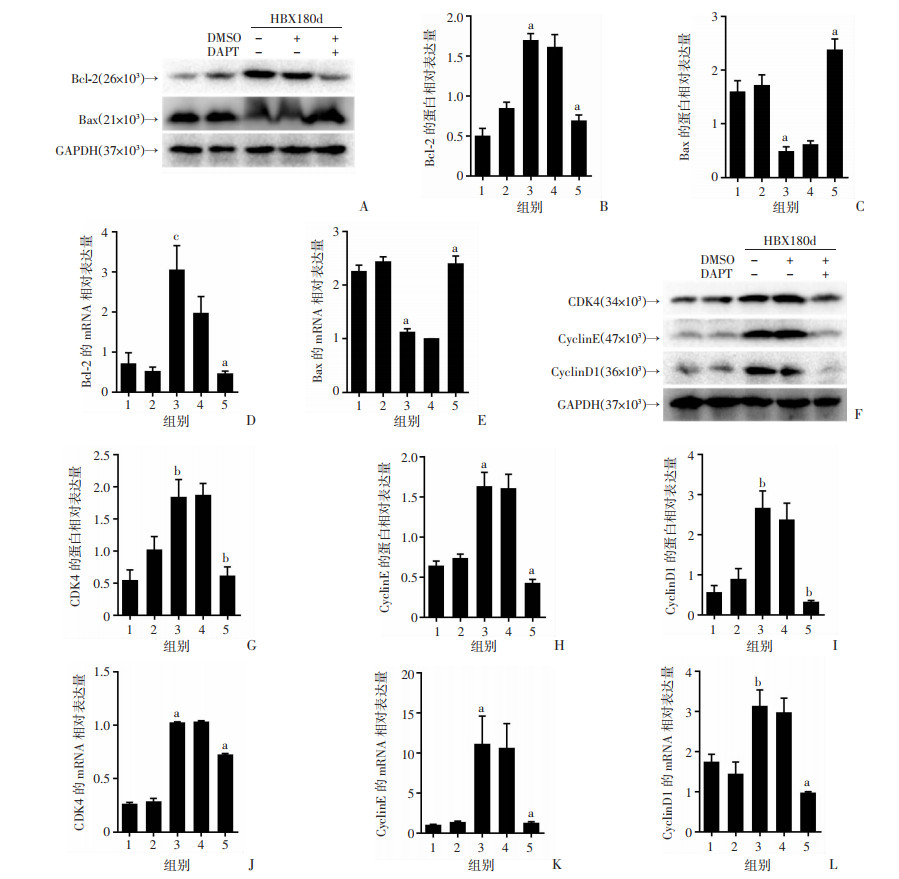
|
| 1:正常组;2:EGFP-14-19组;3:HBx-EGFP-14-19 180 d组;4:HBx-EGFP-14-19 180 d-DMSO组;5:HBx-EGFP-14-19 180 d-DAPT组;A~E:Western blot和RT-qPCR检测抗凋亡指标Bcl-2和促凋亡指标Bax的蛋白表达及mRNA水平a:P < 0.001,b:P < 0.01,c:P < 0.05,与正常组、EGFP-14-19组比较;F~L:Western blot和RT-qPCR检测细胞周期相关指标CDK4、CyclinE、CyclinD1的蛋白表达及mRNA水平a:P < 0.001,b:P < 0.01,与HBx-EGFP-14-19 180 d组、HBx-EGFP-14-19 180 d-DMSO组比较 图 6 HBx在小鼠体内导致肝细胞凋亡和细胞周期相关指标的异常变化与Notch信号通路间的关系(n=5,x±s) |
3 讨论 3.1 HBx与HCC
HCC是世界上常见的恶性肿瘤之一,且病死率极高,严重威胁着人类生命和社会发展[11]。导致HCC发生的危险因素包括过量饮酒、HBV感染、黄曲霉毒素和酒精性脂肪肝,但60%的HCC病例归因于HBV[4]。HBV病毒是一种共价封闭的环状DNA(covalently closed circular DNA,cccDNA),包含一个3.2×103的基因组,该基因组作为转录模板存在于肝细胞核中[12]。此外,正是其核心蛋白HBx促进了HBV病毒基因组的转录[13]。先前的研究表明,上述过程的进行取决于HBx与宿主损伤特异性DNA结合蛋白1(damage-specifific DNA-binding protein 1,DDB1)的结合[14]。此外,HBx还通过上调去乙酰化酶2(sirtuin 2, SIRT2)的表达来促进HBV复制和肝癌发生[15]。
尽管目前可接种HBV疫苗,但世界上仍有2.4亿人受到感染,且许多慢性HBV感染者会发展成肝癌[16]。而现有的肝癌治疗手段复发率高、预后差,只能提高生存率。因此,越来越多的研究者将注意力转向了肝癌的遗传背景和分子机制等方面[17-18],旨在发现异常变化并尽早进行干预。但是,先前关于HBx-HCC的大多数研究均使用传统的免疫缺陷肿瘤模型或转基因小鼠模型[19-20],由于肿瘤的形成与复杂的免疫功能障碍有关,因此在某种程度上具有一定的局限性。在本研究中,我们通过将HBx-EGFP-14-19细胞注射到正常免疫的昆明小鼠中,构建了长期稳定携带HBx的动物模型,以探索HBx引起HCC的机制。我们的动物模型是在自然状态下模拟HBx感染,因此可能更接近真实结果。
3.2 Notch信号通路与HCCNotch信号通路介导的旁分泌信号传导路径是通过跨膜配体和受体相互作用而实现的,通路激活使相邻细胞进行通讯传导,从而调节凋亡、增殖和决定细胞命运等[21]。Notch信号通路主要由Notch受体、Notch配体和细胞内效应分子组成[22],其激活需要相邻细胞的受体和配体结合,然后被γ-分泌酶切割成Notch细胞内结构域(notch intracellular domain,NICD),NICD进入细胞核并与RBPJ区域(recombination signal binding protein for immunoglobulin kappa J region)结合,最终激活下游转录因子Hes和Hey家族等。当前,已经在哺乳动物中发现了Notch 1/2/3/4四个受体和Delta-like 1 (DLL1)、DLL3、DLL4、Jagged 1(JAG1)和JAG2五个配体。
近年来,越来越多的研究表明Notch信号通路在肝癌的发生发展中起着重要作用,并逐渐成为肝癌研究中的热点。研究表明[23],Notch信号通路可以通过激活下游核受体基因NR4A2发挥致癌作用。雄激素受体(Androgen receptor,AR)可以通过下调Notch4的表达,从而抑制HCC血管生成[24]。基因工程模型研究表明[25],长期表达NICD的裸鼠模型在6个月时肿瘤生长率达到33%,在9个月达到50%,而在12个月达到100%,同时在体外阻断Notch信号通路的表达时也显著抑制了肝癌细胞的恶性增殖。这些数据表明,Notch信号通路不仅影响HCC的进展,而且可能是诱导HCC发生的重要因素,我们的研究结果与此一致。首次以长期动态方式监测Notch信号通路的变化,我们发现Notch1和Notch4在感染HBx 30 d后显示明显的高表达,并一直持续到360 d HCC发生。我们的研究提供了充分的证据,表明Notch信号通路的异常激活是导致HCC发生的重要因素。此外,Notch还可以与Hippo信号通路形成正反馈回路,以促进HCC的进展[26]。但是,Notch信号通路、HBx和HCC之间的关系和分子机制尚不清楚。因此,我们的研究基于携带HBx的正常免疫小鼠模型,检测了Notch通路特异性抑制剂DAPT使用前后的细胞周期相关因子和凋亡相关因子的变化,初步探讨了三者间的关系和机制。
3.3 总结与展望总之,我们构建了一个新的小鼠模型来探讨HBx的功能和分子机制。不仅首次以长期动态的方式监测了从HBx感染到HCC发生过程中的Notch信号通路的变化,而且在360 d模型小鼠中发现了肝癌产生,这首次为HBx的可致癌性提供了直接证据。我们的研究结果表明,HBx在体内持续性激活Notch信号通路,从而促进细胞周期异常加速并抑制细胞凋亡,最终导致HCC的发生。重要的是,这些数据为肝癌的早期诊断和治疗奠定了基础。值得注意的是,我们的小鼠模型是使用肝前体细胞(hepatic progenitor cells,HPCs)来构建携带HBx的慢病毒,而不是肿瘤细胞或正常肝细胞。据报道,肝前体细胞可以分化为肝细胞和胆管上皮细胞,而人类肝细胞癌变可能是基于HPCs的转化[27]。此外,HCC细胞的形态主要是细胞谱系中的早期恶性转化,通常起源于HPCs[28]。因此,使用不同的细胞系构建模型更有利于探索肝癌的起源机制。
此外,HBx还可以通过其他信号通路和因子来调节Notch通路,从而促进HCC的进程。根据本课题组前期结果[10]和SOKOLOWSKI等[29]的研究,我们推测HBx可以通过调节Akt信号通路来激活Notch信号通路。另外,首次发现的HBx-miR-3188-ZHX2-Notch1信号通路在HBV-HCC的进展中同样起着重要作用[30]。此外,研究表明[31-32],有免疫抑制作用的代表性因子IL-35等在HCC患者血清中显著高表达,且在慢性HBV感染环境下,IL-35可通过抑制抗病毒免疫反应来维持病毒持久性地发挥功能。因此,我们下一步将继续关注HBx、Notch信号通路和HCC之间的关系,并结合HBx抑制剂,充分发挥正常免疫小鼠模型的优势,着重探讨HBx导致的免疫环境改变,与Notch信号通路异常激活而促使HCC发生间的关系,以加深这三者之间的分子机制研究。然后在我们的小鼠模型基础上进行药物前期干预,旨在找到新的HCC诊断及药物治疗靶标。
| [1] |
SONG P, TOBE R G, INAGAKI Y, et al. The management of hepatocellular carcinoma around the world: a comparison of guidelines from 2001 to 2011[J]. Liver Int, 2012, 32(7): 1053-1063. DOI:10.1111/j.1478-3231.2012.02792.x |
| [2] |
SARTORIUS K, SWADLING L, AN P, et al. The multiple roles of hepatitis B virus X protein (HBx) dysregulated MicroRNA in hepatitis B virus-associated hepatocellular carcinoma (HBV-HCC) and immune pathways[J]. Viruses, 2020, 12(7): E746. DOI:10.3390/v12070746 |
| [3] |
SARTORIUS K, MAKAROVA J, SARTORIUS B, et al. The regulatory role of MicroRNA in hepatitis-B virus-associated hepatocellular carcinoma (HBV-HCC) pathogenesis[J]. Cells, 2019, 8(12): E1504. DOI:10.3390/cells8121504 |
| [4] |
LAMONTAGNE R J, BAGGA S, BOUCHARD M J. Hepatitis B virus molecular biology and pathogenesis[J]. Hepatoma Res, 2016, 2: 163-186. DOI:10.20517/2394-5079.2016.05 |
| [5] |
LU J, XIA Y J, CHEN K, et al. Oncogenic role of the Notch pathway in primary liver cancer[J]. Oncol Lett, 2016, 12(1): 3-10. DOI:10.3892/ol.2016.4609 |
| [6] |
HUANG Q F, LI J H, ZHENG J H, et al. The carcinogenic role of the notch signaling pathway in the development of hepatocellularcarcinoma[J]. J Cancer, 2019, 10(6): 1570-1579. DOI:10.7150/jca.26847 |
| [7] |
WANG X Q, ZHANG W, LUI E L H, et al. Notch1-Snail1-E-cadherin pathway in metastatic hepatocellular carcinoma[J]. Int J Cancer, 2012, 131(3): E163-E172. DOI:10.1002/ijc.27336 |
| [8] |
GIOVANNINI C, MINGUZZI M, GENOVESE F, et al. Molecular and proteomic insight into Notch1 characterization in hepatocellular carcinoma[J]. Oncotarget, 2016, 7(26): 39609-39626. DOI:10.18632/oncotarget.9203 |
| [9] |
GAO J, XIONG Y M, WANG Y, et al. Hepatitis B virus X protein activates Notch signaling by its effects on Notch1 and Notch4 in human hepatocellularcarcinoma[J]. Int J Oncol, 2016, 48(1): 329-337. DOI:10.3892/ijo.2015.3221 |
| [10] |
王薛, 霍本念, 刘洁, 等. HBx基因激活Akt/mTOR信号通路抑制肝脏细胞凋亡[J]. 第三军医大学学报, 2019, 41(10): 931-938. WANG X, HUO B N, LIU J, et al. Hepatitis B virus X gene inhibits hepatocyteapoptosis in mice via Akt/mTOR pathway[J]. J Third Mil Med Univ, 2019, 41(10): 931-938. DOI:10.16016/j.1000-5404.201811185 |
| [11] |
周煜, 薛淑一, 李明春. Notch信号通路及其与肝癌相关性的研究进展[J]. 实用医药杂志, 2018, 35(9): 842-846. ZHOU Y, XUE S Y, LI M C. Research progress on Notch signaling pathway and its relationship with liver carcinoma[J]. Pract J Med Pharm, 2018, 35(9): 842-846. DOI:10.14172/j.issn1671-4008.2018.09.027 |
| [12] |
SEKIBA K, OTSUKA M, OHNO M, et al. Inhibition of HBV transcription from cccDNA with nitazoxanide by targeting the HBx-DDB1 interaction[J]. Cell Mol Gastroenterol Hepatol, 2019, 7(2): 297-312. DOI:10.1016/j.jcmgh.2018.10.010 |
| [13] |
LUCIFORA J, ARZBERGER S, DURANTEL D, et al. Hepatitis B virus X protein is essential to initiate and maintain virus replication after infection[J]. J Hepatol, 2011, 55(5): 996-1003. DOI:10.1016/j.jhep.2011.02.015 |
| [14] |
VAN BREUGEL P C, ROBERT E I, MUELLER H, et al. Hepatitis B virus X protein stimulates gene expression selectively from extrachromosomal DNA templates[J]. Hepatology, 2012, 56(6): 2116-2124. DOI:10.1002/hep.25928 |
| [15] |
CHENG S T, REN J H, CAI X F, et al. HBx-elevated SIRT2 promotes HBV replication and hepatocarcinogenesis[J]. Biochem Biophys Res Commun, 2018, 496(3): 904-910. DOI:10.1016/j.bbrc.2018.01.127 |
| [16] |
TANG L S Y, COVERT E, WILSON E, et al. Chronic hepatitis B infection: a review[J]. JAMA, 2018, 319(17): 1802-1813. DOI:10.1001/jama.2018.3795 |
| [17] |
LI Y, FU Y, HU X, et al. TheHBx-CTTN interaction promotes cell proliferation and migration of hepatocellular carcinoma via CREB1[J]. Cell Death Dis, 2019, 10(6): 405. DOI:10.1038/s41419-019-1650-x |
| [18] |
TAN S Y, VISVANATHAN S, ABU HASSAN R, et al. Autophagic degradation of misfolded nuclear receptor Co-repressor (NCoR) is linked to the growth of tumor cells in HBX positive hepatocellular carcinoma (HCC)[J]. Front Oncol, 2019, 9: 1335. DOI:10.3389/fonc.2019.01335 |
| [19] |
DUAN L, WU R, ZHANG X Y, et al. HBx-induced S100A9 in NF-κB dependent manner promotes growth and metastasis of hepatocellular carcinoma cells[J]. Cell Death Dis, 2018, 9(6): 629. DOI:10.1038/s41419-018-0512-2 |
| [20] |
CHIU A P, TSCHIDA B R, SHAM TT, et al. HBx-K130M/V131I promotes liver cancer in transgenic mice via AKT/FOXO1 signaling pathway and arachidonic acid metabolism[J]. Mol Cancer Res, 2019, 17(7): 1582-1593. DOI:10.1158/1541-7786.MCR-18-1127 |
| [21] |
BRAY S J. Notch signalling in context[J]. Nat Rev Mol Cell Biol, 2016, 17(11): 722-735. DOI:10.1038/nrm.2016.94 |
| [22] |
ADAMS J M, JAFAR-NEJAD H. The roles of notch signaling in liver development and disease[J]. Biomolecules, 2019, 9(10): 608. DOI:10.3390/biom9100608 |
| [23] |
ZHU B, SUN L, LUO W, et al. Activated Notch signaling augments cell growth in hepatocellular carcinoma via up-regulating the nuclear receptor NR4A2[J]. Oncotarget, 2017, 8(14): 23289-23302. DOI:10.18632/oncotarget.15576 |
| [24] |
BAO S X, JIN S, WANG C H, et al. Androgen receptor suppressesvasculogenic mimicry in hepatocellular carcinoma via circRNA7/miRNA7-5p/VE-cadherin/Notch4 signalling[J]. J Cell Mol Med, 2020, 24(23): 14110-14120. DOI:10.1111/jcmm.16022 |
| [25] |
VILLANUEVA A, ALSINET C, YANGER K, et al. Notch signaling is activated in human hepatocellular carcinoma and induces tumor formation in mice[J]. Gastroenterology, 2012, 143(6): 1660-1669. DOI:10.1053/j.gastro.2012.09.002 |
| [26] |
KIM W, KHAN S K, GVOZDENOVIC-JEREMIC J, et al. Hippo signaling interactions withWnt/β-catenin and Notch signaling repress liver tumorigenesis[J]. J Clin Invest, 2017, 127(1): 137-152. DOI:10.1172/JCI88486 |
| [27] |
JIA S Q, REN JJ, DONG P D, et al. Probing the hepatic progenitor cell in human hepatocellular carcinoma[J]. Gastroenterol Res Pract, 2013, 2013: 145253. DOI:10.1155/2013/145253 |
| [28] |
WARD S C, THUNG S N, LIM K H, et al. Hepatic progenitor cells in liver cancers from Asian children[J]. Liver Int, 2010, 30(1): 102-111. DOI:10.1111/j.1478-3231.2009.02126.x |
| [29] |
SOKOLOWSKI K M, BALAMURUGAN M, KUNNIMALAIYAAN S, et al. Role ofAkt inhibition on Notch1 expression in hepatocellular carcinoma: potential role for dual targeted therapy[J]. Am J Surg, 2016, 211(4): 755-760. DOI:10.1016/j.amjsurg.2015.11.029 |
| [30] |
ZHOU S J, DENG Y L, LIANG H F, et al. Hepatitis B virus X protein promotes CREB-mediated activation of miR-3188 and Notch signaling in hepatocellular carcinoma[J]. Cell Death Differ, 2017, 24(9): 1577-1587. DOI:10.1038/cdd.2017.87 |
| [31] |
尹洁, 王晓娜. IL-35调控恶性肿瘤发生发展机制的研究进展[J]. 中国肿瘤临床, 2018, 45(10): 529-534. YIN J, WANG Y N. Advances in the mechanism of IL-35 regulating the development of malignant tumors[J]. Chin J Clin Oncol, 2018, 45(10): 529-534. DOI:10.3969/j.issn.1000-8179.2018.10.050 |
| [32] |
SHAO X, MA J, JIA S, et al. Interleukin-35 suppresses antiviral immune response in chronic hepatitis B virus infection[J]. Front Cell Infect Microbiol, 2017, 7: 472. DOI:10.3389/fcimb.2017.00472 |




