新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)是由新型冠状病毒(severeacute respiratory-syndromecoronavirus2, SARS-CoV-2)引起的全球流行病[1],截至目前,累计感染人数已经超过1亿,感染人数仍在不断上升,新型冠状病毒肺炎是世界范围内一个长期的公共卫生事件。目前我国仍有散发,但国外仍处于疫情暴发阶段,国内随时有二次暴发的风险。最近有研究报道COVID-19不同严重程度的临床特征和预后,但COVID-19患者导致疾病加重和器官功能障碍的潜在机制仍有待进一步探讨[2]。由于危重患者病死率高,缺乏有效的治疗措施,早期识别和预测对危重患者的预后至关重要。目前国内外关于指导治疗的早期敏感生物标记物的研究较少,在以往的临床研究中,低钙血症与危重患者的高死亡率和较差的临床预后相关[3],而且钙在中东呼吸综合征冠状病毒和埃博拉病毒的感染和复制机制中起着核心作用[4],但血钙水平是否影响COVID-19患者预后尚未明确。分析血钙水平是否是COVID-19患者多器官功能损伤以及预后不良的危险因素,有助于发现和确定可能出现不良预后的患者,对指导治疗和降低死亡率意义重大。本研究回顾性分析武汉火神山医院2 651例COVID-19患者临床资料,旨在探讨低血钙与COVID-19患者预后不良的关系。
1 资料与方法 1.1 研究对象收集2020年2月4日至4月11日在中国武汉火神山医院就诊的成人COVID-19患者,根据世界卫生组织的临时指南诊断为COVID-19[5]。纳入标准:入组方式为非选择性连续纳入。排除标准:未成年以及无血钙检查的患者。共入组2 651例。本研究经火神山医院医学伦理委员会批准(HSSLL023),并获得每位患者的口头知情同意。
1.2 数据采集数据均来自标准化的临床电子病历。基线数据包括人口统计学信息、既往史、入院时实验室检查(血常规、肾功能和肝功能检查、凝血功能、心肌酶谱、炎性指标、电解质)、COVID-19的疾病分型。收集住院期间器官损伤情况,包括急性心肌损伤和急性肾损伤。记录急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)、脓毒血症、凝血功能障碍、重症监护室(ICU)住院治疗、机械通气、休克及住院期间死亡情况。
1.3 分组根据血钙的范围分为低血钙组和正常血钙组。低血钙为低于正常值下限2.11 mmol/L。
1.4 评价指标终点事件:住院期间全因死亡。COVID-19临床分型:参考第5版《新型冠状病毒肺炎诊疗方案》[6],分为轻型、普通型、重型、危重型。器官损伤:急性肾功能损伤为48 h内血清肌酐升高超过26.5 mmol/L,或7 d内血清肌酐较入院时升高50%[7];急性心肌损伤定义为超敏肌钙蛋白T超过火神山医院检验正常值上限[8];凝血功能紊乱定义为凝血酶原时间超过3 s和/或活化部分凝血活酶时间超过5 s。ARDS由Berlin定义[9];低蛋白血症定义白蛋白小于25 g/L。
1.5 统计学分析采用SPSS 23.0统计学软件。计量资料以x±s或者M(P25,P75)表示,计量资料的正态性采用Kolmogorov Smirnov检验,正态分布资料采用单对双尾独立组t检验,非正态分布资料采用Mann-Whitney检验。计数资料以例(%)表示,采用卡方检验或Fisher确切概率法进行比较。多元Cox回归模型评估既往血钙对临床结果的影响,剔除因素方法为逐步引入-剔除法。血钙的相关因素采用简单线性相关模型进行分析。多组平均值比较根据方差齐性结果采用方差分析和趋势性检验。P < 0.05(双尾)为差异有统计学意义。
2 结果 2.1 基线资料共纳入2 651例COVID-19患者,年龄60.0 (50.0,68.0)岁,其中男性1 347例(50.8%),COVID-19分型:轻型及普通型1 879例(70.8%),重型743例(28.0%),危重型29例(1.0%)。低血钙组有773例,正常血钙组有1 878例,低血钙组患者年龄、男性比例、吸烟史比例、既往高血压、冠心病、心律失常、COPD和慢性肝脏病史、危重型比例均高于正常血钙组(P < 0.05),其余基线指标无统计学差异(P>0.05)。见表 1。
| 指标 | 总例数(n=2 651) | 低血钙组(n=773) | 正常血钙组(n=1 878) | P值 |
| 年龄/岁 | 60.0(50.0, 68.0) | 65.0(55.0, 72.0) | 58.0(48.0, 67.0) | < 0.001 |
| 男性 | 1 347(50.8) | 429 (55.4) | 918 (48.8) | 0.002 |
| 吸烟史 | 144(5.4) | 54 (6.9) | 90 (4.7) | 0.024 |
| 饮酒史 | 93(3.5) | 33 (4.2) | 60 (3.1) | 0.172 |
| 心律失常 | 81(3.0) | 34 (4.3) | 47 (2.5) | 0.010 |
| 冠心病史 | 175(6.6) | 67 (8.6) | 108 (5.7) | 0.006 |
| 慢性阻塞性肺疾病 | 94(3.5) | 39 (5.0) | 55 (2.9) | 0.007 |
| 高血压病史 | 819(30.8) | 270 (34.9) | 549 (29.2) | 0.004 |
| 糖尿病 | 392(14.7) | 130 (16.8) | 262 (13.9) | 0.059 |
| 慢性肝脏病史 | 65(2.4) | 28 (3.6) | 37 (1.9) | 0.012 |
| 慢性肾脏病史 | 35(1.3) | 13 (1.6) | 22 (1.1) | 0.295 |
| COVID-19疾病分型 | ||||
| 轻型及普通型 | 1 879(70.8) | 452 (58.4) | 1 427 (75.9) | < 0.001 |
| 重型 | 743(28.0) | 301 (38.9) | 442 (23.5) | |
| 危重型 | 29(1.0) | 20 (2.5) | 9 (0.4) |
2.2 低血钙组与正常血钙组COVID-19患者实验室检查、治疗方式、并发症对比 2.2.1 患者的实验室检查
低血钙组患者的淋巴细胞计数、血红蛋白显著低于正常血钙组(P < 0.001),中性粒细胞计数明显高于正常血钙组(P < 0.001),超敏C反应蛋白和降钙素原炎症指标明显高于正常血钙组(P < 0.001),高度敏感肌钙蛋白I、肌酸激酶、B型利钠肽心肌酶谱指标明显高于正常血钙组(P < 0.05), 总蛋白、白蛋白明显低于正常血钙组(P < 0.001)。肝肾功能检查结果显示,低血钙组丙氨酸转氨酶、天冬氨酸转氨酶、乳酸脱氢酶、尿素氮、肌酐均高于正常血钙组(P < 0.05);电解质检查结果显示,低血钙组血钾、血钠、血钙均低于正常血钙组(P < 0.001);凝血功能检查结果显示,与正常血钙组比较,低血钙组凝血酶原时间、凝血酶原时间延长以及纤维蛋白原值更高(P < 0.001),D二聚体水平更高(P < 0.001)。低血钙组与正常血钙组在白细胞计数、肌红蛋白、血小板、总胆红素、氯、活化部分凝血活酶时间指标上无明显差异。见表 2。
| 指标 | 总例数(n=2 651) | 低血钙组(n=773) | 正常血钙组(n=1 878) | P值 |
| 实验室检查 | ||||
| 白细胞计数/109·L-1 | 5.70 (4.70, 7.00) | 5.80 (4.70, 7.38) | 5.70 (4.80, 7.00) | 0.091 |
| 中性粒细胞计数/109·L-1 | 3.51 (2.71, 4.63) | 3.92 (2.81, 5.30) | 3.40 (2.67, 4.36) | < 0.001 |
| 淋巴细胞计数/109·L-1 | 1.50 (1.13, 1.88) | 1.22 (0.89, 1.58) | 1.61 (1.26, 1.98) | < 0.001 |
| 血红蛋白/g·L-1 | 124.00 (113.0, 135.0) | 119.8 (107.0, 130.0) | 125.5 (116.0, 136.0) | < 0.001 |
| 血小板/109·L-1 | 224.30 (183.0, 272.0) | 230.5 (176.4, 288.3) | 222.0 (184.0, 267.0) | 0.239 |
| 超敏C反应蛋白/mg·L-1 | 2.24 (0.79, 8.320) | 7.50 (1.84, 34.44) | 1.60 (0.64, 4.23) | < 0.001 |
| 降钙素原/ng·mL-1 | 0.05 (0.03, 0.12) | 0.09 (0.04, 2.54) | 0.04 (0.03, 0.07) | < 0.001 |
| 高度敏感肌钙蛋白I/ng·mL-1 | 0.01 (0.01, 0.01) | 0.01 (0.01, 0.02) | 0.01 (0.01, 0.01) | < 0.001 |
| 肌红蛋白/ng·mL-1 | 4.61 (0.09, 8.69) | 4.71 (0.06, 10.85) | 4.58 (1.48, 7.93) | 0.392 |
| 肌酸激酶/IU·L-1 | 47.80 (34.00, 70.00) | 45.00 (31.07, 71.85) | 49.20 (35.70, 69.50) | 0.002 |
| B型利钠肽/pg·mL-1 | 0.01 (0.01, 33.18) | 23.81 (0.01, 70.04) | 0.01 (0.01, 20.22) | < 0.001 |
| 总蛋白/g·L-1 | 64.80 (60.70, 68.60) | 60.50 (57.02, 64.00) | 66.40 (62.94, 69.70) | < 0.001 |
| 白蛋白/g·L-1 | 37.75 (34.80, 40.30) | 34.07 (31.20, 36.45) | 39.00 (36.70, 41.20) | < 0.001 |
| 丙氨酸转氨酶/U·L-1 | 23.10 (14.62, 37.92) | 25.47 (15.33, 43.40) | 22.10 (14.20, 35.48) | < 0.001 |
| 天冬氨酸转氨酶/U·L-1 | 19.70 (15.60, 26.40) | 21.90 (16.58, 31.18) | 18.98 (15.35, 25.20) | < 0.001 |
| 总胆红素/mmol·L-1 | 9.40 (7.26, 12.25) | 9.12 (7.04, 12.20) | 9.50 (7.30, 12.29) | 0.137 |
| 乳酸脱氢酶/U·L-1 | 175.90 (151.1, 212.7) | 203.20 (164.8, 267.2) | 169.70 (147.6, 198.6) | < 0.001 |
| v尿素氮/mmol·L-1 | 4.40 (3.63, 5.46) | 4.68 (3.65, 5.96) | 4.32 (3.62, 5.23) | < 0.001 |
| 肌酐/μmol·L-1 | 64.00 (54.80, 75.34) | 65.27 (55.50, 77.58) | 63.40 (54.53, 74.90) | 0.015 |
| 钾/mmol·L-1 | 4.25 (3.97, 4.54) | 4.14 (3.82, 4.45) | 4.28 (4.02, 4.56) | < 0.001 |
| 钠/mmol·L-1 | 141.60 (140.0, 143.1) | 141.10 (138.7, 143.0) | 141.70 (140.3, 143.2) | < 0.001 |
| 氯/mmol·L-1 | 106.10 (104.1, 107.8) | 106.00 (103.3, 108.2) | 106.10 (104.3, 107.6) | 0.603 |
| 钙/mmol·L-1 | 2.16 (2.09, 2.23) | 2.04 (1.98, 2.08) | 2.20 (2.15, 2.26) | < 0.001 |
| 凝血酶原时间/s | 12.82 (12.25, 13.58) | 13.26 (12.51, 14.11) | 12.69 (12.16, 13.38) | < 0.001 |
| 活化部分凝血活酶时间/s | 28.03 (26.15, 30.10) | 28.17 (25.98, 30.39) | 27.97 (26.22, 29.90) | 0.238 |
| 纤维蛋白原/g·L-1 | 2.97 (2.62, 3.39) | 3.21 (2.80, 3.72) | 2.89 (2.57, 3.25) | < 0.001 |
| 凝血酶时间/s | 15.19 (15.19, 16.00) | 15.72 (14.93, 16.63) | 15.01 (14.38, 15.71) | < 0.001 |
| D二聚体/mg·L-1 | 0.41 (0.20, 0.86) | 0.72 (0.40, 1.68) | 0.33 (0.18, 0.64) | < 0.001 |
| 治疗方式 | ||||
| 机械通气 | 82 (3.0) | 73 (9.4) | 9 (0.4) | < 0.001 |
| 使用体外膜肺氧合 | 4 (0.1) | 4 (0.5) | 0 (0.0) | 0.002 |
| ICU | 96 (3.6) | 67 (8.6) | 29 (1.5) | < 0.001 |
| 并发症 | ||||
| 脓毒血症 | 26 (0.9) | 22 (2.8) | 4 (0.2) | < 0.001 |
| 呼吸衰竭 | 105 (3.9) | 83 (10.7) | 22 (1.1) | < 0.001 |
| 休克 | 31 (1.1) | 28 (3.6) | 3 (0.1) | < 0.001 |
| ARDS | 95 (3.5) | 75 (9.7) | 20 (1.0) | < 0.001 |
| 死亡 | 60 (2.3) | 54 (6.9) | 6 (0.3) | < 0.001 |
| 急性心肌损伤 | 162 (6.1) | 85 (10.9) | 77 (4.1) | < 0.001 |
| 低蛋白血症 | 27 (1.0) | 16 (2.0) | 11 (0.5) | 0.001 |
| 急性肾脏损伤 | 47 (1.7) | 24 (3.1) | 23 (1.2) | 0.001 |
| 凝血障碍 | 41 (1.5) | 21 (2.7) | 20 (1.0) | 0.002 |
| 住院时间/d | 13.0 (8.0, 19.0) | 17.0 (11.0, 23.0) | 12.0 (7.0, 17.0) | < 0.001 |
2.2.2 患者治疗方式及并发症的特征
与正常血钙组比较,低血钙组患者有更高的机械通气使用率、体外膜肺氧合使用率和ICU入住率(P < 0.05),具有更高的脓毒血症、休克、ARDS、呼吸衰竭、低蛋白血症、急性心肌损伤、急性肾脏损伤、凝血障碍发生率和死亡率(P < 0.05);低血钙组住院时间长于正常血钙组(P < 0.001)。见表 2。
2.3 COVID-19患者死亡的危险因素COX回归分析将单因素中P < 0.05的因素纳入为自变量到多元COX回归模型中,包含年龄、性别、冠心病史、高血压病史、COPD病史、血钙 < 2.11 mmol/L、慢性肾脏疾病病史、淋巴细胞计数低于1.1×109/L、超敏C反应蛋白>4 mg/L、降钙素原>0.05 ng/mL、D二聚体>1 mg/L纳入到多元COX回归模型中,采用逐步引入-剔除法进行筛除因素,血钙 < 2.11 mmol/L、慢性肾脏疾病病史、冠心病史、淋巴细胞计数低于1.1×109/L、超敏C反应蛋白>4 mg/L、降钙素原>0.05 ng/mL、D二聚体>1 mg/L是COVID-19患者死亡的独立危险因素(P < 0.05),其中血钙 < 2.11 mmol/L可以作为预测COVID-19患者死亡的独立危险因素(HR=5.695, 95%CI: 2.363~13.725),见表 3。生存分析曲线见图 1。
| 变量 | 单因素Cox回归模型 | 多因素Cox回归模型 | |||||
| HR | 95%CI | P值 | HR | 95%CI | P值 | ||
| 年龄 | 1.053 | 1.030~1.077 | < 0.001 | - | |||
| 男性 | 1.958 | 1.135~3.378 | 0.016 | - | |||
| 吸烟史 | 0.893 | 0.280~2.853 | 0.893 | 未选择 | |||
| 饮酒史 | 1.048 | 0.256~4.296 | 0.948 | 未选择 | |||
| 心律失常病史 | 1.384 | 0.433~4.423 | 0.584 | 未选择 | |||
| 冠心病 | 3.443 | 1.827~6.489 | < 0.001 | 2.338 | 1.225~4.462 | 0.010 | |
| COPD | 3.500 | 1.654~7.408 | 0.001 | - | |||
| 高血压病史 | 1.800 | 1.082~2.995 | 0.024 | - | |||
| 糖尿病病史 | 1.524 | 0.837~2.775 | 0.169 | 未选择 | |||
| 慢性肝脏疾病病史 | 2.032 | 0.635~6.499 | 0.232 | 未选择 | |||
| 慢性肾脏疾病病史 | 6.137 | 2.440~15.436 | < 0.001 | 3.029 | 1.166~7.871 | 0.023 | |
| 淋巴细胞计数 < 1.1×109/L | 8.799 | 4.730~16.369 | < 0.001 | 3.129 | 1.638~6.014 | 0.001 | |
| 超敏C反应蛋白>4 mg/L | 11.007 | 4.701~25.772 | < 0.001 | 2.637 | 1.072~6.487 | 0.035 | |
| 降钙素原>0.05 ng/mL | 6.677 | 3.694~12.068 | < 0.001 | 2.732 | 1.481~5.041 | 0.001 | |
| 血钙 < 2.11 mmol/L | 6.320 | 3.658~10.919 | < 0.001 | 5.695 | 2.363~13.725 | < 0.001 | |
| D二聚体> 1 mg/L | 14.389 | 6.142~33.710 | < 0.001 | 1.862 | 1.045~3.319 | 0.035 | |
| 血小板 | 0.856 | 0.380~3.153 | 0.653 | 未选择 | |||
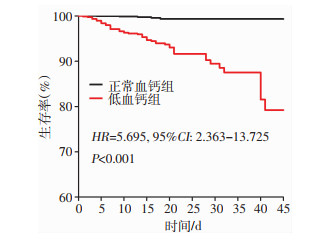
|
| 图 1 2 651例COVID-19患者的生存曲线 |
2.4 相关性分析
患者总蛋白与血钙呈正相关(r=0.547,P < 0.001),白蛋白与血钙呈正相关(r=0.609,P < 0.001),淋巴细胞计数与血钙呈正相关(r=0.277,P < 0.001),超敏C反应蛋白与血钙呈负相关(r=-0.365,P < 0.001),D二聚体与血钙呈负相关(r=-0.221,P < 0.001),凝血酶原时间与血钙呈负相关(r=-0.175,P < 0.001),线性相关图见图 2。
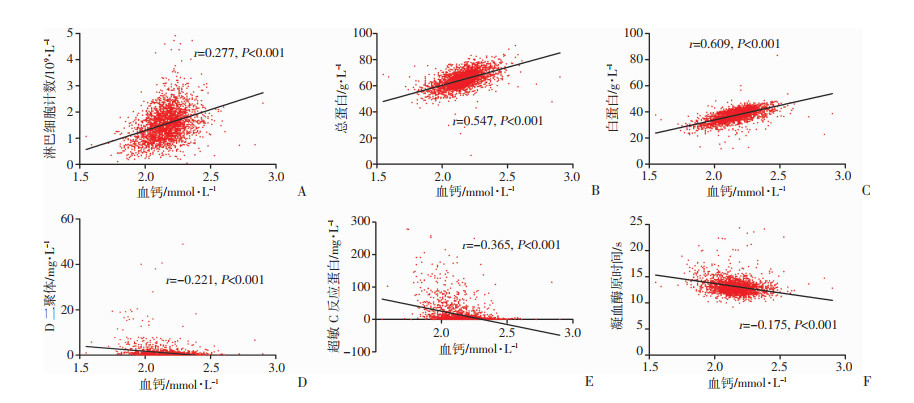
|
| A:淋巴细胞计数与血钙的相关性;B:总蛋白与血钙的相关性;C:白蛋白与血钙的相关性;D:D二聚体与血钙的相关性;E:超敏C反应蛋白与血钙的相关性;F:凝血酶原时间与血钙的相关性 图 2 血钙与其他实验室检测指标的线性相关分析 |
2.5 不同类型COVID-19患者以及不良预后患者中血钙水平对比
轻型及普通型、重型、危重型的血钙水平分别为2.17 (2.11, 2.24)、2.13 (2.04, 2.21)、2.03 (1.89, 2.18)mmol/L,不同临床类型的COVID-19患者中血钙水平明显存在差异(P < 0.05),并且趋势性检验P < 0.05, 表明随着COVID-19的临床类型加重而血钙值越低,见图 3。共有60例死亡患者,死亡患者血钙值低于非死亡患者[1.97 (1.87, 2.03) vs 2.17 (2.09, 2.23) mmol/L,P < 0.001],见图 4。
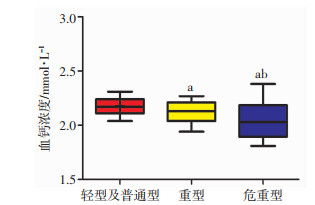
|
| a:P < 0.05,与轻型及普通型比较;b:P < 0.05,与重型比较 图 3 COVID-19患者不同临床类型的血钙水平 |
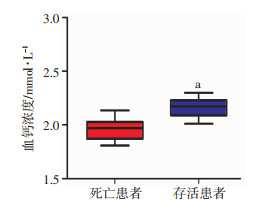
|
| a:P < 0.05,与死亡患者比较 图 4 死亡患者与存活患者血钙水平比较 |
3 讨论
本研究纳入武汉火神山医院的2 651例COVID-19患者,探讨血清钙离子浓度与COVID-19患者临床严重程度以及临床预后的关系,结果发现血钙浓度 < 2.11 mmol/L是COVID-19不良预后的独立危险因素(HR= 5.695,95%CI:2.363~13.725,P < 0.001),血钙浓度 < 2.11 mmol/L人群为773例,死亡人数为54例,病死率6.98%,显著高于正常血钙组(6例,0.3%,P < 0.001),同时低血钙组休克发生率、ARDS发生率、呼吸衰竭发生率、机械通气率、ECMO率、ICU入住率、住院时间、急性心肌损伤发生率、凝血功能障碍发生率均明显高于正常血钙组(P < 0.001)。表明低血钙人群死亡率更高、更易发生器官功能障碍。
低血钙组的COVID-19患者实验室检查结果显示:淋巴细胞减少、低蛋白血症、炎症介质(CRP)和D二聚体浓度升高。这与文献[10-11]报道的预后不良COVID-19患者实验室检查结果一致。血清CRP、D二聚体水平升高,提示新冠病毒感染可能引起持续炎症反应和凝血障碍[12]。病毒感染引起宿主的一系列生理反应,通过迅速而大规模的释放炎症细胞因子,导致组织破坏及器官衰竭,这被称为“细胞因子风暴”[13-15],这一现象已在非典型肺炎、中东呼吸综合征冠状病毒和埃博拉病毒感染患者中观察到。近期研究证实[16],细胞因子风暴也发生在新冠病毒感染患者中,特别是重症和危重患者,引起ARDS和多器官紊乱综合征,甚至导致死亡。本研究发现COVID-19患者中血钙水平与CRP(r=-0.365,P < 0.001)和D二聚体(r=-0.221,P < 0.001)呈负相关,与淋巴细胞计数(r=0.277,P < 0.001)呈正相关。这可能说明低血钙患者炎症反应更强,部分解释了COVID-19患者低血钙预后不良的潜在机制。临床试验的Meta分析显示[17],补充维生素D和钙剂对CRP浓度有抑制作用,KLEIN等[18]研究也揭示补钙的抗炎特性,可能机制是甲状旁腺激素水平降低,从而炎症反应减轻。
在危重患者中低血钙与不良临床结局相关。本研究结果显示29.1%的COVID-19患者在入院时出现低血钙,出现低钙血症的患者入院时病情更严重,预后更差,与既往报道结果相一致。DI FILIPPO等[19]研究表明低钙血症是COVID-19患者中常见的临床事件。BOOTH等[20]报道144例SARS患者中,分别有60%和70%的患者在入院时和住院中检测到低钙血症。由于低钙血症可能对心脏结局产生负面影响,严重时甚至危及生命。本研究结果显示,低血钙组患者发生心肌损伤率明显高于正常血钙组[85 (10.9%) vs 77 (4.1%)]。钙在不同包膜病毒(如非典型肺炎、中东呼吸综合征冠状病毒和埃博拉病毒)的融合中起关键作用,钙直接与这些病毒的融合肽相互作用,促进其复制。在非典型肺炎和埃博拉病毒病患者中,实验室检测常发现低血钙[21],其机制和临床相关性以及其预后意义尚未完全阐明。低钙的原因有甲状旁腺素分泌过多、维生素D缺乏、膳食摄入量减少、低蛋白血症、低镁血症、药物相互作用等[21]。低血钙是病毒性感染和肺炎中常见的实验室异常指标,但是其具体机制尚不清楚[22]。在本研究中,大多数患者是老年人,存在营养不良。慢性营养不良会导致维生素D缺乏,导致低钙血症。此外,还会影响肠道对钙的吸收,导致摄入不足,从而导致负钙平衡[23]。钙主要与血浆中的白蛋白结合,血清白蛋白的减少将导致低钙血症[24]。本研究显示,患者血清白蛋白(r=0.609,P < 0.001)和总蛋白(r=0.547,P < 0.001) 与血清钙离子浓度呈正相关,这也解释了COVID-19患者出现低血钙的潜在机制。此外,组织和器官缺氧可引起细胞膜的损伤,导致钙内流。COVID-19患者的促炎细胞因子抑制甲状旁腺激素分泌,导致钙失衡。
综上所述,低血钙可作为COVID-19患者预后不良和临床严重程度的一个独立危险因素,低血钙的COVID-19患者病死率增高,发生多器官功能损伤可能增加,特别是对于血钙小于2.11 mmol/L的患者,纠正低血钙可能是改善COVID-19患者预后的重要策略。
| [1] |
HUANG C, WANG Y, LI X, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China[J]. Lancet, 2020, 395(10223): 497-506. DOI:10.1016/S0140-6736(20)30183-5 |
| [2] |
CHEN N, ZHOU M, DONG X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study[J]. Lancet, 2020, 395(10223): 507-513. DOI:10.1016/S0140-6736(20)30211-7 |
| [3] |
CHEUNGPASITPORN W, THONGPRAYOON C, MAO M A, et al. Impact of admission serum calcium levels on mortality in hospitalized patients[J]. Endocr Res, 2018, 43(2): 116-123. DOI:10.1080/07435800.2018.1433200 |
| [4] |
MILLET J K, WHITTAKER G R. Physiological and molecular triggers for SARS-CoV membrane fusion and entry into host cells[J]. Virology, 2018, 517: 3-8. DOI:10.1016/j.virol.2017.12.015 |
| [5] |
WHO. Clinical management of severe acute respiratory infection when Novel coronavirus (nCoV) infection is suspected: interim guidance[EB/OL]. [2020-09-25]. |
| [6] |
李想, 白万富, 周红兵. 新型冠状病毒肺炎治疗策略[J]. 包头医学院学报, 2020, 36(3): 118-123. LI X, BAI W F, ZHOU H B. Treatment strategy of COVID-19[J]. Baotou Med College J, 2020, 36(3): 118-123. DOI:10.16833/j.cnki.jbmc.2020.03.043.j.carolcarrollnkiJBMC.2020.03.043 |
| [7] |
JHA V, ARICI M, COLLINS A J, et al. Understanding kidney care needs and implementation strategies in low-and middle-income countries: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference[J]. Kidney Int, 2016, 90(6): 1164-1174. DOI:10.1016/j.kint.2016.09.009 |
| [8] |
LALA A, JOHNSON K W, JANUZZI J L, et al. Prevalence and impact of myocardial injury in patients hospitalized with COVID-19 infection[J]. J Am Coll Cardiol, 2020, 76(5): 533-546. DOI:10.1016/j.jacc.2020.06.007 |
| [9] |
FORCE A D T, RANIERI V M, RUBENFELD G D, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. DOI:10.1001/jama.2012.5669 |
| [10] |
BILINSKI A, EMANUEL E J. COVID-19 and excess all-cause mortality in the US and 18 comparison countries[J]. JAMA, 2020, 324(20): 2100-2102. DOI:10.1001/jama.2020.20717 |
| [11] |
BUDHATHOKI P, SHRESTHA D B, RAWAL E, et al. Corticosteroids in COVID-19: Is it Rational? A Systematic Review and Meta-Analysis[J]. SN Compr Clin Med, 2020, 1-21. DOI:10.1007/s42399-020-00515-6 |
| [12] |
SCHUTTE A E, HARRISON D G. Immunity, inflammation and the vasculature in the COVID-19 era[J]. J Hypertens, 2020, 38(9): 1701-1702. DOI:10.1097/HJH.0000000000002525 |
| [13] |
DE LA RICA R, BORGES M, GONZALEZ-FREIRE M. COVID-19: in the eye of the cytokine storm[J]. Front Immunol, 2020, 11: 558898. DOI:10.3389/fimmu.2020.558898 |
| [14] |
JAFARZADEH A, CHAUHAN P, SAHA B, et al. Contribution of monocytes and macrophages to the local tissue inflammation and cytokine storm in COVID-19: Lessons from SARS and MERS, and potential therapeutic interventions[J]. Life Sci, 2020, 257: 118102. DOI:10.1016/j.lfs.2020.118102 |
| [15] |
YOUNAN P, IAMPIETRO M, NISHIDA A, et al. Ebola virus binding to Tim-1 on T lymphocytes induces a cytokine storm[J]. mBio, 2017, 8(5): 2586. DOI:10.1128/mBio.00845-17 |
| [16] |
HUSSAIN F S, ELDEEB M A, BLACKMORE D, et al. Guillain Barre syndrome and COVID-19: Possible role of the cytokine storm[J]. Autoimmun Rev, 2020, 19(12): 102681. DOI:10.1016/j.autrev.2020.102681 |
| [17] |
ASBAGHI O, SADEGHIAN M, MOZAFFARI-KHOSRAVI H, et al. The effect of vitamin d-calcium co-supplementation on inflammatory biomarkers: A systematic review and meta-analysis of randomized controlled trials[J]. Cytokine, 2020, 129: 155050. DOI:10.1016/j.cyto.2020.155050 |
| [18] |
KLEIN G L. The role of calcium in inflammation-associated bone resorption[J]. Biomolecules, 2018, 8(3): 69. DOI:10.3390/biom8030069 |
| [19] |
DI FILIPPO L, FORMENTI A M, DOGA M, et al. Hypocalcemia is a distinctive biochemical feature of hospitalized COVID-19 patients[J]. Endocrine, 2021, 71(1): 9-13. DOI:10.1007/s12020-020-02541-9 |
| [20] |
BOOTH C M, MATUKAS L M, TOMLINSON G A, et al. Clinical features and short-term outcomes of 144 patients with SARS in the greater Toronto area[J]. JAMA, 2003, 289(21): 2801-2809. DOI:10.1001/jama.289.21.JOC30885 |
| [21] |
LIU J, HUANG Q, YANG M, et al. Risk factors predicting severe hypocalcemia after total parathyroidectomy without autotransplantation in patients with secondary hyperparathyroidism[J]. J Int Med Res, 2020, 48(1): 300060519897505. DOI:10.1177/0300060519897505 |
| [22] |
AMIRJAMSHIDI A. Hypocalcemia as a prognostic factor in mortality and morbidity in moderate and severe traumatic brain injury[J]. Asian J Neurosurg, 2015, 10(3): 138. |
| [23] |
SUN X, ZHANG X, LU Y, et al. Risk factors for severe hypocalcemia after parathyroidectomy in dialysis patients with secondary hyperparathyroidism[J]. Sci Rep, 2018, 8(1): 7743. DOI:10.1038/s41598-018-26142-9 |
| [24] |
CHISTHI M M, NAIR R S, KUTTANCHETTIYAR K G, et al. Mechanisms behind post-thyroidectomy hypocalcemia: interplay of calcitonin, parathormone, and albumin—a prospective study[J]. J Invest Surg, 2017, 30(4): 217-225. DOI:10.1080/08941939.2016.1235238 |




