血管生成是指现有血管出芽生成新生血管的过程,血管生成对发育、人体稳态的维持至关重要。正常的血管网络系统为机体提供氧气和营养并处理代谢废物,有利于组织生长和再生[1]。异常的血管生成将导致疾病的发生,例如心肌梗死、糖尿病性视网膜病变、动脉粥样硬化斑块、类风湿关节炎、子宫内膜异位症、银屑病、子宫肌瘤和癌症[2]。内皮细胞迁移调控是血管生成的基础,因此进一步探索新基因在内皮细胞迁移中的作用,将为血管异常生成相关疾病的治疗提供新的线索和策略。
N6甲基腺苷(N6-methyladenosine, m6A)是一种真核生物中普遍存在的mRNA甲基化修饰,能够参与细胞的表观遗传调控过程[3]。m6A由核内的RNA甲基转移酶复合体催化形成。甲基转移酶样蛋白3 (methyltransferase like 3,METTL3) 是RNA甲基转移酶复合体的核心组成部分[4]。近年来报道METTL3在多种生理及病理过程中发挥重要作用,如造血细胞分化[5]、神经发育[6]等多种生理过程中发挥重要作用。此外,研究表明METTL3的异常表达与肿瘤发生、发展密切相关[7]。血管生成是肿瘤生长和转移基本因素之一,研究显示METTL3高表达肿瘤组织的微血管密度高于低表达组[8]。这表明METTL3与血管生成紧密相关,血管生成依赖于内皮细胞迁移,但METTL3在内皮细胞迁移中的作用仍有待进一步研究。本研究拟利用CRISPR-Cas9技术敲低METTL3表达,观察METTL3对人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)迁移的影响,并初步探究相关作用机制。
1 材料与方法 1.1 材料HUVECs和293FT细胞购自中国科学院细胞库,分别用ECM培养基(Science cell公司)和含10% 胎牛血清的DMEM培养基(Gibco公司)在37 ℃、5% CO2的孵箱中培养。3 μm多聚微孔膜Transwell小室购自Corning公司;lentiCRISPR v2载体、病毒包装系统质粒pspAx2和pMD2.G由本实验保存;限制性内切酶BsmBⅠ(NEB公司);T4 DNA Ligase(Invitrogen公司);Fast-T1感受态细胞(诺唯赞公司);无内毒素质粒大提试剂盒(天根公司);RIPA细胞裂解液(Abcam公司);METTL3抗体(ABclonal公司);HRP鼠抗兔IgG(Santa cruz公司);goat anti-rabbit IgG荧光二抗(Invitrogen公司);TRIzol试剂(Thermo公司);RT酶(TaKaRa公司);superscript Ⅱ reverse transcriptase (Invitrogen公司);Dynabeads myone SLIANE (Life technologies公司);Protein G Magnetic Beads (Invitrogen公司);Lipofectamine 3000(Invitrogen公司);m6A抗体(Abcam公司);IGF2BP2抗体(Proteintech公司);抗兔IgG(Abcam公司);qPCR试剂(Toyobo公司);放线菌素D(Sigma公司)。本研究所用的引物、sgRNA、shRNA、siRNA及sanger测序均在北京擎科生物科技有限公司完成。
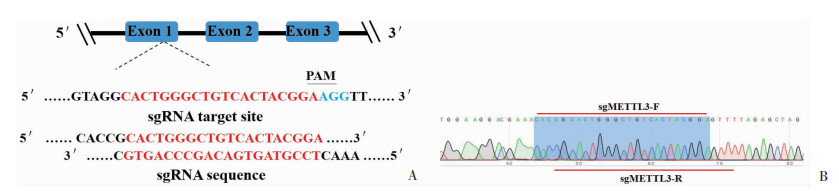
1.2 方法 1.2.1 lentiCRISPR v2-sgMETTL3载体的构建利用哈佛大学张锋实验室CRISPR-sgRNA设计网站(https://benchling.com/crispr), 设计靶向人METTL3基因第1个外显子的sgRNA序列,加上BsmBⅠ酶切位点的粘性末端后,合成寡核苷酸sgMETTL3-上游:5′-CACCGCACTGGGCTGTCACTACGGA-3′,sgMETTL3-下游:5′-AAACTCCGTAGTGACAGCCCAGTGC-3′,经退火后形成DNA双链(图 1A)。lentiCRISPR v2载体通过BsmBⅠ酶切、回收与连接,将退火sgMETTL3片段连入lentiCRISPR v2载体。经转化、测序,获得序列正确的表达lentiCRISPR v2-sgMETTL3的慢病毒质粒(图 1B)。
|
| A: 靶向METTL3基因的sgRNA的位置示意图;B: lentiCRISPR v2-sgMETTL3载体测序峰图 图 1 lentiCRISPR v2-sgMETTL3载体构建 |
1.2.2 构建METTL3稳定敲低细胞系
慢病毒包装方法参考文献[9],293FT为包装细胞,病毒包装质粒psPAX2,病毒膜蛋白质粒pMD2.G和lentiCRISPR v2或lentiCRISPR v2-sgMETTL3质粒混匀后,磷酸钙法转染。转染48、72 h后收集上清、过滤。将病毒液加入HUVEC细胞培养基中,感染72 h后,加入1 μg/mL的嘌呤霉素进行抗性筛选,连续筛选1周,获得lentiCRISPR v2和lentiCRISPR v2-sgMETTL3稳定细胞系。
1.2.3 shRNA构建IGF2BP1/IGE2BP2稳定敲低细胞系采用慢病毒包装法,病毒包装质粒psPAX2,病毒膜蛋白质粒pMD2.G以及scramble或shIGF2BP1、shIGF2BP2质粒混匀后,参照1.2.2进行磷酸钙法转染、病毒感染、抗性筛选细胞系。shIGF2BP1靶序列:5′-CCGGCTCCAAAGTTCGTATGGTTATCTCGAGATAA-CCATACGAACTTTGGAGTTTTTG-3′;shIGF2BP2靶序列:5′-CCGGCTTAACCAGTGCAGAAGTCATCTCGAGA-TGACTTCTGCACTGGTTAAGTTTTTG-3′。
1.2.4 siRNA转染构建YTHDF2敲低细胞系HUVECs达到50%融合度时,根据Lipofectamine 3000转染试剂盒说明书进行细胞转染,转染60 h,收集siYTHDF2和对照细胞RNA。siYTHDF2上游:5′-GAUAUUCACCGUUCCAUUATT-3′;siYTHDF2下游:5′-UAAUGGAACGGUGAAUAUCTT-3′。
1.2.5 Western blot检测收集细胞,加入RIPA细胞裂解液提取总蛋白。SDS-PAGE法分离蛋白,将蛋白转移至PVDF膜上,5% BSA室温封闭1 h,一抗1 ∶1 000稀释后,4℃孵育过夜。二抗1 ∶5 000稀释后室温孵育1 h。化学发光法显影,成像仪采集数据。GAPDH为内参对照。采用ImageJ软件定量蛋白条带灰度值。
1.2.6 免疫荧光染色细胞爬片24 h后,4%多聚甲醛室温固定15 min,0.5% Triton X-100室温通透10 min,5% BSA室温封闭1 h,一抗1 ∶100稀释后室温孵育2 h,二抗1 ∶200稀释后室温孵育1h,DPAI室温孵育5 min,封片后荧光显微镜采集数据。
1.2.7 划痕实验细胞接种前在6孔板底部均匀划5条横线,细胞接种6孔板培养24 h后,用10 μL枪头在每孔底部划线,PBS清洗3次去除漂浮细胞,每孔加入2 mL无血清培养基,分别在划痕0、24、48 h后于同一位置在显微镜下拍照,利用Image J软件计算迁移面积。
1.2.8 Transwell实验将Transwell小室置于12孔板中,将细胞消化后,用无血清无抗生素培养基准备成细胞悬液接种于Transwell小室上室中,下室加入含10%FBS的完全培养基,置于培养箱中培养,24 h后取出小室,甲醛固定,甲醇通透,结晶紫染色,显微镜下拍照、计数穿过微孔膜的细胞。
1.2.9 m6A甲基化RNA免疫沉淀实验用TRIzol抽提细胞RNA后,高温下ZnCl2溶液将RNA打断,m6A抗体与片段后的RNA 4 ℃孵育4 h,磁珠室温孵育2 h,高盐溶液室温漂洗4次后,用RNase-free H2O洗脱m6A抗体富集的RNA。
1.2.10 RNA免疫沉淀实验收集HUVECs,RIPA Buffer裂解细胞,超声破碎裂解细胞,IGF2BP2抗体或IgG抗体与磁珠4 ℃孵育30 min,细胞裂解物与磁珠-抗体复合物4 ℃孵育2 h,漂洗液4 ℃漂洗6次,用洗脱液洗脱IGF2BP2结合的复合物,抽提RNA。
1.2.11 mRNA半衰期实验IGF2BP2敲低及对照HUVECs细胞接种在12孔板中,培养24 h后,每孔加入终浓度为5 μg/mL放线菌素D处理0、2、6 h后,抽提细胞RNA,qPCR检测并计算LYN mRNA的半衰期。
1.2.12 qPCR检测用TaKaRa反转录试剂盒制备cDNA,THUNDERBIRD qPCR Mix试剂盒进行目的基因检测。qPCR引物:LYN上游5′-ACGATGGAGTAGA-TTTGAAGAC-3′;下游5′-GTTCCTCTGGATCTTTAGTTTG-3′;GAPDH上游5′-TCTCCTCTGACTTCAACAGCGACA-3′;下游5′-CCCTGTTGCTGTAGCCAAATTCGT-3′;IGF2BP1上游5′-AAACGCTTAGAG-ATTGAACATT-3′;下游5′-CACTTGCTCACAGTTCTCTACT-3′;IGF2BP2上游5′-GTCACATATGCAACAAGAGAAG-3′;下游5′-GATGTAGGAAATCTTGAAGGAG-3′;YTHDF2上游5′-GGAAACAAAGTACAAAATGGAT-3′;下游5′-GAGGGACTGTAGTAACTGGGTA-3′。用CFX96 Touch实时荧光定量PCR仪进行反应,qPCR反应参数如下:95 ℃预变性1 min,循环反应95 ℃变性10 s,60 ℃退火延伸30 s,40个循环。以GAPDH为内参,采用2-ΔΔCt方法计算相对表达量。m6A甲基化检测引物:LYN m6A上游5′-ACCCTCTAAATGGGAAAGTATT-3′;下游5′-ATGGTCTCTGAAACTTTGAGTC-3′;GAPDH m6A上游5′-TCAAGGCTGAGAACGGGAAG-3′;下游5′-GGACTCCACGACGTACTCAG-3′。
1.3 统计学分析数据以x±s表示。采用GraphPad 7.0软件作图,SPSS 20.0统计软件进行数据分析,采用非配对样本t检验。每组实验重复3次,检验水准α=0.05。
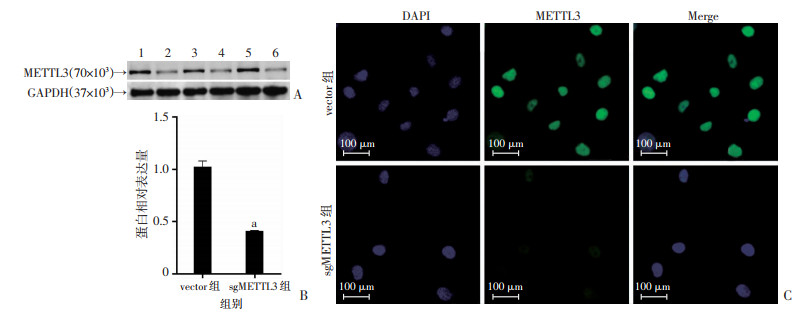
2 结果 2.1 构建METTL3基因稳定敲低HUVECs细胞系Western blot实验结果显示:sgMETTL3组与对照组(vector组)相比,METTL3蛋白表达水平明显下调,约为对照组的50% (图 2A、B)。荧光显微镜观察,与对照组相比,sgMETTL3组荧光减弱(图 2C),也证实METTL3被成功敲低。
|
| A: Western blot检测结果 1、3、5:vector组;2、4、6:sgMETTL3组;B: METTL3半定量分析 a:P<0.05,与vector组比较;C:免疫荧光染色检测METTL3表达情况 图 2 METTL3基因在HUVECs中敲低效果验证 |
2.2 METTL3敲低对HUVECs细胞迁移的影响
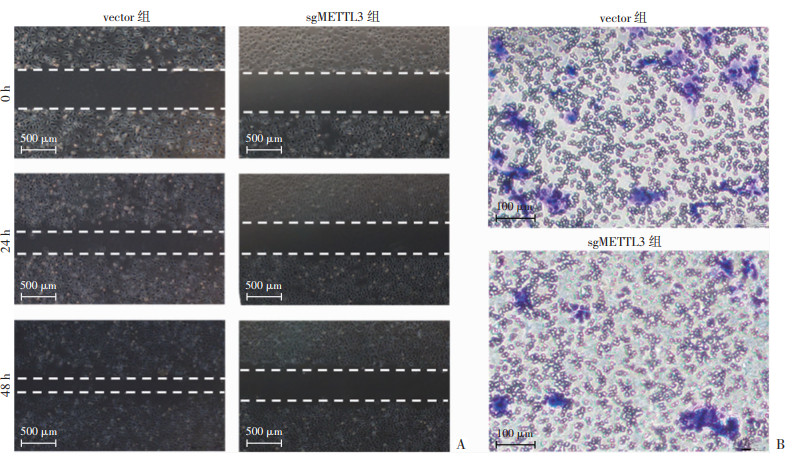
划痕实验结果显示:在划痕24 h后,敲低METTL3的表达导致该组细胞迁移率(11.4%)比对照组(29%)减少了50%,在划痕48 h后,sgMETTL3组迁移率(27%)比对照组(38%)减少30%(P<0.05,图 3A)。无Matrigel胶条件Transwell实验结果显示,sgMETTL3组细胞穿透小室的数量(10个)比对照组(29个)减少65%(P<0.05,图 3B)。以上结果表明,敲低METTL3减弱HUVECs细胞的迁移能力。
|
| A:划痕实验;B:Transwell实验 图 3 敲低METTL3基因对HUVECs细胞迁移能力的影响 |
2.3 METTL3敲低对HUVECs细胞迁移相关基因的影响
METTL3是m6A甲基化转移酶复合体中最核心的组成蛋白,负责催化mRNA发生m6A甲基化修饰。通过UCSC GEO测序数据库发现酪氨酸激酶LYN(LYN Proto-Oncogene, Src Family Tyrosine Kinase, LYN)mRNA上有m6A甲基化修饰(图 4A),m6A甲基化RNA免疫沉淀实验结果显示:HUVECs细胞中LYN mRNA也存在m6A修饰(图 4B),敲低METTL3后,导致LYN mRNA的m6A甲基化修饰明显减少(P<0.05,图 4C)。qPCR检测结果显示:与对照组相比,sgMETTL3组中LYN的表达量显著下调(P<0.05,图 4D)。

|
| a:P<0.05,与vector组比较;b:P<0.05,与GAPDH比较 A:UCSC数据库中LYN mRNA上的甲基化测序峰;B:m6A-RIP qPCR检测HUVEC中LYN mRNA上的m6A富集;C:m6A-RIP qPCR检测敲低METTL3后LYN mRNA上的m6A富集;D:qPCR检测敲低METTL3基因对LYN mRNA的表达 图 4 敲低METTL3对LYN m6A甲基化修饰及表达水平的影响 |
2.4 IGF2BP2识别LYN mRNA上的m6A修饰并增强LYN mRNA稳定性
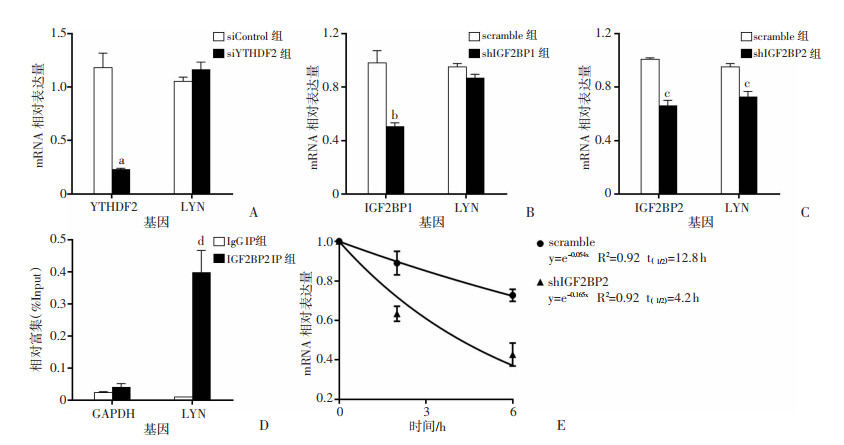
在甲基转移酶METTL3的催化下,mRNA会发生m6A修饰。发生m6A修饰的mRNA发挥生物学功能依赖于特定的RNA结合蛋白——m6A识别蛋白。识别蛋白识别发生m6A修饰的mRNA后,从而激活下游的调控通路例如RNA稳定性、RNA翻译效率等。目前发现的m6A识别蛋白有YTHDF1-3、IGF2BP1-3。其中YTHDF2、IGF2BP1、IGF2BP2等能提高m6A修饰mRNA的稳定性来调控mRNA的表达水平。为了进一步明确LYN mRNA上的m6A甲基化修饰是被何种识别蛋白所识别,我们检测了以上m6A识别蛋白敲低后,LYN mRNA表达水平。qPCR检测结果显示:siRNA敲低YTHDF2后,对LYN的mRNA水平无显著影响(P>0.05,图 5A); shRNA敲低IGF2BP1后,LYN的mRNA水平无明显变化(P>0.05,图 5B); shRNA敲低IGF2BP2后,LYN的mRNA水平显著降低(P<0.05,图 5C);RNA免疫沉淀实验结果显示:IGF2BP2与LYN mRNA结合(图 5D)。mRNA半衰期实验结果显示:对照组中LYN mRNA半衰期t(1/2)为12.8 h,敲低IGF2BP2组中LYN mRNA半衰期为4.2 h,敲低IGF2BP2后,LYN mRNA稳定性显著降低(图 5E)。以上结果显示IGF2BP2识别并结合LYN mRNA上m6A修饰位点,介导RNA稳定性来调控其mRNA表达水平。
|
| a:P<0.05,与siControl组比较;b:P<0.05,与scramble组比较;c:P<0.05,与scramble组比较;d:P<0.05,与IgG IP组比较;t(1/2):表示mRNA半衰期 A:qPCR检测敲低YTHDF2对LYN mRNA的表达;B:qPCR检测敲低IGF2BP1对LYN mRNA的表达;C:qPCR检测敲低IGF2BP2对LYN mRNA的表达;D:RNA免疫共沉淀结合qPCR检测IGF2BP2与LYN结合GAPDH为阴性对照;E:qPCR检测敲低IGF2BP2对LYN mRNA稳定性的影响 图 5 m6A识别蛋白IGF2BP2识别LYN mRNA上的m6A修饰 |
3 讨论
m6A是一种重要的转录后修饰,占RNA修饰的60%,是最丰富的RNA修饰,存在于保守序列RRACH(R=G, A; H=A, C或U)中。m6A修饰水平是动态变化的,其调控由RNA甲基转移酶和去甲基化酶介导。甲基转移酶包括:METTL3、METTL14、WTAP、RBM15和KIAA1492,其中METTL3是核心蛋白,负责催化m6A形成。去甲基化酶包括:FTO和ALKBH5。此外,还有一系列负责识别m6A修饰的蛋白,如YTHDF1/2/3、YTHDC1、IGF2BP1/2/3和HNRNPA2B1[10]。m6A修饰参与调控mRNA剪接、出核、翻译、RNA稳定性以及microRNA加工等生物学过程[11],在神经发育、免疫活化、节律调控、脂肪分化、肿瘤生成等生理病理过程中也发挥关键作用[10]。
METTL3是第一个被发现的、具有催化m6A功能的蛋白,能够催化RRACH序列中N6-甲基腺嘌呤发生m6A修饰。METTL3具有高度的保守性,分布于各类真核生物中。研究表明,METTL3具有重要的生物学功能。敲除小鼠METTL3基因导致其早期胚胎致死[4],表明METTL3在哺乳动物胚胎发育中扮演着不可或缺的角色。在氧诱导视网膜病变模型,敲除METTL3小鼠的角膜新生血管形成受到抑制[12],提示METTL3与血管生成紧密相关。血管生成参与许多生理和病理过程,包括胚胎发育、伤口愈合、组织再生和肿瘤生长[13]。内皮细胞迁移对血管生成至关重要,METTL3在内皮细胞迁移中的作用待进一步研究。
为了探究METTL3对血管内皮细胞迁移的影响,本研究利用CRISPR-Cas9敲低HUVECs细胞中METTL3的表达,检测内皮细胞的迁移情况。结果表明,敲低METTL3导致内皮细胞迁移能力明显减弱。METTL3是m6A甲基化转移酶复合体中一个最重要的组成蛋白,METTL3的缺失会下调细胞内mRNA m6A水平。本研究发现,酪氨酸激酶LYN mRNA上有m6A修饰,敲低METTL3导致LYN mRNA m6A修饰水平下调,LYN的mRNA表达量下调。m6A修饰的mRNA由m6A识别蛋白识别并参与mRNA的命运决定。其中m6A识别蛋白YTHDF1、YTHDF3能够促进mRNA翻译,YTHDF2、IGF2BP1和IGF2BP2能够促进mRNA稳定性来调控其表达水平。本研究发现,敲低YTHDF2、IGF2BP1后,LYN的mRNA水平没有明显差异。敲低IGF2BP2后,LYN的mRNA水平显著下调,且LYN的mRNA稳定性显著降低;RNA免疫沉淀实验进一步证明IGF2BP2与LYN mRNA结合。以上结果显示:METTL3催化LYN mRNA发生m6A修饰后,由IGF2BP2识别并结合LYN mRNA上m6A位点,提高LYN mRNA稳定性;下调METTL3后,LYN mRNA上的m6A修饰减少,IGF2BP2识别结合的LYN mRNA减少,RNA稳定性减少导致LYN mRNA表达水平下调。LYN是重要的信号转导中介[14],LYN的异常表达会导致免疫疾病[15]、肿瘤和白血病[16]的发生。LYN通过参与PI3K/Akt和JAK2/STAT3信号转导来调控癌症的发生[17],抑制LYN的表达能够明显抑制肿瘤细胞迁移[18]。本研究发现敲低METTL3导致LYN表达下调,内皮细胞迁移能力减弱。然而,除了LYN以外,METTL3下游靶分子还有哪些,这些靶分子上的m6A修饰被哪些m6A识别蛋白识别,识别蛋白又是如何影响靶分子RNA命运的仍需要后续实验进一步深入研究。
| [1] |
CARMELIET P, JAIN R K. Molecular mechanisms and clinical applications of angiogenesis[J]. Nature, 2011, 473(7347): 298-307. DOI:10.1038/nature10144 |
| [2] |
FOLKMAN J. Angiogenesis: an organizing principle for drug discovery?[J]. Nat Rev Drug Discov, 2007, 6(4): 273-286. DOI:10.1038/nrd2115 |
| [3] |
LIU J Z, YUE Y N, HAN D L, et al. A METTL3-METTL14 complex mediates mammalian nuclear RNA N6-adenosine methylation[J]. Nat Chem Biol, 2014, 10(2): 93-95. DOI:10.1038/nchembio.1432 |
| [4] |
GEULA S, MOSHITCH-MOSHKOVITZ S, DOMINISSINI D, et al. Stem cells. m6A mRNA methylation facilitates resolution of naïve pluripotency toward differentiation[J]. Science, 2015, 347(6225): 1002-1006. DOI:10.1126/science.1261417 |
| [5] |
ZHANG C, CHEN Y, SUN B, et al. m6A modulates haematopoietic stem and progenitor cell specification[J]. Nature, 2017, 549(7671): 273-276. DOI:10.1038/nature23883 |
| [6] |
SHI H L, ZHANG X L, WENG Y L, et al. m6A facilitates hippocampus-dependent learning and memory through YTHDF1[J]. Nature, 2018, 563(7730): 249-253. DOI:10.1038/s41586-018-0666-1 |
| [7] |
CHEN X Y, ZHANG J, ZHU J S. The role of m6A RNA methylation in human cancer[J]. Mol Cancer, 2019, 18(1): 103. DOI:10.1186/s12943-019-1033-z |
| [8] |
WANG Q, CHEN C, DING Q Q, et al. METTL3-mediated m6A modification of HDGF mRNA promotes gastric cancer progression and has prognostic significance[J]. Gut, 2020, 69(7): 1193-1205. DOI:10.1136/gutjnl-2019-319639 |
| [9] |
KUTNER R H, ZHANG X Y, REISER J. Production, concentration and titration of pseudotyped HIV-1-based lentiviral vectors[J]. Nat Protoc, 2009, 4(4): 495-505. DOI:10.1038/nprot.2009.22 |
| [10] |
YANG Y, HSU P J, CHEN Y S, et al. Dynamic transcriptomic m6A decoration: writers, erasers, readers and functions in RNA metabolism[J]. Cell Res, 2018, 28(6): 616-624. DOI:10.1038/s41422-018-0040-8 |
| [11] |
LEE Y, CHOE J, PARK O H, et al. Molecular mechanisms driving mRNA degradation by m6A modification[J]. Trends Genet, 2020, 36(3): 177-188. DOI:10.1016/j.tig.2019.12.007 |
| [12] |
YAO M D, JIANG Q, MA Y, et al. Role of METTL3-dependent N6-methyladenosine mRNA modification in the promotion of angiogenesis[J]. Mol Ther, 2020, 28(10): 2191-2202. DOI:10.1016/j.ymthe.2020.07.022 |
| [13] |
LAMALICE L, LE BOEUF F, HUOT J. Endothelial cell migration during angiogenesis[J]. Circ Res, 2007, 100(6): 782-794. DOI:10.1161/01.RES.0000259593.07661.1e |
| [14] |
MANNING G, WHYTE D B, MARTINEZ R, et al. The protein kinase complement of the human genome[J]. Science, 2002, 298(5600): 1912-1934. DOI:10.1126/science.1075762 |
| [15] |
SCAPINI P, HU Y M, CHU C L, et al. Myeloid cells, BAFF, and IFN-gamma establish an inflammatory loop that exacerbates autoimmunity in Lyn-deficient mice[J]. J Exp Med, 2010, 207(8): 1757-1773. DOI:10.1084/jem.20100086 |
| [16] |
INGLEY E. Functions of the Lyn tyrosine kinase in health and disease[J]. Cell Commun Signal, 2012, 10(1): 21. DOI:10.1186/1478-811X-10-21 |
| [17] |
SU R, ZHANG J. Oncogenic role of LYN in human ga-stric cancer via the Wnt/β-catenin and AKT/mTOR pathways[J]. Exp Ther Med, 2020, 20(1): 646-654. DOI:10.3892/etm.2020.8672 |
| [18] |
WHEELER S E, MORARIU E M, BEDNASH J S, et al. Lyn kinase mediates cell motility and tumor growth in EGFRvⅢ-expressing head and neck cancer[J]. Clin Cancer Res, 2012, 18(10): 2850-2860. DOI:10.1158/1078-0432.CCR-11-2486 |




