2. 400014 重庆,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心
2. Key Laboratory of Child Developmental Disorders of Ministry of Education, National Clinical Research Center for Child Health and Disorders, Affiliated Children's Hospital of Chongqing Medical University, Chongqing, 400014, China
脓毒症是儿童ICU常见的危重症,具有高发病率、高病死率、高治疗费用等特点[1]。脓毒症疾病进展过程中,肺脏常是第一个被攻击的靶器官[2]。临床表现为急性肺损伤(acute lung injury,ALI),甚至发展为急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[3]。过度失调的全身炎症反应综合征是导致脓毒症相关性ALI发生的关键环节[4-5]。焦亡作为炎症反应介导的程序性细胞死亡模式之一,主要由NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体以半胱天冬酶-1(Caspase-1)依赖的方式触发,导致GSDMD(gasdermin D)的切割和多聚化,使细胞膜崩解穿孔,导致主要炎症因子IL-1β和IL-18的释放。NLRP3炎症小体主要由NLRP3炎症小体受体蛋白、ASC、Caspase-1构成[6-7]。当其被重症感染等病理刺激触发后,会裂解细胞释放出炎性介质,引发生物体级联放大免疫反应,从而抵御病原体攻击,但过度的免疫应答也会对机体的免疫功能造成损害[8]。因此,了解细胞焦亡途径对脓毒症ALI的免疫机制研究至关重要。
近年来研究发现,主要由胃黏膜细胞产生的ghrelin蛋白,除具有生长激素促分泌剂的最初特征外,还具有抗炎、调节免疫等多种生理学特性[9-10]。ghrelin在肺、肝、肾及胎盘等器官和免疫器官及T、B淋巴细胞、中性粒细胞、单核细胞等免疫细胞也可分泌[9],其可能对脓毒症ALI具有潜在的保护作用。因此,本研究拟从ghrelin对细胞焦亡途径及炎症因子表达作用研究着手,探讨其对脓毒症肺损伤的保护机制。
1 材料与方法 1.1 实验动物及分组健康雄性6~8周龄C57BL/6小鼠180只,体质量16~22 g,购于重庆医科大学实验动物中心。提供小鼠标准的食物和水,小鼠饲养在室温(20~22 ℃),湿度30%~70%并且保持每隔12 h的光暗循环的环境中。所有实验方案均经重庆医科大学附属儿童医院实验动物伦理委员会批准(271/2 019),按机构指南执行。随机数学表法分为3组:假手术(sham,n=24)组、盲肠结扎穿刺模型(the cecal ligation and puncture, CLP,n=78)组、ghrelin组(n=78)。
1.2 脓毒症模型的建立根据有关脓毒症模型的文献[11],使用盲肠结扎穿刺法建立脓毒症动物模型。小鼠腹腔注射0.5%戊巴比妥钠(50 mg/kg),无菌手术环境下腹部脱毛、消毒,腹部正中逐层切开1~2 cm显露盲肠,在距离盲肠末端大约1/3处用外科4-0带针缝合线进行结扎。用20号针从盲肠远端3/4处穿盲肠2次,并从穿刺点挤出少量粪便,以确保穿刺口通畅,后将肠道送回腹部。用6-0号无菌丝绸缝合切口。sham组小鼠不结扎盲肠,不穿孔,其他手术步骤一致。术后皮下注射0.5 mL预温无菌生理盐水进行复苏。ghrelin组于造模后3、20 h腹腔给药ghrelin(12 nmol/kg,phoenix031-31,溶于0.5 mL生理盐水中),sham组和CLP组给予等量的生理盐水。各组行120 h观察生存率。收集小鼠6、12、24 h CLP组、ghrelin组和24 h sham的肺泡灌洗液和肺组织,于-80 ℃中保存。
1.3 支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中细胞计数和蛋白量造模后6、12、24 h,用0.5%戊巴比妥钠腹腔注射麻醉小鼠,颈部消毒,分离小鼠颈部支气管,将留置针置入气管中固定,缓慢将预冷的0.5 mL磷酸盐缓冲液(PBS)注入肺中,吸出后再次注入,反复3次,抽出的灌洗液置于无菌EP管中,反复灌洗2次,保证回收率在80%以上为合格。将灌洗液在4 ℃下3 000 r/min离心10 min,收集上清液并分装后冻存于-80 ℃冰箱保存。其沉淀用PBS进行重悬,计数板计数各组细胞数,用BCA蛋白分析试剂盒(Bio-Rad实验室)测定BALF蛋白含量。
1.4 小鼠肺组织病理检查取小鼠左上肺组织4%多聚甲醛固定,行石蜡包埋,5 μm厚度切片后行HE染色。观察肺泡腔中性粒细胞数目、肺间质中性粒细胞数目、透明膜、肺泡腔蛋白碎片及肺泡间隔厚度[12]。
1.5 BALF中ghrelin和炎症因子IL-10、IL-6、TNF-α、IL-1β和IL-18水平检测按照ELISA试剂盒说明书检测BALF中ghrelin(Ebioscience)浓度及IL-10、IL-6、TNF-α、IL-1β和IL-18(欣博盛)浓度。
1.6 ghrelin水平及通路蛋白在脓毒症肺损伤小鼠中的表达 1.6.1 Real-time PCR检测肺组织中ghrelin水平及通路蛋白的表达使用eastepTM Super TotalRNA Extraction试剂盒(Promega)提取小鼠肺脏组织中的RNA,通过QuantiNova SYBR Green PCR试剂盒(QIAGEN)反转录为cDNA,引物由生工生物工程(上海)股份有限公司合成,运用SYBR Green荧光染料法,数据分析根据公式2-ΔΔCt计算各组与sham组之间目的基因相对表达含量的变化。GAPDH作为内参,每个样本3个复孔。
1.6.2 免疫荧光检测GSDMD将石蜡切片于60 ℃烘烤至少1 h,脱蜡后经枸橼酸钠抗原修复液进行修复,PBS洗3次/5 min,通过5%浓度BSA孵育封闭30 min,将封闭液轻轻甩干,加入一抗GSDMD(抗体用缓冲液按1 ∶200稀释)在4 ℃孵育过夜,在室温黑暗条件下与荧光二抗(北京中杉金桥生物公司)孵育1 h,DAPI染核5 min后,防荧光淬灭剂封片,显微镜下观察。
1.6.3 Western blot检测焦亡通路蛋白的表达试剂盒提取组织蛋白(上海贝博科技有限公司),通过BCA试剂盒(凯基生物公司)测定蛋白浓度,蛋白样品经10% SDS-PAGE电泳分离,转移到PVDF膜上,用5% 脱脂奶粉封闭,与一抗在4 ℃孵育过夜,在室温下与二抗孵育70 min,使用Bio-Rad成像系统检测蛋白条带。Image J软件分析各组焦亡通路及内参GAPDH(Zenbio, 1 ∶5 000)的灰度值,NLRP3(Abcam,1 ∶1 000)、ASC[ASC (F-9), Santa Cruz Biotechnology, 1 ∶1 000]、Caspase-1(Genetex, 1 ∶1 000)、GSDMD[GSDMDC1 (A-7), Santa Cruz Biotechnology, 1 ∶1 000]水平分别用NLRP3/GAPDH、ASC/GSDMD、Caspase-1/GAPDH和GSDMD/GAPDH表示。
1.7 统计学分析采用SPSS21.0统计软件,所有数据以x±s表示,组间差异通过单因素方差分析,组间两两比较采用最小显著性差异法(LSD法)。通过Kaplan-Meier方法(log-rank检验)分析各组存活率,并且绘制生存曲线,生存时间组间比较采用秩和检验。
2 结果 2.1 ghrelin对脓毒症小鼠存活率的影响观察3组小鼠120 h生存率发现,sham组存活率为100%,CLP小鼠24 h存活率为50%,48 h为20%,而ghrelin干预组提高了存活率,24 h为80%,48 h为70%,显著高于CLP组,差异有统计学意义(P < 0.05)。见图 1。
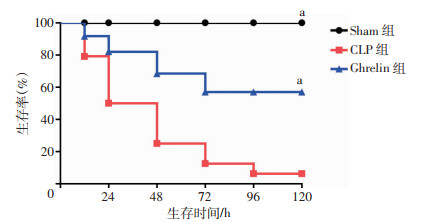
|
| a:P < 0.05,与CLP组比较 图 1 Ghrelin对脓毒症小鼠存活率的影响(n=24,x±s) |
2.2 脓毒症小鼠肺组织中ghrelin水平
CLP小鼠肺组织和BALF中ghrelin水平低于sham组,差异具有统计学意义(P < 0.05)。给予外源性ghrelin后,CLP小鼠ghrelin水平明显升高,差异具有统计学意义(P < 0.05)。见图 2A、B。
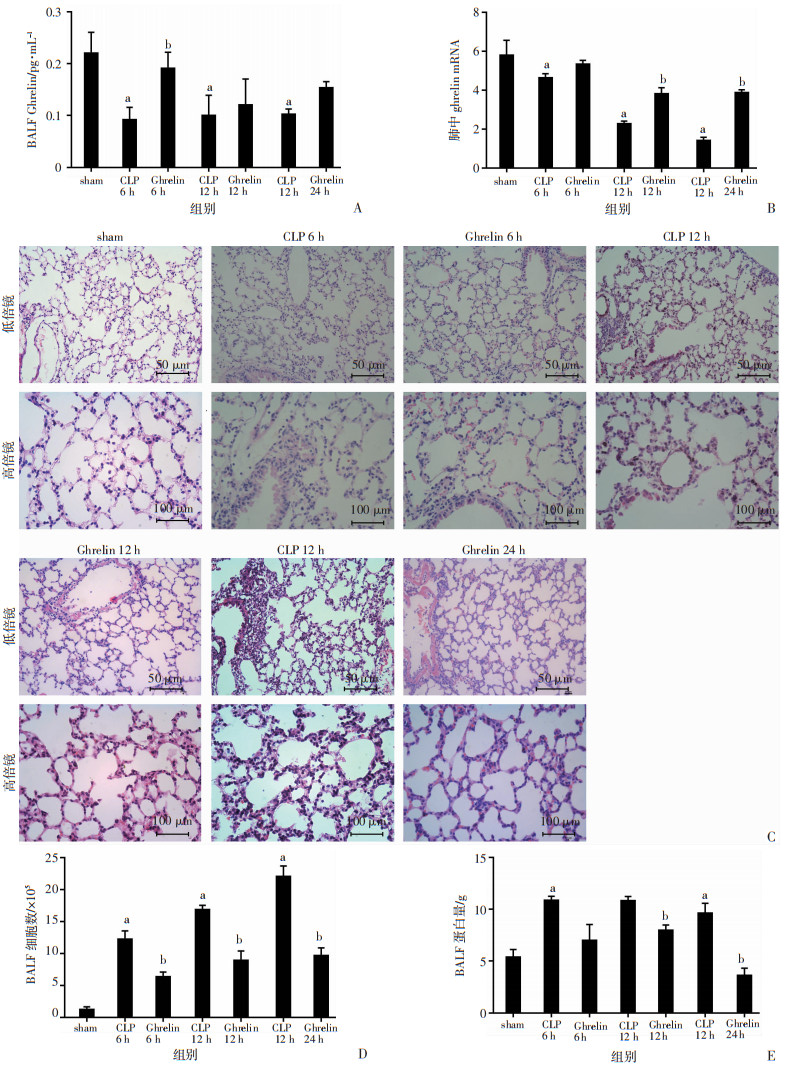
|
| A:BALF中ghrelin的含量;B:肺组织中ghrelin mRNA含量;C:HE染色检测各组肺组织病理变化;D:BALF中细胞计数;E:BALF中蛋白的含量;a:P < 0.05,与sham组比较;b:P < 0.05,与CLP组比较 图 2 ghrelin对脓毒症小鼠肺组织病理的影响(n=14,x±s) |
2.3 肺组织病理学检查
sham组肺泡结构完整,CLP组肺泡腔与肺泡间质中性粒细胞增加以及肺泡壁增厚,24 h CLP组病理学改变更明显,ghrelin组改善了以上病理组织改变。与sham组相比,CLP组BALF中细胞总数、总蛋白均显著增加,ghrelin干预后BALF中细胞总数、总蛋白明显减少,差异具有统计学意义(P < 0.05)。见图 2C~E。
2.4 ghrelin对脓毒症小鼠炎症因子的影响CLP小鼠BALF中炎症因子IL-6、TNF-α和IL-10明显高于sham组,差异具有统计学意义(P < 0.05)。ghrelin组促炎因子IL-6和TNF-α水平低于CLP组,抗炎因子IL-10水平明显高于CLP组,差异具有统计学意义(P < 0.05),见图 3A~C。
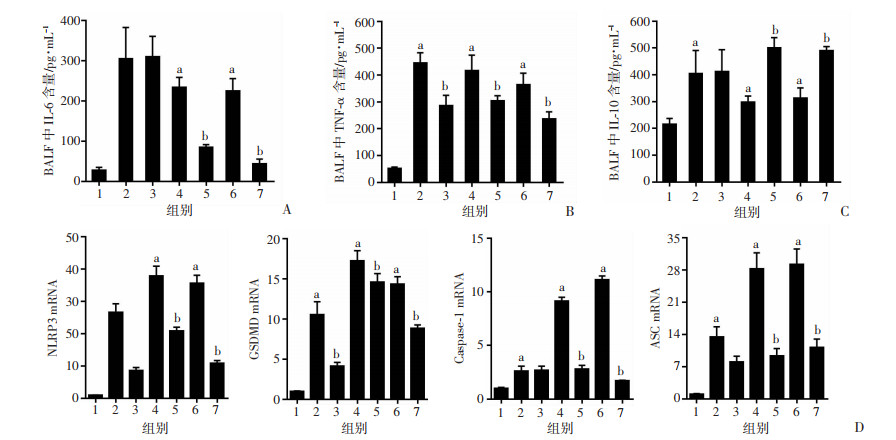
|
| A~C分别为BALF中IL-6、TNF-α、IL-10的含量;D~G分别为各组肺组织中NLRP3、GSDMD、Caspase-1、ASCmRNA的表达;1:sham组;2:CLP 6 h组;3:ghrelin 6 h组;4:CLP 12 h组;5:ghrelin 12 h组;6:CLP 12 h组;7:ghrelin 24 h组;a:P < 0.05,与sham组比较;b:P < 0.05,与CLP组比较 图 3 ghrelin对脓毒症小鼠的炎症因子及GSDMD通路mRNA的影响(n=14,x±s) |
2.5 ghrelin对脓毒症肺损伤小鼠中GSDMD通路的影响 2.5.1 qPCR检测ghrelin对小鼠肺组织中GSDMD通路mRNA的影响
CLP组和ghrelin组肺组织GSDMD通路mRNA相对表达升高,与sham组比较差异有统计学意义(P < 0.05),与CLP组相比,ghrelin组显著降低了NLRP3、ASC、Caspase-1、GSDMD mRNA的表达(P < 0.05,图 3D)。
2.5.2 免疫荧光检测小鼠肺组织GSDMD的表达通过免疫荧光观察小鼠肺组织GSDMD定位表达,与sham组相比,CLP组GSDMD共定位表达明显增强,ghrelin降低了其表达(P < 0.05,图 4A)。
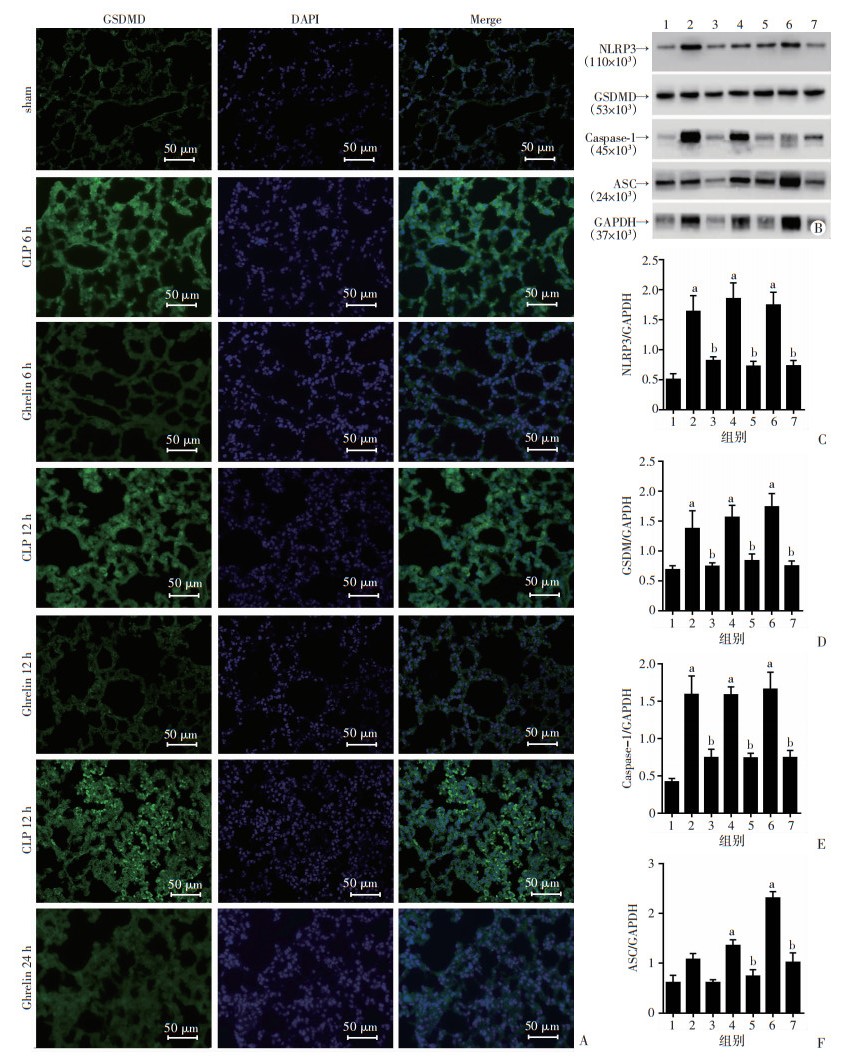
|
| A:免疫荧光检测各组小鼠肺组织GSDMD的表达;B:Western blot检测各组GSDMD焦亡通路蛋白表达;C~F分别为各组肺组织中NLRP3、GSDMD、Caspase-1、ASC相当表达量;1:sham组;2:CLP 6 h组;3:ghrelin 6 h组;4:CLP 12 h组;5:ghrelin 12 h组;6:CLP 12 h组;7:ghrelin 24 h组;a:P < 0.05,与sham组比较;b:P < 0.05,与CLP组比较(n=14,x±s) 图 4 ghrelin对小鼠肺组织中GSDMD通路蛋白表达的影响 |
2.5.3 Western blot检测ghrelin对小鼠肺组织中GSDMD通路蛋白的影响
与sham组比较,CLP组的NLRP3、ASC、Caspase-1、GSDMD蛋白表达水平明显升高(P < 0.05),ghrelin组蛋白表达水平显著低于CLP组(P < 0.05,图 4B~F)。
2.5.4 ELISA检测ghrelin对小鼠BALF中焦亡相关炎症因子的影响ELISA检测BALF中IL-1β和IL-18的表达水平,CLP组高于sham组,差异有统计学意义(P < 0.05),ghrelin组降低了焦亡相关炎症因子IL-1β和IL-18的水平,差异有统计学意义(P < 0.05,图 5)。
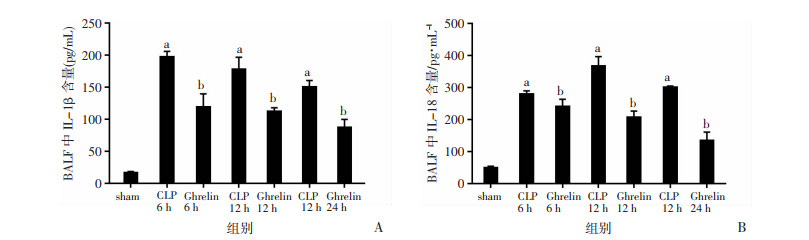
|
| A:BALF中IL-1β的含量;B:BALF中IL-18的含量;a:P < 0.05,与sham组比较;b:P < 0.05,与CLP组比较 图 5 ghrelin对小鼠BALF中焦亡相关炎症因子表达的影响(n=14,x±s) |
3 讨论
脓毒症是宿主对感染的反应失调而导致的危及生命的器官功能障碍,机体表现过度的炎症反应和免疫抑制[13],患者短期死亡风险高[14]。作为炎性细胞程序性死亡的焦亡模式,广泛参与了多种疾病的细胞死亡过程。焦亡有3种类型,依赖Caspase-1炎症小体的经典途径、Caspase-11的非经典炎症小体途径以及Caspase-3的凋亡向焦亡转化途径。焦亡途径会释放IL-1β和IL-18等炎症因子,导致炎症级联放大反应[15]。经典焦亡途径主要是NLRP3炎性小体激活Caspase-1,将前体IL-1β和前体IL-18裂解成有活性的IL-1β和IL-18[16]。其中GSDMD是焦亡的一个关键靶点,Caspase-1通过裂解GSDMD为IL-1β和IL-18释放提供条件,是焦亡的执行者[17]。如能有效地调控细胞焦亡通路中的关键分子或蛋白复合体,有助于了解脓毒症肺损伤复杂的发病机制,并为寻找干预治疗的靶点提供理论依据。本研究结果表明,脓毒症肺损伤时小鼠BALF中IL-1β和IL-18水平升高,肺组织含量NLRP3、ASC、Caspase-1、GSDMD明显升高,免疫荧光共聚焦提示GSDMD表达明显,提示脓毒症肺损伤其炎性反应与焦亡途径激活来促进炎性因子大量释放有关。
ghrelin是GHSR-1a的内源性配体,近年来研究表明ghrelin具有调节免疫和炎症的功能[18-19]。在油酸诱导的大鼠ALI模型,ALI大鼠血浆和肺组织ghrelin含量降低,mRNA表达下调,ghrelin可改善油酸诱导的大鼠ALI模型肺损伤、炎性细胞浸润等[20]。本研究中CLP脓毒症模型可导致肺间质充血水肿、炎症细胞浸润和肺内出血,表现为典型急性肺损伤病理改变。研究还显示,CLP组ghrelin水平降低,给予外源性ghrelin后,BALF中炎性细胞数及总蛋白明显减少,肺泡壁结构改善,肺泡间质炎症浸润减轻,中性粒细胞减少,同时BALF中促炎细胞因子TNF-α和IL-6水平降低,抗炎因子IL-10水平升高。结果表明,ghrelin对CLP诱导的脓毒症ALI具有保护作用。
多项研究发现,ghrelin蛋白在多种危重疾病状态下,表现出其对细胞焦亡的积极影响[21-23]。在创伤性脑损伤诱导的ALI中,ghrelin减弱了IL-1β、IL-6、TNF-α和IL-18 mRNA水平与凋亡相关的蛋白NLRP3炎症小体和GSDMD,因此认为ghrelin通过调节细胞焦亡减轻炎症反应,从而减轻ALI的病情[22]。在实验性自身免疫性脑脊髓炎中发现,ghrelin可抑制NLRP3炎性体信号传导途径和焦亡,以及促炎细胞因子的分泌,使实验组大鼠的神经系统症状得以延迟,行为功能得到改善[24]。本研究结果显示,脓毒症小鼠给予外源性ghrelin干预后,IL-1β和IL-18显著降低,GSDMD的共聚焦定位明显弱于CLP组,脓毒症ALI肺组织中NLRP3、ASC、Caspase-1、GSDMD的表达水平明显低于CLP组,生存率也明显提高。
综上所述,急性肺损伤是脓毒症多器官功能障碍的重要组成部分,过度失调的炎症反应是其发生发展的关键环节,而焦亡途径参与了脓毒症肺损伤的病理生理过程。近年来ghrelin多系统效应中,其减轻炎症的能力受到越来越多的关注,本研究提示ghrelin提高了脓毒症ALI小鼠生存率,改善了肺组织病理损伤,对CLP诱导的脓毒症ALI具有保护作用,其机制可能与抑制焦亡信号通路及降低炎症因子的表达相关。
| [1] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. DOI:10.1001/jama.2016.0287 |
| [2] |
WU R, DONG W, ZHOU M, et al. Ghrelin attenuates sepsis-induced acute lung injury and mortality in rats[J]. Am J Respir Crit Care Med, 2007, 176(8): 805-813. DOI:10.1164/rccm.200604-511OC |
| [3] |
WONG J J, JIT M, SULTANA R, et al. Mortality in pediatric acute respiratory distress syndrome: a systematic review and meta-analysis[J]. J Intens Care Med, 2019, 34(7): 563-571. DOI:10.1177/0885066617705109 |
| [4] |
RUDD K E, JOHNSON S C, AGESA K M, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017: analysis for the global burden of disease study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [5] |
ROWAN C M, SMITH L S, LOOMIS A, et al. Pediatric acute respiratory distress syndrome in pediatric allogeneic hematopoietic stem cell transplants: a multicenter study[J]. Pediatr Crit Care Med, 2017, 18(4): 304-309. DOI:10.1097/PCC.0000000000001061 |
| [6] |
LIU Y, JING Y Y, ZENG C Y, et al. Scutellarin suppresses NLRP3 inflammasome activation in macrophages and protects mice against bacterial sepsis[J]. Front Pharmacol, 2017, 8: 975. DOI:10.3389/fphar.2017.00975 |
| [7] |
CHEN Y L, XU G, LIANG X, et al. Inhibition of hepatic cells pyroptosis attenuates CLP-induced acute liver injury[J]. Am J Transl Res, 2016, 8(12): 5685-5695. |
| [8] |
JORGENSEN I, MIAO E A. Pyroptotic cell death defends against intracellular pathogens[J]. Immunol Rev, 2015, 265(1): 130-142. DOI:10.1111/imr.12287 |
| [9] |
NARULA T, DEBOISBLANC B P. Ghrelin in critical illness[J]. Am J Respir Cell Mol Biol, 2015, 53(4): 437-442. DOI:10.1165/rcmb.2014-0226TR |
| [10] |
AMITANI M, AMITANI H, CHENG K C, et al. The role of ghrelin and ghrelin signaling in aging[J]. Int J Mol Sci, 2017, 18(7): 1511. DOI:10.3390/ijms18071511 |
| [11] |
ZHU H, LUO P, FU Y, et al. Dihydromyricetin prevents cardiotoxicity and enhances anticancer activity induced by adriamycin[J]. Oncotarget, 2015, 6(5): 3254-3267. DOI:10.18632/oncotarget.2410 |
| [12] |
LI K, YANG J, HAN X. Ketamine attenuates sepsis-induced acute lung injury via regulation of HMGB1-RAGE pathways[J]. Int Immunopharmacol, 2016, 34: 114-128. DOI:10.1016/j.intimp.2016.01.021 |
| [13] |
ZHOU J, TIAN H, DU X, et al. Population-based epidemiology of sepsis in a subdistrict of beijing[J]. Crit Care Med, 2017, 45(7): 1168-1176. DOI:10.1097/CCM.0000000000002414 |
| [14] |
王照良, 张文玲, 黄涛, 等. 动态联合监测血清淀粉样蛋白A、血清可溶性髓系细胞触发受体-1、D-二聚体对Sepsis患者预后的评估价值: 前瞻性巢式病例对照研究[J]. 协和医学杂志, 2020, 11(1): 34-39. WANG Z L, ZHANG W L, HUANG T, et al. Value of dynamic combined monitoring of serum amyloid a protein, soluble triggering receptor expressed on myeloid cell-1, and D-dimer in evaluating the prognosis of patients with sepsis: a prospective nested case-control study[J]. Med J PUMCH, 2020, 11(1): 34-39. DOI:10.3969/j.issn.1674-9081.20190051 |
| [15] |
SHI J, ZHAO Y, WANG K, et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death[J]. Nature, 2015, 526(7575): 660-665. DOI:10.1038/nature15514 |
| [16] |
WU D, PAN P, SU X, et al. Interferon regulatory factor-1 mediates alveolar macrophage pyroptosis during LPS-induced acute lung injury in mice[J]. Shock, 2016, 46(3): 329-338. DOI:10.1097/SHK.0000000000000595 |
| [17] |
KAYAGAKI N, STOWE I B, LEE B L, et al. Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling[J]. Nature, 2015, 526(7575): 666-671. DOI:10.1038/nature15541 |
| [18] |
ZHANG L N, GONG W D, LUO J, et al. Exogenous ghrelin ameliorates acute lung injury by modulating the nuclear factor kappaB inhibitor kinase/nuclear factor kappaB inhibitor/nuclear factor kappaB pathway after hemorrhagic shock[J]. Int Immunopharmacol, 2019, 69: 95-102. DOI:10.1016/j.intimp.2019.01.019 |
| [19] |
NIKITOPOULOU I, KAMPISIOULI E, JAHAJ E, et al. Ghrelin alterations during experimental and human sepsis[J]. Cytokine, 2020, 127: 154937. DOI:10.1016/j.cyto.2019.154937 |
| [20] |
TIAN X, LIU Z, YU T, et al. Ghrelin ameliorates acute lung injury induced by oleic acid via inhibition of endoplasmic reticulum stress[J]. Life Sci, 2018, 196: 1-8. DOI:10.1016/j.lfs.2017.07.023 |
| [21] |
SONG F, HOU J, CHEN Z, et al. Sphingosine-1-phosphate receptor 2 signaling promotes caspase-11-dependent macrophage pyroptosis and worsens Escherichia coli sepsis outcome[J]. Anesthesiology, 2018, 129(2): 311-320. DOI:10.1097/ALN.0000000000002196 |
| [22] |
SHAO X F, LI B, SHEN J, et al. Ghrelin alleviates traumatic brain injury-induced acute lung injury through pyroptosis/NF-kappaB pathway[J]. Int Immunopharmacol, 2020, 79: 106175. DOI:10.1016/j.intimp.2019.106175 |
| [23] |
WANG Y, AN R, UMANAH G K, et al. A nuclease that mediates cell death induced by DNA damage and poly(ADP-ribose) polymerase-1[J]. Science, 2016, 354(6308): aad6872. DOI:10.1126/science.aad6872 |
| [24] |
LIU F, LI Z, HE X, et al. Ghrelin attenuates neuroinflammation and demyelination in experimental autoimmune encephalomyelitis involving NLRP3 inflammasome signaling pathway and pyroptosis[J]. Front Pharmacol, 2019, 10: 1320. DOI:10.3389/fphar.2019.01320 |




